修回日期: 2014-03-10
接受日期: 2014-03-18
在线出版日期: 2014-03-28
目的: 探讨监护室新生儿长期胃肠外营养相关性胆汁淤积症(parenteral nutrition associated cholestasis, PNAC)的表现及预后.
方法: 选择2010-01/2013-12在我院新生儿监护室接受持续胃肠外营养≥14 d的102例新生儿为研究对象, 其中42例发生了PNAC, 作为研究组(PNAC组), 未发生PNAC的60例患儿为对照组(非PNAC组). 观察PNAC患儿PNAC发生时间、持续时间、肝功能损害及预后等情况.
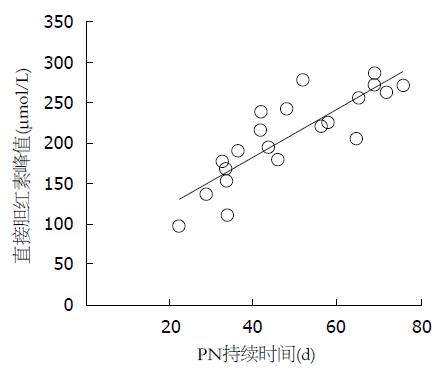
结果: PNAC组患儿发生PNAC的平均时间为开始接受胃肠外营养(parenteral nutrition, PN)后3.4 wk±1.5 wk, 平均持续时间为13.4 wk±5.2 wk, 平均总胆红素(total bilirubin, TB)峰值为198.9 μmol/L±95.8 μmol/L, 平均直接胆红素(direct bilirubin, DB)峰值为137.1 μmol/L±64.3 μmol/L; PNAC组患儿中有77.8%(28/36)伴有肝功能损害, 肝损一般发生于PN后6.5 wk±2.9 wk, 持续9.6 wk±5.2 wk. 多重线性回归分析显示, 胆汁淤积程度与PN持续时间呈正相关(r = 0.287, P<0.05), 与其他各项指标无线性关系.
结论: PNAC患儿总体预后良好, 临床应用中应该避免长时间持续PN, 同时防治感染、尽早开始肠内营养、改善PN配方等, 可以有效减少PNAC发生.
核心提示: 本研究中, 42例胃肠外营养相关性胆汁淤积症(parenteral nutrition associated cholestasis, PNAC)患儿肝功能损害发生率为77.8%, 一般发生于胃肠外营养(parenteral nutrition, PN)后6.5 wk±2.9 wk, 较PNAC出现晚, 肝损持续时间大约9.6 wk±5.2 wk. 部分研究表明, 停用PN后PNAC症状会好转缓解. 本次入组的42例PNAC患儿在停用PN, 并给予能量合剂、熊脱氧胆酸及护肝治疗后, 40例患儿临床症状消失, 随诊1-2 mo肝功能指标正常, 2例患儿治疗2 wk临床症状无改善, 自动出院.
引文著录: 赵军育, 吴立江, 刘晓莉. 监护室新生儿长期胃肠外营养致胆汁淤积症的表现及预后. 世界华人消化杂志 2014; 22(9): 1317-1321
Revised: March 10, 2014
Accepted: March 18, 2014
Published online: March 28, 2014
AIM: To explore the clinical manifestations and prognosis of parenteral nutrition induced cholestasis (PNIC).
METHODS: One hundred and two newborns receiving continuous parenteral nutrition (PN) ≥ 14 d from January 2010 to December 2013 were divided into either a PNIC group (n = 42) or a non-PNIC group (n = 60). PNAC onset time, duration and hepatic injury were compared between the two groups.
RESULTS: PNIC occurred 3.4 wk ± 1.5 wk after PN administration, and its mean duration was 13.4 wk ± 5.2 wk. The maximum total bilirubin was 198.9 μmol/L ± 95.8 μmol/L, and the direct bilirubin was 137.1 μmol/L ± 64.3 μmol/L. In the PNIC group, 77.8% (28/36) suffered from hepatic injury. Hepatic injury occurred 6.5 wk ± 2.9 wk after PN administration, and lasted for 9.6 wk ± 5.2 wk. Multiple linear regression analysis showed that the severity of cholestasis was positively correlated with the duration of PN (r = 0.287, P < 0.05).
CONCLUSION: The prognosis of PNIC was favorable. To reduce the incidence of PNIC, long-term PN and infections should be avoided, enteral feeding should be started early and the PN formula should be improved.
- Citation: Zhao JY, Wu LJ, Liu XL. Clinical manifestations and prognosis of long-term parenteral nutrition induced cholestasis in neonates. Shijie Huaren Xiaohua Zazhi 2014; 22(9): 1317-1321
- URL: https://www.wjgnet.com/1009-3079/full/v22/i9/1317.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i9.1317
胃肠外营养(parenteral nutrition, PN)广泛应用于危重症新生儿, 尤其危重症早产儿及低出生体重儿的救治中. 然而由于新生儿胃肠道及肝脏等重要脏器尚未完全发育成熟, PN在应用过程中出现诸多并发症, 其中胃肠外营养相关性胆汁淤积症(parenteral nutrition associated cholestasis, PNAC)是PN并发症中最为严重的一种, 部分患儿甚至可以发展为肝功能衰竭而死亡[1,2]. PNAC的发病机制目前尚不完全清楚, 了解新生儿PNAC的临床表现及预后, 采取合理的干预措施对于新生儿PNAC的救治具有十分重要的意义. 本研究对2010-01/2013-12我院新生儿监护室接受PN治疗的患者临床资料进行总结, 分析PNAC的临床特征及预后.
选择2010-01/2013-12在我院新生儿监护室接受持续胃肠外营养≥14 d的102例新生儿为研究对象, 其中42例发生了PNAC, 作为研究组(PNAC组), 剩余未发生PNAC的60例患儿作为对照组(非PNAC组).
1.2.1 PNAC诊断标准: 持续胃肠外营养≥14 d, 临床表现有皮肤黄染和(或)大便颜色呈白陶土样, 直接胆红素(direct bilirubin, DB)>34 μmol/L(2 mg/dL), 排除病毒、细菌等感染, 胆道畸形、外科手术及遗传代谢疾病等原因引起的胆汁淤积[3]. 肝功能损害标准: 谷丙转氨酶(alanine aminotransferase, ALT)>50 U/L, 谷草转氨酶(aspartate aminotransferase, AST)>50 U/L, 排除标本溶血等因素者可诊断为肝功能损害.
1.2.2 肠外营养支持: PN液配方包括10%葡萄糖、6.74%小儿复方氨基酸、20%中长链脂肪乳、水溶性及脂溶性维生素、电解质、微量元素. 氨基酸及脂肪乳均由1 g/(kg•d)开始, 每天增加0.5 g/kg, 最大增至2.5-3.5 g/(kg•d), 葡萄糖用量开始用量为6-8 g/(kg•d), 逐渐增至12-16 g/(kg•d). PN液由周围或中心静脉微泵输入, 输注过程注意避光处理.
1.2.3 观察项目: 包括各组患儿的性别、胎龄、出生体质量、禁食时间、PN时间、是否窒息、有无感染、颅内出血、机械通气、动脉导管开放等情况, 所有患儿定期接受头颅B超, 心脏彩超, 腹部B超, 甲状腺功能及其他常规检查.
1.2.4 PNAC患儿的治疗: DB>3 mg/dL时予以减少PN用量, DB>8 mg/dL时停用PN, 并根据患儿胆汁淤积情况给予熊脱氧胆酸及护肝治疗, 如果经上述治疗4 wk, 患儿病情无好转甚至加重者, 则转上级医院进一步治疗.
统计学处理 采用SPSS19.0统计软件进行统计分析. 计量资料以mean±SD表示, 两组之间比较采用t检验, 计数资料比较采用χ2检验, P<0.05为差异有统计学意义.
PNAC组与非PNAC组患儿临床资料比较如表1. 两组患儿在性别比例、合并感染及动脉导管开放方面差异无统计学意义(P>0.05). PNAC组患儿的胎龄及出生体质量均小于非PNAC组, 禁食时间、PN时间长于非PNAC组, 同时PNAC组窒息、颅内出血的患儿明显多于非PNAC组, 差异均有统计学意义(P<0.05).
| 项目 | PNAC组 | 非PNAC组 | t或χ2值 | P值 |
| n | 42 | 60 | ||
| 性别(男/女) | 18/24 | 21/39 | 0.646 | >0.05 |
| 胎龄(wk) | 31.4±3.5 | 33.1±3.3 | 2.497 | <0.05 |
| 出生体质量(g) | 1351.6±321.5 | 1832.9±256.1 | 8.402 | <0.05 |
| 禁食时间(d) | 10.6±6.8 | 4.5±3.6 | 5.878 | <0.05 |
| PN时间(d) | 39.5±19.2 | 24.6±9.3 | 5.209 | <0.05 |
| 窒息n(%) | 15(35.7) | 7(11.7) | 8.446 | <0.05 |
| 感染n(%) | 18(42.9) | 17(28.3) | 2.312 | >0.05 |
| 颅内出血n(%) | 24(57.1) | 21(35.0) | 4.913 | <0.05 |
| 机械通气n(%) | 26(61.9) | 18(30.0) | 10.253 | <0.05 |
| 动脉导管开放n(%) | 13(31.0) | 17(28.3) | 0.816 | >0.05 |
PNAC组患儿发生PNAC的平均时间为开始接受PN后3.4 wk±1.5 wk, 其中5例发生在停用PN 1 wk, 1例发生在停用PN 2 wk, 停用PN后发生PNAC的患儿在排除其他原因引起后, 给予常规利胆护肝治疗等对症支持治疗后好转. PNAC平均持续时间为13.4 wk±5.2 wk, 总胆红素(total bilirubin, TB)峰值为198.9 μmol/L±95.8 μmol/L, DB峰值为137.1 μmol/L±64.3 μmol/L; PNAC患儿中有77.8%(28/36)伴有肝功能损害, 肝损一般发生于PN后6.5 wk±2.9 wk, 较PNAC发生晚, 持续9.6 wk±5.2 wk, ALT峰值120.9 U/L±47.3 U/L, AST峰值239.6 U/L±121.8 U/L(表2). PNAC发生后, 逐渐停用PN, 并给予能量合剂、熊脱氧胆酸及护肝治疗, 40例患儿临床症状消失, 随诊1-2 mo肝功能指标正常, 2例患儿治疗2 wk临床症状无改善, 自动出院.
| 项目 | n | mean±SD | 最小值 | 最大值 |
| PNAC发生时间(wk) | 42 | 3.4±1.5 | 1 | 7.5 |
| PNAC持续时间(wk) | 42 | 13.4±5.2 | 4 | 24 |
| TB-max(μmol/L) | 36 | 198.9±95.8 | 58.5 | 486.3 |
| DB-max(μmol/L) | 36 | 137.1±64.3 | 47.3 | 293.8 |
| 肝损发生时间(wk) | 28 | 6.5±2.9 | 1 | 15 |
| 肝损持续时间(wk) | 28 | 9.6±5.2 | 2 | 21 |
| ALT-max(U/L) | 28 | 120.9±47.3 | 50 | 248 |
| AST-max(U/L) | 28 | 239.6±121.8 | 81 | 642 |
通过对胆汁淤积程度即直接胆红素峰值与胎龄、出生体质量、禁食时间、PN持续时间进行多重线性回归分析, 结果显示, 胆汁淤积程度与PN持续时间呈正相关(r = 0.287, P<0.05), 其他各项指标无线性关系(图1).
PNAC的确切病因尚不明确, 目前[4,5]认为PNAC可能是脓毒血症、肝脏发育不成熟、肠内营养缺乏、肠外营养毒素等因素单独或相互作用导致的胆汁酸分泌受抑, 致使胆管内胆汁流速及胆汁成份改变引起的一种综合征. 其中有关胃肠外营养导致的PNAC越来越受重视.
胃肠外营养是新生儿学中的一个重要发展, 目前已成为新生儿监护室救治患儿的重要方法, 但胃肠外营养液成分本身具有的毒性作用可以导致肝脏损害, 出现PNAC. 有报道, PN液中牛磺酸、谷氨酰胺缺乏或蛋氨酸过多等可引起PNAC[6,7], 另外热卡过高、水份及脂肪乳配伍不均等也可能是PNAC的重要因素[8,9]. 本次研究中我们通过对本院新生儿监护室接受持续PN治疗的患儿进行研究显示: PNAC患儿的胎龄及出生体质量普遍小于非PNAC患儿, 平均禁食时间、PN时间均长于非PNAC患儿, 同时PNAC组窒息、颅内出血的患儿明显多于非PNAC组. 通过对上述因素进一步行多重线性回归分析显示, 胆汁淤积程度与PN持续时间呈正相关其他各项指标无线性关系. 说明PN持续时间是PNAC的重要危险因素, PN时间越长, PNAC发生的可能性越大, 这与国内外报道结论一致[10-13]. 其原因可能与长时间的PN增加了PN液的累积毒性, 同时由于过高的非蛋白热卡摄入, 水份、糖原及脂肪乳等在肝脏的沉积致使肝细胞发生肿胀、变性, 进而堵塞胆管引起胆汁淤积, 从而对肝脏造成进一步的损害.
Cober等[14]曾报道, PN治疗小于2 wk的患儿没有或程度较轻的胆汁淤积, 而超过2 wk的患儿PNAC发生机率增高, PN持续超过6 wk者则会发生胆汁淤积及胆管增生. 本研究中, 我们通过对PNAC组42例患儿的临床资料分析发现, PNAC的主要临床表现为黄疸、肝脾肿大、大便呈白陶土样外, PNAC平均时间为开始接受PN后3.4 wk±1.5 wk, 最早发生在开始PN后1 wk, 最晚发生在开始PN后7.5 wk. 其中5例发生在停用PN 1 wk, 1例发生在停用PN 2 wk, 停用PN后发生PNAC的患儿在排除其他原因引起后, 给予常规利胆护肝治疗等对症支持治疗后好转, PNAC平均持续时间为13.4 wk±5.2 wk. 可见, 临床上对于使用持续PN治疗的患儿应该定期监测肝功能, 尤其对于持续使用2 wk以上的患儿, 应密切观察患儿有无皮肤黄染, 大便颜色变浅等情况, 并结合相应肝功能检测结果, 判断是否发生PNAC. 另外, 我们发现PNAC患儿的胆汁淤积程度并不一致, PNAC组患儿平均TB峰值为198.9 μmol/L±95.8 μmol/L, 平均DB峰值为137.1 μmol/L±64.3 μmol/L; 而最严重的患儿TB峰值可达486.3 μmol/L, DB可达293.8 μmol/L. 这与国内学者报道的数据基本一致[15,16]. 线性回归分析结果也显示, 胆汁淤积程度与PN持续时间呈正相关. 这可能是由于新生儿机体降解机制尚不完善, 肝脏、肾脏等重要脏器功能不全, 长期PN致使患儿体内氨基酸不断积累, 又缺乏相应的代谢, 所以DB水平升高[17].
PNAC患儿常伴有肝功能的损害[18,19]. 本研究中, 42例PNAC患儿肝功能损害发生率为77.8%, 一般发生于PN后6.5 wk±2.9 wk, 较PNAC出现晚, 肝损持续时间大约9.6 wk±5.2 wk. 部分研究表明[20,21]停用PN后PNAC症状会好转缓解. 本次入组的42例PNAC患儿在停用PN, 并给予能量合剂、熊脱氧胆酸及护肝治疗后, 40例患儿临床症状消失, 随诊1-2 mo肝功能指标正常, 2例患儿治疗2 wk临床症状无改善, 自动出院. 所以我们认为, PNAC患儿总体预后良好, 当然这可能与本次研究中患儿接受PN治疗时间相对较短有关.
在PN治疗过程中, 除了避免消除危险因素, 如长时间持续PN外, 防治感染、尽早开始肠内营养、改善PN配方等也是有效的预防手段[21]. 医务工作者应该密切观察患儿临床表现, 及时调整PN用量并监测肝功能的变化.
胃肠外营养(parenteral nutrition, PN)广泛应用于危重症新生儿, 尤其危重症早产儿及低出生体质量儿的救治中. 然而由于新生儿胃肠道及肝脏等重要脏器尚未完全发育成熟, PN在应用过程中出现诸多并发症, 其中胃肠外营养相关性胆汁淤积症(parenteral nutrition associated cholestasis, PNAC)是PN并发症中最为严重的一种, 部分患儿甚至可以发展为肝功能衰竭而死亡.
崔清波, 副主任医师, 副教授, 哈尔滨医科大学附属第二医院儿外科
PNAC的确切病因尚不明确, 目前认为PNAC可能是脓毒血症、肝脏发育不成熟、肠内营养缺乏、肠外营养毒素等因素单独或相互作用导致的胆汁酸分泌受抑, 致使胆管内胆汁流速及胆汁成份改变引起的一种综合征. 其中有关胃肠外营养导致的PNAC越来越受重视.
Cober等曾报道, PN治疗小于2 wk的患儿没有或程度较轻的胆汁淤积, 而超过2 wk的患儿PNAC发生机率增高, PN持续超过6 wk者则会发生胆汁淤积及胆管增生.
PNAC的发病机制目前尚不完全清楚, 了解新生儿PNAC的临床表现及预后, 采取合理的干预措施对于新生儿PNAC的救治具有十分重要的意义.
本研究内容实用, 结果清晰, 对临床医师有一定的参考价值.
编辑: 田滢 电编: 鲁亚静
| 1. | 刘 艳, 黄 志华, 徐 三清, 黄 永建, 周 华, 董 永绥, 冯 杰雄. 肝组织病理学检查在婴儿胆汁淤积症鉴别诊断中的价值. 世界华人消化杂志. 2012;20:2200-2204. [DOI] |
| 2. | Willis TC, Carter BA, Rogers SP, Hawthorne KM, Hicks PD, Abrams SA. High rates of mortality and morbidity occur in infants with parenteral nutrition-associated cholestasis. JPEN J Parenter Enteral Nutr. 2010;34:32-37. [PubMed] [DOI] |
| 3. | Rangel SJ, Calkins CM, Cowles RA, Barnhart DC, Huang EY, Abdullah F, Arca MJ, Teitelbaum DH. Parenteral nutrition-associated cholestasis: an American Pediatric Surgical Association Outcomes and Clinical Trials Committee systematic review. J Pediatr Surg. 2012;47:225-240. [PubMed] [DOI] |
| 4. | Costa S, Maggio L, Sindico P, Cota F, De Carolis MP, Romagnoli C. Preterm small for gestational age infants are not at higher risk for parenteral nutrition-associated cholestasis. J Pediatr. 2010;156:575-579. [PubMed] [DOI] |
| 5. | Arsenault DA, Potemkin AK, Robinson EM, Fallon EM, Ozonoff A, de Meijer VE, Puder M. Surgical intervention in the setting of parenteral nutrition-associated cholestasis may exacerbate liver injury. J Pediatr Surg. 2011;46:122-127. [PubMed] [DOI] |
| 7. | 邓 亚楠, 王 琳琳, 唐 清, 陈 秀奇, 陈 萍, 单 庆文, 连 淑君, 云 翔. 胆盐输出泵基因V444A与特发性婴儿肝炎肝内胆汁淤积的关系. 世界华人消化杂志. 2011;19:38-43. [DOI] |
| 11. | 许 靖, 张 小英, 李 秋平, 王 自珍, 周 丽, 杨 璐, 马 兴娜, 封 志纯. 超低出生体质量儿早期胃肠内微量喂养的临床研究. 实用儿科临床杂志. 2012;27:486-488, 518. |
| 12. | Blackmer AB, Btaiche IF, Arnold MA, Teitelbaum DH. Parenteral Nutrition-Associated Liver Disease in Pediatric Patients: Strategies for Treatment and Prevention. Diseases of the Liver in Children. New York: Springer 2014; 327-349. [DOI] |
| 14. | Cober MP, Teitelbaum DH. Prevention of parenteral nutrition-associated liver disease: lipid minimization. Curr Opin Organ Transplant. 2010;15:330-333. [PubMed] [DOI] |
| 15. | 庞 占凤, 郭 静, 孙 梅. 早产儿胃肠外营养相关性胆汁淤积的临床研究. 中华临床医师杂志(电子版). 2011;5:4331-4335. |