修回日期: 2014-01-05
接受日期: 2014-01-16
在线出版日期: 2014-03-18
目的: 探讨通过阻断花生四烯酸(arachidonic acid, AA)代谢途径抑制胰腺癌细胞增殖.
方法: 将胰腺癌细胞SW1990分为对照组, MK886干预组、塞莱昔布(Celecoxib)干预组, MK886+Celecoxib干预组, 用RT-PCR法检测细胞白三烯B4受体1(leukotriene B4 receptor 1, BLT1)mRNA, 血管内皮生长因子(vascular endothelial growth factor, VEGF) mRNA的表达量变化, 用Western blot检测磷酸化-Erk(phosphorylated-extracellular regulated protein, p-Erk)表达量变化.
结果: MK886作用下, BLT1 mRNA、VEGF mRNA等表达量均减少(P<0.01), p-Erk表达量明显减少(P<0.05), Celecoxib作用下, VEGF mRNA表达量明显减少(P<0.01), BLT1 mRNA表达与对照组无明显差异, p-Erk表达量与MK886组比较明显增加(P<0.01), MK886+80 μmol/L Celecoxib作用下, BLT1 mRNA、VEGF mRNA表达量明显减少(P<0.01), p-Erk表达量与对照组无明显差异.
结论: 花生四烯酸的两条代谢途径均与胰腺癌的发生及增殖均有密切关系, 而抑制5-脂氧合酶(5-lipoxygenase)途径较环氧化酶2(cyclooxygenase 2)途径相比, 抑制肿瘤细胞增殖作用更强.
核心提示: 本文证实了通过阻断花生四烯酸两条代谢途径均可抑制胰腺癌细胞的增殖, 而抑制5-脂氧合酶(5-lipoxygenase)代谢途径起更明显作用, 在联合拮抗中, 阻断环氧化酶2(cyclooxygenase 2)途径对肿瘤细胞增殖的抑制起到明显的辅助作用.
引文著录: 朱陈, 周国雄. 通过阻断花生四烯酸代谢途径抑制胰腺癌细胞增殖. 世界华人消化杂志 2014; 22(8): 1106-1111
Revised: January 5, 2014
Accepted: January 16, 2014
Published online: March 18, 2014
AIM: To investigate the effect of inhibition of arachidonic acid metabolism on proliferation of pancreatic cancer cells.
METHODS: Cultured pancreatic cancer SW1990 cells were treated with different concentrations of MK886, celecoxib, or MK886 + celecoxib. After treatment, the expression of leukotriene B4 receptor 1 (BLT1) and vascular endothelial growth factor (VEGF) mRNAs was detected by semi-quantitative RT-PCR and the expression of phosphorylated extracellular regulated protein (p-Erk) was measured by Western blot.
RESULTS: Treatment with MK886 significantly decreased the expression of BLT1 and VEGF mRNAs (P < 0.01 for both) and p-Erk (P < 0.05). Treatment with celecoxib did not alter the expression of BLT1 mRNA and decreased the expression of VEGF mRNA compared with untreated cells (P < 0.01), but increased the expression of p-Erk compared with the MK886 group (P < 0.01). Treatment with MK886 and celecoxib significantly decreased the expression of BLT1 and VEGF mRNAs (P < 0.01 for both), but did not alter the expression of p-Erk.
CONCLUSION: Both two pathways of arachidonic acid metabolism are associated with pancreatic cancer cell proliferation, with the pathway involving 5-lipoxygenase being more important.
- Citation: Zhu C, Zhou GX. Inhibition of arachidonic acid metabolism to decrease pancreatic cancer cell proliferation. Shijie Huaren Xiaohua Zazhi 2014; 22(8): 1106-1111
- URL: https://www.wjgnet.com/1009-3079/full/v22/i8/1106.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i8.1106
胰腺癌是一种高度恶性的肿瘤, 五年生存期低于5%[1], 一旦被确诊为胰腺癌, 则平均寿命为6 mo. 直到现在, 仍未发现有效的治疗方法[2,3], 研究发现, 胰腺癌对大多数传统化疗药物如紫杉醇、顺铂、阿霉素等均不敏感[4], 目前, 吉西他滨和S-1(替加氟+吉莫斯特+氧嗪酸钾)是标准的治疗晚期胰腺癌的唯一方案[5-8], 因此迫切需要有效的化疗药物. 近来多有研究报道花生四烯酸的代谢与胰腺癌的增值有密切关系, 花生四烯酸代谢有两条途径, 环氧化酶(cyclooxygenase, COX)和脂氧合酶(lipoxygenase, LOX), 探讨阻断该代谢途径在抑制胰腺癌发生发展中的作用机制以及是否具有潜在的临床治疗价值, 目前较少有研究将两条途径的抑制作用进行对比分析. 本研究通过分别抑制两条代谢途径及联合抑制, 分析得出哪一条途径起到更重要作用.
胰腺癌细胞株SW1990由上海交通大学附属医院第一人民医院消化内科王兴鹏教授惠赠. MK886(5-LOX拮抗剂)(纯度99.8%): Bimol公司; 塞莱昔布(Celecoxib)(纯度99.8%): 上海信合化工有限公司, 高糖型DMEM培养基(Dulbecco's Modified Eagle Medium): 美国Gibco公司; 新生小牛血清: 杭州四季青公司; 目的基因(2A/条)引物和Oligo dT(18)碱基随机引物: 上海由上海生工生物技术服务有限公司合成; OmniscriptTM逆转录试剂盒: 德国QIAGEN公司; Gene RulerTM 100 bp DNA-ladder plus(SM0321-50 μg): Fermentas公司; 琼脂糖(AB0014-10 g): BBI公司; p44/p42 MAP Kinase多克隆抗体, PHospho-p44/p42 MAP Kinase(Thr202/Tyr204)、p44/42 MAP Kinase抗体、辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗兔IgG: Cell Signaling Technology, USA.
1.2.1 细胞培养: 用含10%新生小牛血清的DMEM培养液, 置于37 ℃、5%CO2混合气体恒温暖箱中按常规方法进行培养. 细胞每2-3天换液1次. 每3-4天以0.25%胰酶-EDTA消化, 按1:3传代, 配制100 μL细胞悬液, 于96孔板上每孔内接种1×104个细胞, 在37 ℃, 5%CO2饱和湿度的培养箱中培养过夜, 吸出原培养液, 加入含有不同浓度MK886、Celecoxib、MK886+Celecoxib的培养液100 μL, 每个剂量组设3个复孔.
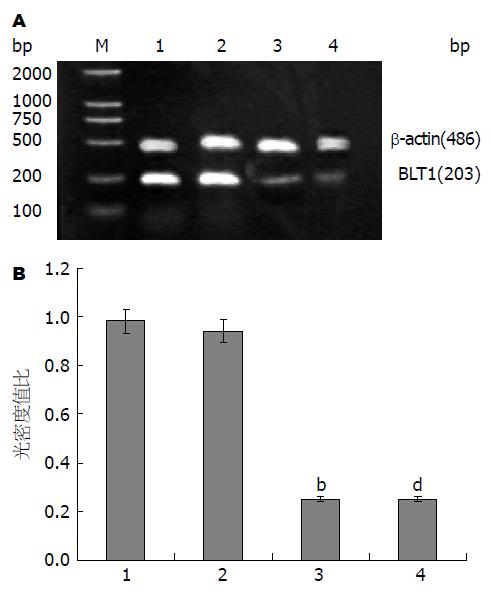
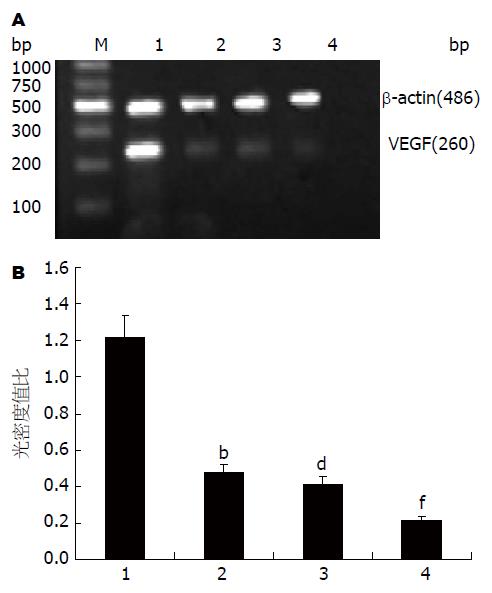
1.2.2 RT-PCR检测细胞白三烯B4受体1(leukotriene B4 receptor 1, BLT1)、血管内皮生长因子(vascular endothelial growth factor, VEGF) mRNA的表达: RNA提取按TRIzol法进行. 引物序列及扩增长度如表1, 扩增产物经琼脂糖凝胶电泳后用捷达801"凝胶分析软件"对条带作半定量分析, 读取其积分光密度值(IA值), 以平均IA/β-actin平均IA值来表示目的基因相对表达强度.
| 基因名称 | Genbank编号 | 引物 | 扩增片段(bp) |
| BLT1 | NM_181657 | 5'-CAGGCATCTGGGTGTTGT-3' | 203 |
| 5'-ACGCCCTATCTCCGACTA-3' | |||
| VEGF | NM_003376 | 5'-GGGCCTCCGAAACCATGAACTT-3' | 260 |
| 5'-TCGCATCAGGGGCACACAG-3' | |||
| β-actin | NM_001101 | 5'-AAGTACTCCGTGTGGATCGG-3' | 486 |
| 5'-ATGCATTCACCTCCCCTGTG-3' |
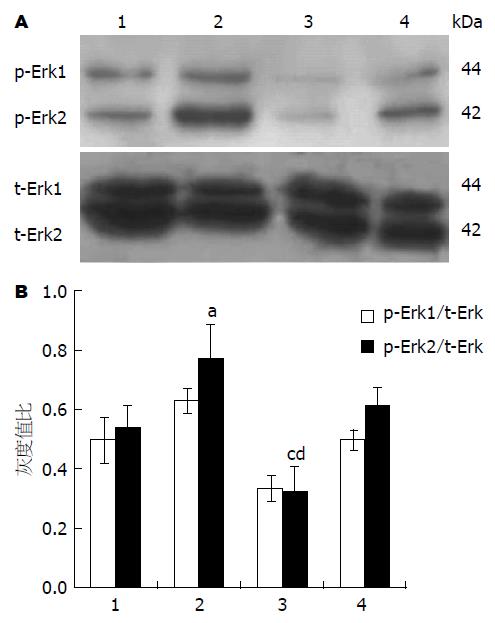
1.2.3 Western blot 检测磷酸化-Erk(phosphorylated-extracellular regulated protein, p-Erk)的表达: 将各组细胞弃去上清液, 用冰冷的PBS洗2遍, 然后置于冰台上, 在PBS中用自制的细胞刮刮取培养瓶中的贴壁SW1990细胞, 分别收集于相应的微量离心管中, 10000 r/min离心5 min, 弃上清, 于沉淀中加入200 μL裂解液(裂解液的量视细胞的数目可有所增减), 冰水浴裂解30 min, 以10000 r/min离心5 min, 上清液为全细胞提取液, 使用改良Lowry法检测蛋白质的含量, 定量后分装冻存. 蛋白转移至PVDF膜转入一盛有5%脱脂奶粉的平皿中, 室温下摇床包被2 h. 封闭结束后, 将膜浸入加有一抗[抗t-Erk(总-Erk)抗体, 抗p-Erk抗体1:1000稀释]的新鲜配置的封闭液, 4 ℃过夜. 次日, 用TBS溶液将膜漂洗3遍, 每遍5 min. 向膜的正面滴加含有二抗(羊抗兔IgG/HRP均1:1000稀释)的封闭液, 室温摇床反应2 h. 取出滤膜, TBS溶液漂洗3遍, 每遍5 min. 用滤纸吸干膜上液体, 备用. 等量吸出ECL试剂A和B(每2 cm2膜须ECL总量0.1 mL), 混匀后滴加在膜正面. 5 min后, 将膜上的多余液体吸干, 封入保鲜膜, 放入压片盒中. 在暗室中将胶片放在PVDF膜的正面, 盖上暗盒. 曝光1 min后, 取出胶片放入显影液中, 待条带出现后取出用自来水冲洗, 放入定影液中. 取出胶片, 晾干, 待拍照用. 如条带不明显, 可再压一张胶片, 约5 min后再洗胶片. 胶片曝光显影后将图片扫描保存为电脑文件, 并用GIS1000分析软件将图片上每个特异条带灰度值数字化.
统计学处理 采用STATA7.0统计软件进行分析, 计量资料采用多个均数比较采用单因素方差分析, 多个样本率的比较采用χ2检验, P<0.05为差异有统计学意义.
2.1.1 代谢通路拮抗剂对SW1990细胞BLT1基因表达的影响: BLT1是LTB4的高亲和力受体, 一般在白细胞表达, 也在胸腺和脾脏上少量表达. 逆转录聚合酶链反应(RT-PCR)结果显示(图1A), 对照组胰腺癌SW1990细胞表达BLT1的mRNA非常明显, 100 μmol/L的MK886和50 μmol/L MK886与80 μmol/L的Celecoxib联合干预使BLT1 mRNA表达受到抑制, 单独Celecoxib的干预与对照组相比未出现明显变化, 三次独立实验结果进行灰度分析, 统计结果如图1B.
2.1.2 代谢通路拮抗剂对SW1990细胞VEGF基因表达的影响: VEGF与肿瘤组织血管生成及肿瘤的转移密切相关, 逆转录聚合酶链反应(RT-PCR)结果显示(图2A), 100 μmol/L的Celecoxib, 100 μmol/L的MK886和50 μmol/L MK886与80 μmol/L的Celecoxib联合干预使VEGF mRNA表达受到抑制, 三次独立实验结果进行灰度分析, 统计结果如图2B.
用Western blot法测SW1990细胞的p-Erk表达量, 用MK886 100 μmol/L干预, 可见p-Erk表达量明显减少, 而使用Celecoxib 100 μmol/L干预, p-Erk表达量较对照组增加, 同时使用MK886 50 μmol/L+Celecoxib 80 μmol/L未见明显明显变化(图3A), 以t-Erk为内参, 实验结果经凝胶图象分析系统进行灰度扫描, 统计结果如图3B.
关于花生四烯酸体内两条主要代谢途径(COX2途径和5-LOX途径)对肿瘤的影响, 早期研究主要集中在前者, 首先报道了COX2在结肠癌中的高表达[9]. 随后, 通过RT-PCR检测到胰腺癌细胞中COX2 mRNA和蛋白表达的量是正常胰腺细胞的60倍, 在体外实验使用肿瘤诱导剂产生的胰腺癌细胞中COX2 mRNA和蛋白表达得到相似的结果[10], 并有研究发现非甾体类抗炎药对结直肠癌、胃癌、食管癌、胰腺癌等多种消化系肿瘤具有一定的化学预防作用, 并且研究发现, 将COX2拮抗剂和其他抗肿瘤药物联合应用对治疗胰腺癌有明显效果[11]. 近年来研究发现, 脂氧合酶中的5-LOX也与多种肿瘤的发生、发展和转移有关, 本实验进一步从转录水平上检测MK886对胰腺癌增殖的影响, 以及两条途径进行对比.
LTB4是5-LOX代谢途径的下游产物, 有研究发现LTB4本身刺激胰腺癌细胞生长, LTB4受体拮抗剂LY293111在体内外均阻滞胰腺癌生长[12]; 通过RT-PCR发现, LTB4的高亲和力受体BLT1也呈高表达. BLT1是G-蛋白偶联受体, 正常情况下, 仅表达于白细胞, 在胸腺和脾脏上少量表达, Hong等[13]在对结肠癌的研究中发现通过小干扰RNA敲除BLT1基因抑制BLT1蛋白的表达可减少结肠癌细胞的增殖, 并且使用BLT1抑制剂U75302后对Erk途径也有明显的抑制, 他们的出结论LTB4-BLT1信号途径与结肠癌细胞的增殖有关. 本实验也对BLT1进行了研究, 通过RT-PCR发现, 在胰腺癌细胞SW1990中BLT1呈高表达, 在使用MK886干预后, BLT1 mRNA的表达受到显著抑制作用, 因此, 在阻断5-LOX代谢途径的同时可以阻断LTB4-BLT1信号途径.
肿瘤细胞肿瘤的生长、浸润和转移都有赖于血管提供营养物质与氧气, 排除代谢产物, 持续的新生血管形成对实体瘤生长是一个关键因素, VEGF是刺激肿瘤血管生长的最主要因子, 在肿瘤新生血管生成中起着极其重要的作用, 研究表明VEGF在刺激血管内皮细胞增殖的同时可作为自分泌生长因子促进肿瘤自身的增殖. 在本次实验中, 通过RT-PCR在转录水平上检测到Celecoxib、MK886、MK886和Celecoxib的联合干预均可使VEGF的表达量明显减少, 且联合干预较单独干预效果更为明显. 因此, 阻断花生四烯酸的代谢, 对抑制肿瘤的生长及转移有明显作用.
MEK/Erk信号传导途径的激活可抑制凋亡, LOX的代谢物5-HETE、12-HETE和LTB4促进MEK/Erk磷酸化, 抑制癌细胞凋亡[14-16], 本研究通过Western blot结果显示, 通过MK886的干预, 可使Erk磷酸化明显受到抑制, 从而促进细胞的凋亡. 而Celecoxib对SW1990细胞Erk磷酸化起促进作用. 从而进一步证实了阻断COX2代谢途径会使花生四烯酸5-LOX代谢途径增强, 5-LOX代谢途径为花生四烯酸的主要代谢途径, 虽然MK886和Celecoxib的联合干预对Erk磷酸化的影响同对照组相比未有明显变化, 但肿瘤的凋亡为多基因联合作用, 不能因此推断联合干预对胰腺癌的凋亡无明显作用.
本文探讨了花生四烯酸代谢途径与胰腺癌的发生发展的关系, 证实了通过阻断花生四烯酸代谢可抑制胰腺癌细胞的增殖. 同时提示了在两条代谢途径中, 抑制5-LOX代谢途径起到更明显效果, 单独拮抗COX2途径虽然对肿瘤细胞增殖的抑制有一定的效果, 但作用并不明显, 而在联合拮抗中, 阻断COX2途径对肿瘤细胞增殖的抑制起到明显的辅助作用, 为临床胰腺癌的治疗提供新的思路.
胰腺癌是高度恶性肿瘤, 一般发现时患者大部分为中晚期, 五年生存率低, 且目前无特别有效的抗肿瘤药物, 因此对抑制胰腺肿瘤生长的研究尤为重要.
巩鹏, 教授, 大连医科大学附属第一医院普外二科
对花生四烯酸代谢产物与肿瘤相关性研究较多, 在胰腺癌方面, 大多对两条途径分别进行研究, 两条途径之间的比较较少.
针对BLT1与肿瘤相关性方面的研究, Aya Ihara等认为BLT1在结肠癌细胞中高表达, 抑制BLT1可阻断结肠癌细胞增值. 针对COX2途径与胰腺癌的关系中, 刘江伟的研究表明胰腺癌组织中P53的突变和COX2代谢途径在肿瘤的发生发展中起协同作用.
本文与其他相关文章比较, 更侧重对两条花生四烯酸两条代谢途径进行分析对比, 并对两条途径同时抑制进行研究分析, 从而得出更佳的抑制胰腺癌的方法.
本文旨在探讨通过阻断花生四烯酸代谢途径抑制胰腺癌细胞增殖. 整体上, 文章的立意尚可, 该方面的报道虽多, 但本文重点在于说明花生四烯酸的两条代谢途径均与胰腺癌的发生及增殖均有密切关系, 而抑制5-LOX途径较COX2途径相比, 抑制肿瘤细胞增殖作用更强.
编辑: 郭鹏 电编: 鲁亚静
| 1. | Asuthkar S, Rao JS, Gondi CS. Drugs in preclinical and early-stage clinical development for pancreatic cancer. Expert Opin Investig Drugs. 2012;21:143-152. [PubMed] [DOI] |
| 2. | Lionetto R, Pugliese V, Bruzzi P, Rosso R. No standard treatment is available for advanced pancreatic cancer. Eur J Cancer. 1995;31A:882-887. [PubMed] [DOI] |
| 3. | Philip PA, Benedetti J, Corless CL, Wong R, O'Reilly EM, Flynn PJ, Rowland KM, Atkins JN, Mirtsching BC, Rivkin SE. Phase III study comparing gemcitabine plus cetuximab versus gemcitabine in patients with advanced pancreatic adenocarcinoma: Southwest Oncology Group-directed intergroup trial S0205. J Clin Oncol. 2010;28:3605-3610. [PubMed] [DOI] |
| 4. | Arumugam T, Ramachandran V, Fournier KF, Wang H, Marquis L, Abbruzzese JL, Gallick GE, Logsdon CD, McConkey DJ, Choi W. Epithelial to mesenchymal transition contributes to drug resistance in pancreatic cancer. Cancer Res. 2009;69:5820-5828. [PubMed] [DOI] |
| 5. | Qiu MT, Ding XX, Hu JW, Tian HY, Yin R, Xu L. Fixed-dose rate infusion and standard rate infusion of gemcitabine in patients with advanced non-small-cell lung cancer: a meta-analysis of six trials. Cancer Chemother Pharmacol. 2012;70:861-873. [PubMed] [DOI] |
| 6. | Conroy T, Desseigne F, Ychou M, Bouché O, Guimbaud R, Bécouarn Y, Adenis A, Raoul JL, Gourgou-Bourgade S, de la Fouchardière C. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med. 2011;364:1817-1825. [PubMed] [DOI] |
| 7. | Von Hoff DD, Ramanathan RK, Borad MJ, Laheru DA, Smith LS, Wood TE, Korn RL, Desai N, Trieu V, Iglesias JL. Gemcitabine plus nab-paclitaxel is an active regimen in patients with advanced pancreatic cancer: a phase I/II trial. J Clin Oncol. 2011;29:4548-4554. [PubMed] [DOI] |
| 8. | Ko AH, Venook AP, Bergsland EK, Kelley RK, Korn WM, Dito E, Schillinger B, Scott J, Hwang J, Tempero MA. A phase II study of bevacizumab plus erlotinib for gemcitabine-refractory metastatic pancreatic cancer. Cancer Chemother Pharmacol. 2010;66:1051-1057. [PubMed] [DOI] |
| 9. | Eberhart CE, Coffey RJ, Radhika A, Giardiello FM, Ferrenbach S, DuBois RN. Up-regulation of cyclooxygenase 2 gene expression in human colorectal adenomas and adenocarcinomas. Gastroenterology. 1994;107:1183-1188. [PubMed] |
| 10. | Tucker ON, Dannenberg AJ, Yang EK, Zhang F, Teng L, Daly JM, Soslow RA, Masferrer JL, Woerner BM, Koki AT. Cyclooxygenase-2 expression is up-regulated in human pancreatic cancer. Cancer Res. 1999;59:987-990. [PubMed] |
| 11. | Ferrari V, Valcamonico F, Amoroso V, Simoncini E, Vassalli L, Marpicati P, Rangoni G, Grisanti S, Tiberio GA, Nodari F. Gemcitabine plus celecoxib (GECO) in advanced pancreatic cancer: a phase II trial. Cancer Chemother Pharmacol. 2006;57:185-190. [PubMed] [DOI] |
| 12. | Funk CD, Funk LB, FitzGerald GA, Samuelsson B. Characterization of human 12-lipoxygenase genes. Proc Natl Acad Sci USA. 1992;89:3962-3966. [PubMed] |
| 13. | Hong SH, Avis I, Vos MD, Martínez A, Treston AM, Mulshine JL. Relationship of arachidonic acid metabolizing enzyme expression in epithelial cancer cell lines to the growth effect of selective biochemical inhibitors. Cancer Res. 1999;59:2223-2228. [PubMed] |
| 14. | Yoshimura R, Inoue K, Kawahito Y, Mitsuhashi M, Tsuchida K, Matsuyama M, Sano H, Nakatani T. Expression of 12-lipoxygenase in human renal cell carcinoma and growth prevention by its inhibitor. Int J Mol Med. 2004;13:41-46. [PubMed] |
| 15. | Yoshimura R, Matsuyama M, Tsuchida K, Kawahito Y, Sano H, Nakatani T. Expression of lipoxygenase in human bladder carcinoma and growth inhibition by its inhibitors. J Urol. 2003;170:1994-1999. [PubMed] [DOI] |
| 16. | Yoshimura R, Matsuyama M, Mitsuhashi M, Takemoto Y, Tsuchida K, Kawahito Y, Sano H, Nakatani T. Relationship between lipoxygenase and human testicular cancer. Int J Mol Med. 2004;13:389-393. [PubMed] |