修回日期: 2014-01-01
接受日期: 2014-01-08
在线出版日期: 2014-03-08
目的: 系统评价超声内镜对早期食管癌术前分期的准确性.
方法: 在计算机上检索Medline、PubMed、Web of Science、Ovid、Cochrane Central Trials databases、万方、CBM、CNKI及维普数据库收集相关文献, 检索年限均从建库到2013-05, 全面收集国内外有关超声内镜对早期食管癌分期的相关研究, 手工检索相关杂志、会议论文集、学位论文汇编等. 按照诊断试验的纳入标准筛选文献, 提取纳入文献的特征信息(研究背景、设计信息和诊断参数信息), 根据诊断性试验质量评价工具(quality assessment of diagnostic accuracy studies, QUADAS)质量评价标准纳入文献的质量. 采用Meta-Disc1.4软件进行Meta分析, 检验异质性, 并根据异质性结果选择相应的效应模型. 对纳入文献予以加权定量合并, 计算汇总敏感度、特异度、阳性似然比、阴性似然比和诊断优势比及其95%CI, 绘制汇总受试者工作特征(summary receiver-operating characteristic curve, SROC)曲线, 并计算曲线下面积(area under curve, AUC). 然后根据研究对象的特点进行Meta回归分析来寻找潜在引起异质性的因素, 同时按Deville介绍的方法筛选并剔除异质性明显的研究进行亚组分析, 最后使用Stata10.0软件计算Begg-Mazumdar和Harbord-Egger指数来判断发表偏移并绘制漏斗图.
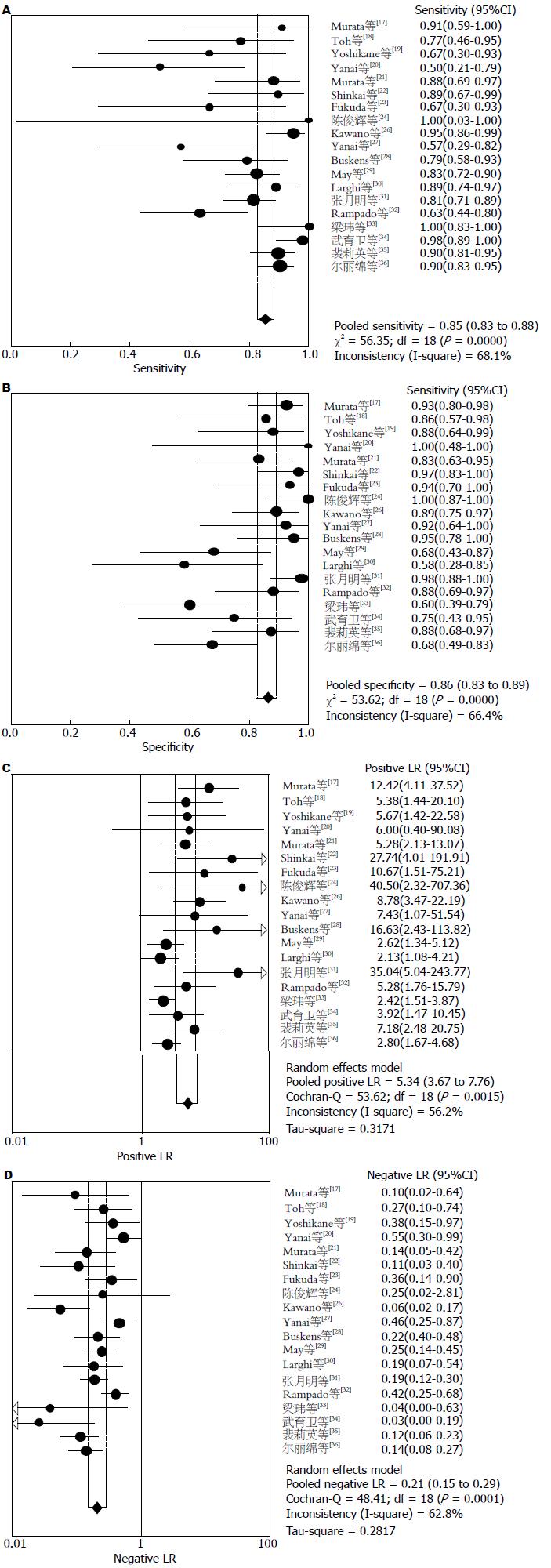
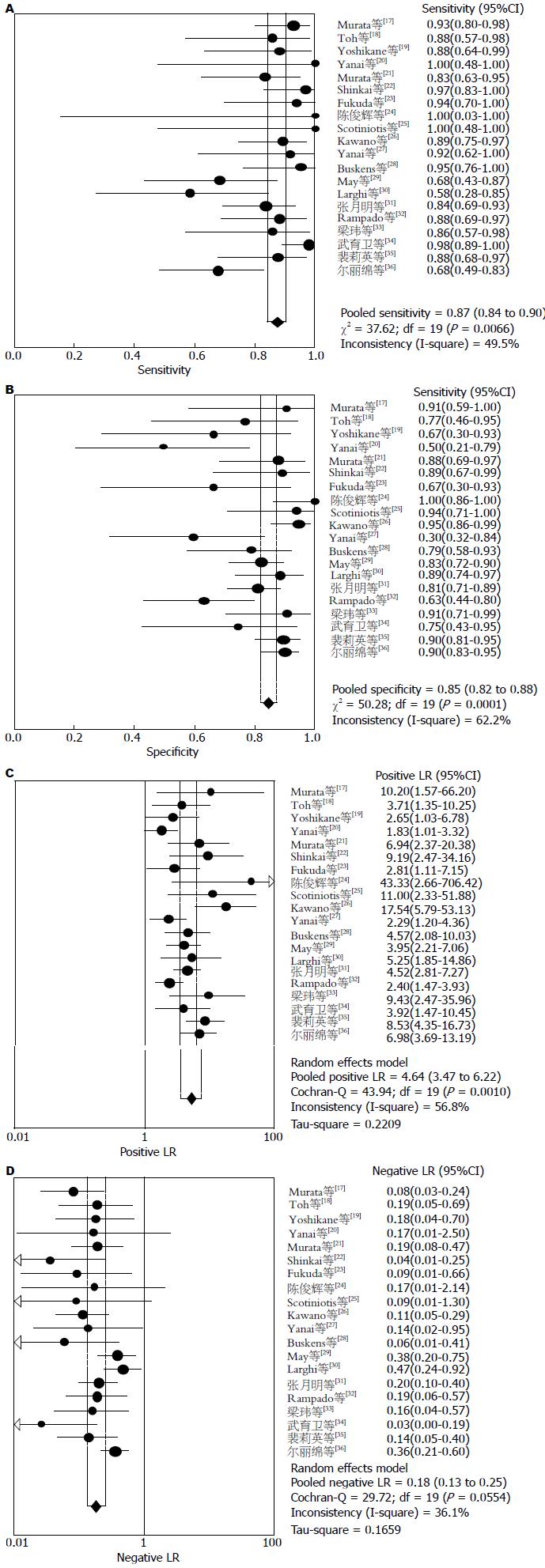
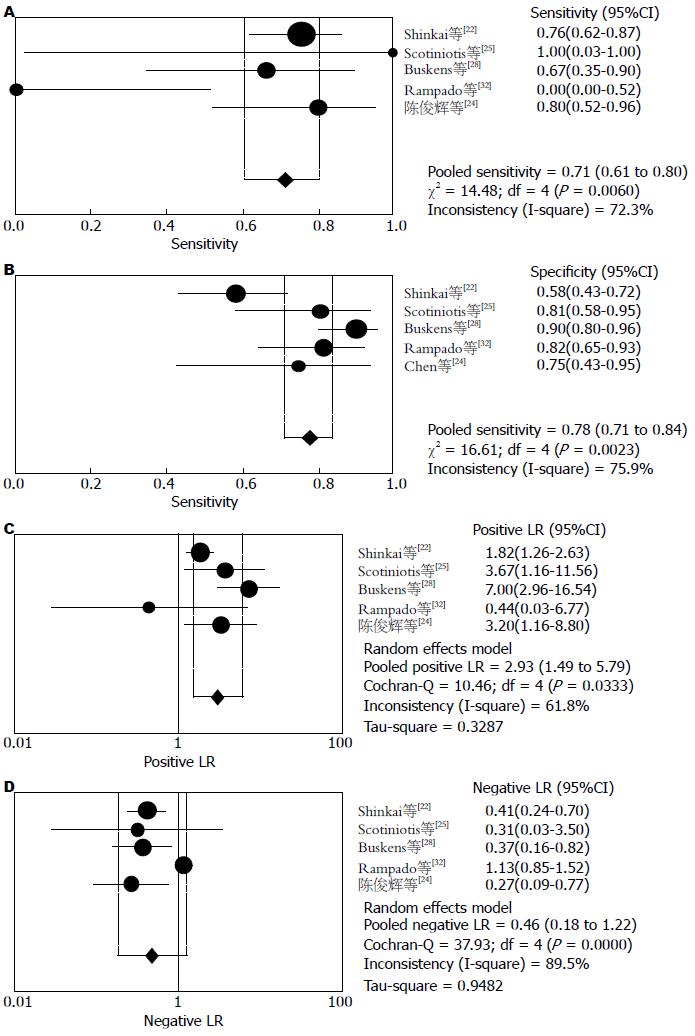
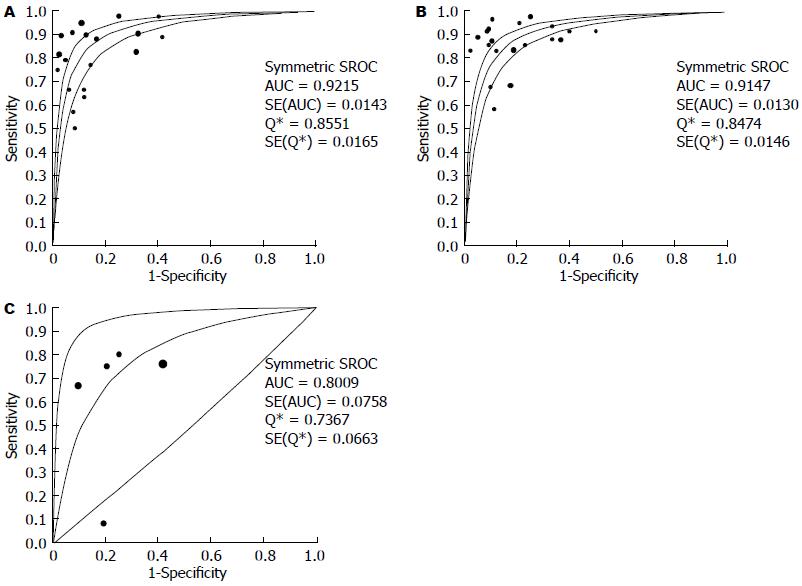
结果: 纳入文献20篇涉及研究对象共1115例. Meta分析结果提示: 超声内镜判断食管黏膜内癌T1m期汇总的敏感度、特异度、阳性似然比及阴性似然比是0.85(95%CI: 0.83-0.88), 0.86(95%CI: 0.83-0.89), 5.34(95%CI: 3.67-7.76), 0.21(95%CI: 0.15-0.29); 食管黏膜下癌T1sm期汇总的敏感度、特异度、阳性似然比及阴性似然比是0.87(95%CI: 0.84-0.90), 0.85(95%CI: 0.82-0.88), 4.64(95%CI: 3.47-6.22), 0.18(95%CI: 0.13-0.25); 早期食管癌N期汇总的敏感度、特异度、阳性似然比及阴性似然比是0.71(95%CI: 0.61-0.80), 0.78(95%CI: 0.71-0.84), 2.93(95%CI: 1.49-5.79), 0.46(95%CI: 0.18-1.22); T1m期和T1sm期拟合SROC曲线下面积AUC分别是0.921、0.915, N期拟合SROC曲线下面积AUC是0.80. Begg-Mazumdar法(P = 0.216)和Harbord-Egger法(P = 0.412)检验发表偏倚结果提示纳入Meta分析的文献结果之间无发表偏倚.
结论: 现有证据表明, 超声内镜能较准确鉴别食管早期癌病变的浸润深度, 食管黏膜内癌和食管黏膜下癌的准确性分期具有较高的敏感度和特异度, 但其结果受检查者的经验, 超声内镜选择及频率的种类等因素影响. 他对指导临床选择合理的手术方式和治疗手段具有重要意义.
核心提示: 本研究通过应用循证医学Meta分析的方法, 准确的评价了超声内镜(endoscopic ultrasonography, EUS)对早期食管癌的分期, 表明EUS具有较高的敏感度和特异度, 但其结果受检查者的经验, 超声内镜选择及频率的种类等因素影响.
引文著录: 周思思, 严苏, 陈卫昌, 史冬涛, 付婷. 超声内镜对早期食管癌术前分期准确性的Meta分析. 世界华人消化杂志 2014; 22(7): 988-999
Revised: January 1, 2014
Accepted: January 8, 2014
Published online: March 8, 2014
AIM: To evaluate the accuracy of endoscopic ultrasound (EUS) in the preoperative staging of early esophageal cancer.
METHODS: We searched the Medline, PubMed, Web of Science, Embase, Cochrane Central Trials, Wanfang, CBM, CNKI and VIP databases for relevant studies published. Study selection, quality assessment and data extraction were performed by two reviewers independently. Meta-Disc (version1.4) software was used to perform the meta-analysis for sensitivity, specificity, positive likelihood ratio (LR), and negative LR. Pooling results were derived (by) using the fixed-effect model when significant heterogeneity was not present, and the random-effect model was applied otherwise. A summary receiver-operating characteristic (SROC) curve was constructed. Furthermore, to explore the potential sources of heterogeneity, we used meta-regression to estimate the effect of the characteristics of the studies on the diagnostic accuracy of EUS. In addition, the outliers were identified by the method described by Deville and a subgroup analysis was performed by excluding the outliers. We used Stata statistical software (version 10.0) to assess the publication bias using the Begg-Mazumdar indictor and Harbord-Egger indictor.
RESULTS: Twenty studies with a total of 1115 patients were included in this analysis. The pooled sensitivity, specificity, and positive and negative likelihood ratio of EUS for T1m staging were 0.85 (95%CI: 0.83-0.88), 0.86 (95%CI: 0.83-0.89), 5.34 (95%CI: 3.67-7.76), and 0.21 (95%CI: 0.15-0.29), respectively. For stage T1sm, these results were 0.87 (95%CI: 0.84-0.90), 0.85 (95%CI: 0.82-0.88), 4.64 (95%CI: 3.47-6.22), and 0.18 (95%CI: 0.13-0.25). For stage N, these results were 0.71 (95%CI: 0.61-0.80), 0.78 (95%CI: 0.71-0.84), 2.93 (95%CI: 1.49-5.79), and 0.46 (95%CI: 0.18-1.22). The percent of area under the curve was 92.1% for both stage T1m and stage T1sm, and 80% for stage N. No significant publication bias was found with either the Begg-Mazumdar indictor (P = 0.216) or the Harbord-Egger indictor (P = 0. 412).
CONCLUSION: EUS has excellent sensitivity and specificity in diagnosing the T1 stage of early esophageal cancer. However, the frequency of EUS probe and the experience of the endosonographers can affect the diagnostic accuracy of EUS. EUS plays an important role in clinical selection of surgical approaches and treatments.
- Citation: Zhou SS, Yan S, Chen WC, Shi DT, Fu T. Accuracy of endoscopic ultrasound in preoperative staging of early esophageal cancer: A Meta-analysis. Shijie Huaren Xiaohua Zazhi 2014; 22(7): 988-999
- URL: https://www.wjgnet.com/1009-3079/full/v22/i7/988.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i7.988
食管癌是严重威胁人类健康的常见恶性肿瘤, 估计全球每年有20万例死于本病, 占男性恶性肿瘤发病率和病死率的第5位[1]. 我国是食管癌疾病高发国家之一, 近年来, 食管癌的治疗已经取得了长足进步, 文献显示, 早期食管癌治疗后5年生存率高达90%-100%, 而进展期癌5年生存率低于10%. 大量研究表明, 食管癌的浸润深度和淋巴结转移情况是影响食管癌预后的最重要因素[2]. 因此, 提高食管癌患者生存率及生活质量关键在于早期发现、早期诊断、早期治疗. 早期食管癌通常无症状, 临床表现缺乏特异性, 待出现吞咽困难等症状时, 往往已进入进展期, 故早期癌诊断比较困难. 早期食管癌是指病变仅局限于黏膜层和黏膜下层, 超声内镜(endoscopic ultrasonography, EUS)为早期食管癌的诊断及确定相应治疗方案给予很大帮助. 日本食管疾病学会(Japan Esophagus Study Disease, JESD)又将早期食管癌分为m1(限于黏膜上皮层)、m2(侵及黏膜固有层)、m3(侵及黏膜肌层)、sm1(侵及黏膜下层上1/3)、sm2(侵及黏膜下层中1/3)、sm3(侵及黏膜下层下1/3)等类型[3]. EUS主要从淋巴结的大小、形态、边界、内部回声等方面判断有无淋巴结转移. 恶性淋巴结多>1 cm, 呈圆形, 边界较清, 内部回声不均匀. 食管癌手术可切除性的判定主要来源于纵隔脏器是否被浸润, EUS可以清晰显示胸主动脉、气管、心包、下腔静脉等. 食管癌的病死率高, 手术风险大, 因此术前分期很关键. 大量研究表明, 上皮内癌、黏膜内癌是内镜下黏膜切除术(endoscopic mucosal resection, EMR)、内镜下黏膜剥离术(endoscopic submucosal dissection, ESD)治疗绝对适应证, 并与传统外科手术治疗具有等同临床价值[4,5], 而黏膜下癌通常行外科手术治疗. 一项多中心观察报告指出在食管癌的手术治疗病死率为3%-13%, 复发率则高40%-50%[6-9], 而内镜下的EMR/ESD治疗有较低的复发率(1%-3%)和病死率(0%)并能保持组织结构的完整性, 提高患者的生活质量[10-12]. 因此EUS在鉴别早期食管癌的T1m期和T1sm期中起着关键性的作用, 在评价肿瘤的可切除性、治疗方案的制定、术式的选择、预后评估等具有重要的意义. 本研究通过应用循证医学Meta分析的方法, 全面收集国内外有关EUS对早期食管癌术前分期的准确性的相关研究, 评价EUS临床应用价值并为其临床早期诊治食管癌提供科学依据.
数据库查找有关EUS诊断早期食管癌的文献, 按照诊断试验的纳入标准筛选文献, 提取纳入文献的特征信息(研究背景、设计信息和诊断参数信息), 进行系统性评价分析. 在计算机上检索Medline、PubMed、Web of Science、Ovid、Cochrane Central Trials databases、万方、CBM、CNKI及维普数据库收集相关文献, 检索年限均从建库到2013-05, 全面收集国内外有关超声内镜对早期食管癌术前分期诊断的相关研究, 手工检索相关杂志、会议论文集、学位论文汇编等. 对纳入研究的参考文献进行检索以获取补充资料. 文献检索策略采用主题词和自由词结合的原则, 检索词包括: early esophageal cancers; endoscopic ultrasound; endoscopic classification; diagnostic accuracy; 早期食管癌、癌前病变、超声内镜、T1分期等. 由两位研究者分别独立提取文献信息, 其中包括研究作者、发表年限、地区、样本量、性别、年龄、金标准、评价指标等. 如存在争议, 通过与第三方讨论解决分歧.
1.2.1 文献纳入和排除标准: 同时符合以下条件的文献被纳入: (1)研究目的为评价EUS对早期食管癌术前分期诊断准确性的相关临床研究; (2)所有纳入的研究对象均进行EUS检查以评价癌肿的浸润程度及N分期; (3)以病理组织学或细胞学活检的结果为金标准; (4)若数据重复发表, 选择其中最详尽的数据或最近发表的文章; (5)文章能直接或间接提供数据, 可分别计算真阳性值(true Positive, TP)、假阳性值(false positive, FP)、真阴性值(true negative, TN)、假阴性值(false negative, FN). 文献排除标准: (1)数据不完整或数据有误; (2)病例未经"金标准"确诊; (3)文摘、综述、讲座和述评文献; (4)无法获得全文者.
1.2.2 文献资料提取及文献质量的评估: 主要包括作者、发表时间、患者的年龄、样本量及诊断试验的参数信息. 计算各文献的敏感度、特异度、阳性和阴性似然比. 用诊断性试验质量评价工具(quality assessment of diagnostic accuracy studies, QUADAS)评价文献质量[13], 每个项目按"是"、"否"、"不清楚"3个标准进行评价, 若14条质量评价标准均满足则研究存在偏倚的可能性极低(A级); 如果其中任何一条或多条质量评价标准仅部分满足即不清楚, 则该研究存在偏倚的可能性为中等(B级); 如果其中任何一条或多条质量评价标准完全不满足即未采用或不正确, 则该研究存在偏倚的可能性为高度(C级). 2名评价员独立完成文献质量评估及资料提取, 有分歧时通过讨论解决.
统计学处理 首先, 使用MetaDiSc1.4软件分析异质性, 采用卡方检验或产值进行异质性检验, P<0.05或, I2>50%时认为研究结果存在异质性. 接着, 根据异质性的有无采用随机效应模型(random effects models, REM)或固定效应模型(fixed effects model, FEM)计算合并灵敏度、特异度、阳性似然比、阴性似然比等指标, 同时绘制汇总受试者工作特征曲线(summary receiver-operating characteristic curve, SROC), 估计试验的总诊断精确度. 然后, 根据研究对象的特点进行Meta回归分析来寻找潜在引起异质性的因素, 同时按Deville等[14]介绍的方法筛选并剔除异质性明显的研究进行亚组分析. 最后, 使用Stata10.0软件计算Begg-Mazumdar和Harbord-Egger指数来判断发表偏移[15,16].
最初检索到相关文献548篇, 经过阅读文题及摘要后, 排除综述类文章及信件, 筛选得到68篇文献, 仔细查阅全文后. 严格根据纳入排除标准筛选, 20篇文献符合纳入标准, 包括1115例早期食管癌患者. 纳入的20篇文献[17-36]发表年限在1988-2013年. 其中日本的研究9篇, 中国的研究6篇, 美国的研究2篇, 德国、荷兰、意大利的研究各1篇, 所有病例组患者均经术后病理组织学或细胞学证实为早期食管癌. 所有纳入研究均提供了完善的四格表资料. 纳入研究的基线特征如表1.
| 文献来源 | 年份 | 国家 | 超声内镜频率(MHz) | n | 研究形式 | 确诊方式 |
| Murata等[17] | 1988 | Japan | 7.5,10 | 52 | retrospective | surgery |
| Toh等[18] | 1993 | Japan | 7.5,12 | 26 | retrospective | surgery |
| Yoshikane等[19] | 1994 | Japan | 7.5,12 | 26 | prospective | surgery or EMR |
| Yanai等[20] | 1996 | Japan | 20 | 17 | prospective | surgery or EMR |
| Murata等[21] | 1996 | Japan | 15,20 | 49 | prospective | surgery or EMR |
| Shinkai等[22] | 2000 | Japan | 7.5,12,15,20 | 50 | prospective | surgery or EMR |
| Fukuda等[23] | 2000 | Japan | 12, 20 | 25 | prospective | surgery |
| 陈俊辉等[24] | 2000 | China | 12,15, 20 | 30 | prospective | surgery or EMR |
| Scotiniotis等[25] | 2001 | USA | 7.5,12 | 22 | prospective | surgery |
| Kawano等[26] | 2003 | Japan | 20 | 96 | prospective | surgery or EMR |
| Yanai等[27] | 2003 | Japan | 12, 20 | 26 | prospective | surgery or EMR |
| Buskens等[28] | 2004 | Netherland | 7.5,12, 20, 30 | 45 | retrospective | surgery |
| May等[29] | 2004 | Germany | 20 | 93 | prospective | surgery or EMR |
| Larghi等[30] | 2005 | USA | 7.5, 20 | 48 | prospective | surgery or EMR |
| 张月明等[31] | 2008 | China | 7.5,12, 20 | 121 | prospective | surgery or EMR |
| Rampado等[32] | 2008 | Italy | 20 | 55 | prospective | surgery or EMR |
| 梁玮等[33] | 2009 | China | 7.5,12, 20 | 36 | prospective | surgery or EMR |
| 武育卫等[34] | 2011 | China | 12, 20 | 61 | prospective | surgery or EMR |
| 裴莉英等[35] | 2012 | China | 20 | 102 | prospective | surgery or EMR/ESD |
| 尔丽绵等[36] | 2013 | China | 15, 20 | 135 | retrospective | surgery or EMR |
2.2.1 Meta分析: Meta分析异质性检验后发现研究之间存在异质性, 采用随机效应模型进行Meta分析. 结果显示: T1m期汇总的敏感度、特异度、阳性似然比及阴性似然比是0.85(95%CI: 0.83-0.88)(图1A), 0.86(95%CI: 0.83-0.89(图1B), 5.34(95%CI: 3.67-7.76)(图1C), 0.21(95%CI: 0.15-0.29)(图1D); T1sm期汇总的敏感度、特异度、阳性似然比及阴性似然比是0.87(95%CI: 0.84-0.90)(图2A), 0.85(95%CI: 0.82-0.88)(图2B), 4.64(95%CI: 3.47-6.22)(图2C), 0.18(95%CI: 0.13-0.25)(图2D); 早期食管癌N期汇总的敏感度、特异度、阳性似然比及阴性似然比是0.71(95%CI:0.61-0.80)(图3A), 0.78(95%CI:0.71-0.84)(图3B), 2.93(95%CI: 1.49-5.79)(图3C), 0.46(95%CI:0.18-1.22)(图3D); T1m期和T1sm期拟合SROC曲线下面积AUC分别是0.921、Q = 0.855(图4A), 0.915、Q = 0.847(图4B), N期拟合SROC曲线下面积AUC分别是0.80、Q = 0.736(图4C).
2.2.2 回归分析: 根据研究特点, 针对研究年限(1988-2000年对2001-2013年)、诊断设备[EUS对小探头超声内镜(mini-probe sonography, MPS)]和研究国家(日本、中国对其他)等进行逐一回归分析, 结果发现研究国家存在明显的异质性, 超声内镜的选择和研究年限在回归分析中没有明显的影响(表2). 根据上述结果再次进行亚组分析: (1)研究年限在1988-2000年; (2)研究年限2001-2013年; (3)EUS检查病变组; (4)联合使用20 MHz的EUS检查病变组; (5)日本的研究病例组; (6)中国的研究病例组(表3). 我们发现研究年限在1988-2000年的T1m期、T1sm期诊断DOR(39.99、32.58)较2001-2013年DOR(28.99、28.89)增高, 提示诊断实验的判别效果较前好, 并发现同时联合应用高频微小探头检查的研究组的诊断DOR(37.01、34.28)较仅用低频超声探头组的诊断DOR(29.35、30.56)高, 更有趣的发现是来自日本和中国研究组的诊断DOR值明显高于其他国家的水平, SROC曲线下面积AUC分别为0. 95、0.95, 提示诊断试验的诊断准确性较高.
| 回归分析 | 回归系数 | P值 | OR值(95%CI) |
| 年限(1988-2000年对2001-2013年) | 0.240 | 0.726 | 1.27(0.30-5.42) |
| 诊断设备(EUS对MPS) | -0.043 | 0.448 | 0.96(0.85-1.08) |
| 国家(日本、中国对其他) | 0.962 | 0.034 | 2.62(1.09-6.30) |
| n | 敏感度(95%CI) | 特异度(95%CI) | OR值 (95%CI) | AUC | |
| T1m期 | |||||
| 总体研究 | 19 | 0.86(0.83-0.88) | 0.86(0.82-0.89) | 35.24(23.02-75.04) | 0.92 |
| 研究时间1988-2000年 | 5 | 0.77(0.66-0.86) | 0.89(0.81-0.94) | 28.99(11.44-72.92) | 0.93 |
| 研究时间2001-2013年 | 14 | 0.87(0.84-0.90) | 0.85(0.81-0.89) | 39.99(20.19-79.19) | 0.93 |
| EUS | 3 | 0.79(0.61-0.91) | 0.90(0.81-0.96) | 29.35(8.63-99.85) | 0.93 |
| EUS+20 MHz | 16 | 0.86(0.83-0.89) | 0.85(0.81-0.89) | 37.01(20.32-67.40) | 0.96 |
| 日本EUS+20 MHz | 9 | 0.83(0.76-0.89) | 0.91(0.85-0.96) | 53.95(21.42-135.71) | 0.95 |
| 中国EUS+20 MHz | 6 | 0.92(0.88-0.95) | 0.82(0.74-0.88) | 51.40(20.92-125.31) | 0.95 |
| 其他国家EUS+20 MHz | 4 | 0.80(0.73-0.86) | 0.81(0.70-0.89) | 13.71(6.62-28.8) | 0.86 |
| T1sm期 | |||||
| 总体研究 | 20 | 0.87(0.84-0.90) | 0.85(0.82-0.88) | 30.27(19.36-47.33) | 0.91 |
| 研究时间1988-2000年 | 8 | 0.89(0.81-0.94) | 0.77(0.66-0.86) | 28.89(11.44-72.92) | 0.93 |
| 研究时间2001-2013 | 12 | 0.87(0.82-0.90) | 0.86(0.83-0.89) | 32.58(18.54-52.27) | 0.92 |
| EUS | 4 | 0.91(0.82-0.96) | 0.84(0.71-0.93) | 30.56(11.04-108.19) | 0.91 |
| EUS+20 MHz | 16 | 0.86(0.82-0.90) | 0.85(0.82-0.88) | 34.28(18.15-50.51) | 0.96 |
| 日本的研究 | 9 | 0.91(0.85-0.96) | 0.83(0.76-0.89) | 54.24(21.67-135.74) | 0.95 |
| 中国的研究 | 6 | 0.85(0.78-0.91) | 0.89(0.85-0.93) | 33.17(16.89-65.17) | 0.92 |
| 其他国家的研究 | 5 | 0.81(0.70-0.89) | 0.80(0.73-0.86) | 13.71(6.62-28.38) | 0.86 |
2.2.3 发表偏倚分析结果: Begg-Mazumdar法检验发表偏倚结果提示的Kendall's tau b值为16(P = 0.216), 其相应的漏斗图各散点分布均匀, 且都在可信区间内; Harbord-Egger检验结果为t = 0.350(95%CI: -0.2310-1.2781, P = 0.412), Egger回归图截距段横跨0点. 故纳入Meta分析的文献结果之间无发表偏倚.
食管癌是较常见的食管疾病, 恶性程度高, 晚期患者手术机会小, 生存率较低, 而早期食管癌的5年生存率高达90%-100%, 因此根治的关键是提高早期诊断率. 早期食管癌及癌前病变的内镜下表现轻微或无异常表现, 常规内镜发现率不高[37,38], 超声内镜是近十几年来兴起的一种将内镜与超声结合为一体的新型检查技术, 一方面通过内镜直接观察消化系腔内的形态改变, 一方面又可以进行实时超声扫描, 以获得管道层次的组织学特征及周围邻近脏器的超声图像, 从而提高了内镜与超声的双重诊断水平. 而超声微探头的使用始于1992年, 与普通超声内镜相比, 其具有频率高、可直视下操作、用途广泛等特点, 尤其适用于早期癌的诊断及黏膜下微小病变的鉴别, 指导黏膜及黏膜下病变的内镜切除. 对于早期食管癌, 超声内镜检查的意义在于精确区分癌灶的大小、边缘、包膜、内部回声及其均匀性、有无周围淋巴结肿大和邻近脏器情况, 特别是准确评估病变的浸润深度, 在明确病变未超过黏膜肌层, 无淋巴结转移时, 采取EMR和ESD治疗将病变精确切除, 患者可以治愈, 并较外科手术更安全, 创伤更小[39,40]. 在过去的20年中, 超声内镜对于早期食管癌分期的准确性有大量的研究报道, 部分研究表明EUS高估了病变浸润深度, 对可切除性的评估较为保守; 或EUS低估了病变浸润深度, 造成对内镜可切除性的评估不充分.
本研究通过采用诊断试验的系统评价方法对超声内镜在早期食管癌分期的诊断准确性价值进行分析并寻找影响异质性的因素. 本Meta分析总共纳入20篇文献, 共有1115例研究对象, 通过QUADAS方法对纳入文献的评价结果显示文献质量评分为A的16篇, 为B的2篇, 为C的1篇. 纳入研究间未发现发表偏移. Meta分析结果显示: EUS对T1m-T1sm期的诊断准确性均较高, 其合并敏感性(sensitivity, se)分别为85.0%、87.0%, 合并特异性(specificity, sp)分别为86.0%、85.0%, EUS对早期食管癌N分期的并se和sp分别为71%和78%, 但N期指标总体准确性均低于T1分期. T1m期、T1sm期及N期的汇总阳性似然比(positive likelihood ratio, PLR)分别为5.34、4.64、2.93, 提示EUS试验结果为阳性时, 疑似病例可基本确诊为恶性肿瘤; T1m期、T1sm期及N期的汇总阴性似然比(negative likelihood ratio, NLR)分别为0.21、0.18、0.46, 提示诊断试验结果为阴性时, 疑似病例可基本排除为恶性肿瘤; T1m期、T1sm期及N期的诊断汇总DOR分别为34.17、30.56、6.64, 提示诊断试验的判断效果较好, T1m期、T1sm期及N期的SROC AUC分别为0. 92、0.91、0.80, 提示诊断试验的诊断准确性较高. 以上结果表明, EUS对于早期食管癌的T1m、T1sm分期诊断具有较高的敏感度和特异度, 诊断准确性较好, 可以作为T1分期重要的检测手段, 同时EUS对N分期具有较低的敏感度和特异度, 诊断确性较差. 为探讨异质性来源, 我们进行了回归分析和亚组分析, 我们发现来自日本和中国的研究有较高的敏感性、特异性、阳性似然比、DOR和较低的阴性似然比, 这些结果与Thosani[41]于2012年新近发表的荟萃分析结果相似, 我们进一步的回归分析推测可能与不同的操作医生的经验有关, Tsuzuki[42]报道, 影响EUS对上消化道浅表癌内镜下可切除性判断能力的主要因素如下: (1)内镜操作医生的主观因素: 主要是操作经验的影响, 操作不熟练时, 对超声探头的探查位置控制不当, 超声波不能与病灶部位垂直而有倾斜、偏向扫描, 导致影像显示不佳; 经验不足时, 对超声图像的判读也易有误; 另外, 当胃镜病理已确诊为癌, 而 EUS下不能十分明确地区分浸润深度时, 由于担心患者潜在淋巴结转移的风险, 操作医生更倾向于出具黏膜下层受侵犯的报告而建议患者手术切除; (2)器械的影响: 当采用15 MHz以下的频率探查时, 对浅表病变显示的清晰度不够, 不易察觉局部的微小破坏; (3)病变本身的影响: 溃疡表面坏死组织及瘢痕纤维化和结缔组织增生, 周围的炎症误认为肿瘤浸润, 易造成分期过度; 病变面积过大时, 小探头不能全面探查, 可能漏诊黏膜下层浸润. 我们同时在对超声内镜的使用频率不同进行亚组分析中发现, 联合应用20 MHz的EUS组较EUS的研究组的敏感性、特异性及DOR值增高, Murata[21]报道高频微小探头超声其对黏膜层、黏膜下层、固有肌层的诊断准确率可分别达到100%、83%、100%. 20 MHz微探头穿透深度为1 cm, 可分辨相距仅0.2 mm的两个点, 与频率为7.5 MHz和12 MHz的传统超声内镜相比, 频率为20 MHz的超声微探头对黏膜层和黏膜下层具有更高的分辨率.
由于本次纳入研究的文献仅为英文和中文, 可能遗漏使用其他语言撰写的研究, 而且文献结果间存在不同层面的偏倚. 纳入研究对早期食管癌淋巴结转移情况的评价方法存在一定差异, 多数研究仅评价是否存在淋巴结转移(即N-或N ), 仅少数研究严格按照UICC, 故本研究纳入相关研究样本量较小, 该结论尚需大样本诊断试验研究加以证实.
总之, 我们系统评价的结果提示超声内镜对诊断早期食管癌T1m期和T1sm期的准确性分期具有较高的敏感度和特异度, 但其结果受检查者的经验, 超声内镜选择及频率的种类等因素影响. 在未来的研究中需进一步的探究相关的影响因素并且能使超声内镜的检查标准化, 从而全面提高早期食管癌诊断的准确性.
我国是食管癌高发国家之一, 提高食管癌患者生存率及生活质量关键在于早发现、早诊断、早治疗. 超声内镜(endoscopic ultrasonography)在评价食管肿瘤的可切除性、治疗方案的制定、术式的选择、预后评估等具有重要的意义.
杨薇, 副主任医师, 副教授, 北京大学肿瘤医院超声科
虽然超声内镜(endoscopic ultrasonography)有较高的诊断率, 但其结果存在一定的假阳性率和假阴性率, 使其在临床的诊断价值受到争议和广泛推广受到限制.
近年来国内外研究显示该技术能明显提高早期食管癌的诊断能力, 但各家报道不一, 并且样本量不大, 故对早期食管癌的诊断价值尚不肯定.
本研究通过应用循证医学Meta分析的方法, 汇集国内外有关超声内镜(endoscopic ultrasonography, EUS)对早期食管癌术前分期的准确性的相关研究, 减少了因各中心小样本的病例分析而出现的差异, 更准确的评价EUS的临床价值.
本研究显示超声内镜(endoscopic ultrasonography)能较准确鉴别食管早期癌病变的浸润深度, 对食管早期癌的准确性分期具有较高的敏感度和特异度, 但其结果受检查者的经验, 超声内镜选择及频率的种类等因素影响. 他对指导临床选择合理的手术方式和治疗手段具有重要意义.
本研究目的合理, 有可行性及临床意义, 收集的文献较全面, Meta分析步骤合理, 明确了EUS的诊断价值.
编辑: 郭鹏 电编:鲁亚静
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 3. | Fujishiro M. Endoscopic submucosal dissection for stomach neoplasms. World J Gastroenterol. 2006;12:5108-5112. [PubMed] [DOI] |
| 4. | Ishikawa S, Togashi A, Inoue M, Honda S, Nozawa F, Toyama E, Miyanari N, Tabira Y, Baba H. Indications for EMR/ESD in cases of early gastric cancer: relationship between histological type, depth of wall invasion, and lymph node metastasis. Gastric Cancer. 2007;10:35-38. [PubMed] [DOI] |
| 6. | Stahl M, Budach W, Meyer HJ, Cervantes A. Esophageal cancer: Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2010;21 Suppl 5:v46-v49. [PubMed] [DOI] |
| 7. | Millikan KW, Silverstein J, Hart V, Blair K, Bines S, Roberts J, Doolas A. A 15-year review of esophagectomy for carcinoma of the esophagus and cardia. Arch Surg. 1995;130:617-624. [PubMed] [DOI] |
| 8. | Svanes K, Stangeland L, Viste A, Varhaug JE, Grønbech JE, Søreide O. Morbidity, ability to swallow, and survival, after oesophagectomy for cancer of the oesophagus and cardia. Eur J Surg. 1995;161:669-675. [PubMed] |
| 9. | Hünerbein M, Ulmer C, Handke T, Schlag PM. Endosonography of upper gastrointestinal tract cancer on demand using miniprobes or endoscopic ultrasound. Surg Endosc. 2003;17:615-619. [PubMed] [DOI] |
| 10. | Crumley AB, Going JJ, McEwan K, McKernan M, Abela JE, Shearer CJ, Stanley AJ, Stuart RC. Endoscopic mucosal resection for gastroesophageal cancer in a U.K. population. Long-term follow-up of a consecutive series. Surg Endosc. 2011;25:543-548. [PubMed] [DOI] |
| 11. | Pech O, Behrens A, May A, Nachbar L, Gossner L, Rabenstein T, Manner H, Guenter E, Huijsmans J, Vieth M. Long-term results and risk factor analysis for recurrence after curative endoscopic therapy in 349 patients with high-grade intraepithelial neoplasia and mucosal adenocarcinoma in Barrett's oesophagus. Gut. 2008;57:1200-1206. [PubMed] [DOI] |
| 12. | Whiting P, Rutjes AW, Reitsma JB, Bossuyt PM, Kleijnen J. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews. BMC Med Res Methodol. 2003;3:25. [PubMed] [DOI] |
| 13. | Reed CE. Surgical management of esophageal carcinoma. Oncologist. 1999;4:95-105. [PubMed] |
| 14. | Devillé WL, Buntinx F, Bouter LM, Montori VM, de Vet HC, van der Windt DA, Bezemer PD. Conducting systematic reviews of diagnostic studies: didactic guidelines. BMC Med Res Methodol. 2002;2:9. [PubMed] [DOI] |
| 15. | Begg CB, Mazumdar M. Operating characteristics of a rank correlation test for publication bias. Biometrics. 1994;50:1088-1101. [PubMed] [DOI] |
| 16. | Harbord RM, Egger M, Sterne JA. A modified test for small-study effects in meta-analyses of controlled trials with binary endpoints. Stat Med. 2006;25:3443-3457. [PubMed] [DOI] |
| 17. | Murata Y, Suzuki S, Hashimoto H. Endoscopic ultrasonography of the upper gastrointestinal tract. Surg Endosc. 1988;2:180-183. [PubMed] [DOI] |
| 18. | Toh Y, Baba K, Ikebe M, Adachi Y, Kuwano H, Sugimachi K. Endoscopic ultrasonography in the diagnosis of an early esophageal carcinoma. Hepatogastroenterology. 1993;40:212-216. [PubMed] |
| 19. | Yoshikane H, Tsukamoto Y, Niwa Y, Goto H, Hase S, Shimodaira M, Maruta S, Miyata A, Yoshida M. Superficial esophageal carcinoma: evaluation by endoscopic ultrasonography. Am J Gastroenterol. 1994;89:702-707. [PubMed] |
| 20. | Yanai H, Yoshida T, Harada T, Matsumoto Y, Nishiaki M, Shigemitsu T, Tada M, Okita K, Kawano T, Nagasaki S. Endoscopic ultrasonography of superficial esophageal cancers using a thin ultrasound probe system equipped with switchable radial and linear scanning modes. Gastrointest Endosc. 1996;44:578-582. [PubMed] [DOI] |
| 21. | Murata Y, Suzuki S, Ohta M, Mitsunaga A, Hayashi K, Yoshida K, Ide H. Small ultrasonic probes for determination of the depth of superficial esophageal cancer. Gastrointest Endosc. 1996;44:23-28. [PubMed] [DOI] |
| 22. | Shinkai M, Niwa Y, Arisawa T, Ohmiya N, Goto H, Hayakawa T. Evaluation of prognosis of squamous cell carcinoma of the oesophagus by endoscopic ultrasonography. Gut. 2000;47:120-125. [PubMed] [DOI] |
| 23. | Fukuda M, Hirata K, Natori H. Endoscopic ultrasonography of the esophagus. World J Surg. 2000;24:216-226. [PubMed] [DOI] |
| 25. | Scotiniotis IA, Kochman ML, Lewis JD, Furth EE, Rosato EF, Ginsberg GG. Accuracy of EUS in the evaluation of Barrett's esophagus and high-grade dysplasia or intramucosal carcinoma. Gastrointest Endosc. 2001;54:689-696. [PubMed] [DOI] |
| 26. | Kawano T, Ohshima M, Iwai T. Early esophageal carcinoma: endoscopic ultrasonography using the Sonoprobe. Abdom Imaging. 2003;28:477-485. [PubMed] [DOI] |
| 27. | Yanai H, Harada T, Okamoto T, Hirano A, Takeo N, Yoshida T, Okita K, Kawano T. Prognostic value and interobserver agreement of endoscopic ultrasonography for superficial squamous cell carcinoma of the esophagus: a prospective study. Int J Gastrointest Cancer. 2003;34:1-8. [PubMed] [DOI] |
| 28. | Buskens CJ, Westerterp M, Lagarde SM, Bergman JJ, ten Kate FJ, van Lanschot JJ. Prediction of appropriateness of local endoscopic treatment for high-grade dysplasia and early adenocarcinoma by EUS and histopathologic features. Gastrointest Endosc. 2004;60:703-710. [PubMed] [DOI] |
| 29. | May A, Günter E, Roth F, Gossner L, Stolte M, Vieth M, Ell C. Accuracy of staging in early oesophageal cancer using high resolution endoscopy and high resolution endosonography: a comparative, prospective, and blinded trial. Gut. 2004;53:634-640. [PubMed] [DOI] |
| 30. | Larghi A, Lightdale CJ, Memeo L, Bhagat G, Okpara N, Rotterdam H. EUS followed by EMR for staging of high-grade dysplasia and early cancer in Barrett's esophagus. Gastrointest Endosc. 2005;62:16-23. [PubMed] [DOI] |
| 31. | 张 月明, 程 贵余, 贺 舜, 苏 凯, 吕 宁, 薛 丽燕, 倪 晓光, 张 蕾, 赖 少清, 李 晓燕. 联合应用超声内镜与超声小探头在早期食管癌术前分期中的作用. 中华消化内镜杂志. 2008;25:138-141. |
| 32. | Rampado S, Bocus P, Battaglia G, Ruol A, Portale G, Ancona E. Endoscopic ultrasound: accuracy in staging superficial carcinomas of the esophagus. Ann Thorac Surg. 2008;85:251-256. [PubMed] [DOI] |
| 34. | 武 育卫, 彭 贵勇, 胡 文华, 高 春芳, 郭 先科, 房 殿春. 食管早期癌和癌前病变超声内镜诊断及内镜下食管黏膜切除术的临床研究. 胃肠病学和肝病学杂志. 2011;20:785-788. |
| 36. | 尔 丽绵, 张 立玮, 徐 志彬, 袁 丽, 吴 明利, 王 顺平, 高 扬, 曹 颖. 超声小探头对高发区早期食管癌及癌前病变术前治疗的评估及其影响因素. 中国内镜杂志. 2013;19:239-242. |
| 37. | Lu Z, Huang XQ. Advanced in diagnosis of esophageal cancer. Shiiie Huaren Xiaohua Zazhi. 2000;8:1017-1019. |
| 38. | Zheng GL. Endoscopic sequence diagnosis of esophageal cancer. Shiiie Huaren Xiaohua Zazhi. 2000;8:1019-1020. |
| 39. | Kelly S, Harris KM, Berry E, Hutton J, Roderick P, Cullingworth J, Gathercole L, Smith MA. A systematic review of the staging performance of endoscopic ultrasound in gastro-oesophageal carcinoma. Gut. 2001;49:534-539. [PubMed] [DOI] |
| 40. | Tajima Y, Nakanishi Y, Ochiai A, Tachimori Y, Kato H, Watanabe H, Yamaguchi H, Yoshimura K, Kusano M, Shimoda T. Histopathologic findings predicting lymph node metastasis and prognosis of patients with superficial esophageal carcinoma: analysis of 240 surgically resected tumors. Cancer. 2000;88:1285-1293. [PubMed] [DOI] |
| 41. | Thosani N, Singh H, Kapadia A, Ochi N, Lee JH, Ajani J, Swisher SG, Hofstetter WL, Guha S, Bhutani MS. Diagnostic accuracy of EUS in differentiating mucosal versus submucosal invasion of superficial esophageal cancers: a systematic review and meta-analysis. Gastrointest Endosc. 2012;75:242-253. [PubMed] [DOI] |
| 42. | Tsuzuki T, Okada H, Kawahara Y, Nasu J, Takenaka R, Inoue M, Kawano S, Kita M, Hori K, Yamamoto K. Usefulness and problems of endoscopic ultrasonography in prediction of the depth of tumor invasion in early gastric cancer. Acta Med Okayama. 2011;65:105-112. [PubMed] [DOI] |