修回日期: 2013-12-24
接受日期: 2013-12-25
在线出版日期: 2014-02-28
目的: 构建裸鼠人肝癌种植瘤模型, 观察沉默特异性蛋白3(specificity protein 3, Sp3)对裸鼠人肝癌种植瘤侵袭能力的影响, 并探讨其机制.
方法: 将Sp3 shRNA转染人肝癌HepG2细胞, 并设无关序列阴性组及空白组为对照, 建立3组裸鼠人肝癌种植瘤模型. 观察裸鼠肿瘤的成瘤率, 瘤体进行HE染色观察其病理学改变, 采用Real-time PCR及免疫组织化学检测瘤组织中Sp3、β-连接素(β-catenin)、E-钙黏附蛋白(E-cadherin)及基质金属蛋白酶9(matrix metalloproteinase 9, MMP-9)mRNA和蛋白的表达情况.
结果: 实验组的成瘤率明显低于其他两组(60% vs 100%, 100%); HE观察实验组肿瘤细胞侵袭能力明显降低. 荧光定量PCR检测结果显示, 种植瘤中实验组的Sp3、β-catenin及MMP-9 mRNA相对表达量明显低于空白组及阴性组, 差异有统计学意义(F = 29.692, P = 0.001; F = 21.894, P = 0.002; F = 109.414, P<0.001); 实验组瘤体中E-cadherin mRNA的相对表达量高于其他两组(F = 66.983, P<0.001). 免疫组织化学结果显示, 实验组Sp3蛋白表达为30±5.69、β-catenin蛋白表达为28±5.13、MMP-9蛋白表达为97±10.41均低于空白组及阴性组; E-cadherin蛋白表达为132±4.36明显高于其他两组, 差异有统计学意义(P = 0.000).
结论: Sp3可通过上调β-catenin及其下游基因MMP-9表达, 同时下调E-cadherin的表达, 增强人肝癌细胞的侵袭能力.
核心提示: 本研究结果表明, 沉默特异性蛋白3(specificity protein 3)可通过上调Wnt/β-连接素(β-catenin)信号中β-catenin及其下游基因基质金属蛋白酶9(matrix metalloproteinase 9)表达, 同时下调E-钙黏附蛋白(E-cadherin)的表达, 增强肝癌细胞侵袭性, 共同促进肿瘤的演进.
引文著录: 李佳, 陆会平, 莫伟嘉, 李海荣, 冯振博. RNAi沉默Sp3基因对裸鼠人肝癌种植瘤细胞侵袭能力的影响. 世界华人消化杂志 2014; 22(6): 813-818
Revised: December 24, 2013
Accepted: December 25, 2013
Published online: February 28, 2014
AIM: To observe the influence of specificity protein 3 (Sp3) silencing on invasion of HepG2 cells in a xenogeneic graft mouse model, and to explore the possible mechanisms involved.
METHODS: A shRNA-Sp3 or non-relevant shRNA was transfected into HepG2 cells using a lentiviral vector. Non-transfected HepG2 cells were used as controls. The three groups of cells were injected into nude mice. Tumor formation rate was determined, and the pathological morphology of cells in three groups was observed. The mRNA and protein expression of Sp3, β-catenin, E-cadherin and matrix metallopeptidase 9 (MMP-9) was detected by real-time PCR and immunohistochemistry.
RESULTS: The tumor formation rate was lower in the shRNA-Sp3 group than in the non-relevant group and control group (60% vs 100%, 100%). The ability of invasion was weaker in the shRNA-Sp3 group. The expression of Sp3, β-catenin and MMP-9 mRNAs in the shRNA-Sp3 group was significantly lower than that in the non-relevant group and control group (F = 29.692, 21.894, 109.414; P = 0.001, 0.002, < 0.001). The expression of E-cadherin mRNA was significantly higher in the shRNA-Sp3 group than in the other two groups (F = 66.983, P < 0.001). The expression levels of Sp3 (30 ± 5.69), β-catenin (28 ± 5.13) and MMP-9 proteins (97 ± 10.41) were significantly lower than those in the non-relevant group and control group (P = 0.000 for all). The expression of E-cadherin protein (132 ± 4.36) was significantly higher in the shRNA-Sp3 group than in the other two groups (P = 0.000).
CONCLUSION: Sp3 may influence the invasion of HepG2 cells in vivo by up-regulating the expression of β-catenin and MMP-9 and down-regulating the expression of E-cadherin.
- Citation: Li J, Lu HP, Mo WJ, Li HR, Feng ZB. RNAi-mediated silencing of Sp3 expression reduces invasion of HepG2 cells in a xenogeneic graft mouse model. Shijie Huaren Xiaohua Zazhi 2014; 22(6): 813-818
- URL: https://www.wjgnet.com/1009-3079/full/v22/i6/813.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i6.813
特异性蛋白3(specificity protein 3, Sp3)作为特异蛋白家族成员之一, 属于特殊转录因子, Sp3和其他Sp特殊蛋白家族成员一样, 在胚胎形成及出生后发育时期广泛表达并起关键作用, 但在成熟齿类动物模型及人类正常组织中, Sp3表达较低或不表达, 例如裸鼠的肝组织中Sp3几乎不表达[1]. 而在多种人肿瘤细胞株及组织中高表达[2-7], 从而调控肿瘤细胞的生长、侵袭等生物学行为. 我们前期试验证实了Sp3在人肝癌细胞HepG2中高表达, 并且沉默Sp3基因表达可引起人肝癌细胞HepG2的生长速度减慢、细胞周期阻滞[8]. 这些结果提示我们Sp3基因与肝细胞癌发生发展有关. 侵袭是恶性肿瘤具有的特征性生物学行为. Wnt/β-catenin信号通路的异常激活参与肝癌的发生发展, 促进肿瘤细胞增殖及侵袭. 本研究利用已构建的三株细胞株分别建立裸鼠人肝癌种植瘤模型, 观察沉默Sp3基因表达对肝癌细胞侵袭能力的影响, 初步探讨Sp3对Wnt/β-catenin信号通路的调控对移植瘤肝癌细胞侵袭能力的影响, 并探讨其可能机制.
HepG2肝癌细胞购自中国科学院上海生物细胞研究所. Balb/c裸鼠购自广西医科大学动物实验中心, 生产许可证号SCXK桂2009-000, 鼠龄6 wk, 雌雄兼用, 饲养于广西医科大学动物实验中心SPF级饲养房. cDNA逆转录试剂盒购自Fermentas公司, FastStart Universal SYBR Green Master (ROX)购自Roche公司. Sp3多克隆一抗(浓缩液)购自美国Santa Cruze公司, β-catenin、E-cadherin及基质金属蛋白酶9(matrix metalloproteinase 9, MMP-9)单克隆抗体工作液购自北京中杉金桥生物技术有限公司, 鼠兔通用型二抗购自上海长岛生物技术有限公司, DAB显色剂购自北京中杉金桥生物技术有限公司.
1.2.1 细胞转染及裸鼠人肝细胞癌成瘤模型的构建: 细胞株实验组(Lv-shRNA-Sp3)、阴性组(Lv-shRNA-NC)由本课题组构建[8]. 将30只裸鼠随机分为3组: 实验组、阴性组和空白组, 每组10只. 参照相关文献[9]中的裸鼠皮下种植瘤模型建立方法, 将转染后48 h的实验组、阴性组及处于对数期生长的HepG2 3组细胞, 常规消化, 细胞悬液以1×107细胞/0.2 mL剂量分别接种于相应组的裸鼠右前肢腋下, 皮下接种. 每隔3 d观察皮下成瘤情况, 裸鼠接种细胞后第28天处死. 解剖观察瘤体生长情况. 瘤体组织分为2份: 一份用4%中性甲醛固定, 制作蜡块后切片进行HE染色及免疫组织化学染色. 另一份标本立即放置液氮中, 随后转移至-80 ℃超低温冰箱保存, 用来提取RNA.
1.2.2 Real-time PCR检测基因表达: 应用Primer 5.0软件设计引物并由Invitrogen公司合成, 引物序列如表1. 使用TRIzol分别提取3组种植瘤的总RNA, 检测RNA完整度后, 逆转录为cDNA, 参照逆转录试剂盒说明书进行, Real-time PCR方法采用ROX公司试剂盒说明书进行, 以β-actin为内参, 使用ABI公司的PCR仪对PCR产物进行定量检测, 由计算机分析给出Ct及RQ值.
| 基因名称 | 上游引物 | 下游引物 | 产物长度(bp) |
| Sp3 | 5'-GCTTGCACCTGTCCCAACTGTA-3' | 5'-CTCCAGAATGCCAACGCAGA-3' | 148 |
| β-catenin | 5'-GAGTGCTGAAGGTGCTATCTGTC-3' | 5'-CTGAACAAGAGTCCCAAGGAGA-3' | 197 |
| E-cadherin | 5'-CCAGCGTGGGAGGCTGTATA-3' | 5'-TCCAAGCCCTTTGCTGTTTT-3' | 110 |
| MMP-9 | 5'-CGTGTCTGGAGATTCGACTTGA-3' | 5'-TTGGAAACTCACACGCCAGA-3' | 165 |
| β-actin | 5'-GCACCACACCTTCTACAATGAGC-3' | 5'-GGATAGCACAGCCTGGATAGCAAC-3' | 166 |
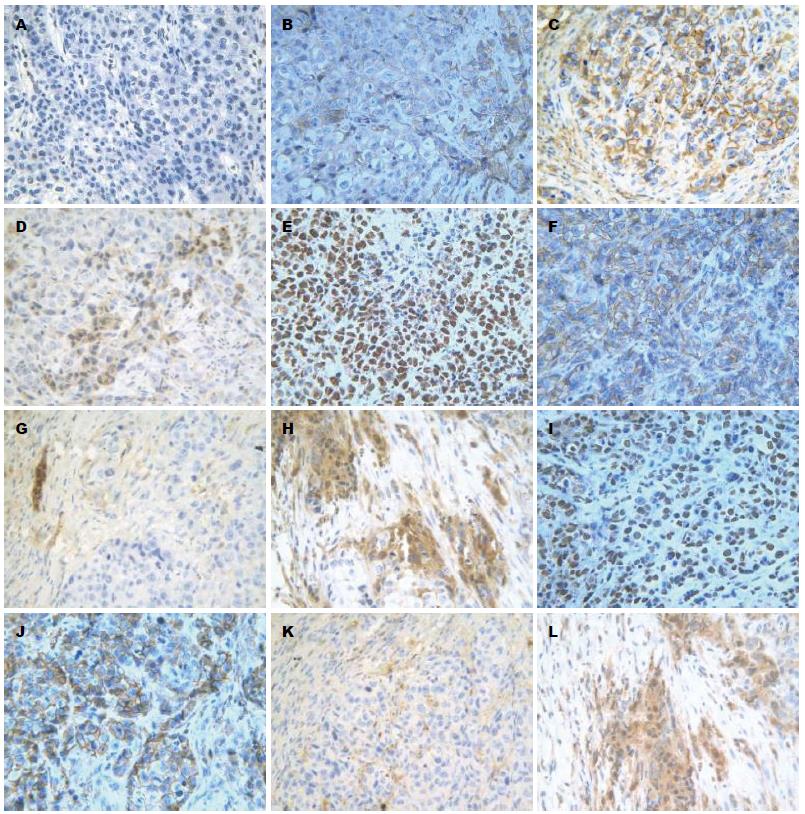
1.2.3 免疫组织化学检测β-catenin、E-cadherin及MMP-9: 石蜡切片脱蜡后, 进行Sp3及E-cadherin检测的切片浸入pH 8.0 EDTA, 进行β-catenin及MMP-9检测的切片浸入柠檬酸缓冲液, 均用高压锅修复1 min 30 s, 3%H2O2于室温孵育10 min以消除内源性过氧化物酶活性; 分别滴加Sp3(稀释1:150)、β-catenin、E-cadherin及MMP-9一抗, 37 ℃温箱孵育1.5 h; PBS冲洗后滴加二抗, 继续37 ℃孵育30 min; PBS冲洗后DAB显色, 苏木素复染, 脱水透明, 中性树胶封片. 实验均设立阳性对照及阴性对照. 结果判断: 判断结果综合染色深度结合阳性细胞百分比统计计分. Sp3、β-catenin、E-cadherin及MMP-9阳性染色呈棕褐色颗粒, Sp3阳性定位于细胞核, β-catenin定位于细胞膜、细胞浆及细胞核, E-cadherin阳性定位于细胞膜, MMP-9阳性定位于细胞浆. 400倍高倍镜下随机选取10个不连续视野进行观察, 每个视野计算200个细胞中阳性细胞数, 取其均值.
统计学处理 应用SPSS16.0软件进行统计分析, 计量资料用mean±SD表示, 组间比较用单因素方差分析, 组间多重比较用t检验. P<0.05差异有统计学意义.
在给药期间, 共有4只裸鼠死亡, 其中空白组3只, 阴性组1只, 死亡原因可能与皮下瘤体生长较快导致恶病质有关. 各组裸鼠接种肿瘤细胞悬液28 d后处死, 解剖结果显示: 空白组7只裸鼠均成瘤, 成瘤率100%; 阴性组9只均成瘤, 成瘤率100%; 实验组10只裸鼠中成瘤6只, 成瘤率只有60%.
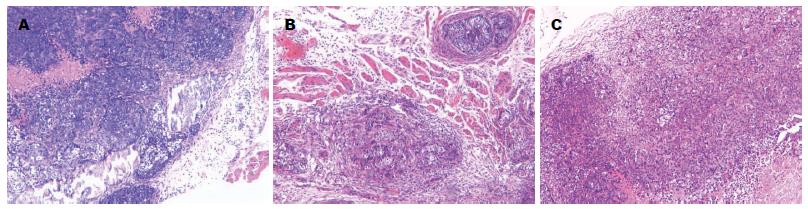
3组瘤体大体形态均呈结节状或分叶状, 切面灰白、实性质中, 中央可见坏死. 实验组瘤体包膜均完整, 与周围组织无黏连, 瘤体易剥离; 空白组和阴性组瘤体包膜与周围组织粘连. HE染色结果可见3组种植瘤瘤体镜下均为中等分化肝细胞癌, 癌巢内癌细胞呈梁状排列, 中间可见坏死, 癌细胞胞浆呈嗜酸性, 细胞核圆形, 核浆比例增大, 可见瘤巨细胞. 空白组和阴性组可见癌细胞突破包膜, 侵犯周围肌组织(图1); 实验组瘤体包膜完整, 未见癌细胞侵犯周围组织.
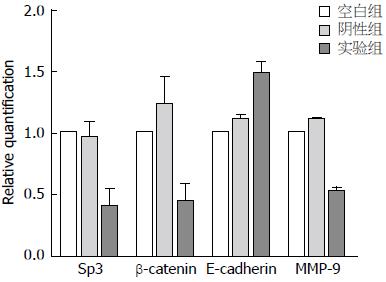
荧光定量PCR检测结果显示, 种植瘤中实验组的Sp3、β-catenin及MMP-9 mRNA相对表达量明显低于空白组及阴性组, 差异有统计学意义(F = 29.692, P = 0.001; F = 21.894, P = 0.002; F = 109.414, P<0.001), 空白组和阴性组之间的差异无统计学意义(P>0.05). 实验组瘤体中E-cadherin mRNA的相对表达量高于其他两组, 差异有统计学意义(F = 66.983, P<0.001), 空白组和阴性组之间的差异无统计学意义(P>0.05)(图2).
结果显示, 实验组Sp3蛋白表达为30±5.69、β-catenin蛋白表达为28±5.13、MMP-9蛋白表达为97±10.41均低于空白组及阴性组, 差异有统计学意义(P = 0.000), 空白组和阴性组之间差异无统计学意义(P>0.05). 而实验组E-cadherin蛋白表达为132±4.36明显高于其他两组, 差异有统计学意义(P = 0.000), 空白组和阴性组之间差异无统计学意义(P>0.05)(表2, 图3).
| 实验组 | 阴性组 | 空白组 | F值 | P值 | |
| Sp3 | 30±5.69 | 188±5.57 | 196±1.53 | 1194 | 0.000 |
| β-catenin | 28±5.13 | 135±5.14 | 141±4.00 | 525.16 | 0.000 |
| E-cadherin | 132±4.36 | 41±8.39 | 32±4.73 | 244.95 | 0.000 |
| MMP-9 | 97±10.41 | 166±12.30 | 156±4.73 | 43.262 | 0.000 |
Sp家族属于特殊转录因子, 目前发现有Sp1-9等9个成员[10-12], 均为具有相似结构及转录特性的DNA结合蛋白, 该家族成员在C端均存在3个串联的Cys2His2型锌指结构域, 此结构域使该Sp家族成员以不同亲和力识别GC/GT盒, 激活很多哺乳动物细胞的启动子, 决定启动子的特异性和转录效率从而参与多种基因的调控. 目前发现许多癌症和疾病都存在Sp1和Sp3异常调节, 在大多数肿瘤中呈高表达, 并在肿瘤形成过程中起重要作用, 维持或促进细胞增殖及侵袭, 包括膀胱癌[2]、乳腺癌[4]、前列腺癌[13]等. 本课题组前期实验结果[14]也发现肝细胞癌组织中Sp3蛋白高表达, Sp3高表达与肿瘤恶性程度呈正相关, 表明Sp3与肝细胞癌的发生发展有关. Wnt/β-catenin信号通路的异常激活参与肝癌的发生发展, 而β-catenin是该信号通路中的关键作用分子[15-17], 不仅在钙黏蛋白介导的细胞黏附、细胞骨架分化中起重要作用, 而且在Wnt/β-catenin信号通道的关键环节调控cyclin D1、c-myc及MMPs等基因的表达, 从而促进肿瘤细胞增殖及浸润.
近年来不断有新的β-catenin调节因子被发现, 提示β-catenin的调控机制极为复杂. β-catenin启动子含有丰富的GC盒, 此结构能被Sp家族识别并结合. 在2012年Pathi等[18]对阿司匹林在结肠癌治疗的研究中发现, 在结肠癌细胞SW480中利用小RNA干扰技术沉默Sp3导致β-catenin的表达减少, 表明β-catenin是Sp家族的下游靶基因. 本实验利用RNA干扰技术构建下调Sp3表达的裸鼠人肝癌种植瘤模型, 结果发现瘤体Sp3和β-catenin mRNA及蛋白低表达, 两者表达均呈正相关, 提示Sp3直接或间接的调控β-catenin的表达, 这与Pathi的研究是一致的. 裸鼠种植瘤大体和镜下观察结果显示, 实验组中癌细胞侵袭能力减弱, 瘤体周围未见明显浸润. 为了了解Sp3是否通过调控β-catenin及其下游基因的表达, 参与肝细胞癌细胞浸润及侵袭, 本实验对3组种植瘤体中E-cadherin及MMP-9的表达进行检测, Real-time PCR和免疫组织化学结果显示: 实验组中β-catenin和MMP-9 mRNA及蛋白表达显著降低, E-cadherin表达增加. 本部分实验结果提示我们: 沉默Sp3基因减弱了人肝癌细胞HepG2的侵袭能力, Sp3基因在体内参与肝细胞癌侵袭能力的调控, 其机制可能与抑制Wnt/β-catenin信号通路有关.
随着肿瘤的进展, 肿瘤细胞内Sp3合成增多并促进β-catenin转录, 细胞膜上的β-catenin逐渐转位到细胞质并转移进入细胞核与转录因子TCF/LEF-1结合, 激活下游肿瘤相关基因的表达, 诱导肝细胞癌的演进: 包括激活上皮-间充质转变(epithelial-mesenchymal transition, EMT)调控基因Slug[19], 后者可抑制E-cadherin的转录, 进而减少E-cadherin/β-catenin复合体形成, 减弱细胞间的黏附; 同时Wnt/β-catenin信号通路可通过调节环氧化物酶-2(cyclooxygenase type 2, COX-2)提高MMPs的表达[20]; 共同导致肿瘤的浸润及转移.
以上研究结果表明, Sp3可通过上调Wnt/β-catenin信号中β-catenin及其下游基因MMP-9表达, 同时下调E-cadherin的表达, 增强肝癌细胞侵袭性, 共同促进肿瘤的演进. 因此, 深入探讨Sp3调控Wnt/β-catenin信号通路, 对揭示其在肝细胞癌恶性生物学行为调控具有重大意义, 两者之间的具体作用机制, 还有待我们的进一步研究.
转录因子Sp3在多种人肿瘤细胞株及组织中高表达, 调控肿瘤细胞生长、侵袭等生物学行为. β-catenin是Wnt/β-catenin信号通路中的关键作用分子, 与肿瘤细胞增殖及浸润有关. β-catenin的启动子含有丰富的GC盒, 此结构能被Sp家族识别并结合. 可见β-catenin为Sp3调控的下游基因, 提示Sp3基因在体内参与肝细胞癌侵袭能力的调控, 其机制可能与Wnt/β-catenin信号通路有关.
高润平, 教授, 吉林大学第一医院肝胆胰内科
Wnt/β-catenin信号通路的异常激活参与肝癌的发生发展, β-catenin是该信号通路中的关键作用分子, 与肿瘤侵袭及转移有关, 近年来不断有新的β-catenin调节因子被发现, 提示β-catenin的调控机制极为复杂. 因此, 深入探讨Sp3调控Wnt/β-catenin信号通路, 对揭示其在肝细胞癌恶性生物学行为调控具有重大意义.
Pathi等对阿司匹林在结肠癌治疗的研究中表明β-catenin是Sp家族的下游靶基因. 本课题组前期实验结果发现Sp3在人肝癌细胞HepG2中高表达, 并且沉默Sp3基因表达可引起人肝癌细胞HepG2的生长速度减慢、细胞周期阻滞; 肝细胞癌组织中Sp3蛋白高表达, Sp3高表达与肿瘤恶性程度呈正相关; 这些结果提示我们Sp3基因与肝细胞癌的生长及浸润转移有关.
本实验构建了基于HepG2细胞的裸鼠人肝癌种植瘤模型, 观察沉默Sp3基因表达对肝癌细胞侵袭能力的影响, 初步探讨Sp3对Wnt/β-catenin信号通路的调控对移植瘤肝癌细胞侵袭能力的影响, 并探讨其可能机制.
Sp3可通过上调Wnt/β-catenin信号中β-catenin及其下游基因MMP-9表达, 同时下调E-cadherin的表达, 增强肝癌细胞侵袭性, 共同促进肿瘤的演进. 本文将为肝癌侵袭及转移的分子机制研究提供线索, 同时为肝癌晚期治疗提供新思路.
本文通过裸鼠人肝癌种植瘤模型证明沉默Sp3基因在体内可减弱人肝癌细胞HepG2的迁移及侵袭能力, 并初步探讨其机制, 对探索肝癌发病机制具有实际意义.
编辑: 郭鹏 电编:鲁亚静
| 1. | Chintharlapalli S, Papineni S, Ramaiah SK, Safe S. Betulinic acid inhibits prostate cancer growth through inhibition of specificity protein transcription factors. Cancer Res. 2007;67:2816-2823. [PubMed] [DOI] |
| 2. | Jutooru I, Chadalapaka G, Sreevalsan S, Lei P, Barhoumi R, Burghardt R, Safe S. Arsenic trioxide downregulates specificity protein (Sp) transcription factors and inhibits bladder cancer cell and tumor growth. Exp Cell Res. 2010;316:2174-2188. [PubMed] [DOI] |
| 3. | Chintharlapalli S, Papineni S, Lei P, Pathi S, Safe S. Betulinic acid inhibits colon cancer cell and tumor growth and induces proteasome-dependent and -independent downregulation of specificity proteins (Sp) transcription factors. BMC Cancer. 2011;11:371. [PubMed] [DOI] |
| 4. | Mertens-Talcott SU, Chintharlapalli S, Li X, Safe S. The oncogenic microRNA-27a targets genes that regulate specificity protein transcription factors and the G2-M checkpoint in MDA-MB-231 breast cancer cells. Cancer Res. 2007;67:11001-11011. [PubMed] [DOI] |
| 5. | Papineni S, Chintharlapalli S, Abdelrahim M, Lee SO, Burghardt R, Abudayyeh A, Baker C, Herrera L, Safe S. Tolfenamic acid inhibits esophageal cancer through repression of specificity proteins and c-Met. Carcinogenesis. 2009;30:1193-1201. [PubMed] [DOI] |
| 6. | Gao Y, Jia Z, Kong X, Li Q, Chang DZ, Wei D, Le X, Suyun H, Huang S, Wang L. Combining betulinic acid and mithramycin a effectively suppresses pancreatic cancer by inhibiting proliferation, invasion, and angiogenesis. Cancer Res. 2011;71:5182-5193. [PubMed] [DOI] |
| 7. | Colon J, Basha MR, Madero-Visbal R, Konduri S, Baker CH, Herrera LJ, Safe S, Sheikh-Hamad D, Abudayyeh A, Alvarado B. Tolfenamic acid decreases c-Met expression through Sp proteins degradation and inhibits lung cancer cells growth and tumor formation in orthotopic mice. Invest New Drugs. 2011;29:41-51. [PubMed] [DOI] |
| 9. | 梁 治坤, 黄 志勇, 陈 孝平, 刘 聪, 吴 在德. 5-杂氮-2'-脱氧胞苷诱导裸鼠HepG2种植瘤细胞T-cadherin的表达及其对种植瘤的抑制作用. 世界华人消化杂志. 2008;16:1741-1745. |
| 10. | Scohy S, Gabant P, Van Reeth T, Hertveldt V, Drèze PL, Van Vooren P, Rivière M, Szpirer J, Szpirer C. Identification of KLF13 and KLF14 (SP6), novel members of the SP/XKLF transcription factor family. Genomics. 2000;70:93-101. [PubMed] [DOI] |
| 11. | Lu X, Gilbert L, He X, Rubin J, Nanes MS. Transcriptional regulation of the osterix (Osx, Sp7) promoter by tumor necrosis factor identifies disparate effects of mitogen-activated protein kinase and NF kappa B pathways. J Biol Chem. 2006;281:6297-6306. [PubMed] [DOI] |
| 12. | Kawakami Y, Esteban CR, Matsui T, Rodríguez-León J, Kato S, Izpisúa Belmonte JC. Sp8 and Sp9, two closely related buttonhead-like transcription factors, regulate Fgf8 expression and limb outgrowth in vertebrate embryos. Development. 2004;131:4763-4774. [PubMed] [DOI] |
| 13. | Ganapathy M, Ghosh R, Jianping X, Zhang X, Bedolla R, Schoolfield J, Yeh IT, Troyer DA, Olumi AF, Kumar AP. Involvement of FLIP in 2-methoxyestradiol-induced tumor regression in transgenic adenocarcinoma of mouse prostate model. Clin Cancer Res. 2009;15:1601-1611. [PubMed] |
| 15. | Schmalhofer O, Brabletz S, Brabletz T. E-cadherin, beta-catenin, and ZEB1 in malignant progression of cancer. Cancer Metastasis Rev. 2009;28:151-166. [PubMed] [DOI] |
| 16. | Fu Y, Zheng S, An N, Athanasopoulos T, Popplewell L, Liang A, Li K, Hu C, Zhu Y. β-catenin as a potential key target for tumor suppression. Int J Cancer. 2011;129:1541-1551. [PubMed] [DOI] |
| 17. | Jeanes A, Gottardi CJ, Yap AS. Cadherins and cancer: how does cadherin dysfunction promote tumor progression? Oncogene. 2008;27:6920-6929. [PubMed] [DOI] |
| 18. | Pathi S, Jutooru I, Chadalapaka G, Nair V, Lee SO, Safe S. Aspirin inhibits colon cancer cell and tumor growth and downregulates specificity protein (Sp) transcription factors. PLoS One. 2012;7:e48208. [PubMed] [DOI] |
| 19. | Storci G, Bertoni S, De Carolis S, Papi A, Nati M, Ceccarelli C, Pirazzini C, Garagnani P, Ferrarini A, Buson G. Slug/β-catenin-dependent proinflammatory phenotype in hypoxic breast cancer stem cells. Am J Pathol. 2013;183:1688-1697. [PubMed] [DOI] |