修回日期: 2013-12-16
接受日期: 2013-12-25
在线出版日期: 2014-02-18
目的: 观察亮氨酸拉链EF-hand结构域跨膜蛋白1(leucine zipper/EF-hand-containing transmembrane protein 1, LETM1)在结肠癌中的表达情况, 探讨LETM1蛋白是否能够成为判断结肠癌患者预后的新的生物学指标.
方法: 利用免疫组织化学法检测73例结肠癌患者组织中LETM1蛋白的表达水平和蛋白激酶B(protein kinase B, PKB)/Akt的丝氨酸473(Ser473)、苏氨酸308(Thr308)两个磷酸化位点及葡萄糖合成激酶3β(glycogen synthase kinase 3β, GSK3β)的磷酸化水平, 并根据LETM1蛋白表达水平进行高表达和低表达分组; 采用Kaplan-Meier法分析各组无疾病生存期; 采用χ2检验进行组间单因素分析.
结果: 在结肠癌患者中LETM1蛋白高表达率为54.8%, LETM1蛋白在结肠癌浸润深度、分化及淋巴结转移中低表达和高表达率分别为27.3%/72.7%、38.3%/61.7%和22.7%/77.3%, 其差异均有统计学意义(P<0.05), 而与年龄、性别、肿瘤大小未见统计学意义(P>0.05). LETM1蛋白在结肠癌组织中可以激活磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase , PI-3K)/Akt信号传导通路. LETM1高表达患者无疾病生存期显著低于LETM1低表达患者(P<0.05).
结论: LETM1蛋白在结肠癌中高表达, 可能参与结肠癌的发生、发展与复发. LETM1蛋白可以作为预测结肠癌患者预后的新的生物学指标.
核心提示: 亮氨酸拉链EF-hand结构域跨膜蛋白1(leucine zipper/EF-hand- containing transmembrane protein 1, LETM1)表达水平的改变, 影响线粒体功能, 导致NADH/NADPH比率改变, 从而抑制人第10号染色体缺失的磷酸酶(phosphatase and tensin homolog deleted on chromosome 10, PTEN)的活性, 最终激活磷脂酰肌醇3激酶(phosphatidylinositol-3-kinase, PI3K)/丝/苏氨酸蛋白酶(serine/threonine kinase, Akt)信号传导通路.
引文著录: 高爱花, 金永民, 孙红花, 金文彪, 崔海, 崔现, 崔玉珍, 沈雄虎, 张松男, 朴龙镇. LETM1蛋白在结肠癌组织中的表达及临床意义. 世界华人消化杂志 2014; 22(5): 718-723
Revised: December 16, 2013
Accepted: December 25, 2013
Published online: February 18, 2014
AIM: To observe the expression of leucine zipper/EF-hand-containing transmembrane protein 1 (LETM1) protein in colonic cancer and to determine whether LETM1 can be used as a marker for this malignancy.
METHODS: Immunohistochemical method was used to detect the expression of LETM1 and phosphorylated Akt (protein kinase B, PKB/Akt) and glycogen synthase kinase 3β (GSK3β) in 73 specimens of colonic carcinoma. Disease-free survival time of colonic cancer patients was analyzed by Kaplan-Meier method. Univariate analysis was performed to determine the correlation between LETM1 expression and clinicopathologic parameters of colonic cancer.
RESULTS: The rate of high LTEM1 protein expression was 54.8% in 73 colonic cancer specimens. LETM1 protein expression was significantly correlated with degree of invasion (27.3% vs 72.7%, P < 0.05), differentiation (38.3% vs 61.7%, P < 0.05) and lymph node metastasis (22.7% vs 77.3%, P < 0.05), but not with age, sex or tumor size (P > 0.05 for all). High expression of LETM1 protein could activate the phosphatidylinositol 3 kinase (PI3K)/Akt signal transduction pathway. The disease-free survival time of patients with high expression of LETM1 was significantly lower than that of patients with low expression of LETM1 (P < 0.05).
CONCLUSION: High expression of LETM1 may play a role in the pathogenesis, metastasis and recurrence of colon cancer. LETM1 protein may be used as an indicator to determine the prognosis of colon cancer patients.
- Citation: Gao AH, Jin YM, Sun HH, Jin WB, Cui H, Cui X, Cui YZ, Shen XH, Zhang SN, Piao LZ. Clinical significance of LETM1 protein expression in colonic cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(5): 718-723
- URL: https://www.wjgnet.com/1009-3079/full/v22/i5/718.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i5.718
结直肠癌(colorectal cancer)是常见的消化系恶性肿瘤, 发病率为全球第4位的常见恶性肿瘤之一. 国际癌症研究机构(International Agency for Research on Cancer, IARC)最新数据显示, 2009年全球结直肠癌新病例接近120万例, 死亡63万例, 分别比2000年增加27%和28%, 平均年增3.9%和4%[1], 而中国的结直肠癌每年发病递增速度为世界平均数的两倍[2]. 蛋白激酶B(protein kinase B, PKB)又称丝/苏氨酸蛋白酶(serine/threonine kinase, Akt)是一种60 kDa左右的蛋白激酶[3]. Akt参与的磷脂酰肌醇3激酶(phosphatidylinositol-3-kinase, PI3K)介导的信号传导通路, 与细胞生长、抑制凋亡、增强端粒酶活性、促进肿瘤新生血管形成以及增加肿瘤细胞侵袭力等密切相关[3,4]. 越来越多的研究表明, 在结肠癌中Akt的磷酸化水平不同程度的增多[5-8]. 亮氨酸拉链EF-hand结构域跨膜蛋白1(leucine zipper/EF-hand- containing transmembrane protein 1, LETM1)是最近新发现的线粒体蛋白, 曾经在医学学术界查明了LETM1蛋白质是诱发Wolf-Hirschhorn Syndrome(沃尔夫综合症)的原因蛋白质[9]. 最近研究表明, LETM1在宫颈癌中高表达, 且可激活PI3K-Akt信号传导通路, 从而影响肿瘤的发生发展, 同时在结肠癌组织中发现LETM1蛋白高表达. 为结合临床, 我们采用结肠癌术后存档蜡块标本进行免疫组织化学, 进一步证明在结肠癌组织中LETM1蛋白表达水平及与Akt之间的关系. 本研究通过观察结肠癌组织中LETM1蛋白表达及Akt磷酸化水平, 同时分析两者之间的关系, 为判定结肠癌患者的预后提供一个新的肿瘤生物学标志物.
收集2006-01/2010-12在延边大学附属医院接受手术治疗及正规术后辅助化疗的Ⅱ、Ⅲ期患者. 病例资料完整的73例结肠癌患者, 其中男性46例, 女性27例, 中位年龄为55岁. 截止于2012-12-30随访结束. 鼠抗人LETM1单克隆抗体(1:500稀释, Abnova公司); 磷酸化Akt(pSer473)和磷酸化Akt(pThr308)抗体(1:200稀释, Cellsignaling公司); 兔抗人多磷酸化葡萄糖合成激酶3β(glycogen synthase kinase 3β, GSK3β)多克隆抗体(1:100稀释, Abcam公司). SP试剂盒和二氨基联苯胺(DAB)显色试剂均购自北京中杉金桥生物技术有限公司.
采用免疫组织化学SP法检测结肠癌组织中LETM1蛋白的表达情况, 同时测定Akt的Ser473、Thr308两个磷酸化位点及GSK3β磷酸化水平. 切片常规二甲苯脱蜡, 梯度乙醇水化后微波抗原修复, 滴加适量H2O2阻断内源性过氧化酶, 然后滴加一抗, 4 ℃冰箱过夜(以PBS作为阴性对照). 结果判定由2名病理医师分别对LETM1蛋白、Akt及GSK3β磷酸化的阳性细胞比例及染色强度进行评价. 评价标准如下: 根据Beesley分级法[10], 按阳性细胞所占百分比并参考着色强度确定分级, 无明显阳性细胞或着浅黄色为(-); 阳性细胞数<25%, 颗粒棕黄色为(+); 阳性细胞数25%-50%, 颗粒棕黄色为(++); 阳性细胞数>50%, 颗粒深棕色为(+++). LETM1染色--+纳入低表达组, LETM1染色++-+++纳入高表达组.
统计学处理 利用SPSS17.0统计学软件进行数据分析. 采用Kaplan-Meier法分析各组无疾病生存期; 采用χ2检验进行组间单因素分析, P<0.05为差异有统计学意义.
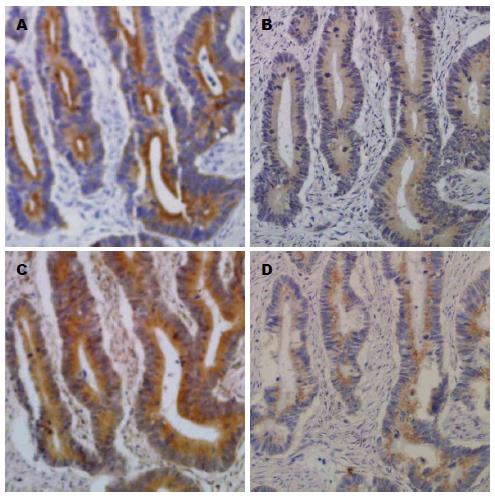
利用免疫组织化学检测LETM1蛋白在结肠癌组织表达情况, 其结果LTEM1蛋白主要表达于肿瘤细胞胞浆中, 阳性细胞的胞浆呈棕褐色(图1). LETM1蛋白在结肠癌中高表达40例(54.8%), 低表达33例(45.2%)(表1, 图1). LETM1蛋白在结肠癌组织中的表达与淋巴结转移、浸润程度及分化程度具有统计学意义, 呈正相关(P<0.05), 与年龄、性别、肿瘤大小无统计学意义(P>0.05), (表1).
| 临床病理生理特性 | n | LEMT1表达 | P值 | |||
| n | 低表达率(%) | n | 高表达率(%) | |||
| 年龄(岁) | 0.711 | |||||
| ≤60 | 47 | 22 | 46.8 | 25 | 53.2 | |
| >60 | 26 | 11 | 42.3 | 15 | 57.7 | |
| 性别 | 0.173 | |||||
| 男 | 46 | 18 | 39.1 | 28 | 60.9 | |
| 女 | 27 | 15 | 55.6 | 12 | 44.4 | |
| 肿瘤大小(cm) | 0.800 | |||||
| ≤5 | 41 | 18 | 43.9 | 23 | 56.1 | |
| >5 | 32 | 15 | 46.9 | 17 | 53.1 | |
| 淋巴转移 | 0.011 | |||||
| 阳性 | 22 | 5 | 22.7 | 17 | 77.3 | |
| 阴性 | 51 | 28 | 54.9 | 23 | 45.1 | |
| 浸润程度 | 0.043 | |||||
| T1、T2 | 51 | 27 | 52.9 | 24 | 47.1 | |
| T3、T4 | 22 | 6 | 27.3 | 16 | 72.7 | |
| 分化程度 | 0.011 | |||||
| 高、中分化 | 60 | 23 | 38.3 | 37 | 61.7 | |
| 低分化 | 13 | 10 | 76.9 | 3 | 23.1 | |
Ser473及Thr308分别是Akt的两个磷酸化位点, 而GSK3β作为Akt激酶磷酸化的底物, 在此实验中作为了判定Akt激酶活性的参照物. 在同一患者结肠癌组织中随LETM1蛋白表达水平升高, 其Akt的两个磷酸化位点的磷酸化, 即Ser473和Thr308位点的磷酸化水平继而也增加. 采用χ2检验统计学方法分析, 结果表明LETM1蛋白表达水平与Ser473、Thr308及GSK3β磷酸化水平呈正相关, P<0.05(表2, 3), 进一步Akt的两个磷酸化位点的磷酸化水平与GSK3β的磷酸化也呈正相关, P<0.05(表4, 5). 结果提示, 在结肠癌组织中随LETM1蛋白表达的异常可以改变Akt的活性, 继而影响PI3K/Akt信号传导通路的开启, 最终影响着细胞的生长、凋亡及血管的再生等生理学功能.
| 参数 | n | Ser473磷酸化 | χ2 | P值 | |
| 阴性 | 阳性 | ||||
| LETM1 | 0.539 | 0.000 | |||
| 低表达 | 33 | 21 | 12 | ||
| 高表达 | 40 | 6 | 34 | ||
| 参数 | n | Thr308磷酸化 | χ2 | P值 | |
| 阴性 | 阳性 | ||||
| LETM1 | 0.556 | 0.000 | |||
| 低表达 | 33 | 23 | 10 | ||
| 高表达 | 40 | 6 | 34 | ||
| 参数 | n | GSK3β磷酸化 | χ2 | P值 | |
| 阴性 | 阳性 | ||||
| Thr308磷酸化 | 0.542 | 0.000 | |||
| 阴性 | 29 | 21 | 8 | ||
| 阳性 | 44 | 8 | 36 | ||
| 参数 | n | GSK3β磷酸化 | χ2 | P值 | |
| 阴性 | 阳性 | ||||
| Ser473磷酸化 | 0.480 | 0.000 | |||
| 阴性 | 27 | 19 | 8 | ||
| 阳性 | 46 | 10 | 36 | ||
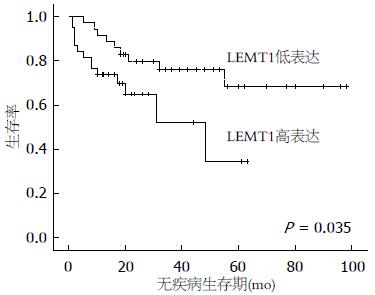
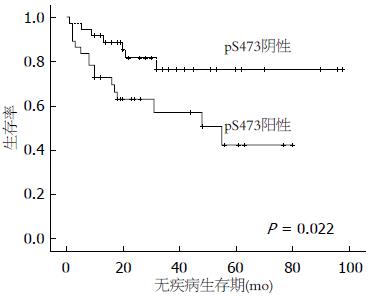
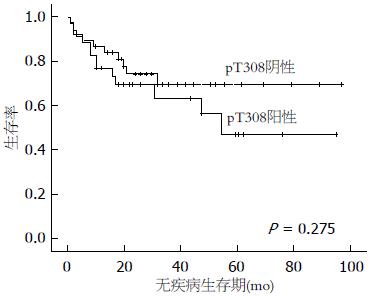
LETM1蛋白高表达组患者无疾病生存率显著低于LETM1蛋白低表达患者(P<0.05)(图2), Ser473磷酸化阳性患者无疾病生存期显著低于Ser473磷酸化阴性患者(P<0.05)(图3). Thr308磷酸化阳性患者与阴性患者无疾病生存期未见明显统计学差异(P>0.05)(图4).
结肠癌的发生, 发展及演进是多步骤, 多基因突变共同作用的结果, 其中涉及多个途径的分子改变, 其确切机制仍不十分明确. PI3K/Akt信号通路是细胞内信号传导的重要环节, 参与细胞代谢、生存、凋亡、分化和增殖等过程. 目前研究认为PI3K/Akt途径参与了结肠组织的恶性转化和演进过程. Piao等[11]研究发现, 在人宫颈癌细胞株HeLa细胞中过表达LETM1蛋白可激活Akt的活性, 推测LETM1蛋白的表达的改变可诱导肿瘤的发生, 同时发现在结肠癌组织中LETM1蛋白高表达.
我们实验结果发现, 在结肠癌组织中LETM1的高表达率为54.8%(表2), 且与淋巴结转移、分化及浸润程度具有正相关(表2). 这些结果表明, LETM1蛋白表达的增多可能是结肠肿瘤复发及转移的高危因素之一, 且与结肠癌的预后有密切的相关性.
为观察在结肠癌组织中Akt的两个磷酸化位点的磷酸化水平, 我们免疫组织化学检测了Ser473和Thr308的磷酸化水平. 结果显示, 在结肠癌组织中Ser473磷酸化阳性率为63.0%, Thr308磷酸化阳性率为60.3%(表2, 3). 我们的结果表明结肠癌组织中Akt磷酸化程度在高水平状态, 这与绝大多数国内外的研究结果相符合. 而且我们的结果提示, Ser473磷酸化水平与浸润程度及分化程度呈正相关, Thr308磷酸化水平与淋巴结转移呈正相关, 这些结果基本与文献报道相符. 这些结果提示, 在结肠癌中随Akt磷酸化水平的升高, 可激活PI3K/Akt信号传导通路, 促进肿瘤细胞的生长、抑制细胞凋亡及影响细胞周期, 从而成为不良的预后因素之一.
本次研究为GSK3β作为Akt激酶的底物[12], 我们进一步检测了两者之间的关系, 发现Akt的Ser473和Thr308磷酸化水平与GSK3β磷酸化呈正相关(P<0.05)(表4, 5), 说明当Akt活性增加时, 相应的其底物的磷酸化水平也随之升高. 该结果进一步证明Akt信号转导通路在结肠癌中的重要性.
此次研究结果还发现, LETM1蛋白表达分别与Ser473及Thr308磷酸化水平呈正相关(表2, 3), 证明结肠癌组织中LETM1蛋白的高表达, 可激活PI3K/Akt信号传导通路, 此结果与既往Piao等[11]研究宫颈癌细胞中LETM1蛋白激活PI3K/Akt信号通路一致. 据此推测, 在结肠癌中LETM1蛋白表达也可影响Akt的活性, 在肿瘤的发生及发展过程中发挥着重要的角色.
Piao等[11]报道, LETM1蛋白高表达诱导线粒体功能障碍, 导致糖酵解的增加, 使乳酸分泌增多. 线粒体功能障碍及通过糖酵解增加ATP, 都可以调节NADH/NADPH的比值. NADPH是维持硫氧还蛋白酶活性的重要分子, 当NADH/NADPH比值上升, 使人第10号染色体缺失的磷酸酶(phosphatase and tensin homolog deleted on chromosome 10, PTEN)保持在氧化/失活状态, 进一步激活PI3K/Akt信号转导通路[13]. PTEN是一种抑癌基因, PTEN抑癌作用主要是通过催化第3位磷酸发生脱磷酸, 使3, 4, 5三磷酸磷脂酰肌醇(phosphatidylinositol 3, 4, 5-trisphosphate, PIP3)的磷酸脱磷酸形成4, 5二磷酸磷脂酰肌醇(phosphatidylinositol, 4, 5-bisphosphate, PIP2), 使之丧失信号传导功能, 从而间接抑制PI3K/Akt信号传导通路, 抑制细胞增殖和细胞凋亡[14,15]. 结合我们研究结果及以往的结果, 推测LETM1蛋白在结肠癌中随着表达水平的增加影响线粒体的功能, 改变NADH/NADPH的比值, 抑制PTEN的活性, 使无法灭火Akt的活性, 从而使细胞趋向于存活的优势, 所有这些变化都可能是导致癌变的原因之一.
另外, 为进一步证实LETM1蛋白在结肠癌发展过程中的作用, 观察结肠癌患者无疾病生存时间. 结果显示LETM1蛋白高表达组患者无疾病生存率显著低于LETM1低表达组患者(图2), 且Ser473磷酸化阳性组无疾病生存期显著低于Ser473阴性组患者(图3), 然而Thr308阳性组患者与阴性组患者无疾病生存期未见明显统计学差异(图4), 考虑与标本数少有关. 由于LTEM1蛋白可激活PI3K/Akt信号传导通路, 我们推测, LETM1蛋白高表达在结肠癌患者发生复发及转移过程中发挥重要作用. 据此判断, LETM1蛋白是一个比Akt更理想的预示结肠癌演进和预后的重要生物学指标.
总之, 我们的研究提示, 在结肠癌发生、发展过程中, 可能由于LETM1高表达导致PI3K/Akt所介导的信号传导通路异常激活, Akt持续活化, 使细胞异常增殖进一步恶性转化, 并促使肿瘤浸润及转移. 因此, 对结肠癌组织中LETM1蛋白表达表达和Akt信号传导通路的相关作用的研究, 将有助于进一步了解结肠癌的发生及发展, 从而寻找新的、有价值的肿瘤分子标志物, 为肿瘤的临床诊断、治疗以及预后评估提供新的生物学指标.
氨酸拉链EF-hand结构域跨膜蛋白1(leucine zipper/EF-hand-containing transmembrane protein 1, LETM1)是最近新发现的线粒体蛋白, 曾经在医学学术界查明了LETM1蛋白是诱发沃尔夫综合症的原因蛋白质. 最近研究表明, LETM1在宫颈癌中高表达, 且可激活PI3K/Akt信号传导通路, 在肿瘤的发生、发展, 且发现在多种肿瘤组织中其表达水平异常升高.
卢宁, 副主任医师, 兰州军区乌鲁木齐总医院肿瘤科
肿瘤细胞的代谢与正常细胞不同, 能量来源主要是由胞浆内的糖酵解途径所获得, 而一些线粒体的蛋白的表达异常或基因的突变, 常常在不同肿瘤细胞中发生, 而这种线粒体代谢功能紊乱必然带来细胞的异常增生, 目前有很多线粒体蛋白研究于肿瘤的发生与发展, 且用于早期诊断、疗效评估及判断预后.
Piao等研究首次发现, 在人宫颈癌细胞株HeLa细胞中过表达LETM1通过抑制线粒体的功能, 改变细胞的NADH/NADPH的比率, 激活Akt的活性, 从而推测LETM1蛋白表达水平的改变可诱导肿瘤的发生.
LETM1不仅可激活PI3K/Akt信号传导通路的开启, 在肿瘤的发生、发展中起着重要的作用, 且有希望成为判断结肠癌患者预后的新的肿瘤分子生物学标志物.
LETM1在结肠癌中高表达, 可能参与结肠癌的发生、发展与复发. LETM1蛋白可以作为预测结肠癌患者预后的新的生物学指标.
本文结果提示LETM1在结肠癌中高表达, 可能参与结肠癌的发生、发展与复发. LETM1蛋白可以作为预测结肠癌患者预后的新的生物学指标物. 本文内容客观, 观点新颖, 具有一定的科学意义.
编辑: 郭鹏 电编:鲁亚静
| 1. | Picelli S, Von Holst S, Wessendorf P. The continuing search for predisposing colorectal cancer variants. Cancer Genomics Proteomics. 2009;6:305-316. [PubMed] [DOI] |
| 2. | Sung JJ, Lau JY, Goh KL, Leung WK. Increasing incidence of colorectal cancer in Asia: implications for screening. Lancet Oncol. 2005;6:871-876. [PubMed] [DOI] |
| 3. | Zou W, Li ZY, Li CL, Cui ZC. [Protein kinase B and its role in the signal transduction pathway mediated by phosphoinositide 3-kinase]. Sheng Li Ke Xue Jin Zhan. 2000;31:120-124. [PubMed] |
| 4. | Cheng GZ, Park S, Shu S, He L, Kong W, Zhang W, Yuan Z, Wang LH, Cheng JQ. Advances of AKT pathway in human oncogenesis and as a target for anti-cancer drug discovery. Curr Cancer Drug Targets. 2008;8:2-6. [PubMed] [DOI] |
| 5. | Roy HK, Olusola BF, Clemens DL, Karolski WJ, Ratashak A, Lynch HT, Smyrk TC. AKT proto-oncogene overexpression is an early event during sporadic colon carcinogenesis. Carcinogenesis. 2002;23:201-205. [PubMed] |
| 6. | Johnson SM, Gulhati P, Rampy BA, Han Y, Rychahou PG, Doan HQ, Weiss HL, Evers BM. Novel expression patterns of PI3K/Akt/mTOR signaling pathway components in colorectal cancer. J Am Coll Surg. 2010;210:767-76, 776-8. [PubMed] [DOI] |
| 7. | Baba Y, Nosho K, Shima K, Hayashi M, Meyerhardt JA, Chan AT, Giovannucci E, Fuchs CS, Ogino S. Phosphorylated AKT expression is associated with PIK3CA mutation, low stage, and favorable outcome in 717 colorectal cancers. Cancer. 2011;117:1399-1408. [PubMed] [DOI] |
| 8. | Weng D, Song X, Xing H, Ma X, Xia X, Weng Y, Zhou J, Xu G, Meng L, Zhu T. Implication of the Akt2/survivin pathway as a critical target in paclitaxel treatment in human ovarian cancer cells. Cancer Lett. 2009;273:257-265. [PubMed] [DOI] |
| 9. | Schlickum S, Moghekar A, Simpson JC, Steglich C, O'Brien RJ, Winterpacht A, Endele SU. LETM1, a gene deleted in Wolf-Hirschhorn syndrome, encodes an evolutionarily conserved mitochondrial protein. Genomics. 2004;83:254-261. [PubMed] |
| 10. | Beesley MF, McLaren KM. Cytokeratin 19 and galectin-3 immunohistochemistry in the differential diagnosis of solitary thyroid nodules. Histopathology. 2002;41:236-243. [PubMed] |
| 11. | Quintavalle C, Incoronato M, Puca L, Acunzo M, Zanca C, Romano G, Garofalo M, Iaboni M, Croce CM, Condorelli G. c-FLIPL enhances anti-apoptotic Akt functions by modulation of Gsk3β activity. Cell Death Differ. 2010;17:1908-1916. [PubMed] [DOI] |
| 12. | Piao L, Li Y, Kim SJ, Byun HS, Huang SM, Hwang SK, Yang KJ, Park KA, Won M, Hong J. Association of LETM1 and MRPL36 contributes to the regulation of mitochondrial ATP production and necrotic cell death. Cancer Res. 2009;69:3397-3404. [PubMed] [DOI] |
| 13. | Pelicano H, Xu RH, Du M, Feng L, Sasaki R, Carew JS, Hu Y, Ramdas L, Hu L, Keating MJ. Mitochondrial respiration defects in cancer cells cause activation of Akt survival pathway through a redox-mediated mechanism. J Cell Biol. 2006;175:913-923. [PubMed] [DOI] |
| 14. | Depowski PL, Rosenthal SI, Ross JS. Loss of expression of the PTEN gene protein product is associated with poor outcome in breast cancer. Mod Pathol. 2001;14:672-676. [PubMed] [DOI] |