修回日期: 2014-11-10
接受日期: 2014-11-18
在线出版日期: 2014-12-28
目的: 探讨硫化氢(H2S)对原代肝纤维化鼠肝细胞增殖、凋亡的作用及其与磷酯酰肌醇3激酶(phosphoinositide-3-kinase, PI3K)/Akt通路的关系.
方法: 采用CCl4复合因素法制备肝纤维化大鼠模型, 胰酶两步灌流法提取肝纤维化鼠肝细胞, 设对照组、NaHS组、NaHS+LY294002组, MTT法测定NaHS和LY294002对大鼠肝细胞的增殖抑制率(inhibition rate), Hochest33342法检测各组肝细胞的凋亡率, Western blot检测PI3K、Phospho-Bad蛋白的表达量.
结果: 50 μmol/L NaHS、50 μmol/L LY294002为最适浓度; 与对照组相比, NaHS+LY294002组细胞凋亡率高(P<0.05), NaHS组细胞凋亡率低, 但差异无统计学意义; NaHS组PI3K、Phospho-Bad蛋白表达量高于对照组和NaHS+LY294002组, 而NaHS+LY294002组PI3K、Phospho-Bad蛋白表达量低于对照组和NaHS组, 各组间相互比较差异均有统计学意义(P<0.05).
结论: H2S可以通过激活PI3K/Akt通路促进肝细胞的增殖, 抑制肝细胞的凋亡.
核心提示: 在本实验中, 给予外源性硫化氢(H2S)可促进肝细胞的增殖, 抑制肝细胞的凋亡, 激活磷酯酰肌醇3激酶(phosphoinositide-3-kinase, PI3K)/Akt通路的上游蛋白PI3K, 促使下游的凋亡蛋白Bad磷酸化而失活, 给予PI3K/Akt通路抑制剂LY294002后, H2S对肝细胞的保护作用可被完全阻断, 这提示我们, H2S对肝细胞的保护作用可能是通过PI3K/Akt通路来调节的.
引文著录: 岳雅伦, 宋丽秀, 郑娜娜, 张传峰, 张宁, 韩延智, 陈卫刚, 郑勇. 外源性硫化氢在PI3K/Akt通路对大鼠纤维化肝细胞增殖、凋亡的影响. 世界华人消化杂志 2014; 22(36): 5602-5608
Revised: November 10, 2014
Accepted: November 18, 2014
Published online: December 28, 2014
AIM: To explore the effect of exogenous hydrogen sulfide on rat hepatocyte proliferation and apoptosis and the role of phosphoinositide-3-kinase (PI3K)/Akt pathway.
METHODS: Female SD rats were subcutaneously injected with carbon tetrachloride to induce hepatic fibrosis, and hepatocytes were isolated from the rats. Primary hepatocytes were divided into three groups: a normal control group, a hydrogen sulfide group, and an LY294002 plus hydrogen sulfide group. MTT method was used to determine cell proliferation. Apoptosis of liver cells was detected by Hoechst 33342 staining. The expression of PI3K and phosphorylated Bad protein was detected by Western blot.
RESULTS: Sodium hydrosulfide at 50 μmol/L promoted cell proliferation (P < 0.05, compared with the control group), while 50 μmol/L LY294002 inhibited cell proliferation (P < 0.05, compared with the control group). Compared with the control group and sodium hydrosulfide group, the LY294002 plus hydrogen sulfide group had a significantly higher rate of cell apoptosis (P < 0.05). The expression of PI3K and phosphorylated Bad protein in the sodium hydrosulfide group was significantly higher than that in the control group and LY294002 plus hydrogen sulfide group (P < 0.05). However, PI3K and phospho-Bad protein expression in the LY294002 plus hydrogen sulfide group was significantly less than in the control group (P < 0.05).
CONCLUSION: Hydrogen sulfide promotes primary hepatocyte proliferation and inhibits its apoptosis possibly through the PI3K/Akt pathway.
- Citation: Yue YL, Song LX, Zheng NN, Zhang CF, Zhang N, Han YZ, Chen WG, Zheng Y. Exogenous hydrogen sulfide promotes proliferation and inhibits apoptosis of hepatocytes via PI3K/Akt pathway. Shijie Huaren Xiaohua Zazhi 2014; 22(36): 5602-5608
- URL: https://www.wjgnet.com/1009-3079/full/v22/i36/5602.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i36.5602
硫化氢(H2S)是继NO、CO之后发现的第三类气体信号分子, 分布于哺乳动物的多种组织和器官中, 有着广泛的生物学效应. 课题组的前期研究[1,2]已表明, H2S可降低门静脉压力, 下调肝组织中Ⅰ、Ⅲ型胶原蛋白的表达, 这提示H2S可以显著延缓肝纤维化的进程, 但具体机制尚需进一步探讨. 激活磷酯酰肌醇3激酶(phosphoinositide-3-kinase, PI3K)/Akt通路是广泛存在细胞中的信号转导通路, 参与调节细胞的增殖、凋亡, 维持周期运行[3]. 近来研究[4,5]表明, PI3K/Akt通路介导了H2S对心肌细胞、海马神经元等的保护作用, 然而其具体机制尚不明确. 肝纤维化是肝硬化演变过程的一个重要阶段, 肝细胞是肝脏的主要实质细胞[6], 各种因素导致肝细胞损伤, 发生变性坏死, 纤维结缔组织增生, 进而促使肝纤维化形成. 本实验拟从肝纤维化大鼠中成功提取肝细胞, 并给予外源性H2S及LY294002(PI3K/Akt通路抑制剂)干预, 探讨H2S在PI3K/Akt通路对原代肝纤维化鼠肝细胞增殖、凋亡的影响.
SD大鼠, 150-200 g, 清洁级, 新疆医科大学实验动物中心提供; 多聚赖氨酸(北京Solarbio公司); WME培养基(美国Gibco公司): 胎牛血清(美国Hyclone公司): 胰酶(美国Amresco公司); 青霉素、链霉素、胰岛素、地塞米松(美国Sigma公司); D-Hank液、Hank液(北京Solarbio公司); NaHS(美国Sigma公司); LY294002(美国Sigma公司); 噻唑蓝(MTT, 美国Sigma公司); Hochest33342(美国Gibco公司); 兔抗鼠PI3K单克隆一抗(美国Cell Signal Technology公司); 兔抗鼠bad单克隆一抗(英国Abcam公司); 二抗检测试剂盒均购自北京中杉金桥有限公司; 化学发光试剂盒(美国Thermo公司); 变性型裂解液(北京Bioteke公司); 二氧化碳培养箱(美国Forma公司); 其他试剂国产分析纯.
1.2.1 肝纤维化模型的制备: 参照刘浩等[4]CCl4复合因素法制备肝纤维化大鼠模型, 模型制备成功后用于下一步实验.
1.2.2 大鼠肝细胞的分离、纯化与培养: 造模好的大鼠腹部备皮, 消毒, 10%的水合氯醛3 mL/kg腹腔注射麻醉, 将大鼠四肢固定于泡沫板上, 腹部皮肤消毒, 剪开腹腔, 分离下腔静脉及门静脉并结扎其远心端, 将连接输液器的留置针从门静脉的近心端插入, 然后将输液器的所有开关开到最大, 待肝脏肿大时剪开下腔静脉. 将37 ℃预热的D-Hank液以流速25 mL/min灌流约10 min待肝脏变为土黄色后, 改用37 ℃预热含0.18%的胰酶继续灌流约10 min至肝脏呈白色龟裂状停止灌流. 取下灌流好的肝脏, 用含1%双抗的4 ℃预冷的Hanks液冲洗2遍, 置入培养皿中, Hanks液终止消化, 去除肝包膜及血管等纤维结缔组织, 收集肝细胞悬液, 200目筛网过滤, 500 r/min离心5 min, 弃上清液, 再次重复上述操作, 离心4-5次以去除胰酶及非肝实质细胞. 将纯化后的肝细胞收集于含10%FBS、0.8 μmol/L胰岛素、0.5 μmol/L地塞米松和1%双抗的WME培养基培养, 台盼蓝染色检测细胞活力并计数, 细胞活力>80%者用于后续实验, 将调整好密度的肝细胞种于提前用多聚赖氨酸铺过板的35 mm培养板中, 37 ℃、50 mL/L CO2条件下培养. 4-6 h细胞贴壁后换液, 去除活力不高的肝细胞, 继续培养进行后续实验.
1.2.3 四甲基偶氮唑蓝(MTT)法检测细胞增殖: 将提取的原代肝细胞以105个/孔种于无菌96孔板中, 每孔加入培养基至200 μL, 37 ℃ CO2培养箱培养6 h, 换液, 去除活力不好的肝细胞, 继续培养20 h后加药处理. NaHS组分别按照 25、50、75、100、200 μmol/L浓度梯度给药, LY组分别按照25、50、75、100、200 μmol/L浓度梯度给药, 确定最适浓度. 每组设6个复孔, 边缘孔用PBS填充, 继续在CO2培养箱中继续孵育48 h后, 除边缘孔外每孔均加入5 mg/mL的MTT 20 μL. 反应4 h后吸去培养基, 并加150 μL DMSO, 避光振荡混匀10 min后用酶标仪测定其吸光度(A)值, 测定波长490 nm, 计算细胞增殖抑制率(inhibition rate, IR), 换算公式为: IR = (1-实验组A值/对照组A值)×100%.
1.2.4 Hoechst染色检测细胞凋亡: 将提取的原代肝细胞接种于6孔培养板中, 培养6 h后换液, 去除活力不好的肝细胞, 继续培养20 h后加药处理, 设N组(正常对照组), H2S组(加入50 μmol/L NaHS), LY+H2S组(加入50 μmol/L/L NaHS+50 μmol/L LY294002)处理48 h, 以4%多聚甲醛固定液2 min, 去固定液, 用PBS洗2次, 每次3 min, 吸尽液体, 加入终浓度为10 ng/L的Hoechst33342染色液染色, 37 ℃孵育15 min, 用PBS洗2次, 每次3 min, 荧光显微镜可检测到呈蓝色的细胞核.
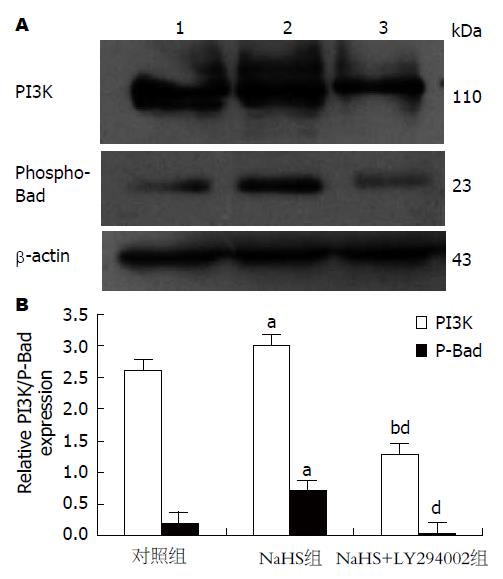
1.2.5 Western blot检测PI3K、Bad蛋白的表达: 提取的肝细胞按上述步骤接种于6孔培养板中, 分组加药处理, 48 h后用PBS洗2次, 加入细胞裂解液, 4 ℃静置30 min, 12000 r/min离心5 min, 取上清, 采用紫外分光光度计法测定蛋白浓度, 统一蛋白浓度为20 g/L, 蛋白变性后待用. 加样量每孔5 μL, 总蛋白经SDS-PAGE分离后, Marker位置标记, 转移至PVDF膜上. 室温下目的蛋白用5%BSA封闭2 h, 内参用5%脱脂奶粉封闭2 h, PI3K、Bad加入兔抗鼠一抗均为1:1000, β-actin加入鼠抗鼠一抗1:1000, 4 ℃冰箱过夜, TBST洗5次, 5 min/次, 再各加入山羊抗兔二抗1:30000, β-actin加入山羊抗鼠二抗1:30000常温下孵育2 h, 再用TBST洗5次, 5 min/次. 将PVDF膜用发光试剂ECL显色, 暗室曝光到X线片上, 显影、定影后将胶片置于凝胶成像进行定量分析, 计算目的蛋白灰度值与β-actin蛋白灰度值的比值.
统计学处理 所有数值均用mean+SD示, 采用SPSS17.0统计学软件, 多个处理组与对照组相比采用单因素方差分析, 进一步组间两两比较采用SNK-q检验, P<0.05为差异有统计学意义.
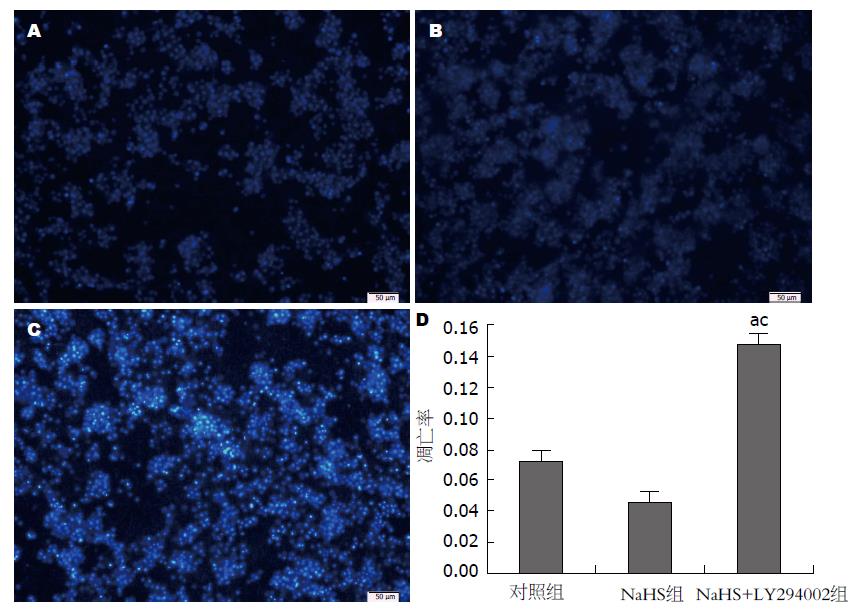
置于倒置相差显微镜下观察, 可见刚提的原代纤维化鼠的肝细胞呈圆形透亮, 核仁清晰, 培养24 h后, 肝细胞拉平变薄, 立体结构明显, 多呈岛状连接, 双核或多核多见, 台盼蓝染色可见, 活细胞拒染, 整个活细胞呈透亮无色(图1).
由表1可知, 在25-75 μmol/L, NaHS可促进肝细胞的增殖, 而当NaHS浓度>100 μmol/L以后, 肝细胞的增殖受到抑制, 且各组与对照组相比差异有统计学意义, 以50 μmol/L NaHS促增殖作用最明显, LY294002在各个浓度下A值均小于对照组(P<0.05), 且随着药物浓度的增大, 抑制率逐渐增高. 低浓度的LY294002抑制作用不明显, 高浓度的LY294002又对肝细胞的形态, 功能影响较大, 因此本实验选用50 μmol/L浓度的LY294002用于后续实验.
| 分组 | 药物浓度(µmol/L) | A值 | P值 | IR(%) |
| 对照组 | - | 0.63±0.36 | - | 0.0 |
| NaHS组 | 25 | 0.69±0.30 | 0.001 | 9.7b |
| 50 | 0.78±0.20 | 0.000 | 23.9b | |
| 75 | 0.64±0.10 | 0.592 | 1.2 | |
| 100 | 0.57±0.01 | 0.000 | 10.0b | |
| 200 | 0.55±0.14 | 0.000 | 12.1b | |
| LY294002组 | 25 | 0.52±0.01 | 0.000 | 17.0b |
| 50 | 0.47±0.02 | 0.000 | 24.7b | |
| 75 | 0.36±0.01 | 0.000 | 42.7b | |
| 100 | 0.22±0.01 | 0.000 | 64.5b | |
| 200 | 0.17±0.07 | 0.000 | 73.7b |
如图2所示, 对照组与NaHS组肝细胞细胞核呈淡蓝色低密度荧光, 无明显的核碎裂, 两组相比差异无统计学意义, 而加入LY294002(PI3K/Akt通路抑制剂)后凋亡细胞较对照组与NaHS组明显增多, 细胞核碎裂明显, 细胞膜通透性增加, 细胞核呈高密度蓝色荧光. NaHS+LY294002组与对照组和NaHS组比较差异有统计学意义(图2D).
与对照组相比, NaHS组PI3K蛋白表达量高(P<0.05), Phospho-Bad蛋白表达量明显增高(P<0.05); NaHS+LY294002组PI3K蛋白表达量低(P<0.05), Phospho-Bad蛋白表达量降低, 但差异无统计学意义(图3).
肝纤维化是肝硬化演变发展过程中的一个重要阶段, 细胞外基质的大量沉积是肝纤维化的基础, 其中以胶原的合成, 过度沉积为主, 近年来, 肝细胞的胶原合成功能已经得到公认[7-10], 这使得在肝纤维化发生发展过程, 对肝细胞的研究价值大为提高. 临床上, 慢性重型肝炎患者应用促肝细胞生长素可促进肝细胞在损伤过程中的修复和再生, 显著提高慢性重型肝炎患者的疗效[11], 这说明, 肝细胞的增殖和凋亡对肝纤维化的发生发展和转归产生了重要的作用.
H2S是广泛存在体内的第3种气体信号分子, 本课题组前期研究发现, H2S在肝硬化发生发展过程中具有保护性作用, 其机制与其对肝组织内细胞增殖的调节有关[12,13]. 研究[14]发现, 在组织中, H2S缺乏可促使肝硬化大鼠肝细胞的凋亡增加, 进而促进肝纤维化的启动与发生甚至引起门静脉压力的进一步提高. 但机体是多因素综合作用的结果, 为了进一步说明H2S对肝细胞的具体作用及其与PI3K/Akt通路的关系, 本课题组对传统的Seglen两步胶原酶灌流法进行改良, 经过反复实验发现, 胶原酶提取的肝细胞产量高, 但活力低, 难以进行后续实验, 且胶原酶价格昂贵, 胰酶提取的肝细胞产量较胶原酶较低, 但活力高, 且胰酶的价格便宜, 使用两步胰酶灌流肝细胞方便、经济[15], 另外, 因Ca、Mg离子对胰酶的活化有抑制作用, 因此, 本实验选用无Ca、Mg离子的D-Hanks液作为灌流液, 并且在灌流的过程中, 灌流时的温度和灌注压对肝细胞的活性和产量有很大的影响. 本课题组成功从CCl4所致肝纤维化大鼠肝脏中提取原代肝纤维化肝细胞, 这种肝细胞较正常肝细胞内含较多脂滴, 细胞核大.
我们的研究发现, 低浓度的H2S促进原代肝纤维化鼠肝细胞的增殖, H2S对细胞的生存有双重调节作用. Du等[16]证实NaHS浓度在100-500 μmol/L之间时可抑制鼠动脉血管平滑肌细胞的增殖, 而Baskar等[17]发现当H2S的浓度在10-75 μmol/L时, NaHS的浓度越高, 人类肺纤维化细胞的增殖越明显, 因此, H2S既可以是毒性的, 也可以是保护作用的, 这取决于不同的实验条件, 包括研究的细胞的类型和H2S的浓度[18,19]. 在当前的研究中, H2S在体外可直接影响肝细胞的数量, 但是这个研究展示在体外培养肝细胞时, H2S仅仅在25-75 µmol/L之间可促进肝细胞的增殖, 提示H2S可能是调节肝细胞数量的一个关键因子. 而H2S对肝细胞凋亡的抑制作用与正常组对比差异并不显著, 因此, 我们并不能说, H2S抑制了肝细胞的凋亡, 分析原因为, 肝细胞在提取过程中会受到损伤, 而到第3天时, 受损的肝细胞的功能和活性可以得到完全修复, 其功能为最佳状态[20], 因此, 我们推测, 由于对照组的肝细胞凋亡较少, 所以在加入H2S干预后对他的抑制凋亡作用并不显著, 与对照组相比差异无统计学意义, 而当我们在另一组同时加入NaHS和LY294002后, 肝细胞的凋亡大量增加, 这说明当我们用LY294002阻断PI3K/Akt通路后, H2S对肝细胞的这一保护作用也被阻断.
当前的研究展示H2S的促肝细胞增殖作用是依赖于PI3K/Akt通路的活化, PI3K/Akt通路广泛存在细胞中, 是参与细胞生长、增殖、分化调节、维持周期运行、抑制细胞凋亡的信号转导通路[21], PI3K作为联系胞外信号和细胞应答效应的桥梁分子, 可被一系列上游或旁路信号分子所影响, 研究发现在Cajal间质细胞[22]和海马神经元细胞[23]中, H2S可以诱导PI3K的活化, 活化的PI3K通过一系列级联反应促使下游Akt的活化, Akt是PI3K下游的关键因子, 活化的Akt通过磷酸化作用激活或抑制其下游的一系列底物如Bad、核因子-κB(nuclear factor-κB, NF-κB)、糖原合成酶激酶-3β(glycogen synthesis kinase-3β, GSK-3β)等改变, 从而调节细胞的增殖、分化、凋亡以及迁移等. LY294002, 一种PI3K/Akt信号通路传统抑制剂[24], 可以阻止H2S激活PI3K/Akt通路, 更重要的是, 他能破坏低浓度的H2S增加肝细胞的数量, 当我们用NaHS作为外源性H2S的供体处理肝细胞时, NaHS组PI3K蛋白的表达量较对照组明显增加, NaHS促使PI3K的活化, 也就是说, H2S在肝细胞中激活了PI3K/Akt通路. 活化的PI3K/Akt通路可促使下游的凋亡蛋白磷酸化而失活, 从而起到抗凋亡的作用, 例如, Bad蛋白, 作为Bcl-2家族的一员, Bad蛋白在多种细胞中表达, 参与细胞凋亡的全过程[25,26], 当PI3K/Akt信号通路被H2S激活后, 活化的Akt可以磷酸化Bad使他处于失活状态, 从而起到抗凋亡的作用[27], 王慧等[28]通过体外培养大鼠肝星状细胞并给予外源性H2S干预发现, 对照组与各处理组之间Bad总蛋白的表达无明显差异, Yadav等[29]也发现, LY294002可以降低磷酸化Bad蛋白的表达, 但对Bad总蛋白的表达无明显影响, 因此, 本实验通过检测磷酸化Bad蛋白的表达量, 发现H2S可以通过活化PI3K/Akt通路增加磷酸化Bad蛋白的表达量, Bad磷酸化而失活, 促凋亡作用被抑制, 我们推测, 在肝细胞中, H2S通过活化PI3K/Akt通路上游的蛋白因子, 促使下游的一系列促凋亡蛋白磷酸化或去磷酸化而失活, 从而起到抗凋亡, 促进肝细胞增殖的作用, 但是, 已有报道[19]显示, H2S在不同组织和细胞中分布的浓度不同, 所起到的作用也不同, 本实验也证实, 低浓度的H2S可以起到促进肝细胞增殖的保护作用, 但高浓度的H2S却抑制肝细胞的增殖, 对肝细胞表现为损害作用, 张宁等[30]通过检测大鼠肝纤维化早、中、晚期门静脉血中H2S的浓度, 发现随着肝纤维化的发生发展, 门静脉血中H2S的浓度呈递减的趋势, 那么, 在肝纤维化发生发展的不同时期, 内源性的H2S在肝细胞中的浓度是如何变化的, 是不是随着肝纤维化的发生, 内源性的H2S在肝细胞中的浓度会再分布, 从而表现为促进肝细胞增殖, 抑制肝纤维化的保护作用, 这些问题尚有待于我们的进一步研究.
总之, 我们的初步研究显示, 给予外源性H2S可促进肝细胞的增殖, 抑制肝细胞的凋亡, 激活PI3K/Akt通路的上游蛋白, 促使下游的凋亡蛋白磷酸化而失活, 给予PI3K/Akt通路抑制剂LY294002后, H2S对肝细胞的保护作用可被完全阻断, 这提示我们, H2S对肝细胞的保护作用可能是通过PI3K/Akt通路来调节的. 但其具体调节机制尚待我们进一步研究. 我们推测, H2S可能通过PI3K/Akt通路来调节肝细胞的增殖、凋亡, 从而延缓肝纤维化的发生, 这可能会为肝纤维化的防治及研究提供新的思路.
硫化氢(H2S)作为一种新型的气体信号分子, 广泛参与体内多种组织和器官的生理调节, 本课题组前期研究发现: H2S在肝纤维化的发生发展过程中具有保护作用.
陈积圣, 教授, 中山大学孙逸仙纪念医院肝胆外科; 邓庆, 副研究员, 上海人类基因组研究中心功能基因组部
H2S可通过活化PI3K/Akt通路调节心肌细胞、海马神经元和肝星状细胞的增殖和凋亡, 但对肝细胞, 尤其是肝纤维化进程中的肝细胞的作用目前报道较少.
刘浩等研究发现在H2S缺乏的状态下, 肝硬化大鼠肝细胞的凋亡增加, 进而促进肝纤维化启动与发生甚至引起门静脉压力的进一步增高, 这说明在肝纤维化的进程中, H2S可能通过调节肝细胞的增殖和凋亡来抗肝纤维化.
本实验通过提取原代肝纤维化大鼠的肝细胞, 并给予H2S供体(NaHS)及PI3K/AKT信号通路特异性阻断剂(LY294002)干预, 观察在体外H2S对肝细胞数量的调节及其对PI3K/Akt通路的影响, 为明确H2S产生的抗肝纤维化机制提供了理论基础.
在肝纤维化进程中, H2S通过PI3K/Akt通路促进肝细胞的增殖, 从而延缓肝纤维化的发生, 这可能会为肝纤维化的防治及研究提供新的思路.
选题先进, 设计合理, 讨论得当, 有一定的科研意义.
编辑: 郭鹏 电编:闫晋利
| 1. | 李 文娟, 郑 勇, 陈 卫刚, 刘 清华, 张 宁, 宋 丽秀, 刘 维国. 内源性硫化氢对实验性肝硬化门静脉高压调节作用. 中华实用诊断与治疗杂志. 2010;24:429-432. |
| 2. | Fiorucci S, Antonelli E, Mencarelli A, Orlandi S, Renga B, Rizzo G, Distrutti E, Shah V, Morelli A. The third gas: H2S regulates perfusion pressure in both the isolated and perfused normal rat liver and in cirrhosis. Hepatology. 2005;42:539-548. [PubMed] |
| 3. | Yan-nan B, Zhao-yan Y, Li-xi L, jiang Y, Qing-jie X, Yong Z. MicroRNA-21 accelerates hepatocyte proliferation in vitro via PI3K/Akt signaling by targeting PTEN. Biochem Biophys Res Commun. 2014;443:802-807. [PubMed] [DOI] |
| 4. | Yao LL, Huang XW, Wang YG, Cao YX, Zhang CC, Zhu YC. Hydrogen sulfide protects cardiomyocytes from hypoxia/reoxygenation-induced apoptosis by preventing GSK-3beta-dependent opening of mPTP. Am J Physiol Heart Circ Physiol. 2010;298:H1310-H1319. [PubMed] [DOI] |
| 5. | Chen Y, Zhao J, Du J, Xu G, Tang C, Geng B. Hydrogen sulfide regulates cardiac sarcoplasmic reticulum Ca(2+) uptake via K(ATP) channel and PI3K/Akt pathway. Life Sci. 2012;91:271-278. [PubMed] [DOI] |
| 6. | Zeisberg M, Yang C, Martino M, Duncan MB, Rieder F, Tanjore H, Kalluri R. Fibroblasts derive from hepatocytes in liver fibrosis via epithelial to mesenchymal transition. J Biol Chem. 2007;282:23337-23347. [PubMed] |
| 10. | Guzelian PS, Qureshi GD, Diegelmann RF. Collagen synthesis by the hepatocyte: studies in primary cultures of parenchymal cells from adult rat liver. Coll Relat Res. 1981;1:83-93. [PubMed] |
| 12. | 任 嫱, 李 睿, 赵 强, 徐 霞, 杨 新疆, 陈 卫刚, 郑 勇. LY294002在外源性H2S预处理肝纤维化大鼠肝星状细胞增殖、凋亡中的作用. 胃肠病学和肝病学杂志. 2013;22:804-807. |
| 13. | Łowicka E, Bełtowski J. Hydrogen sulfide (H2S) - the third gas of interest for pharmacologists. Pharmacol Rep. 2007;59:4-24. [PubMed] |
| 14. | 赵 强, 陈 卫刚, 赵 瑾, 李 睿, 宋 丽秀, 任 嫱, 杨 新疆, 郑 勇. 硫化氢对肝纤维化大鼠肝脏Ⅰ、Ⅲ型胶原表达的影响. 世界华人消化杂志. 2013;21:300-306. [DOI] |
| 16. | Du J, Hui Y, Cheung Y, Bin G, Jiang H, Chen X, Tang C. The possible role of hydrogen sulfide as a smooth muscle cell proliferation inhibitor in rat cultured cells. Heart Vessels. 2004;19:75-80. [PubMed] |
| 17. | Baskar R, Li L, Moore PK. Hydrogen sulfide-induces DNA damage and changes in apoptotic gene expression in human lung fibroblast cells. FASEB J. 2007;21:247-255. [PubMed] |
| 18. | Deplancke B, Gaskins HR. Hydrogen sulfide induces serum-independent cell cycle entry in nontransformed rat intestinal epithelial cells. FASEB J. 2003;17:1310-1312. [PubMed] |
| 19. | Fiorucci S, Distrutti E, Cirino G, Wallace JL. The emerging roles of hydrogen sulfide in the gastrointestinal tract and liver. Gastroenterology. 2006;131:259-271. [PubMed] |
| 20. | Wen X, Qi D, Sun Y, Huang X, Zhang F, Wu J, Fu Y, Ma K, Du Y, Dong H. H2S attenuates cognitive deficits through Akt1/JNK3 signaling pathway in ischemic stroke. Behav Brain Res. 2014;269:6-14. [PubMed] [DOI] |
| 22. | Huang Y, Li F, Tong W, Zhang A, He Y, Fu T, Liu B. Hydrogen sulfide, a gaseous transmitter, stimulates proliferation of interstitial cells of Cajal via phosphorylation of AKT protein kinase. Tohoku J Exp Med. 2010;221:125-132. [PubMed] |
| 23. | Shao JL, Wan XH, Chen Y, Bi C, Chen HM, Zhong Y, Heng XH, Qian JQ. H2S protects hippocampal neurons from anoxia-reoxygenation through cAMP-mediated PI3K/Akt/p70S6K cell-survival signaling pathways. J Mol Neurosci. 2011;43:453-460. [PubMed] [DOI] |
| 26. | Yang E, Zha J, Jockel J, Boise LH, Thompson CB, Korsmeyer SJ. Bad, a heterodimeric partner for Bcl-XL and Bcl-2, displaces Bax and promotes cell death. Cell. 1995;80:285-291. [PubMed] |
| 27. | Datta SR, Dudek H, Tao X, Masters S, Fu H, Gotoh Y, Greenberg ME. Akt phosphorylation of BAD couples survival signals to the cell-intrinsic death machinery. Cell. 1997;91:231-241. [PubMed] |