修回日期: 2014-10-15
接受日期: 2014-11-05
在线出版日期: 2014-12-18
目的: 在体外条件下, 探讨山奈酚对内质网应激(endoplasmic reticulum stress, ERS)诱导人正常肝细胞株HL-7702细胞凋亡的保护作用以及机制.
方法: 通过ERS诱导剂衣霉素(tunicamycin, TM)诱导HL-7702细胞发生凋亡, 建立肝细胞损伤模型, 以不同浓度的山奈酚干预HL-7702细胞. 分别采用倒置显微镜观察细胞形态学变化; 采用MTT法检测细胞存活率; 采用乳酸脱氢酶(lactate dehydrogenase, LDH)活力定量测定试剂盒测定细胞上清液LDH活性; 采用流式细胞术检测细胞凋亡率; 同时采用免疫印迹法检测ERS相关凋亡相关蛋白CHOP的表达情况.
结果: 与TM诱导的肝细胞凋亡组相比, 低浓度山奈酚(0.01、0.10、1.00 μmol/L)显著抑制ERS诱导的肝细胞凋亡, 但随着浓度升高其保护作用减弱, 包括改善细胞形态, 增加肝细胞的存活率(TM模型组80.14%±8.00%, 不同浓度山奈酚干预组分别为96.16%±10.00%, P<0.01; 91.43%±9.10%, P<0.01; 87.84%±6.90%, P<0.01), 减少了HL-7702细胞释放LDH(TM模型组398.5 U±30.8 U, 不同浓度山奈酚干预组分别为89.9 U±21.4 U, P<0.05; 95.1 U±8.9 U, P<0.05; 120.5 U±24.2 U, P<0.05), 减少HL-7702细胞的凋亡率(TM模型组4.58%±0.90%, 不同浓度山奈酚干预组分别为1.18%±0.48%, P<0.05; 1.97%±0.32%, P<0.05; 2.63%±0.16%, P<0.05), 并显著下调ERS特异性凋亡蛋白CHOP的表达.
结论: 低浓度山奈酚可能通过抑制CHOP的表达保护ERS诱导的肝细胞凋亡HL-7702细胞, 因此应用山奈酚可能为肝病所引发的肝损伤提供新的干预措施.
核心提示: 深入探讨山奈酚对内质网应激(endoplasmic reticulum stress, ERS)诱导正常肝细胞凋亡的作用, 证实山奈酚对ERS诱导细胞凋亡的保护作用, 并阐明低浓度山奈酚对细胞凋亡具有更好保护作用; 此外, 山奈酚通过抑制CHOP分子改善ERS诱导细胞凋亡.
引文著录: 郭媛媛, 任锋, 张向颖, 段钟平, 张桓虎. 山奈酚对内质网应激诱导的肝细胞损伤的保护及机制. 世界华人消化杂志 2014; 22(35): 5400-5407
Revised: October 15, 2014
Accepted: November 5, 2014
Published online: December 18, 2014
AIM: To explore the protective effect of kaempferol on human normal hepatocyte line HL-7702 cells under the endoplasmic reticulum stress and the underlying mechanism.
METHODS: In order to develop a hepatocyte apoptosis model, endoplasmic reticulum stress inducer tunicamycin was used to induce HL-7702 cell apoptosis. After HL-7702 cells were incubated with different concentrations of kaempferol (0.01, 0.1, 1 μmol/L), cell morphological changes were observed by microscopy, cell viability was measured by MTT assay, lactate dehydrogenase (LDH) activity in cell supernatants was determined with an LDH assay kit, apoptosis was measured by flow cytometry, and the protein expression of CHOP, a special marker of apoptosis induced by endoplasmic reticulum stress, was detected by Western blot.
RESULTS: Compared with the tunicamycin-induced hepatocyte apoptosis group, low concentrations of kaempferol (0.01, 0.1, 1 μmol/L) significantly inhibited endoplasmic reticulum stress-induced hepatocyte apoptosis. Kaempferol improved cell morphology, increased liver cell survival (tunicamycin model group, 80.14% ± 8.00%; 0.01 μmol/L kaempferol group, 96.16% ± 10.00%, P < 0.01; 0.1 μmol/L kaempferol, 91.43% ± 9.10%, P < 0.01; 1 μmol/L kaempferol, 87.84% ± 6.90%, P < 0.01), and reduced the levels of LDH released from HL-7702 cells (tunicamycin model group, 398.5 U ± 30.8 U; 0.01 μmol/L kaempferol, 89.9 U ± 21.4 U, P < 0.05; 0.1 μmol/L kaempferol, 95.1 U ± 8.9 U, P < 0.05; 1 μmol/L kaempferol, 120.5 U ± 24.2 U, P < 0.05), the apoptosis rates (tunicamycin model group, 4.58% ± 0.90%; 0.01 μmol/L kaempferol, 1.18% ± 0.48%, P < 0.05; 0.1 μmol/L kaempferol, 1.97% ± 0.32%, P < 0.05; 1 μmol/L kaempferol, 2.63% ± 0.16%, P < 0.05) and significantly reduced the expression of CHOP protein.
CONCLUSION: Low concentrations of kaempferol may inhibit endoplasmic reticulum stress-induced hepatocyte apoptosis by decreasing the expression of CHOP. Kaempferol may be a new drug to protect against liver injury induced by liver disease.
- Citation: Guo YY, Ren F, Zhang XY, Duan ZP, Zhang HH. Protective effect of kaempferol on endoplasmic reticulum stress-induced hepatocyte apoptosis and underlying mechanism. Shijie Huaren Xiaohua Zazhi 2014; 22(35): 5400-5407
- URL: https://www.wjgnet.com/1009-3079/full/v22/i35/5400.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i35.5400
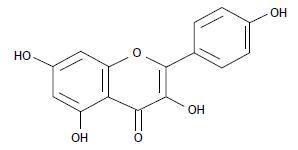
山奈酚(kaempferol)是一种天然的黄酮类化合物(化学结构如图1), 主要来源于姜科植物山奈的根茎, 还存在于黄芪、银杏、藏茵陈等中草药中, 还广泛存在于各种水果、蔬菜等食物中[1-4], 具有抗癌、抗氧化、抗炎、抗病毒等功效[4]. 近年来, 人们对于山奈酚的抗癌方面做了大量研究, 并证实一定浓度的山奈酚有诱导肺癌[5]、胃癌[6]、食管癌[7]、肝癌[8]细胞凋亡的作用. 对于正常细胞, 有报道称山奈酚可以显著提高细胞应对氧化应激的能力, 降低活性氧(reactive oxygen species, ROS)的产生[9,10], 达到保护细胞抗凋亡的作用. 据报道, 山奈酚可通过抑制促炎因子的表达, 对人类肝细胞有炎症抑制作用, 达到抗炎效果[11,12]. 因此, 山奈酚不仅在抗肿瘤方面有优势, 对损伤的正常细胞也有保护作用, 目前对于山奈酚对内质网应激(endoplasmic reticulum stress, ERS)诱导的细胞损伤的作用研究较少, 值得进一步研究.
ERS是由于各种原因引起的内质网中出现错误折叠或未折叠蛋白在腔内聚集以及钙离子平衡紊乱的状态[13]. 肝脏的代谢功能旺盛, 拥有大量的内质网, 肝脏中各种蛋白的合成、分泌, 胆固醇的合成都与内质网的功能状态关系密切[14-16]. 细胞发生持续的ERS将会引起凋亡(apoptosis), 表达凋亡相关蛋白, 如Caspase3、CHOP等. 衣霉素(tunicamycin, TM)是公认的ERS诱导剂, 可以诱导细胞凋亡. TM是一种的核苷抗生素, 也是N-糖链抑制剂, 可通过抑制蛋白糖基化途径中十四糖二磷酸长萜醇的生成, 使糖链加工受阻, 形成脱糖蛋白, 阻碍内质网内新生蛋白质糖基化修饰, 介导细胞凋亡[17,18]. 本实验通过观察在体外条件下, 探讨山奈酚干预对ERS诱导的HL-7702细胞凋亡的作用及其机制, 为山奈酚今后应用于临床治疗急慢性肝损伤提供实验依据.
山奈酚(纯度>95%)、二甲基亚砜(dimethylsulfoxide, DMSO)、TM、胰蛋白酶购自美国Sigma公司; 噻唑蓝(thiazolyl blue, MTT)购自美国Amresco公司; RPMI 1640培养基、胎牛血清(fetal bovine serum, FBS)购自美国Hyclone公司; 乳酸脱氢酶(lactic dehydrogenase, LDH)活力定量测定试剂盒购自普利莱基因技术有限公司; Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司; ECL化学发光液购自美国Thermo公司; β-actin、CHOP抗体及辣根酶标记抗兔、抗鼠二抗均购自美国Cell Signaling公司; 其他试剂为国产分析纯.
1.2.1 细胞培养: 正常人肝细胞系HL-7702细胞(保存于北京佑安医院肝病研究所), 于含10% FBS、100 U/mL青霉素、100 mg/L链霉素的RPMI 1640培养基中(5%CO2、37 ℃、饱和湿度)培养传代.
1.2.2 药品制备: 山奈酚溶于DMSO, 配置成0.01 mmol/L、0.10 mmol/L、1.00 mmol/L的储存浓度; TM溶于DMSO, 储存浓度为10 μg/μL.
1.2.3 倒置显微镜观察细胞形态学变化: 将对数生长期的HL-7702细胞以1×104/孔接种于96孔细胞培养板, 培养24 h. 换成含有山奈酚浓度分别为0.01 μmol/L、0.10 μmol/L、1.00 μmol/L的培养基预孵育2 h. 2 h后弃掉细胞上清, 换成上述相同浓度的山奈酚并含TM终浓度为20 μg/mL的培养基培养. 同时设溶剂对照组(DMSO终浓度为0.2%)、模型组(TM为20 μg/mL)和空白对照组. 12 h后, 吸弃上清液, 1×PBS洗涤1次, 将HL-7702细胞置于倒置显微镜下观察并拍照. 所有实验重复3次, 下同.
1.2.4 MTT法检测山奈酚干预对HL-7702细胞存活率的影响: MTT法又称MTT比色法, 是一种检测细胞存活和生长的方法. 其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒(formazan)并沉积在细胞中, 而死细胞无此功能. DMSO能溶解细胞中的甲瓒, 用酶联免疫检测仪在490 nm波长处测定其光吸收(A)值, 可间接反映活细胞数量. 在一定细胞数范围内, MTT结晶形成的量与细胞数成正比. 如上所述培养细胞, 弃去培养液, 每孔加入MTT(0.5 mg/mL) 200 μL, 继续培养4 h, 弃去MTT, 每孔加入DMSO 150 μL, 振荡器振荡10 min, 于酶标仪490 nm波长处测定吸光度值, 计算细胞存活率[19]. 公式如下:
细胞相对存活率(%) = (药物处理组A值-空白对照组A值)/(溶剂对照组A值-空白对照组A值)×100%
1.2.5 细胞上清液LDH活性测定: LDH是哺乳动物细胞内糖酵解的关键酶, 存在于大多数组织的细胞内液中, 在组织液和细胞外液含量很低. 因此, 通过测定细胞上清液的LDH含量, 可以判断细胞的损伤程度. 如上所述进行细胞培养后, 留取细胞上清液, 按照LDH试剂盒说明书进行操作, 酶标仪测定A440值, 根据标准曲线计算细胞上清液LDH活力单位.
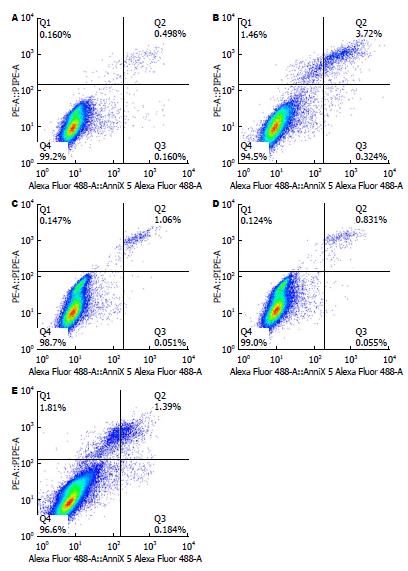
1.2.6 流式细胞术检测山奈酚干预对HL-7702细胞凋亡率的影响: 将HL-7702细胞以6×105/孔接种于60 mm培养皿中, 培养24 h后, 同上述实验步骤, 山奈酚不同浓度预孵育2 h, 2 h后加入TM继续培养12 h, 收集细胞上清液到15 mL离心管中, 用0.25%胰酶消化细胞, 将细胞收集于同一离心管中, 离心, 1000 r/min, 5 min, 弃掉细胞上清, 用1×PBS洗涤细胞2次, 加入500 μL结合缓冲液,将细胞移入流式管中, 每管加入5 μL Annexin V-FITC及5 μL PI, 避光, 室温放置15 min, 流式细胞仪进行检测.
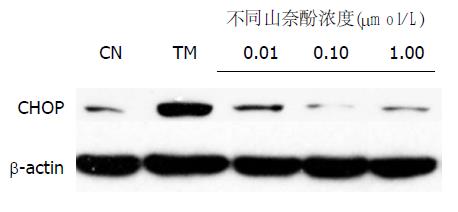
1.2.7 免疫印迹法(Western blot)检测CHOP表达: 如上所述对细胞进行培养, 并进行药物干预, 12 h后, 吸弃上清液, 1×PBS洗3次, 用15 mL离心管收集细胞, 每管加入200 μL细胞裂解液(含蛋白酶抑制剂), -80 ℃与4 ℃之间反复冻融3次, 充分裂解细胞蛋白, 用Bio-Rad Dc蛋白分析微孔板法测定上清液中蛋白浓度, 具体操作按说明书进行. Western blot操作如下: 取30 μg HL-7702细胞蛋白上样、蛋白样品利用12%SDS-PAGE凝胶电泳(开始80 V, 当蛋白Marker电泳至分离胶后调为120 V至蛋白充分分离)、蛋白转膜(聚偏氟乙烯膜, 30 V、4 ℃过夜转膜)、一抗(1:1000稀释)4 ℃孵育过夜、二抗(1:2000稀释)室温孵育1 h、TBST漂洗3次, 取等量的ECL化学发光试剂A液和B液混匀后孵育聚偏氟乙烯膜, 压片曝光.
统计学处理 采用SPSS16.0统计学软件进行数据处理. 结果以mean±SD表示, 多组间数据比较采用单因素方差分析, 两组间数据比较采用t检验, P<0.05为差异有统计学意义.
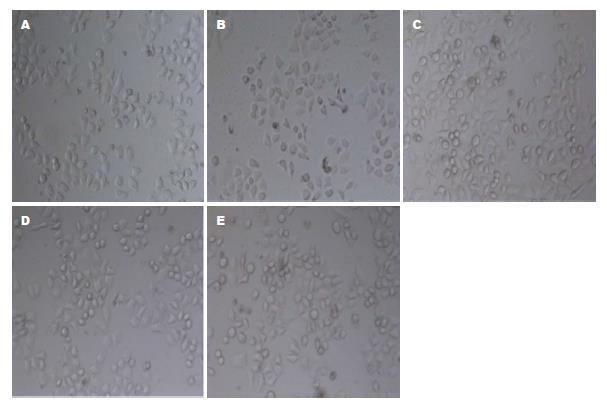
与正常对照组比较, TM作用于细胞12 h引起细胞数量减少, 细胞变形, 由多边形变成圆形或不规则形, 胞质内形成凋亡小体, 贴壁性差. 以不同浓度山奈酚干预TM处理细胞, 山奈酚浓度为0.01 μmol/L、0.10 μmol/L、1.00 μmol/L细胞形态与对照组无明显差异(图2).
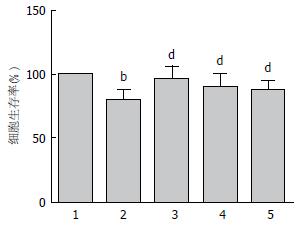
TM作用于HL-7702细胞12 h, 通过MTT法测定相对存活率分别为80.14%±8.00%, 与正常对照组存活率100%相比, 差异有统计学意义(P = 0.001). 山奈酚0.01 μmol/L+TM组、0.10 μmol/L+TM组和1.00 μmol/L+TM组存活率分别为96.16%±10.00%、91.43%±9.10%和87.84%±6.90%, 与TM模型组存活率80.14%±8.00%相比, 具有明显差别, 差异有统计学意义(P<0.01)(图3).
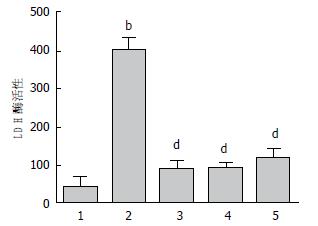
TM作用于HL-7702细胞12 h后, 测定细胞上清液中LDH活力单位分别为398.5 U±30.8 U, 与正常对照组相比48.3 U±18.9 U, 差异有统计学意义(P<0.01). 山奈酚0.01 μmol/L+TM组、0.10 μmol/L+TM组和1.00 μmol/L+TM组LDH活力单位分别为89.9 U±21.4 U 、95.1 U±8.9 U、120.5 U±24.2 U, 与TM模型组相比LDH活力单位398.5 U±30.8 U具有明显差别, 差异有统计学意义(P<0.01)(图4).
TM作用于HL-7702细胞12 h后, 通过流式术检测模型组, 其凋亡率分别为: TM模型组4.58%±0.90%. 与正常对照组0.77%±0.04%比较, 差异有统计学意义(P<0.01). 山奈酚0.01 μmol/L+TM组、0.10 μmol/L+TM组和1.00 μmol/L+TM组的凋亡率分别为1.18%±0.48%、0.97%±0.32%、2.63%±0.16%, 与 TM模型组4.58%±0.9%相比具有明显差别, 差异有统计学意义(P<0.01)(图5).
蛋白印迹法检测ERS特异性凋亡标志性蛋白CHOP的表达. 实验以β-actin作为参照, 结果证实, 当山奈酚浓度为0.01、0.10 μmol/L时, 作用于ERS的HL-7702细胞能明显减少CHOP的表达, 而较高浓度1.00 μmol/L对CHOP蛋白的表达抑制作用不明显(图6).
本次实验研究结果表明了山奈酚对TM诱导的人肝细胞株HL-7702发生ERS具有保护作用, 在一定的浓度范围内有效的抑制了ERS产生的促凋亡作用. 实验结果显示, 在TM诱导的HL-7702细胞损伤模型中, 当浓度为0.01-0.10 μmol/L时, 山奈酚的保护作用较明显, 显著提高HL-7702细胞的生存率、减少细胞上清LDH含量、减少细胞凋亡率并且不同程度的影响ERS、凋亡相关蛋白的表达. 然而随着山奈酚浓度升高, 这种保护作用越来越不明显, 甚至对细胞产生损伤. 因此, 较低浓度的山奈酚作用于发生ERS的HL-7702细胞是具有保护作用的.
ERS在各种肝病的发病机制中发挥着重要作用. 近年的研究[14-16,20]报道, 各种肝炎病毒感染所致肝损伤, 非酒精性脂肪性肝病, 中毒性肝损害以及肝癌、肝硬化都与ERS关系密切. 当细胞发生ERS, 可通过1型ER跨膜蛋白激酶(type-1 ER transmembrane rrotein kinase, IRE1)、双链RNA依赖的蛋白激酶样ER激酶[double-stranded RNA-dependent protein kinase (PKR)-like ER kinase, PERK]和活化转录因子6(activating transcription factor 6, ATF6)三个重要蛋白通路诱导3种不同的信号途径来介导未折叠蛋白反应(unfold protein response, UPR)[13]. UPR通过一系列适应性反应提高内质网处理未折叠或错折叠蛋白的能力[21]. 正常情况下, PERK、ATF6、IRE1分别与分子伴侣GRP78/BIP结合, 处于无活性状态; 当ERS存在时, 堆积未折叠蛋白使GRP78/BIP从3种跨膜应激感受蛋白上解离, 并结合未折叠蛋白, 改变细胞转录和翻译程序而调节蛋白的合成, 分泌和降解以缓解ERS, 从而达到保护细胞的目的[22]. 当ERS超出机体可调控范围后, 细胞将发生凋亡.
CHOP首先被作为一种C/EBPs(CCAAT/enhancer binding proteins)同源蛋白所发现, C/EBPs是一类具有亮氨酸拉链结构的转录因子, 均含有一个转录激活功能域(氨基末端)和一个与DNA结合及形成二聚体的bZIP结构域(羧基末端), 表达于多种组织中, 对调节细胞分化具有十分重要的作用, 同时是凋亡中控制基因编码成分的转录因子[22,23]. 当ERS持续进展, 三条通路活化最终会诱导凋亡因子CHOP的表达[24]. 这三条信号通路中, PERK通路最重要, 激活的PERK使真核翻译起始因子eukaryotic translation initiation factor 2a(eIF2a)发生磷酸化, 磷酸化的eIF2a可以诱导ATF4的表达. ATF4是CREB家族成员, 他可以促进CHOP活化, 进而引起细胞凋亡[25-27]. PERK-eIF2A-ATF4是CHOP蛋白表达所必需的[28]. 当然, CHOP不会直接诱导细胞凋亡, 而是通过调节参与凋亡途径的基因表达来起作用: 高表达的CHOP触发Bax/Bad系统, 从而导致Caspase9和Caspase3激活[29]. CHOP又会诱导GADD34(生长停滞和DNA损伤诱导剂34)表达, GADD34参与eIF2α去磷酸化的反馈通路, 通过与蛋白磷酸1C(protein phosphatase 1C, PP1C)的相互作用, 能够恢复蛋白合成, 新合成的蛋白质进入稳态尚未恢复的内质网腔中, 会激发活性氧簇(re-active oxygen species, ROS)引起氧化应激反应引起细胞损伤[30,31].
在本研究中, 我们对山奈酚干预抑制ERS诱导的肝细胞凋亡的具体机制进行了研究, 结果发现, 山奈酚可以抑制ERS诱导的CHOP表达, 因此, 我们认为, 山奈酚通过抑制了CHOP的表达而减轻了ERS诱导的细胞凋亡. 今后我们还将对山奈酚干预抑制ERS诱导的肝细胞凋亡进行更深入的研究. 总之, 山奈酚可能通过干预CHOP通路, 抑制CHOP的表达, 从而达到保护ERS诱导的肝细胞损伤. 本研究为山奈酚的进一步开发和临床应用提供了实验依据.
山奈酚具有抗癌、抗氧化、抗炎、抗病毒等作用, 但山奈酚对正常肝细胞凋亡的影响还不是很清楚. 内质网应激(endoplasmic reticulum stress, ERS)在各种肝病的发病机制中发挥着重要作用, 同时ERS凋亡通路是除了氧化应激以外的一种新的内源性凋亡通路. 因此, 我们对山奈酚干预抑制ERS诱导的肝细胞凋亡的具体机制进行了研究.
姜慧卿, 教授, 河北医科大学第二医院消化科
主要研究山奈酚对ERS的干预及作用于损伤肝细胞的保护作用, 亟待解决的问题是进一步研究山奈酚对损伤细胞保护作用的最佳浓度, 以及从分子水平探讨其作用机制.
关于山奈酚的抗细胞凋亡作用已有很多研究, 但山奈酚干预ERS通路诱导细胞凋亡的研究还比较少.
本文首次探讨山奈酚对ERS诱导的肝细胞损伤的保护及机制.
本文为基础研究, 采用多种常用实验方法, 从不同角度验证本文观点, 为中药单体山奈酚今后应用于临床治疗急慢性肝损伤提供实验依据.
未折叠蛋白反应: ERS导致内质网内未折叠和错误折叠的蛋白聚集, 内质网通过激活胞内信号转导来缓解腔内未折叠蛋白的压力, 这统称为未折叠蛋白反应; ERS: 是由于各种原因引起的内质网中出现错误折叠或未折叠蛋白在腔内聚集以及钙离子平衡紊乱的状态; 凋亡: 也称为"固缩坏死"、"程序性细胞死亡"或"细胞自杀", 为维持内环境稳定, 由基因控制的细胞自主的有序的死亡.
本文在临床上有一定的应用价值.
编辑: 韦元涛 电编:都珍珍
| 1. | Xu W, Liu J, Li C, Wu HZ, Liu YW. Kaempferol-7-O-beta-D-glucoside (KG) isolated from Smilax china L. rhizome induces G2/M phase arrest and apoptosis on HeLa cells in a p53-independent manner. Cancer Lett. 2008;264:229-240. [PubMed] [DOI] |
| 2. | Sharma V, Joseph C, Ghosh S, Agarwal A, Mishra MK, Sen E. Kaempferol induces apoptosis in glioblastoma cells through oxidative stress. Mol Cancer Ther. 2007;6:2544-2553. [PubMed] [DOI] |
| 3. | Bandyopadhyay S, Romero JR, Chattopadhyay N. Kaempferol and quercetin stimulate granulocyte-macrophage colony-stimulating factor secretion in human prostate cancer cells. Mol Cell Endocrinol. 2008;287:57-64. [PubMed] [DOI] |
| 5. | Leung HW, Lin CJ, Hour MJ, Yang WH, Wang MY, Lee HZ. Kaempferol induces apoptosis in human lung non-small carcinoma cells accompanied by an induction of antioxidant enzymes. Food Chem Toxicol. 2007;45:2005-2013. [PubMed] [DOI] |
| 10. | Lee S, Kim YJ, Kwon S, Lee Y, Choi SY, Park J, Kwon HJ. Inhibitory effects of flavonoids on TNF-alpha-induced IL-8 gene expression in HEK 293 cells. BMB Rep. 2009;42:265-270. [PubMed] |
| 11. | García-Mediavilla V, Crespo I, Collado PS, Esteller A, Sánchez-Campos S, Tuñón MJ, González-Gallego J. The anti-inflammatory flavones quercetin and kaempferol cause inhibition of inducible nitric oxide synthase, cyclooxygenase-2 and reactive C-protein, and down-regulation of the nuclear factor kappaB pathway in Chang Liver cells. Eur J Pharmacol. 2007;557:221-229. [PubMed] [DOI] |
| 12. | Kou Y, Inaba H, Kato T, Tagashira M, Honma D, Kanda T, Ohtake Y, Amano A. Inflammatory responses of gingival epithelial cells stimulated with Porphyromonas gingivalis vesicles are inhibited by hop-associated polyphenols. J Periodontol. 2008;79:174-180. [PubMed] [DOI] |
| 13. | Walter P, Ron D. The unfolded protein response: from stress pathway to homeostatic regulation. Science. 2011;334:1081-1086. [PubMed] [DOI] |
| 14. | Asselah T, Bièche I, Mansouri A, Laurendeau I, Cazals-Hatem D, Feldmann G, Bedossa P, Paradis V, Martinot-Peignoux M, Lebrec D. In vivo hepatic endoplasmic reticulum stress in patients with chronic hepatitis C. J Pathol. 2010;221:264-274. [PubMed] [DOI] |
| 15. | Ji C, Kaplowitz N. Betaine decreases hyperhomocysteinemia, endoplasmic reticulum stress, and liver injury in alcohol-fed mice. Gastroenterology. 2003;124:1488-1499. [PubMed] [DOI] |
| 16. | Wei Y, Wang D, Topczewski F, Pagliassotti MJ. Saturated fatty acids induce endoplasmic reticulum stress and apoptosis independently of ceramide in liver cells. Am J Physiol Endocrinol Metab. 2006;291:E275-E281. [PubMed] [DOI] |
| 22. | Pillai S. Birth pangs: the stressful origins of lymphocytes. J Clin Invest. 2005;115:224-227. [PubMed] |
| 23. | Wang XZ, Kuroda M, Sok J, Batchvarova N, Kimmel R, Chung P, Zinszner H, Ron D. Identification of novel stress-induced genes downstream of chop. EMBO J. 1998;17:3619-3630. [PubMed] [DOI] |
| 26. | Harding HP, Zhang Y, Zeng H, Novoa I, Lu PD, Calfon M, Sadri N, Yun C, Popko B, Paules R. An integrated stress response regulates amino acid metabolism and resistance to oxidative stress. Mol Cell. 2003;11:619-633. [PubMed] [DOI] |
| 27. | Lanqe PS, Chavez JC, Pinto JT, Coppola G, Sun CW, Townes TM, Geschwind DH, Ratan RR. ATF4 is an oxidative stress-inducible, prodeath transcription factor in neurons in vitro and in vivo. Exp Med. 2008;205:1227-1242. [PubMed] [DOI] |
| 28. | Fels DR, Koumenis C. The PERK/eIF2alpha/ATF4 module of the UPR in hypoxia resistance and tumor growth. Cancer Biol Ther. 2006;5:723-728. [PubMed] [DOI] |
| 29. | Oyadomari S, Mori M. Roles of CHOP/GADD153 in endoplasmic reticulum stress. Cell Death Differ. 2004;11:381-389. [PubMed] [DOI] |
| 30. | Novoa I, Zeng H, Harding HP, Ron D. Feedback inhibition of the unfolded protein response by GADD34-mediated dephosphorylation of eIF2alpha. J Cell Biol. 2001;153:1011-1022. [PubMed] [DOI] |
| 31. | Back SH, Scheuner D, Han J, Song B, Ribick M, Wang J, Gildersleeve RD, Pennathur S, Kaufman RJ. Translation attenuation through eIF2alpha phosphorylation prevents oxidative stress and maintains the differentiated state in beta cells. Cell Metab. 2009;10:13-26. [PubMed] [DOI] |