修回日期: 2014-10-23
接受日期: 2014-10-29
在线出版日期: 2014-11-28
目的: 观察急性胰腺炎(acute pancreatitis, AP)患者肠黏膜屏障功能改变机制.
方法: 68例AP患者按病情程度分为重症组和轻症组, 另35例健康志愿者作为对照组, 电镜观察十二指肠肠黏膜超微结构变化, 比较血清内毒素、白介素(interleukin, IL)-18、一氧化氮(nitric oxide, NO)及肠黏膜紧密连接蛋白(tight junction protein, ZO)-1、封闭蛋白(Occludin)的变化.
结果: 重症组ZO-1、Occludin蛋白染色变浅, 重症组ZO-1、Occludin蛋白水平较对照组下降(0.31±0.010 vs 38±0.03, 0.26±0.02 vs 0.34±0.02, P<0.05), 血清内毒素、NO和IL-18含量较轻症组增高(0.39 EU/mL±0.05 EU/mL vs 0.23 EU/mL±0.04 EU/mL, 138.32 µmol/L±27.49 µmol/L vs 117.32 µmol/L±19.23 µmol/L, 76.47 ng/L±19.37 ng/L vs 34.41 ng/L±16.33 ng/L, P<0.05). 血清内毒素、IL-18以及NO同ZO-1和Occludin蛋白光密度值呈负相关(P<0.05).
结论: AP患者早期肠黏膜受损严重, 肠黏膜通透性明显增加, 部分细胞因子协同并促进肠黏膜的破坏.
核心提示: 本研究中, 重症组合轻症组患者的封闭蛋白(Occludin)和肠黏膜紧密连接蛋白(tight junction protein, ZO)-1染色较浅, 部分出现连续性中断, 细胞间连接变得比较松散, 连接复合体间隙加宽. 本研究通过对Occludin和ZO-1蛋白水平比较, 结果表明重症组患者的Occludin和ZO-1蛋白水平明显低于轻症组, 提示急性胰腺炎患者尤其重症患者肠黏膜上皮Occludin和ZO-1蛋白水平表达下降, 屏障功能破坏严重, 导致肠黏膜上皮细胞通透性加大.
引文著录: 陈健, 齐菲, 王磊, 刘志远, 尹春英, 张雷, 李炳庆. 急性胰腺炎患者肠黏膜屏障功能损害的相关性. 世界华人消化杂志 2014; 22(33): 5063-5068
Revised: October 23, 2014
Accepted: October 29, 2014
Published online: November 28, 2014
AIM: To investigate the mechanism of intestinal mucosal barrier dysfunction in patients with acute pancreatitis (AP).
METHODS: Sixty-eight AP patients were divided into either a severe group or a mild group according to disease severity. Another 35 healthy volunteers were used as controls. The ultrastructural changes of the intestinal mucosa were observed by electron microscope. Serum levels of endotoxin, interleukin-18 (IL-18) and nitric oxide (NO), and expression of tight junction protein-1 (ZO-1) and occludin in the intestinal mucosa were determined.
RESULTS: The levels of ZO-1 and occludin protein expression in the severe group were significantly lower than those in the mild group (0.31 ± 0.010 vs 38 ± 0.03, 0.26 ± 0.02 vs 0.34 ± 0.02, P < 0.05). Serum levels of endotoxin, NO and IL-18 in the severe group were significantly higher than those in the mild group (0.39 EU/mL ± 0.05 EU/mL vs 0.23 EU/mL ± 0.04 EU/mL, 138.32 µmol/L ± 27.49 µmol/L vs 117.32 µmol/L ± 19.23 µmol/L, 76.47 ng/L ± 19.37 ng/L vs 34.41 ng/L ± 16.33 ng/L, P < 0.05). There were significant positive correlations among serum levels of endotoxin, IL-18, NO and intestinal expression of ZO-1 and occludin (P < 0.01).
CONCLUSION: Intestinal mucosa is damaged and intestinal permeability is increased in patients with AP. Some inflammatory mediators may participat in the pathogenesis of intestinal mucosal injury.
- Citation: Chen J, Qi F, Wang L, Liu ZY, Yin CY, Zhang L, Li BQ. Intestinal mucosal barrier dysfunction in patients with acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2014; 22(33): 5063-5068
- URL: https://www.wjgnet.com/1009-3079/full/v22/i33/5063.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i33.5063
以急性胰腺炎(acute pancreatitis, AP)为临床常见的急腹症, 胰腺的损伤常诱发其他脏器功能障碍, 严重时容易导致患者死亡[1,2]. 肠黏膜屏障功能损害为AP诱发的常见的并发症, 患者肠道通透性发生改变, 肠道中细菌和内毒素发生移位[3], 胰腺发生激发继发感染, 通过血循环激活单核和巨噬细胞, 炎症介质大量释放, 产生全身炎症反应, 严重时多器官功能障碍综合征, 部分患者死亡[4]. 因此, 肠黏膜障碍、炎症介质以及肠黏膜超微结构的改变与AP诱发的并发症发生和发展关系密切[5,6]. 本项目通过观察肠黏膜紧密连接蛋白(tight junction protein, ZO)以及部分炎症介质水平的变化, 探讨他们在AP患者肠黏膜屏障功能损害中的作用和机制.
随机选取2011-01/2013-01在承德医学院附属医院消化内科接受治疗的AP患者68例, 均经彩超、计算机断层扫描(computed tomography, CT)和生化确诊, 符合AP的诊断标准和分级标准[7]. 其中男39例, 女29例. 年龄38-71岁, 平均41.7岁±11.5岁. 其中胆石病史者22例, 酒精性29例, 高脂血性17例. 排除慢性胃肠道疾病以及糖尿病患者. 患者依据轻重症标准分为两组, 重症组33例, 男19例, 女14例. 年龄38-70岁, 平均41.3岁±11.2岁. 轻症组35例, 男20例, 女15例. 年龄39-70岁, 平均42.1岁±11.8岁. 选择同期35例健康志愿者为正常对照组, 均无慢性胃肠道疾病. 患者均告知并签署知情同意书. 3组患者在性别、年龄等方面比较, 差异均无统计学意义(P>0.05).
1.2.1 重症急性胰腺炎(severe acute pancreatitis, SAP)诊断标准: 胰腺局部并发坏死、假性囊肿、胰腺脓肿或部分器官衰竭, 或Ranson评分≥3, 或急性生理与慢性健康Ⅱ(acute physiology and chronic health evaluation Ⅱ, APACHEⅡ)评分≥8, 或CT积分≥D级[8].
1.2.2 组织活检: 所有AP患者均在内镜下置入空肠营养管同时对十二指肠乳头以远3-5 cm对侧十二指肠黏膜活检取组织, 备用.
1.2.3 透射电镜观察: 十二指肠肠黏膜组织采用2.5%戊二醛固定, 0.1%磷酸盐缓冲液冲洗, PBS 漂洗, 1%四氧化锇进行固定, 纯环氧树脂进行包埋, 样品取出聚合, 样品进行半薄切片定位, 采用醋酸双氧铀-柠檬酸铅进行双重染色, 透射电镜进行观察.
1.2.4 免疫组织化学SP检测ZO-1、封闭蛋白(Occludin): 严格按照说明书程序进行检测, 对ZO-1、Occludin蛋白进行半定量分析. 其中棕黄色为阳性细胞. 不同时间点随机抽取每组不同切片6张, 高倍镜下每张随机抽取5个视野, 图片采用Image-Pro plus 6.0图像分析系统, 分析ZO-1、Occludin蛋白平均光密度值.
1.2.5 血清内毒素、一氧化氮(nitric oxide, NO)及白介素(interleukin, IL)-18水平的测定: 患者和健康自愿者入院第1天抽取静脉血5 mL, 离心封存. 内毒素水平检测采用鲎试剂偶氮基质显色法. NO水平采用硝酸还原酶法. IL-18水平采用ELISA双抗体夹心法. 试剂盒由西安臻品生物技术有限公司提供, 操作均严格按照说明书程序进行.
统计学处理 采用SPSS14.0统计软件包进行分析. 计量资料采用mean±SD表示, 组间比较采用t检验, 计数资料采用百分比, 统计学分析采用χ2检验, 相关分析采用Spearman相关分析法, P<0.05为差异具有统计学意义.
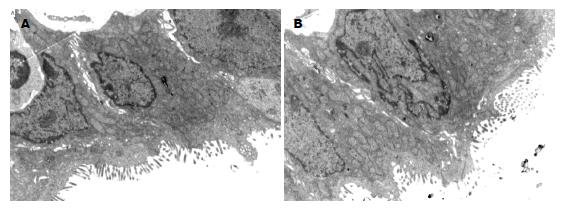
透射电镜显示, AP患者十二指肠微绒毛比较稀疏, 排列不整齐, 部分出现脱落和断裂. 线粒体出现肿胀, 内质网和高尔基体出现空泡, 染色颜色变浅, 细胞间连接明显疏松, 间距加大, 其中以重症患者更加明显(图1).
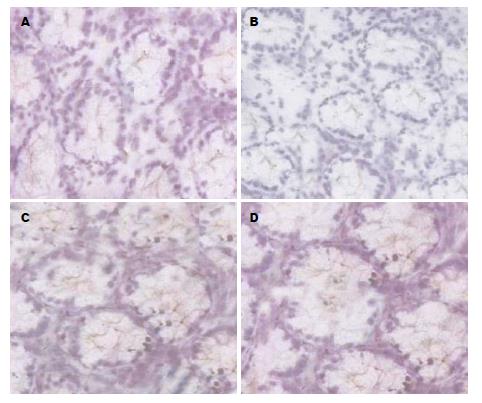
图2显示, AP患者ZO-1、Occludin为棕黄色, 其中重症组患者ZO-1、Occludin蛋白染色较浅, 颜色减弱, 分布不均匀. 表1显示, 轻症组ZO-1、Occludin蛋白光密度水平明显高于重症组(P<0.05), 两组比较差异均有统计学意义(P<0.05).
表2显示, AP组患者入院第1天内毒素、NO和IL-18水平明显高于对照组(P<0.05或P<0.01), 其中重症组内毒素、NO和IL-18水平与轻症组比较, 差异有统计学意义(P<0.05).
AP并发症较多, 其中继发感染容易导致部分脏器功能出现障碍[9,10], 尤其肠黏膜组织的损伤容易改变肠黏膜的通透性和肠上皮细胞间紧密连接, 使机体的内环境的稳定性受到破坏, 肠道细菌产生异位[11,12], 部分细菌和毒素等进入机体组织, 并可以诱发胰腺坏死和继发感染, 病情加重, 形成恶性循环, 病情严重的患者诱发肠源性内毒素血症[13]. Yasuda等[14]研究发现SAP大鼠病后6 h回肠通透性增加, 18 h血内毒素水平明显升高. 国内冯立民等[15]报道SAP患者入院当天尿中乳果糖与甘露醇比值增加, 提示肠黏膜屏障早期即发生改变. 本研究显示, AP患者入院后, 患者十二指肠活检组织经电镜观察显示, 患者十二指肠微绒毛比较稀疏, 排列不整齐, 部分出现脱落和断裂. 线粒体出现肿胀, 内质网和高尔基体出现空泡, 染色颜色变浅, 细胞间连接间距加大, 其中以重症患者更加明显. 提示AP可导致肠黏膜损伤. 另外从患者入院第1天内毒素水平比较显示, AP的内毒素水平明显高于健康自愿者, 而且重症组更加明显, 其肉毒素水平明显高于轻症组, 提示随着病情的加重, 患者的肠黏膜通透性加大.
Occludin和ZO-1蛋白属于紧密连接蛋白, 为构成肠黏膜上皮细胞间连接的主要功能蛋白[16,17], 其中Occludin为一种跨膜功能蛋白, 可以与ZOs蛋白相连, 维持紧密蛋白的形成和屏障功能[18,19], Saitou等[20]研究报告缺乏Ocdudin蛋白的成纤维细胞不能形成典型的紧密连接结. 而ZO-1为一种外周膜蛋白, 可以通过N末端与Occludin的C末端连接, 从而保证Occludin蛋白的准确的连接[21,22], 与肠上皮、基膜等结构构成完整的肠黏膜机械功能屏障, 避免并减少细菌、毒素等通过细胞间隙漏入腹腔[23]. 本研究中, 重症组和轻症组患者的Occludin和ZO-1蛋白染色较浅, 部分出现连续性中断, 细胞间连接变得比较松散, 连接复合体间隙加宽. 本研究通过对Occludin和ZO-1蛋白水平比较, 结果表明重症组患者的Occludin和ZO-1蛋白水平明显低于轻症组, 提示AP患者尤其重症患者肠黏膜上皮Occludin和ZO-1蛋白水平表达下降, 屏障功能破坏严重, 导致肠黏膜上皮细胞通透性加大.
IL-18是促炎性细胞因子家族中一员, 可以启动并释放大量的炎症介质, 同时诱导抗炎因子水平的提高[24,25], 产生抗炎反应综合征. 同时部分炎症因子浸润胰腺、肺等器官, 产生全身炎症综合征[26]. 部分研究[27,28]显示, AP患者血清中IL-18水平较高, 并抑制Occludin、ZO-1蛋白等紧密连接蛋白的表达, 肠黏膜通透性发生改变, 血中内毒素以及NO等水平增高明显. 内毒素水平的提高激活炎症介质如NO,等水平的表达, 加重肠黏膜损伤[29]. 因此可以把IL-18作为急性重症胰腺炎的预测指标. 本研究中, AP患者的血清IL-18和NO水平明显高于对照组, 这与贺丽等[30]研究报告一致. 其中重症组更加明显, 与轻症组比较, 差异明显, 提示IL-18水平与AP患者的严重程度相关, 能预测肠黏膜的损伤的程度和通透性的改变.
本研究显示, AP患者的血清内毒素、IL-18以及NO水平与紧密连接蛋白ZO-1、Occludin蛋白的光密度值出现负相关性, 提示患者的肠黏膜损伤比较严重, 通透性增加, 内毒素进入血清, 加重患者的炎症反应, IL-18、NO水平提高, 影响肠黏膜上皮紧密连接蛋白表达下降并重排, 并进一步诱导ZO-1、Occludin的低表达, 提示降低肠道通透性及血清IL-18水平, 可能对肠黏膜屏障起到保护作用.
总之, AP患者肠黏膜屏障破坏严重, 通透性加大, 内毒素、IL-18以及NO进一步协同肠黏膜屏障的损害, 形成恶性循环. 因此, 降低机体的炎症反应, 改善患者的肠黏膜屏障功能以及内毒素血症, 对AP患者的治疗具有积极的意义.
肠黏膜屏障功能损害为急性胰腺炎(acute pancreatitis, AP)诱发的常见的并发症, 患者肠道通透性发生改变, 肠道中细菌和内毒素发生移位, 胰腺发生激发继发感染, 通过血循环激活单核和巨噬细胞, 炎症介质大量释放, 产生全身炎症反应, 严重时多器官功能障碍综合征, 部分患者死亡. 因此, 肠黏膜障碍、炎症介质以及肠黏膜超微结构的改变与AP诱发的并发症发生和发展关系密切.
刘连新, 教授, 哈尔滨医科大学第一临床医学院
国内外相关研究表明, 肠黏膜紧密连接蛋白以及部分炎症介质水平的改变, 能影响患者的病程、进展和预后.
AP患者肠黏膜屏障破坏严重, 通透性加大, 内毒素、白介素-18及一氧化氮进一步协同肠黏膜屏障的损害, 形成恶性循环.
AP患者可以通过降低机体的炎症反应, 改善患者的肠黏膜屏障功能和内毒素血症, 对患者的治疗具有积极意义.
多器官功能障碍综合征: 是指在严重感染、创伤或大手术等急性疾病过程中, 同时或相继并发一个以上系统和/或器官的急性功能障碍或衰竭, 一般肺先受累, 次为肾、肝、心血管、中枢系统、胃肠、免疫系统和凝血系统功能障碍. 多器官功能障碍综合征发病的特点是继发性、顺序性、和进行性.
本文研究了AP患者的肠黏膜紧密连接蛋白以及部分炎症介质水平的变化, 立题新颖, 设计合理, 结论可信, 有一定的科学性和参考价值.
编辑: 郭鹏 电编:都珍珍
| 4. | 马 庆海, 杨 文东. 急性胰腺炎患者血中NO、TNF-α和sTNF-R的水平变化. 细胞与分子免疫学杂志. 2001;17:590-590. |
| 5. | 李 颖, 方 喜, 吴 俊伟. 肠内营养对急性胰腺炎患者肠黏膜通透性及细菌移位的影响. 中国现代普通外科进展. 2010;13:945-949. |
| 9. | 肖 波, 张 小明. 急性胰腺炎局部并发症的MRI表现. 中国医学计算机成像杂志. 2010;16:66-70. |
| 11. | 田 伯乐, 曹 鸿峰, 胡 伟明, 刘 续宝, 韩 方海, 何 满西, 李 全生, 张 肇达. 重症急性胰腺炎术后早期肠内营养支持治疗人体肠黏膜的形态学变化. 四川大学学报(医学版). 2007;38:264-267. |
| 14. | Yasuda T, Takeyama Y, Ueda T, Shinzeki M, Sawa H, Nakajima T, Kuroda Y. Breakdown of intestinal mucosa via accelerated apoptosis increases intestinal permeability in experimental severe acute pancreatitis. J Surg Res. 2006;135:18-26. [PubMed] [DOI] |
| 15. | 冯 立民, 王 建立, 陈 海龙, 姜 希宏. 急性重症胰腺炎肠黏膜屏障功能改变的临床研究. 中国现代普通外科进展. 2004;7:297-299. |
| 20. | Saitou M, Fujimoto K, Doi Y, Itoh M, Fujimoto T, Furuse M, Takano H, Noda T, Tsukita S. Occludin-deficient embryonic stem cells can differentiate into polarized epithelial cells bearing tight junctions. J Cell Biol. 1998;141:397-408. [PubMed] [DOI] |
| 21. | 曹 洪庆, 黄 鹤光, 陈 燕昌, 李 洪森. 重症急性胰腺炎大鼠紧密连接蛋白-1的表达与肠黏膜屏障损伤. 中国普外基础与临床杂志. 2011;18:240-244. |
| 24. | 庄 岩, 杨 尹默, 王 维民, 万 远廉, 黄 延庭. 急性胰腺炎鼠白细胞介素(IL)1β、IL-18、肿瘤坏死因子α、IL-1β转化酶的表达. 中华实验外科杂志. 2005;22:71-72. |
| 26. | Norman J. The role of cytokines in the pathogenesis of acute pancreatitis. Am J Surg. 1998;175:76-83. [PubMed] [DOI] |
| 27. | 孙 群, 朱 金水, 张 强. NO及细胞因子与急性胰腺炎预后的相关性研究. 同济大学学报(医学版). 2010;31:85-87, 91. |