修回日期: 2014-09-20
接受日期: 2014-10-15
在线出版日期: 2014-11-28
目的: 探讨化痰消瘀方通过凋亡抑制蛋白Survivin、Livin逆转胃癌癌前病变(precancerous lesions of gastric cancer, PLGC)的可能作用机制.
方法: 将6-8 wk SD ♂大鼠96只, 随机分为正常组与造模组, 使用N-甲基-N'-硝基-亚硝基胍、雷尼替丁药物加饥饱失常的造模方法制备PLGC动物模型. 将成功造模后的大鼠随机分为模型组、低剂量中药组、中剂量中药组、高剂量中药组及西药对照组, 第28 wk处死并依次从胃体、胃窦处分别取材并保存. 用HE染色以辨别大鼠胃黏膜病理改变, 用免疫组织化学的方法对比凋亡抑制蛋白Survivin、Livin在各组大鼠胃黏膜组织中的表达情况.
结果: (1)HE染色结果提示正常组胃黏膜未出现PLGC改变; 模型组均出现PLGC改变; 中药中、高剂量治疗组PLGC病理改善具有统计学意义(P<0.05)且高剂量组疗效优于其他各治疗组(P<0.05); 叶酸片治疗组PLGC改善较模型组有统计学意义(P<0.05); (2)免疫组织化学结果显示Survivin、Livin蛋白在正常组极少表达; 模型组表达较正常组显著增加(P<0.01); 各中药治疗组蛋白表达均较模型组减少, 且呈剂量依赖性(P<0.05), 中药高剂量组蛋白表达较其他中药组及西药对照组明显减低(P<0.05).
结论: 结果提示化痰消瘀方可以逆转PLGC, 其疗效优于单纯叶酸片治疗, 且作用机制与抑制细胞凋亡抑制蛋白Survivin、Livin表达密切相关.
核心提示: 本研究发现, Survivin、Livin凋亡抑制蛋白在癌前病变中的表达增高, 推测其可能与癌前病变向胃癌进一步发展相关. 化痰消瘀方对胃癌癌前病变疗效显著, 其机制与抑制Survivin和Livin凋亡抑制蛋白在癌前病变中的表达密切相关.
引文著录: 冷秀梅, 刘皓, 冯小可, 魏睦新. 基于Survivin、Livin凋亡抑制蛋白探讨化痰消瘀方逆转胃癌癌前病变的作用机制. 世界华人消化杂志 2014; 22(33): 5047-5055
Revised: September 20, 2014
Accepted: October 15, 2014
Published online: November 28, 2014
AIM: To explore whether Huatanxiaoyu decoction exerts therapeutic effects against precancerous lesions of gastric cancer (PLGC) by suppressing Survivin and Livin expression in rats.
METHODS: Ninety-six 6-8-week-old male SD rats were randomly divided into either a normal group or a model group. N-methyl-N'-nitro-N-nitrosoguanidine (MNNG), ranitidine and irregular diet were used for preparing PLGC animal models. After successful modeling, the model rats were randomly divided into a model group, low-, medium- and high-dose Chinese medicine groups, and a western medicine (folie acid tablets) group. After 8 wk of treatment, gastric body and antrum mucosal specimens were taken for observing pathological changes of the gastric mucosa after HE staining, or for detecting the expression of Survivin and Livin by immunohistochemistry.
RESULTS: The normal group showed no PLGC changes, while all the other groups had PLGC changes. Medium- and high-dose Huatanxiaoyu decoction significantly improved PLGC changes (P < 0.05), and the improvement was better in the high-dose group than in the other treatment groups (P < 0.05). Treatment with folie acid tablets also significantly improved PLGC pathology compared with the model group (P < 0.05). The expression of Survivin and Livin proteins in the model group was significantly higher than that in the normal group (P < 0.01). Compared with the model group, Huatanxiaoyu decoction significantly decreased the Survivin and Livin expression in a dose-dependent manner (P < 0.05), and the decrease was more significant in the high-dose group than in the other groups (P < 0.05).
CONCLUSION: Huatanxiaoyu decoction is superior to folie acid in treating PLGC, and the therapeutic effects may be closely related to the inhibition of Survivin and Livin expression.
- Citation: Leng XM, Liu H, Feng XK, Wei MX. Expression of Survivin and Livin in precancerous lesions of gastric cancer in rats: Implications for therapeutic effects of Huatanxiaoyu decoction. Shijie Huaren Xiaohua Zazhi 2014; 22(33): 5047-5055
- URL: https://www.wjgnet.com/1009-3079/full/v22/i33/5047.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i33.5047
1978年世界卫生组织(World Health Organization, WHO)伦敦会议统一将胃黏膜异型增生(gastric epithelial dysplasia, Dys)、不完全性大肠型肠化生定义为胃癌癌前病变(precancerous lesions of gastric cancer, PLGC), 而慢性萎缩性胃炎(chronic atrophy gastritis, CAG)伴或不伴有肠化(intestinal metaplasia, IM)、慢性胃溃疡、手术后残胃、胃息肉、恶性贫血及胃黏膜巨大皱襞症等被定义为胃癌癌前疾病(precancerous condition of gastric cancer), 他们均有进一步发展成为胃癌的危险.
胃癌严重影响着全球人类的健康, Globocan 2008和世界卫生组织(World Health Organization, WHO)/国际癌症研究中心(International Agency for Research on Cancer, IARC)公布的统计数据显示, 全球胃癌发病率位居恶性肿瘤中的第4位, 死亡率为恶性肿瘤病死率的第2位, 仅次于肺癌[1]. 胃癌在我国更为常见. 据调查, 2009年全国胃癌发病率位居第2位, 病死率位居第3位[2]. 这主要是由于胃癌治疗方法和疗效的局限. 故逆转PLGC对降低胃癌的发病率和病死率具有重大意义. 我们前期研究[3,4]证明, 化痰消瘀方逆转胃癌前病变具有良好疗效, 而细胞凋亡在胃癌的发生发展与转归中也起着重要作用, 基于Survivin、Livin凋亡抑制蛋白对化痰消瘀方的作用机制进行探索以寻找新的治疗靶点, 具有重要意义.
选用6-8 wk SD♂大鼠(约80-100 g) 96只, 由南京医科大学实验动物中心提供, 动物许可证号: SYXK(苏)2008-0007. N-甲基-N'-硝基-亚硝基胍(N-methyl-N-nitro-N-nitrosoguanidine, MNNG)购自日本东京化成工业株式会社; 雷尼替丁由江苏黄河药业股份有限公司生产; 中药颗粒剂由江阴天江药业有限公司制备; 叶酸片由江苏亚邦爱普森药业生产; Survivin抗体购自Cell signaling公司; Livin抗体购自北京博奥深公司; 二抗免疫组织化学检测试剂购自北京中杉金桥生物有限公司; DAB显色剂购自福州迈新生物技术开发有限公司; 一抗、二抗抗体稀释剂购自碧云天生物技术研究所.
1.2.1 模型制备及随机分组: 参考前期实验方法[5], 将实验动物适应性喂养1 wk, 随机分为两组(A、B组). A组(20只)为正常对照组, 常规饲养; B组(76只)用以造模. 将MNNG用去离子水配成1 g/L的储备液(每周配制1次), 4 ℃避光保存备用. 在临用前用去离子水配制成100 μg/mL, 给模型组大鼠灌胃. 另外, SD大鼠标准饲料中加入0.03%雷尼替丁, 采用饥饱失常法饲喂(进食2 d, 禁食1 d). 饥饿当天给予15%高浓盐水2 mL/只给大鼠灌胃. 此期间模型组大鼠死亡6只. 在造模第10、15、20周随机抽取造模组及正常组大鼠各3只处死, 依次从胃体、胃窦处分别取材, 用40 g/L甲醛固定, 梯度乙醇脱水, 常规石蜡包埋, 并作5 μm厚的连续切片, 常规苏木素-伊红染色(HE染色), 光镜下观察造模情况. 在20 wk时确认造模成功. 确定造模成功后, A组(正常组)11只, B组再随机分为5组(B、C、D、E、F组), 其中B组仍为模型组, C组为中药低剂量组, D组中药中剂量组, E组中药高剂量组, 每组12只, F组西药对照组为13只. 经治疗8 wk后全部处死取材.
1.2.2 中药及西药干预: 确认造模成功及随机分组后, A组继续正常喂养, B组予蒸馏水10 mL/kg灌胃, 每日1次. 化痰消瘀方主要由陈皮、法半夏、鸡内金、紫丹参、薏苡仁、白花蛇舌草、仙鹤草、半枝莲等组成. 中药低剂量、中剂量、高剂量组, 分别按5、10、15 mL/kg的化痰消瘀方给大鼠灌胃, 每天1次. 西药对照组予叶酸片制备好的混悬液按照10 mL/kg灌胃, 1次/d. 共8 wk. 干预结束后, 将所有大鼠处死取材, 方法同上.
1.2.3 胃黏膜病理检测: 制备好的HE染色标本均由两位病理医师完成诊断. 以胃黏膜出现IM、Dys诊断为PLGC, 判定各组大鼠胃黏膜病理情况, 统计PLGC例数.
1.2.4 免疫组织化学染色方法检测Survivin、Livin蛋白的表达: 实验步骤参考试剂盒说明书, 用磷酸盐缓冲液(PBS)代替一抗作为阴性对照, 以已知该蛋白阳性的胃癌为阳性对照. 以DAB显色为例的标准, 对高倍镜下综合染色强度和阳性细胞所占比例进行半定量测定. 染色强度评分标准: 不着色0分; 黄色1分; 棕黄色2分; 黄褐色3分. 阳性细胞所占比例评分标准: 阳性细胞数<10%者0分; 10%-40%者1分; 40%-70%者2分; ≥70%者3分. 两种评分相加0%-70%者2分; ≥70%者3分. 两种评分相加0-2分为弱表达; 3-6分为强表达.
统计学处理 使用统计软件进行分析, 等级资料的比较采用Kruskal-Wallis法, 计量资料的比较采用χ2检验, P<0.05为差异具有统计学意义.
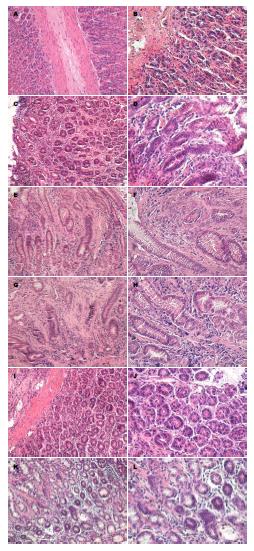
正常组大鼠胃组织结构基本正常, 黏膜呈粉红色, 有光泽, 上皮完整, 腺体排列较整齐, 也可见散在炎性细胞. 模型组黏膜多呈苍白或灰白色, 表面缺少光泽, 黏膜皱襞较平坦, 腺体部分排列疏松, 腺体结构不规则, 出现PLGC改变. 中药干预组及西药干预组胃黏膜病理改变轻于模型组, 炎细胞浸润有所减轻, PLGC得到不同程度的逆转(表1, 图1).
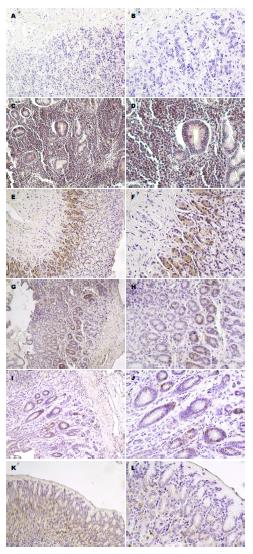
2.2.1 Survivin蛋白在各实验组的阳性表达: 正常组Survivin蛋白免疫组织化学染色几乎不着色; 模型组组织免疫组织化学染色普遍呈深棕色, 其表达呈强阳性; 同样的, 随着治疗组中药剂量增加, Survivin蛋白免疫组织化学染色颜色变浅且着色数目减少. 叶酸组Survivin蛋白染色强度介于中药中剂量组与中药高剂量组之间, 但明显低于模型组(图2).
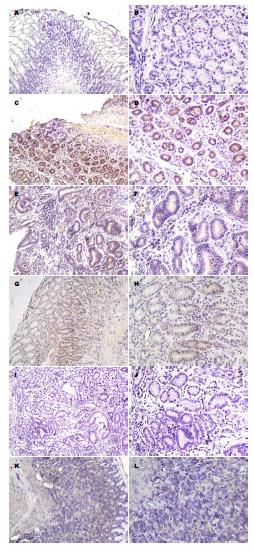
2.2.2 Livin蛋白在各实验组的阳性表达: Livin蛋白在正常组鲜有表达, 免疫组织化学染色基本呈阴性; 模型组免疫组织化学染色呈深棕色, 其表达呈强阳性; 中药治疗组中, 随着中药剂量增加, 其免疫组织化学染色逐渐变浅, 阳性表达逐渐减少. 叶酸组Livin蛋白染色强度介于中药中剂量组与中药高剂量组之间, 但明显低于模型组(图3).
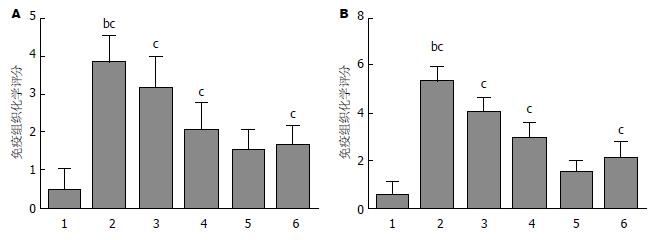
2.2.3 Survivin和Livin蛋白表达在各实验组的免疫组织化学评分: Livin蛋白在模型组表达显著高于正常组(P<0.01), 而中药高剂量组对Livin表达的抑制作用明显强于其他中药治疗组及叶酸片组(P<0.05). Survivin蛋白在模型组表达显著高于正常组(P<0.01), 而中药高剂量组对Survivin表达的抑制作用明显强于其他中药治疗组及叶酸片组(P<0.05)(图4).
目前胃部恶性肿瘤的现代医学研究焦点仍集中在形成肿瘤后的机制及治疗手段, 而对PLGC的认识及干预关注较少. 随着科学的发展和科技的进步, PLGC的检出率不断提高, 但仍缺乏有效的治疗手段. 传统的质子泵抑制剂、胃黏膜保护剂或叶酸等药物, 对PLGC的逆转作用有限, 且长期使用质子泵抑制剂也会加重胃黏膜萎缩等癌前病变. 本课题组在魏睦新教授的指导下对PLGC的基础与临床进行了长期研究[3-6], 不仅临床使用化痰消瘀方逆转了许多PLGC病变, 还发现其逆转机制可能是通过上调Caspase3表达、下调CyclinD1、mTOR表达, 调节细胞周期; 另外, 对PLGC的影响因素进行了临床流行病学调查, 对PLGC的预防和治疗有着重要意义[7]. 在此基础上, 魏睦新教授等[8]认为中医药防治肿瘤的可能机制为增强免疫功能、诱导肿瘤细胞分化、促进肿瘤细胞凋亡、影响拓扑异构酶及端粒酶活性、调节信号转导等, 他们已成为中药抗肿瘤机制的研究热点.
细胞凋亡在PLGC中的作用日益受到重视, 并认为细胞凋亡失常是胃癌演化进程中的早期事件. 细胞凋亡是一种生理过程, 如凋亡增强或凋亡抑制等调控失衡, 可引起多种肿瘤和自身免疫疾病. 目前研究得较深入的凋亡相关基因有bcl-2家族、p53、Caspase等. 各种凋亡信号通过线粒体途径或死亡受体途径传递凋亡信号, 诱导细胞内Caspase活化, 最终导致细胞死亡. 凋亡抑制蛋白家族(inhibitor of apoptosis proteins, IAPs)包括cIAP-1、cIAP-2、NIAP、ILP-2、XIAP、Survivin、Livin等, 可直接结合并抑制Caspase分子, 发挥凋亡抑制作用, 促进细胞增殖与分裂, 是肿瘤发生与细胞转化的关键分子[9].
Survivin在人的胚胎组织和各种肿瘤组织中广泛表达, 仅在极少数正常组织中表达, 具有抑制细胞凋亡和调节细胞有丝分裂的功能, 是联系细胞周期和细胞凋亡的重要因子[10,11]. 其表达与核因子-κB(nuclear factor-κB, NF-κB)、RAS癌基因家族、Wnt-2及胰岛素生长因子1/mTOR信号通路等有关[12-15], 还可选择性表达在细胞周期的G2/M期, 促进细胞分裂[16]. 其作用机制同样与抑制Caspase3、Caspase7等活性有关, 通过与血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)的协同作用, 促进肿瘤血管生成和浸润转移等[17,18]. 研究[19]证明Survivin的表达增高在肿瘤发展的早期就已出现, 并随着肿瘤的生长浸润而表达逐渐增强.
Livin是近年来发现的IAPs新成员, 在正常组织中不表达或低表达, 而高表达于多种恶性肿瘤组织, 具有较强的凋亡抑制作用, 与Caspase蛋白的多个成员相互作用, 抑制凋亡的执行过程, 抑制细胞的程序化死亡, 参与肿瘤的发生和发展[20,21]. 研究[22]表明, 敲除Livin基因可抑制肿瘤细胞在AGS和SNU638人胃癌细胞系的迁移、侵袭和增殖, 这是由于敲除Livin基因激活了Caspase3、Caspase7、PARP和p21、p27, 而降低了Cyclin D1、细胞周期蛋白依赖性激酶4和6等. Livin蛋白可以作为一种E3泛素连接酶, 通过泛素-蛋白酶体途径诱导Smac(Caspase活化蛋白)的降解, 从而抑制细胞凋亡[23]. Livin还可直接结合转化因子B激酶(transforming growthfactor B activated kinase, TAK1)来激活丝裂原激活蛋白JNK1和JNK2, 从而对抗肿瘤坏死因子α和白介素1β转换酶介导的细胞凋亡作用[24].
许多研究者[25-27]建议将Survivin、Livin凋亡抑制蛋白(基因)作为肿瘤发生发展及预后的指标. 寻找能够抑制Survivin、Livin活性的中医药, 对阻断PLGC向胃癌发展及胃癌的治疗具有重要意义.
PLGC在中医学中多归于"胃痞"、"胃脘痛"等范畴. 大量临床研究[28,29]证明中医药在逆转PLGC方面有较好疗效. 胃炎多痛, 胃痛日久, 久则入络, 必有瘀血[30]. 近年来, 魏睦新教授于临床实践中发现痰凝瘀阻是PLGC发生发展的核心病理, 故凝练出化痰消瘀方从根本上治疗PLGC. 全方由陈皮12 g、法半夏10 g、鸡内金10 g、紫丹参15 g、薏苡仁30 g、蒲黄粉10 g、半枝莲15 g、仙鹤草15 g、猫爪草15 g、白花蛇舌草15 g等组成, 随症加减, 具有化痰消瘀、利水消肿、散结消癥、兼以补虚的作用. 化痰消瘀方对具备"痰瘀"病机的PLGC患者疗效显著: 使用化痰消瘀方对CAG的改善率达到75.57%, IM的改善率达到56.98%, Dys改善率达到59.20%; 经治疗胃痛改善率87.31%, 嗳气改善率87.19%, 食欲不振改善率87.39%[31], 为胃癌的二级预防起到了重要作用, 一定程度上达到传统医学"治未病"的目的.
本实验通过免疫组织化学方法检测了Survivin、Livin蛋白在不同实验组的表达, 进一步探讨化痰消瘀方的作用机制. 结果Survivin、Livin在正常组很少表达, 而在PLGC模型组胃黏膜中表达较正常组显著增高(P<0.05); 不同剂量的化痰消瘀方对大鼠PLGC病变中Survivin、Livin表达起到了不同程度的抑制作用, 且呈剂量依赖性(P<0.05); 尤其中药高剂量组疗效明显优于叶酸片组(P<0.05). 提示化痰消瘀方可通过抑制Survivin、Livin表达, 促进细胞凋亡, 这与其逆转PLGC的治疗作用密切相关.
鉴于肿瘤治疗的困难, 患者生存质量的低下等因素, 癌前病变(疾病)的基础与防治已成为研究的重点课题. 然而中医药逆转PLGC是多环节、多靶点、多途径作用的, 故化痰消瘀方的其他作用机制还有待进一步研究, 这将为PLGC的药物研发提供理论依据及新的靶点.
近年来, 在全球范围内, 胃癌的发病率及死亡率居高不下, 因此对胃癌癌前病变的防治成为胃癌二级预防的关键. 中医药在逆转胃癌癌前病变方面具有一定优势, 但其作用机制尚不明确, 细胞凋亡的调控研究的进展, 为我们的机制探索提供了新的思路.
黄颖秋, 教授, 本溪钢铁(集团)总医院消化内科
细胞凋亡及其调控异常在胃癌癌前病变中的作用日益受到重视, 很多学者认为其在胃癌演化进程中扮演着重要角色. 凋亡抑制蛋白家族(inhibitor of apoptosis proteins, IAPs)包括多种蛋白, 可发挥凋亡抑制作用, 促进细胞增殖与分裂, 是肿瘤发生与细胞转化的关键分子, 也已成为目前的研究热点.
Liang等实验表明, Livin蛋白的阳性表达与胃癌细胞的分化程度及淋巴结转移有关, 而与浸润深度及病理类型无关, 为Livin的进一步研究提供了依据. 郭建巍等实现了Survivin蛋白在大肠杆菌BL21中的可溶性表达, 并建立Survivin蛋白抗体检测方法, 并提示在消化系统慢性癌前病变患者血清中已开始出现anti-Survivin, 为Survivin的深入研究及肿瘤的早期诊断奠定了基础.
本实验分别从组织和分子层面研究了化痰消瘀方对胃癌癌前病变的疗效及Survivin、Livin凋亡抑制蛋白在正常组、癌前病变组及中药干预组、叶酸治疗组的表达情况, 探讨了化痰消瘀方在胃癌癌前病变治疗过程中对IAPs的作用, 这在国内外研究中少有报道.
通过对化痰消瘀方逆转胃癌癌前病变的作用机制进行多层次、多靶点的研究, 为临床使用化痰消瘀方治疗胃癌癌前病变提供指导, 并为胃癌及癌前病变的防治及探寻新的治疗靶点提供依据.
IAPs: 是新发现的一类细胞凋亡抑制蛋白, 包括cIAP-1、cIAP-2、NIAP、ILP-2、XIAP、Survivin、Livin等. IAPs与肿瘤、神经系统病变等密切相关, 其特殊的分子结构及抑制细胞凋亡的功能使其备受关注, 并可能成为治疗相关疾病的靶蛋白.
本文初步探讨了化痰消瘀方通过凋亡抑制蛋白Survivin、Livin逆转胃癌癌前病变的可能作用机制, 为相关的中医药研发提供了实验依据.
编辑: 郭鹏 电编:都珍珍
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 3. | 冷 秀梅, 郭 亚云, 魏 睦新. 化痰消瘀方逆转胃癌前病变的临床疗效观察. 中国中西医结合消化杂志. 2013;21:505-508. |
| 6. | 吴 燕敏, 魏 睦新. 胃黏膜肠化生病因及逆转性研究进展. 中国中西医结合消化杂志. 2010;18:62-65. |
| 7. | Wu Y, Fan Y, Jiang Y, Wang Y, Liu H, Wei M. Analysis of risk factors associated with precancerous lesion of gastric cancer in patients from eastern China: a comparative study. J Cancer Res Ther. 2013;9:205-209. [PubMed] [DOI] |
| 9. | Deveraux QL, Reed JC. IAP family proteins--suppressors of apoptosis. Genes Dev. 1999;13:239-252. [PubMed] [DOI] |
| 10. | Tu SP, Jiang XH, Lin MC, Cui JT, Yang Y, Lum CT, Zou B, Zhu YB, Jiang SH, Wong WM. Suppression of survivin expression inhibits in vivo tumorigenicity and angiogenesis in gastric cancer. Cancer Res. 2003;63:7724-7732. [PubMed] |
| 11. | Mita AC, Mita MM, Nawrocki ST, Giles FJ. Survivin: key regulator of mitosis and apoptosis and novel target for cancer therapeutics. Clin Cancer Res. 2008;14:5000-5005. [PubMed] [DOI] |
| 12. | Van Antwerp DJ, Martin SJ, Verma IM, Green DR. Inhibition of TNF-induced apoptosis by NF-kappa B. Trends Cell Biol. 1998;8:107-111. [PubMed] [DOI] |
| 13. | Sommer KW, Schamberger CJ, Schmidt GE, Sasgary S, Cerni C. Inhibitor of apoptosis protein (IAP) survivin is upregulated by oncogenic c-H-Ras. Oncogene. 2003;22:4266-4280. [PubMed] [DOI] |
| 14. | You L, He B, Xu Z, Uematsu K, Mazieres J, Mikami I, Reguart N, Moody TW, Kitajewski J, McCormick F. Inhibition of Wnt-2-mediated signaling induces programmed cell death in non-small-cell lung cancer cells. Oncogene. 2004;23:6170-6174. [PubMed] [DOI] |
| 15. | Vaira V, Lee CW, Goel HL, Bosari S, Languino LR, Altieri DC. Regulation of survivin expression by IGF-1/mTOR signaling. Oncogene. 2007;26:2678-2684. [PubMed] [DOI] |
| 16. | Li F, Ambrosini G, Chu EY, Plescia J, Tognin S, Marchisio PC, Altieri DC. Control of apoptosis and mitotic spindle checkpoint by survivin. Nature. 1998;396:580-584. [PubMed] [DOI] |
| 17. | Wang TT, Qian XP, Liu BR. Survivin: potential role in diagnosis, prognosis and targeted therapy of gastric cancer. World J Gastroenterol. 2007;13:2784-2790. [PubMed] |
| 18. | Sah NK, Khan Z, Khan GJ, Bisen PS. Structural, functional and therapeutic biology of survivin. Cancer Lett. 2006;244:164-171. [PubMed] [DOI] |
| 20. | Deveraux QL, Roy N, Stennicke HR, Van Arsdale T, Zhou Q, Srinivasula SM, Alnemri ES, Salvesen GS, Reed JC. IAPs block apoptotic events induced by caspase-8 and cytochrome c by direct inhibition of distinct caspases. EMBO J. 1998;17:2215-2223. [PubMed] [DOI] |
| 21. | Notarbartolo M, Cervello M, Poma P, Dusonchet L, Meli M, D'Alessandro N. Expression of the IAPs in multidrug resistant tumor cells. Oncol Rep. 2004;11:133-136. [PubMed] |
| 22. | Chung CY, Park YL, Kim N, Park HC, Park HB, Myung DS, Kim JS, Cho SB, Lee WS, Joo YE. Expression and prognostic significance of Livin in gastric cancer. Oncol Rep. 2013;30:2520-2528. [PubMed] [DOI] |
| 23. | Maas C, Verbrugge I, de Vries E, Savich G, van de Kooij LW, Tait SW, Borst J. Smac/DIABLO release from mitochondria and XIAP inhibition are essential to limit clonogenicity of Type I tumor cells after TRAIL receptor stimulation. Cell Death Differ. 2010;17:1613-1623. [PubMed] [DOI] |
| 24. | Chen YS, Li HR, Lin M, Chen G, Xie BS, Xu NL, Lin LF. Livin abrogates apoptosis of SPC-A1 cell by regulating JNKI signaling pathway. Mol Biol Rep. 2010;37:2241-2247. [PubMed] [DOI] |
| 25. | Xiaoyuan C, Longbang C, Jinghua W, Xiaoxiang G, Huaicheng G, Qun Z, Haizhu S. Survivin: a potential prognostic marker and chemoradiotherapeutic target for colorectal cancer. Ir J Med Sci. 2010;179:327-335. [PubMed] [DOI] |
| 26. | Song KY, Jung CK, Park WS, Park CH. Expression of the antiapoptosis gene Survivin predicts poor prognosis of stage III gastric adenocarcinoma. Jpn J Clin Oncol. 2009;39:290-296. [PubMed] [DOI] |