修回日期: 2014-09-22
接受日期: 2014-09-30
在线出版日期: 2014-11-18
目的: 分析实体瘤患者化疗期间乙型肝炎病毒(hepatitis B virus, HBV)DNA的活化情况, 了解初始不同HBV拷贝数患者之间化疗联合抗病毒治疗疗效、不良反应情况.
方法: 87例恶性肿瘤合并HBV感染者, 根据其初始HBV DNA拷贝数随机分为两组, 即初始HBV定量≥1×103 GE/mL的患者44例, 43例患者初始拷贝数<1×103 GE/mL; 常规化疗前1 wk给予抗病毒治疗, 化疗结束后维持3 mo的抗病毒治疗.
结果: 初始HBV DNA拷贝数<1×103 GE/mL组患者的Karnofsky功能状态(Karnofsky performance status, KPS)评分明显优于≥1×103 GE/mL组患者; 同时, 两组患者在近期疗效方面比较相似, 而远期疗效的比较发现, 低拷贝组患者其6 mo以后的疾病进展和死亡风险相对更低, 而化疗期间联合抗病毒并没有增加相关的不良反应.
结论: 对于恶性肿瘤合并HBV感染的患者, 化疗期间联合抗病毒至关重要, 这对于改善患者KPS、不良反应及远期疗效具有深远意义.
核心提示: 本研究在患者化疗结束后3 mo后并没有继续监控乙型肝炎病毒(hepatitis B virus, HBV)DNA水平, 同时由于初始拷贝数高的患者其Karnofsky功能状态(Karnofsky performance status)评分本来就低, 由于后期的HBV病毒再活化而导致肝脏代谢负荷增加, 从而造成长期疗效存在一定差异.
引文著录: 陈莉林, 林东旭, 曾茹, 安汗祥. HBV DNA拷贝数对乙型肝炎肿瘤患者化疗联合抗病毒治疗结果的影响. 世界华人消化杂志 2014; 22(32): 4985-4990
Revised: September 22, 2014
Accepted: September 30, 2014
Published online: November 18, 2014
AIM: To understand the impact of different initial hepatitis B virus (HBV) DNA copies on the efficacy and side effects of chemotherapy combined with antiviral therapy in tumor patients with hepatitis B.
METHODS: Eighty-seven tumor patients with HBV infection were randomly divided into two groups according to the initial HBV DNA copies: A and B. Group A included 44 patients with the initial HBV DNA copies ≥ 1 × 103 GE/mL, while group B included 43 patients with the initial HBV DNA copies < 1×103 GE/mL. All of the patients had been treated with antiviral therapy for one month before conventional chemotherapy and continued to receive antiviral therapy for three months after chemotherapy.
RESULTS: The Karnofsky performance status (KPS) score was significantly higher in group B than in group A. The short-term therapeutic effects were similar between groups A and B, while in terms of long-term efficacy, the disease progression and death risk at 6 mo after chemotherapy were significantly lower in group B than in group A. The rate of related side effects did not increase significantly during chemotherapy combined with antiviral therapy.
CONCLUSION: For tumor patients with HBV infection, chemotherapy combined with antiviral therapy is superior to chemotherapy alone in terms of improving the KPS score and side effects.
- Citation: Chen LL, Lin DX, Zeng R, An HX. Impact of HBV DNA copies on clinical effects of chemotherapy combined with antiviral therapy in tumor patients with hepatitis B. Shijie Huaren Xiaohua Zazhi 2014; 22(32): 4985-4990
- URL: https://www.wjgnet.com/1009-3079/full/v22/i32/4985.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i32.4985
随着社会的发展, 肿瘤的发病率越来越高. 同时, 我国也是乙型肝炎病毒(hepatitis B virus, HBV)感染高流行区域, 特别是很多晚期肿瘤患者在肿瘤的治疗过程中同时面临着HBV激活及化疗引起肝功能损伤的困绕[1,2]. 目前, 国际上通常遵循欧洲肝病研究协会2012年乙型肝炎治疗指南[3]中的推荐, 但这些在国内却未引起临床医生的足够重视. 很多临床工作者只是知晓需要抗病毒治疗或者只在治疗期间给予抗病毒治疗, 而对于抗病毒治疗的周期时间、不同HBV DNA拷贝数的患者是否需要不同抗病毒治疗方案等均没有明确的认识[4-6]. 本研究通过观察在厦门大学附属第一医院接受化疗的乙型肝炎实体瘤患者化疗期间对HBV DNA的活化情况, 了解初始HBV DNA拷贝数不同患者间化疗联合抗病毒治疗疗效、不良反应情况的差异, 从而指导这类患者的治疗.
2012-07-01/2013-01-31在厦门大学附属第一医院肿瘤内科化疗的合并无活性的乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)阳性肿瘤患者87例, 其中结直肠癌43例, 食管癌及胃癌28例, 和肺癌17例. 其中男56例, 女31例, 年龄24-78岁. 所有病例均经病理证实, 均无合并影响患者免疫功能或肝功能的其他疾病. 入选标准: (1)经过病理学确诊的有化疗指征的各种恶性肿瘤(不含淋巴瘤); (2)年龄在18-75岁之间; (3)Karnofsky功能状态(Karnofsky performance status, KPS)>70分, 能耐受化疗并且愿意接受化疗; (4)预计生存期在3 mo以上; (5)无肝、肾转移且化疗前患者肝肾功能均正常; (6)实验组患者在化疗前测HBV DNA定量低于检测下限. 根据既往的研究[7], HBV定量≥1×103 GE/mL被认为存在病毒再活化. 因此, 将入住患者根据测量初始HBV DNA水平分为2组, 一组HBV DNA≥1×103 GE/mL, 另一组HBV DNA<1×103 GE/mL; 考察初始HBV DNA水平对患者化疗情况的影响. 试剂由深圳匹基生物股份有限公司提供, T细胞亚群检测试剂由美国Beckman-Coulter公司提供, 肝功能检测试剂为德国Roche公司原装试剂.
1.2.1 化疗方案与抗病毒治疗: 本研究中的所有患者在治疗前均预防性予以拉米夫定进行治疗, 其中病毒高拷贝数患者则加用恩替卡韦进行抗病毒治疗, 而利妥昔单抗均为化疗前1 d使用, 剂量为375 mg/m2. 本研究中的所有患者均接受环磷酰胺+阿霉素+长春新碱+强的松(prednisone, CHOP)或CHOP样方案化疗, 而病毒高拷贝数患者激素仅使用了标准剂量的1/3.
1.2.2 指标观察与随访: HBV DNA含量测定采用荧光定量PCR法检测(正常值为1×10拷贝/mL), T细胞亚群检测用流式细胞术检测, 肝功能使用速率法检测. 消化系反应及骨髓抑制分度也依据"抗肿瘤药物的急性与亚急性毒性反应的分度标准, 所有患者由专门的医护人员根据研究方案定时电话随访和患者回院随访. KPS评分的获得参考Karnofsky功能状态评分标准.
统计学处理 运用SPSS16.0统计软件对数据结果进行分析, 两组之间化疗前各项指标应用配对t检验进行比较, 以检验配对是否成功. 高拷贝组、低拷贝组内化疗前后各项指标用配对t检验的方法比较. 两组HBV DNA水平、骨髓抑制、消化道反应的比较应用两个相关样本的非参数检验进行统计分析, 有效率与HBV DNA拷贝数的关系用双变量相关分析方法, P<0.05为差异具有统计学意义. 对各组结果均量化赋值以便录入数据.
由于欧洲肝病研究协会2008年乙型肝炎治疗指南中提出, 对血清HBsAg阴性、拟行化疗和免疫抑制剂治疗的患者, 强烈推荐给予乙型肝炎疫苗. HBsAg阳性患者不论HBV DNA水平, 均用核苷类抗病毒药物治疗, 至化疗结束后12 mo. 因此, 在本次研究中我们并没有设置HBV DNA阳性患者化疗期间不进行抗病毒实验组, 一方面避免违反医学实验的伦理, 另一方面也保证了患者的治疗效果.
如表1所示, 根据HBV DNA拷贝数将所有患者随机分为2组, 其中A组HBV DNA拷贝数≥1×103 GE/mL, 共44例患者; B组43例, 其HBV DNA拷贝数<1×103 GE/mL.
| 临床资料 | HBV DNA拷贝数(GE/mL) | |
| ≥1×103 | <1×103 | |
| n | 44 | 43 |
| 性别(男/女) | 29/15 | 27/16 |
| 平均年龄(岁) | 44.2±3.4 | 43.5±3.6 |
| 病理类型 | ||
| (结直肠癌/胃癌/肺癌) | 22/13/9 | 21/15/8 |
| TNM分期 | ||
| (I/II/III/IV期) | 1/5/26/12 | 1/6/24/12 |
为了解HBV感染对患者的影响, 所有入组患者, 在化疗前由独立的KPS评估小组盲法评估患者的KPS评分状况. 结果发现, HBV DNA拷贝数不同的晚期肿瘤患者其卡氏评分存在一定差异, 其中HBV DNA拷贝数高的患者(A组), 其KPS评分明显较B组偏低, P值为0.0375(表2). 这显示肿瘤患者在化疗前, 由于HBV病毒的感染, 已无形中给患者带来了一些相关的负面影响.
| KPS评分(分) | HBV DNA拷贝数(GE/mL) | P值 | |
| ≥1×103 | <1×103 | ||
| n | 44 | 43 | |
| 70 | 4 | 1 | 0.0375 |
| 80 | 25 | 20 | |
| 90 | 14 | 19 | |
| 100 | 1 | 3 | |
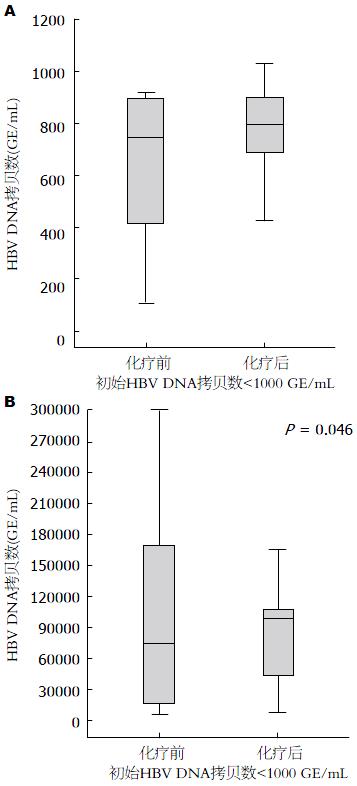
为了探索化疗联合抗病毒治疗期间HBV病毒活化的情况, 我们比较了初始HBV DNA拷贝数不同患者化疗前后两组患者HBV DNA病毒的水平状况, 分别检测了化疗前后两组患者的HBV DNA拷贝数的变化. 结果显示, HBV DNA拷贝数<103的患者(B组), 化疗期期间联合抗病毒治疗后, 其HBV DNA拷贝数并没有明显增加; 而对于初始HBV DNA拷贝数≥103的患者(A组), 化疗后HBV DNA拷贝数相对化疗前有所增加, 存在HBV DNA再活化的状况, 化疗前后HBV DNA拷贝数相比较P值为0.046(图1).
为进一步了解HBV DNA拷贝数对患者化疗疗效的影响, 我们比较了患者化疗的有效率及化疗后6 mo时的随访数据. 通过分析发现(表3), HBV DNA拷贝数对于化疗的有效率并没有明显的影响, 二者之间不存在明显的统计学差异, P值为0.512, 这显示在近期疗效方面, 两组之间并没有明显的差异; 然而, 对于6 mo的随访数据分析却发现, HBV DNA拷贝数高的患者组其疾病进展风险和死亡风险都明显大于HBV DNA拷贝数低的患者组, 其中疾病进展比例二者之间的差异P值为0.0206; 而死亡病例数两组之间比较的P值为0.0314. 这些显示初始HBV DNA拷贝数≥1×103组患者的远期生存数据要明显低于低拷贝组.
| 化疗疗效 | HBV DNA拷贝数(GE/mL) | P值 | |
| ≥1×103 | <1×103 | ||
| n | 44 | 43 | |
| 3周期后反应率 | 0.512 | ||
| CR | 5 | 7 | |
| PR | 17 | 19 | |
| SD | 15 | 11 | |
| PD | 7 | 6 | |
| 6 mo时生存数据 | |||
| 进展(n) | 20 | 12 | 0.0206 |
| 死亡(n) | 15 | 9 | 0.0314 |
由于化疗期间合并抗病毒治疗, 是否增加不良反应的发生也是影响患者生存和生活质量的重要问题. 通过分析两组患者的不良反应发现(表4), 在化疗期间两组患者间不良反应发生率并没有显著性差异, 两组最主要的不良反应都是骨髓抑制, 其中最为常见的是2级骨髓抑制和3级骨髓抑制.
随着肿瘤和乙型肝炎的发病率越来越高, 而我国同时也是HBV病毒感染高流行区域, 特别是很多肿瘤患者在肿瘤的治疗过程中同时面临着HBV病毒再激活的困绕. 目前很多肿瘤科医生对此亦没有一个明确的认识, 2009年Tran等[8]对华盛顿地区的肿瘤科医生作了一项调查, 结果显示80%的受调查者关注过化疗中的乙型肝炎再活化, 但只有30%的人在临床工作中见到过乙型肝炎再活化的病例, 56%的医生考虑过预防性应用抗病毒药及护肝药.
根据欧洲肝病研究协会2008年乙型肝炎治疗指南, 对血清HBsAg阴性、拟行化疗和免疫抑制剂治疗的患者, 强烈推荐给予乙型肝炎疫苗治疗; HBsAg阳性患者不论HBV DNA水平, 均予以核苷类抗病毒药物治疗至化疗结束后12 mo. 因此, 在实验中我们并没有设置HBV DNA阳性患者化疗期间不进行抗病毒实验组, 在避免违反医学实验伦理的同时, 也保证了患者得到最合适的治疗. 根据先前的研究[9,10], HBV定量≥1×103 GE/mL的患者被认为其病毒再活化的几率较大. 因此, 为了考察化疗期间对不同HBV DNA拷贝数肿瘤患者的影响, 我们根据初始测量HBV DNA水平以1×103 GE/mL为界限将入组患者分为2组, 考察初始不同HBV DNA水平对患者化疗期间联合抗病毒治疗对其疗效及不良反应的影响.
初始HBV DNA拷贝数是HBV感染的一个反应, 在所有入组患者中, 我们都检测了患者化疗前的肝功能水平, 结果两组之间并没有明显差异, 但是HBV DNA拷贝数不同的两组患者之间其KPS评分却存在着明显差异, HBV DNA拷贝数≥103的患者, 其KPS评分明显不如拷贝数<103的肿瘤患者, 这可能是由于HBV病毒增加了肝脏代谢功能的负荷, 由于肝功能并不能准确反映出肝脏的真实状态. 迄今为止, 还没有任何一项肝功能实验能完全准确地反映肝病患者肝功能的实际状态, 再者, 肝脏的储备力很强, 只有损伤到一定程度才会出现某些实验室检测结果异常, 而某项检测结果又并不能完全说明肝功能状态或病变的严重程度[11,12]. 所以, 由于HBV轻度感染所带来的肝脏功能负荷并不能在肝功能检测上体现出来.
预防和治疗肿瘤患者HBV再激活有3种方式[13-15]: (1)预防用药, 只要患者HBsAg阳性, 不管谷丙转氨酶(alanine aminotransferase, ALT)、HBV DNA水平如何, 一律在化疗开始前1 wk开始服用NAs, 一直持续到化疗结束后一段时间; (2)早期疗法, 每2 wk检测HBV DNA、ALT, 如果发现HBV DNA升高, 在ALT尚未升高前立即给予NAs治疗; (3)延迟干预, 就是HBV DNA、ALT升高后再接受治疗. 现有的研究认为预防治疗优于早期治疗和延迟治疗.
Ma等[16]将13例合并HBV感染的肿瘤患者分为两组, 预防性服用LVD抗病毒治疗5例, 化疗中HBV再激活后加用LVD治疗8例, 结果预防组无一例患者因HBV复发而中断或推迟化疗, 治疗组有5例死于肝功能衰竭, 提示预防性抗病毒治疗更有临床意义. 而在我们的研究中, 我们两组患者在研究开始之前均采用的是预防用药, 这可能是两组患者在3 mo随访时早期疗效和不良反应相近的主要原因. 而对于6 mo时的随访数据, 两组却存在着统计学差异, 其可能的原因是尽管预防性服用NAs能有效预防HBV感染者化疗时HBV再激活, 但NAs长期使用后病毒基因变异, 使得停药后的反弹等, 因此严密的临床检测还是必须的. 而本研究在患者化疗结束后3 mo后并没有继续监控HBV DNA水平, 同时由于初始拷贝数高的患者其KPS评分本来就低, 由于后期的HBV病毒再活化而导致肝脏代谢负荷增加, 从而造成长期疗效存在一定差异. 同时, 我们期待后续的继续随访结果.
You等[17]报道1例l岁的男性肝癌患者接受了预防性LVD抗病毒治疗, 由于YMDD变异而导致重型肝炎, 所以对于接受抗肿瘤化疗的HBV携带者来说, 优先选择一个有效低耐药的抗病毒药物是非常重要的.
我国作为乙型肝炎病毒(hepatitis B virus, HBV)感染高流行区域, 很多晚期肿瘤患者在治疗的过程中亦面临着HBV病毒激活及化疗引起肝功能损伤的困扰, 但目前临床仅进行抗病毒治疗, 但对于抗病毒治疗的周期时间、不同HBV DNA拷贝数的患者是否需要不同抗病毒治疗方案等均没有明确的认识.
杨江华, 副教授, 皖南医学院弋矶山医院感染科
欧洲肝病研究协会2008年乙型肝炎治疗指南中指出: 对血清HBsAg阴性、拟行化疗和免疫抑制剂治疗的患者, 强烈推荐给予乙型肝炎疫苗治疗; 乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)阳性患者不论HBV DNA水平, 均予以核苷类抗病毒药物治疗至化疗结束后12 mo. 而随着肿瘤和乙型肝炎的发病率越来越高, 很多肿瘤患者在治疗的过程中同时面临着HBV病毒再激活的困绕, 故而, 探索初始不同HBV DNA水平对患者化疗期间联合抗病毒治疗对其疗效及不良反应的影响已成为亟需解决的问题之一.
2009年Tran对华盛顿地区的肿瘤科医生作了一项调查, 结果显示80%的受调查者关注过化疗中的乙型肝炎再活化, 但只有30%的人在临床工作中见到过乙型肝炎再活化的病例, 56%的医生考虑过预防性应用抗病毒药及护肝药, 同时, 已有学者提出, 预防和治疗肿瘤患者HBV再激活有3种方式, 且预防治疗优于早期治疗和延迟治疗. 可见, 如何对此类疾病的患者进行抗病毒治疗已迫在眉睫.
在我们的研究中, 与既往研究分别采用不同的治疗时间的方法区别的是, 将两组患者在研究开始之前均采用的是预防用药, 虽结果证实两组患者在3 mo随访时早期疗效和不良反应相近, 但随着随访时间延长到6 mo时却存在着统计学差异, 对其原因进行探索式本研究的重点所在.
本研究结果将对于指导肿瘤合并乙型肝炎患者的抗病毒治疗时间的选择具有较好的临床意义, 从而提高患者的生活质量大有裨益.
本研究具有较好的临床意义及实用价值.
编辑: 郭鹏 电编:闫晋利
| 4. | 谭 友文, 张 园海, 江 伟俊, 邢 茂迎, 满 晓波, 毛 建忠, 葛 国洪, 吴 翠松, 祝 美琴. 肝细胞癌复发或转移与HBV DNA水平及其基本核心启动子区1762/1764双突变的关系. 中华肝脏病杂志. 2013;21:679-683. |
| 8. | Tran TT, Rakoski MO, Martin P, Poordad F. Screening for hepatitis B in chemotherapy patients: survey of current oncology practices. Aliment Pharmacol Ther. 2010;31:240-246. [PubMed] [DOI] |
| 9. | Zoutendijk R, Reijnders JG, Brown A, Zoulim F, Mutimer D, Deterding K, Petersen J, Hofmann WP, Buti M, Santantonio T. Entecavir treatment for chronic hepatitis B: adaptation is not needed for the majority of naïve patients with a partial virological response. Hepatology. 2011;54:443-451. [PubMed] [DOI] |
| 10. | Lau GK. Hepatitis B reactivation after chemotherapy: two decades of clinical research. Hepatol Int. 2008;2:152-162. [PubMed] [DOI] |
| 11. | Wasmuth JC, Fischer HP, Sauerbruch T, Dumoulin FL. Fatal acute liver failure due to reactivation of hepatitis B following treatment with fludarabine/cyclophosphamide/rituximab for low grade non-Hodgkin's lymphoma. Eur J Med Res. 2008;13:483-486. [PubMed] |
| 14. | 周 佳美, 向 慧玲, 吕 洪敏, 王 凤梅, 张 欣, 李 凤惠, 泽 塔多吉. 预防性抗病毒对TACE治疗的HBV DNA阴性乙型肝炎相关性肝癌的效果. 天津医药. 2013;41:875-877. |
| 16. | Ma LN, Sun GZ, Dong JL, Huang CY, Chen XY. [A clinical analysis of HBV reactivation in patients with malignant tumors]. Zhonghua Gan Zang Bing Za Zhi. 2007;15:809-811. [PubMed] |