修回日期: 2014-09-10
接受日期: 2014-09-21
在线出版日期: 2014-11-08
目的: 探讨血清胃蛋白酶原Ⅰ(pepsinogenⅠ, PGⅠ)和PGⅡ及PGⅠ/PGⅡ水平在对胃癌和胃溃疡诊断中的临床意义.
方法: 分别对经胃镜及病理证实的72例正常对照、78例胃溃疡及38例胃癌患者, 采用定量酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)方法检测血清PGⅠ、PGⅡ水平, 计算PGⅠ/PGⅡ比值.
结果: 胃溃疡组患者血清PGⅠ、PGⅡ水平最高,分别为151.18 µg/L±8.05 µg/L、27.52 µg/L±21.44 µg/L, PGⅠ/PGⅡ比值为8.75±4.95, 对照组PGⅠ、PGⅡ水平分别为115.51 µg/L±54.13 µg/L、13.44 µg/L±11.11 µg/L、PGⅠ/PGⅡ比值为10.93±5.33; 胃癌组PGⅠ、PGⅡ水平最低(81.53 µg/L±17.49 µg/L、12.04 µg/L±8.98 µg/L), PGⅠ/PGⅡ比值为3.89±2.30. 除PGⅡ水平胃癌组与正常对照组无明显意义(P>0.05)外, 其余各组之间都有统计学意义(P<0.05). 通过对胃癌进行受试者工作特征曲线(receiver operating characteristic curve, ROC)分析, 得出PGⅠ最佳界值为62.53 µg/L (灵敏度为70.4%, 特异度为56.4%), 曲线下面积(area under curve, AUC)为0.821; PGⅠ/PGⅡ比值最佳界值为5.45(灵敏度为87.5%, 特异度为64.6%), AUC为0.909; PGⅡ最佳界值为9.67 µg/L(灵敏度为42.6%, 特异度为89.7%), AUC为0.504.
结论: 高水平PGⅠ、PGⅡ是溃疡病的高危因素, 对溃疡病的诊断及治疗效果具有重要的临床意义. 而PGⅠ及PGⅠ/PGⅡ比值的降低可提示胃癌的发生, 适合大规模人群的胃癌筛查.
核心提示: 血清胃蛋白酶原Ⅰ(pepsinogenⅠ, PGⅠ)及PGⅠ/PGⅡ比值的降低可提示胃癌的发生, 适合大规模人群的胃癌筛查, 通过建立本实验室的临床界值提高胃癌的检出率.
引文著录: 谢津璧, 万坚, 张慧, 刘艳丽, 张丽航, 毛峻岭, 张赛森. 血清胃蛋白酶原在胃癌及胃溃疡筛查中的临床意义. 世界华人消化杂志 2014; 22(31): 4820-4824
Revised: September 10, 2014
Accepted: September 21, 2014
Published online: November 8, 2014
AIM: To investigate the clinical significance of serum pepsinogen (PG) Ⅰ and PGⅡ and PGⅠ/PGⅡ ratio in the diagnosis of gastric cancer and gastric ulcer.
METHODS: ELISA was used to detect serum PGⅠ, PGⅡ and the PGⅠ/PGⅡ ratio in 72 normal controls, 78 patients with gastric ulcer and 38 patients with gastric cancer diagnosed by gastroscopy and pathology.
RESULTS: Serum PGⅠ and PGⅡ levels and PGⅠ/PGⅡ ratio in the gastric ulcer group were 151.1 µg/L ± 8.05 µg/L, 27.52 µg/L ± 21.44 µg/L and 8.75 ± 4.95, respectively. In the normal control group, PGⅠ and PGⅡ levels were 115.51 µg/L ± 54.13 µg/L and 13.44 µg/L ± 11.11 µg/L, respectively, and PGⅠ/PGⅡ ratio was 10.93 ± 5.33. In the gastric cancer group, PGⅠ and PGⅡ levels were 81.53 µg/L ± 17.49 µg/L and 12.04 µg/L ± 8.98 µg/L, respectively, and PGⅠ/PGⅡ ratio was 3.89 ± 2.30. Except that PGⅡ level showed no significant difference between the gastric cancer group and normal control group (P > 0.05), all other comparisons between groups had statistical significance (P < 0.05). The receiver operating characteristic curve analysis revealed that the optimal cut-off value was 62.53 µg/L for PGⅠ [sensitivity 70.4%, specificity 56.4%, area under curve (AUC) 0.821]; 5.45 for PGⅠ/PGⅡ ratio (sensitivity 87.5%, specificity 64.6%, AUC 0.909); and 9.67 µg/L for PGⅡ (sensitivity 42.6%, specificity 89.7%, AUC 0.504).
CONCLUSION: High levels of PGⅠ and PGⅡ are risk factors for ulcer disease, and they have important clinical significance in the diagnosis and treatment of ulcer disease. Reduced levels of PGⅠ and PGⅠ/PGⅡ may indicate the occurrence of gastric cancer, and they are suitable for large-scale population screening.
- Citation: Xie JB, Wan J, Zhang H, Liu YL, Zhang LH, Mao JL, Zhang SS. Clinical significance of serum pepsinogens in screening of gastric cancer and gastric ulcer. Shijie Huaren Xiaohua Zazhi 2014; 22(31): 4820-4824
- URL: https://www.wjgnet.com/1009-3079/full/v22/i31/4820.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i31.4820
胃癌(gastric cancer)是最常见的消化系恶性肿瘤之一, 居全球肿瘤发病率和死亡率的第2位, 在我国其死亡率位居恶性肿瘤之首[1]. 早期胃癌多无症状或仅有轻微症状. 当临床症状明显时, 病变多已属晚期, 因此, 胃癌的早期诊断尤为重要. 胃蛋白酶原(pepsinogen, PG)是胃分泌的一种消化酶前体, 是诊断胃癌的理想的肿瘤标志物, 其敏感性和特异性均很高. 利用血清PG检测进行胃癌及其他胃部疾病的关系以及其作为初筛手段在胃癌筛查中的应用已受到越来越多研究者的关注[2-5]. 本研究采用定量酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)法检测胃癌及胃溃疡患者血清胃蛋白酶原Ⅰ(pepsinogenⅠ, PGⅠ)和PGⅡ水平, 探讨血清PGⅠ、PGⅡ含量及PGⅠ/PGⅡ比值在胃腺癌和胃溃疡中的变化规律及临床意义.
选择2008-02/2013-12嘉定区中心医院消化科门诊及住院患者116例及嘉定区中心医院体检中心进行体检的健康人群72例, 具体情况如表1. 所有检测对象均经胃镜及病理检查证实, 并在检测前2 wk内无特殊用药史, 排除急性上消化道出血须立即治疗者.
| 正常对照组 | 胃溃疡组 | 胃癌组 | |
| n | 72 | 78 | 38 |
| 性别(男/女) | 54/18 | 59/19 | 26/12 |
| 年龄范围(岁) | 19-79 | 17-84 | 53-79 |
| 平均年龄(岁) | 56.23±14.17 | 55.7±10.7 | 59.33±19.24 |
血清PGⅠ、PGⅡ测定取清晨空腹静脉血3 mL, 分离血清后迅速冷冻, 即存于-20 ℃冰箱中待测. 采用芬兰Biohit公司试剂盒, 由Tecan公司的Sunrise酶标仪进行定量ELISA, 计算PGⅠ/PGⅡ比值.
统计学处理 方法采用SPSS17.0统计软件进行统计学处理. 符合正态分布的计量资料用mean±SD描述, 组间差异分析采用t检验, 性别比较采用χ2, 年龄采用mean±SD描述, 组间比较采用t检验, 以P<0.05为差异有统计学意义. 各指标对胃癌的诊断价值用受试者工作特征曲线(receiver operating characteristic curve, ROC).
各组间差异结果分析如表2, 3. 由表2可看出胃溃疡的PGⅠ水平最高, 胃癌最低, PGⅡ水平亦同. 由表3分析可看出除PGⅡ水平胃癌组与正常对照组差异无统计学意义(P>0.05)外, 其余各组之间差异都有统计学意义(P<0.05).
| 分组 | n | PG-Ⅰ(μg/L) | PG-Ⅱ(μg/L) | PGⅠ/PGⅡ比值 |
| 正常对照组 | 72 | 115.51±54.13 | 13.44±11.11 | 10.93±5.33 |
| 胃溃疡组 | 78 | 151.18±8.05 | 27.52±21.44 | 8.75±4.95 |
| 胃癌组 | 38 | 81.53±17.49 | 12.04±8.98 | 3.89±2.37 |
| 组1 | 组2 | PGⅠ | PGⅡ | PGⅠ/PGⅡ比值 | |||
| t值 | P值 | t值 | P值 | t值 | P值 | ||
| 正常对照组 | 胃溃疡 | 5.75 | 0.00 | 4.99 | 0.00 | 2.59 | 0.01 |
| 胃癌 | 3.76 | 0.00 | 0.66 | 0.51 | 7.74 | 0.00 | |
| 胃癌 | 胃溃疡 | 29.43 | 0.00 | 4.26 | 0.00 | 5.46 | 0.00 |
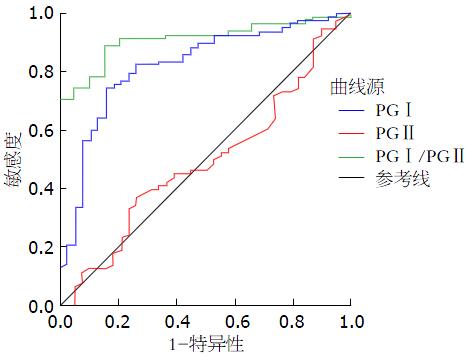
ROC曲线的曲线下面积(area under curve, AUC)越接近于l, 说明诊断效果越好. 表4可看出PGⅠ/PGⅡ的AUC最大为0.909, 对胃癌的诊断可能最有意义, PGⅠ为0.821, 诊断胃癌也有一定的意义, 而PGⅡ的AUC较低为0.504, 意义不大(图1).
| AUC | 最佳界值(μg/L) | 95%可信区间 | 特异度(%) | 敏感度(%) | |
| PGⅠ | 0.821 | 62.53 | 0.738-0.903 | 56.4 | 70.4 |
| PGⅡ | 0.504 | 9.67 | 0.381-0.604 | 89.7 | 42.6 |
| PGⅠ/PGⅡ比值 | 0.909 | 5.45 | 0.855-0.962 | 64.6 | 87.5 |
胃癌是消化系统最常见的恶性肿瘤之一, 在我国其发病率及病死率居各类肿瘤的首位. 早期诊断、早期治疗可提高患者生存质量、降低病死率. 但早期胃癌的症状及体征缺乏特异性, 当出现明显的临床症状而来就诊时, 往往病情已属中、晚期, 失去最佳的治疗时机, 预后较差. 因此胃癌的早期诊断尤为重要. 目前诊断胃癌的主要方法是纤维胃镜下行病理活检, 被称为是确诊胃癌的"金标准". 这种途径检查方法必须要求具备先进的仪器设备和专门的操作人员, 技术要求高, 费用较贵, 而且大部分的患者不能耐受胃镜检查的痛苦, 不能作为普查手段, 因此一种简单有效、痛苦少、适合大众普查的方法极为重要. PG是胃蛋白酶的前体, 分为PGⅠ和PGⅡ, PGⅠ和PGⅡ的细胞来源和组织分布有所不同, PGⅠ主要由胃底腺的主细胞和黏液颈细胞分泌; PGⅡ除由胃底腺的主细胞和黏液颈细胞分泌外, 贲门腺和胃窦的幽门腺的黏液颈细胞以及十二指肠上段也能产生PGⅡ. 当胃黏膜发生病变时, PG分泌细胞受累, 血清PG水平也发生相应的变化. 联合测定PGⅠ和PGⅠ/PGⅡ比值可精确反映胃黏膜的形态和功能, 起到胃黏膜"血清学活检"的作用[6-8]. 本研究显示胃癌的PGⅠ、PGⅠ/PGⅡ比值水平明显低于对照组及溃疡组, 具有统计学意义(P<0.01). 而正常组与胃癌组无统计学差异(P>0.05). 这可能由于胃蛋白酶原主要是由胃底腺细胞分泌, 当胃黏膜病变时, 血清中胃蛋白酶原水平也随之发生改变. 胃癌患者PGⅠ水平明显下降, 表明胃癌患者胃黏膜的功能下降. 有研究报道致癌因子可导致PG基因位点缺失导致突变, 导致分泌PGⅠ的主细胞减少, 从而使分泌PGⅠ的能力下降[9]. 而PGⅡ是由多种腺体产生, 因此PGⅡ水平在胃癌患者中相对稳定[10]. 胃溃疡患者的PGⅠ、PGⅡ较正常对照组及胃癌组明显升高(P<0.01), 这可能是与胃溃疡发生时, 应激状态下胃底腺细胞分泌大量的PGⅠ、PGⅡ入血, 从而使血清中PGⅠ、PGⅡ水平明显增高[11], 因此PGⅠ、PGⅡ显著升高时提示胃溃疡可能, 具有一定的临床价值.
本研究采用ROC曲线进行验证及分析, 从而得到本实验室的胃癌患者的PGⅠ、PGⅡ、PGⅠ/PGⅡ比值的临床界值. AUC的大小可从量上具体表明诊断试验的准确度, AUC越接近1说明准确度越高, AUC在0.9以上时有较高准确性, AUC为0.7-0.9时有一定准确性, AUC在0.5-0.7时有较低准确性, AUC = 0.5时, 说明诊断方法完全不起作用, 无诊断价值. 本试验的PGⅠ最佳界值为62.53 μg/L(灵敏度为70.4%, 特异度为56.4%), AUC为0.821; PGⅠ/PGⅡ比值最佳界值为5.45(灵敏度为87.5%, 特异度为64.6%), AUC为0.909; PGⅡ最佳界值为9.67 μg/L(灵敏度为42.6%, 特异度为89.7%), AUC为0.504. 由以上结果可看出PGⅠ、PGⅠ/PGⅡ比值的AUC接近于1, 说明用PGⅠ、PGⅠ/PGⅡ比值诊断胃癌有一定的准确度. 而PGⅡ比值的AUC接近0.5准确度较低, 无实际意义. 本实验最佳界值的结果与国内外研究结果有一定的差异, 如: 在欧洲PGⅠ为25 μg/L, PGⅠ/PGⅡ为3[12]; 日本为PGⅠ 70 μg/L, PGⅠ/PGⅡ为3[13]; 国内有研究PGⅠ的最佳界值为70.1 μg/L, PGⅠ/PGⅡ比值为6[14]. 这可能与实验方法、地区、种族、饮食习惯、性别、年龄等不同有关, 所以本文赞同在不同地区及实验室应建立符合本地区情况最佳临床界值判断标准. 我们的研究结果表明, PGⅠ及PGⅠ/PGⅡ比值的降低可提示胃癌的发生. 在这一人群中本实验室的最佳临界值PGⅠ为62.53 μg/L(灵敏度为70.4%, 特异度为56.4%); PGⅠ/PGⅡ比值为5.45(灵敏度为87.5%, 特异度为64.6%). 通过对最佳临床界值的判断可以对高危人群行进一步的检查, 提高胃癌的检出率.
总之, 高水平PGⅠ、PGⅡ是溃疡病的高危因素之一, 对溃疡病的诊断及治疗效果具有重要的临床意义. 而PGⅠ及PGⅠ/PGⅡ比值的降低可提示胃癌的发生, 适合大规模人群的胃癌筛查[15], 通过建立本实验室的临床界值, 可针对性对可疑人群行胃镜及病理检查, 提高胃癌的检出率, 降低成本、减少患者痛苦.
胃癌的早期诊断非常重要. 有研究发现, 血清胃蛋白酶原(pepsinogen, PG)检测对胃部良恶性疾病的诊断具有一定的价值.
王邦茂, 教授, 天津医科大学总医院消化内科
PG是胃分泌的一种消化酶前体, 是诊断胃癌的理想的肿瘤标志物, 其敏感性和特异性均很高. 利用血清PG检测进行胃癌及其他胃部疾病的关系以及其作为初筛手段在胃癌筛查中的应用已受到越来越多研究者的关注.
本文证实高水平PGⅠ、PGⅡ是溃疡病的高危因素, 对溃疡病的诊断及治疗效果具有重要的临床意义. 而PGⅠ及PGⅠ/PGⅡ比值的降低可提示胃癌的发生, 适合大规模人群的胃癌筛查.
PGⅠ及PGⅠ/PGⅡ比值的降低可提示胃癌的发生, 适合大规模人群的胃癌筛查, 通过建立本实验室的临床界值, 可针对性对可疑人群行胃镜及病理检查, 提高胃癌的检出率, 降低成本、减少患者痛苦.
国内虽已有类似的报道, 但研究对临床具有一定的指导意义和实用价值.
编辑: 田滢 电编:都珍珍
| 1. | Lin JT. Screening of gastric cancer: who, when, and how. Clin Gastroenterol Hepatol. 2014;12:135-138. [PubMed] [DOI] |
| 2. | Keck JW, Miernyk KM, Bulkow LR, Kelly JJ, McMahon BJ, Sacco F, Hennessy TW, Bruce MG. Helicobacter pylori infection and markers of gastric cancer risk in Alaska Native persons: a retrospective case-control study. Can J Gastroenterol Hepatol. 2014;28:305-310. [PubMed] |
| 3. | Mishima N, Yatani H, Kondo Y, Yokoyama T, Yamashita A. [Effect of zinc iontophoresis on sealing of dentinal tubules by a new handy electolytic applicator]. Nihon Hotetsu Shika Gakkai Zasshi. 1989;33:466-474. [PubMed] |
| 4. | Boltin D, Gingold-Belfer R, Dickman R, Halpern M, Morgenstern S, Roth M, Layfer O, Vilkin A, Niv Y, Levi Z. Gastric mucin expression in first-degree relatives of gastric cancer patients. Eur J Gastroenterol Hepatol. 2014;26:710-714. [PubMed] [DOI] |
| 5. | Tu H, Sun L, Dong X, Gong Y, Xu Q, Jing J, Long Q, Flanders WD, Bostick RM, Yuan Y. Temporal changes in serum biomarkers and risk for progression of gastric precancerous lesions: A longitudinal study. Int J Cancer. 2014; Jun 4. [Epub ahead of print]. [PubMed] [DOI] |
| 6. | Li P, He C, Sun L, Dong N, Yuan Y. Pepsinogen I and II expressions in situ and their correlations with serum pesignogen levels in gastric cancer and its precancerous disease. BMC Clin Pathol. 2013;13:22. [PubMed] [DOI] |
| 7. | Adamczyk M, Peczek Ł, Rudnicki C, Nawrot B, Stec-Michalska K. [The clinical significance of GastroPanel in diagnostics of Helicobacter pylori eradication efficiency in patients with dyspepsia with correlation of family history of gastric cancer]. Pol Merkur Lekarski. 2013;35:141-147. [PubMed] |
| 8. | Boda T, Ito M, Yoshihara M, Kitamura Y, Matsuo T, Oka S, Tanaka S, Chayama K. Advanced method for evaluation of gastric cancer risk by serum markers: determination of true low-risk subjects for gastric neoplasm. Helicobacter. 2014;19:1-8. [PubMed] [DOI] |
| 9. | Lorente S, Doiz O, Trinidad Serrano M, Castillo J, Lanas A. Helicobacter pylori stimulates pepsinogen secretion from isolated human peptic cells. Gut. 2002;50:13-18. [PubMed] |
| 10. | Frasch CE. Vaccines for prevention of meningococcal disease. Clin Microbiol Rev. 1989;2 Suppl:S134-S138. [PubMed] |
| 11. | Pomytkina TE. [The serum content of gastrin-17 and pepsinogen-1 in patients with duodenal ulcerative disease in occupational contact with nitrogenous compounds]. Klin Lab Diagn. 2009;16-19. [PubMed] |
| 12. | Sipponen P, Graham DY. Importance of atrophic gastritis in diagnostics and prevention of gastric cancer: application of plasma biomarkers. Scand J Gastroenterol. 2007;42:2-10. [PubMed] |
| 13. | Watabe H, Mitsushima T, Yamaji Y, Okamoto M, Wada R, Kokubo T, Doi H, Yoshida H, Kawabe T, Omata M. Predicting the development of gastric cancer from combining Helicobacter pylori antibodies and serum pepsinogen status: a prospective endoscopic cohort study. Gut. 2005;54:764-768. [PubMed] |
| 14. | Zhang XM, Li JX, Zhang GY, Li XH, Gu H. The value of serum pepsinogen levels for the diagnosis of gastric diseases in Chinese Han people in midsouth China. BMC Gastroenterol. 2014;14:3. [PubMed] [DOI] |
| 15. | Huang Z, Zhang X, Lu H, Wu L, Wang D, Zhang Q, Ding H. Serum trefoil factor 3 is a promising non-invasive biomarker for gastric cancer screening: a monocentric cohort study in China. BMC Gastroenterol. 2014;14:74. [PubMed] [DOI] |