修回日期: 2014-09-03
接受日期: 2014-09-10
在线出版日期: 2014-10-28
目的: 探讨肠外免疫营养制剂在急性胰腺炎(acute pancreatitis, AP)肠外营养(parenteral nutrition, PN)中的作用.
方法: 计算机检索在2014-05-31在PubMed、Medline、Embase、Science Direct、CBM、Springer link、VIP及CNKI数据库公开发表的关于肠外免疫营养在治疗AP中疗效的英文文献, 由2位研究者严格按纳入、排除标准独立进行文献筛选(PRISMA标准)、资料提取和方法学质量评价, 并采用RevMan 5.2.7软件进行Meta分析.
结果: 共纳入7篇文献, 共包含AP患者264例, 其中行肠外免疫营养制剂患者130例, 行常规PN制剂患者134例. Meta分析结果显示: 肠外免疫营养组与常规PN组对比, 其感染发生率较低(RR = 0.56, 95%CI: 0.39-0.82, P = 0.002)、住院时间较短(RR = -5.63, 95%CI: -9.69--1.57, P = 0.007)、病死率也较低(RR = 0.23, 95%CI: 0.10-0.52, P<0.001).
结论: AP进行PN治疗时, 使用肠外免疫营养制剂能显著减少相关并发症和改善预后, 值得临床上推广. 但仍需大样本、多中心、前瞻性随机对照研究来进一步验证肠外免疫营养制剂在AP治疗中的优点.
核心提示: 在常规的急性胰腺炎的营养治疗中, 如在肠外营养(parenteral nutrition)制剂中添加谷氨酰胺(glutamine)、ω-3多不饱和脂肪酸(omega-3 fatty acids)等营养素组成的肠道制剂可以显著地减少住院时间和各种并发症的发生.
引文著录: 胡俊, 黄强, 林先盛, 刘臣海, 杨骥, 李瑞阳, 汪超. 肠外免疫营养在急性胰腺炎治疗中作用的随机对照试验荟萃分析. 世界华人消化杂志 2014; 22(30): 4647-4653
Revised: September 3, 2014
Accepted: September 10, 2014
Published online: October 28, 2014
AIM: To evaluate the effects of parenteral immunonutrition on clinical outcomes [infectious complications, length of hospital stay (LOS) and mortality] in patients with acute pancreatitis.
METHODS: Pubmed, Medline, Embase, Science Direct, CBM, Springer link, VIP and CNKI were electronically searched before 31st May 2014 to collect the articles on parenteral immunonutrition in acute pancreatitis. The quality of the included trials was assessed according to the inclusive and exclusive criteria, and the data were extracted and analyzed using RevMan 5.2.7 software.
RESULTS: A total of seven randomized controlled trials studies with 264 pancreatitis patients were included. The number of patients receiving parenteral immunonutrition was 130 and the number of patient receiving standard parenteral nutrition was 134. Meta-analysis showed that parenteral immunonutrition significantly reduced the risk of infectious complications (RR = 0.56, 95%CI: 0.39-0.82, P = 0.002) and mortality (RR = 0.23, 95%CI: 0.10-0.52, P < 0.001). LOS was also shorter in patients who received immunonutrition (RR = -5.63, 95%CI: -9.69--1.57, P = 0.007).
CONCLUSION: Immunonutrients like glutamine and omega-3 fatty acids added to parenteral formulas can improve prognoses in patients with acute pancreatitis. Our findings still need to be verified by large, multicenter prospective randomized controlled trials.
- Citation: Hu J, Huang Q, Lin XS, Liu CH, Yang J, Li RY, Wang C. Parenteral immunonutrition in patients with acute pancreatitis: A meta-analysis of randomized controlled trials. Shijie Huaren Xiaohua Zazhi 2014; 22(30): 4647-4653
- URL: https://www.wjgnet.com/1009-3079/full/v22/i30/4647.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i30.4647
急性胰腺炎(acute pancreatitis, AP)是临床常见的急危重症之一, 最新的指南定义为由于胆源性、酒精性等多种病因引起的胰腺胰酶激活, 以胰腺局部炎症反应为主要特征, 伴或不伴有其他器官功能改变的疾病. 临床上, 大多数患者预后较好, 病程呈自限性, 但是仍有20%-30%患者病情经过凶险, 总体病死率为5%-10%[1-4], 临床上根据最新的分级标准[1-4]将AP分为轻度AP(mild AP, MAP)、中度AP(moderately severe AP, MSAP)、重症AP(severe AP, SAP), AP常导致肠黏膜屏障功能受损、肠内细菌易位, 全身性的代谢紊乱、营养不良和免疫功能下降, 患者的营养状态也决定了AP的预后, 因此, 恰当的营养支持在AP的治疗中起着至关重要的作用[5-7]. 目前AP常见的营养治疗方法分为肠内营养(enteral nutrition, EN)和肠外营养(parenteral nutrition, PN)[8-11]. 对于MAP患者只需要短期禁食水, 无需行营养支持治疗; 对于MSAP和SAP患者, 最新治疗指南提倡在早期施行PN, 待患者胃肠动力能够耐受时, 及早(发病48 h内)施行EN[1-4,9], 且在整个AP的营养治疗过程中, 提倡使用EN[9]. 只有在EN提供营养不足、肠道无法耐受EN、肠梗阻或者出现消化道穿孔时, 才使用PN支持.
近年的研究表明[12-15], 在肠道营养制剂中添加谷氨酰胺(glutamine)、ω-3多不饱和脂肪酸(omega-3 fatty acids)等营养素组成的肠道免疫营养制剂, 可以在提供能量的同时, 调控机体的免疫炎症反应和保护肠黏膜屏障的功能[16-18]. 肠道免疫营养治疗在重症患者和大手术术后的临床效果得到肯定, 但是目前AP的肠外免疫营养治疗的临床随机对照试验(randomized controlled trials, RCTs)的结果仍存在争议[19,20]. 为了进一步明确肠外免疫营养制剂在AP治疗的应用, 我们遂采用循征医学的方法来评估肠外免疫营养制剂在AP治疗中的效用.
分别以"acute pancreatitis" or "pancreatitis" or "severe acute pancreatitis"、"nutritional support" or "parenteral nutrition" or "total parenteral nutrition"、"immunonutrition"、"Fatty Acids, Omega-3" or "Fish oil" or "glutamine" or "glutamine dipeptide" or "L-glutamine" or "glutamine supplementation"为检索词, 通过计算机检索数据库: PubMed、Medline、Embase、Science Direct、CBM; Springer link、VIP及CNKI. 并以不同检索策略进行检索, 文献检索的截止时间为: 2014-05-31. 检索语言仅限于英文文献.
1.2.1 纳入标准: (1)纳入研究的试验设计类型为RCT; (2)纳入研究为2014-05-31前公开发表的英文文献; (3)各纳入研究需有肠外免疫营养制剂组和常规PN制剂组对比, 且需有相关表明疗效的指标(感染性并发症、病死率、住院时间等); (4)肠外免疫营养制剂为谷氨酰胺(glutamine)、ω-3多不饱和脂肪酸(omega-3 fatty acids)、精氨酸等制剂或者配合而成的制剂; (5)文献中应该交代肠外免疫营养制剂的剂量和治疗方案; (6)纳入研究中的研究对象的年龄应为≥16岁且诊断明确.
1.2.2 排除标准: (1)非随机对照试验; (2)研究为EN和PN之间对比的RCT; (3)诊断不明确或者纳入的研究人群包含有不同疾病的, 则不予以纳入.
1.2.3 研究: 严格按照Cochrane协作组的系统评价文献筛选流程[21]和Meta分析报告规范PRISMA标准进行文献筛选[22], 首先由三位研究者分别独立进行文献检索和文献的初筛, 整个筛选过程采用盲法. 具体的文献筛选过程为: 先独立阅读所获文献的题目及摘要, 剔除明显不符合纳入标准的文献, 再对可能符合纳入标准的文献阅读全文, 以确定该文献是否真正符合纳入标准. 如果对对筛选过程中有分歧而难以确定是否纳入的文献, 则通过讨论或由第三个研究者决定其是否纳入. 两位研究人员独立地对符合纳入标准的试验进行资料提取(第一作者、发表年限、人群构成、研究类型等), 再填写资料提取表格, 并交叉核对提取的资料, 缺乏的资料通过与临床试验通讯作者联系予以补充.
1.2.4 文献质量评估: 采用Cochrane协作组的Cochrane Handbook 5.0推荐的"偏倚风险评估"工具对本主题词检索纳入后所得到的研究进行方法学质量评价. 具体的评价包括6个方面: (1)随机分配方法; (2)隐藏分组; (3)盲法: 对研究对象、治疗方案实施者、研究结果测量者; (4)结果数据的完整性; (5)选择性报告研究结果; (6)其他偏倚来源. 将研究治疗分为3级: 完全满足上述6条标准者, 即为"正确或充分", 其发生各种偏倚的可能性最小, 质量为A级; 上述有1条描述不清楚者为部分满足, 质量为B级; 上述有1条描述有发生相应偏倚的可能性, 质量为C级.
统计学处理 本文采用Cochrane协作网提供的RevMan 5.2.7软件进行Meta分析. 对纳入的研究资料进行临床异质性分析, 研究中存在吻合方式的差异, 采用随机效应模型合并数据. 计数资料采用相对危险度(risk ratio, RR)以及95%可信区间(95% confidence interval, 95%CI)表示. P<0.05为差异有统计学意义.
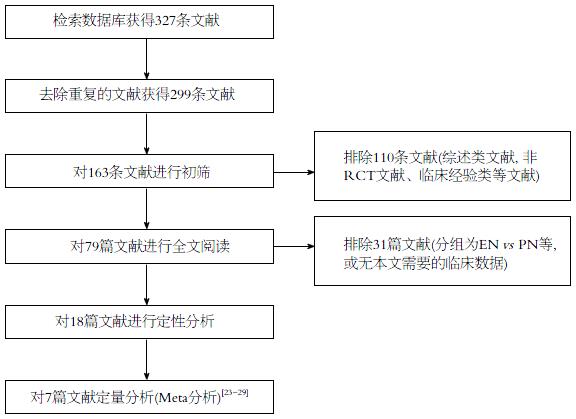
由两位研究者严格按照PRISMA标准进行文献筛选流程和既定的纳入排除标准进行文献筛选, 共纳入文献7篇[23-29]. 具体筛选文献的PRISMA流程图如图1. 其中共纳入AP病例数264例, 其中行肠外免疫营养制剂患者130例, 行常规PN制剂患者134例, PN制剂为谷氨酰胺添加或者ω-3多不饱和脂肪酸添加组. 各纳入文献分别介绍了文中AP患者的纳入和诊断标准, 两组之间的基线具有可比性. 其中具体纳入文献的分组情况及一般情况如表1.
| 纳入研究 | 国家 | 肠外免疫营养制剂 | 分组(n) | |
| 肠外营养制剂组 | 常规组 | |||
| de Beaux等[23]1998 | United Kingdom | Glutamine | 6 | 7 |
| Ockenga等[24]2002 | Germany | Glutamine | 14 | 14 |
| He等[25]2004 | China | Glutamine | 20 | 23 |
| Sahin等[26]2007 | Turkey | Glutamine | 20 | 20 |
| Fuentes-Orozco等[27]2008 | Mexico | Glutamine | 22 | 22 |
| Wang等[28]2009 | China | Omega-3 fatty acids | 28 | 28 |
| Wang等[29]2008 | China | Omega-3 fatty acids | 20 | 20 |
| 合计 | 130 | 134 | ||
采用Cochrane协作组的Cochrane Handbook 5.0推荐的"偏倚风险评估"工具从随机分配方法的描述、隐藏分组、盲法的说明、结果数据的完整性、选择性报告研究结果和其他偏倚来源六个方面对纳入文献进行质量评价. 具体质量评价的结果详如表2. 由表2可知: 各纳入研究的AP的诊断标准均根据1992年的亚特兰大标准, 且诊断重症胰腺炎均叙述了诊断标准. 各纳入研究均包含了PN制剂组的剂量和使用时间的比较, 也包含预后指标, 如病死率、感染率、住院时间等. 纳入研究中质量为A级的2篇[27,29], 质量为B级的4篇[23-25,28], 仅有1篇[26]因为未明确交代随机方法的分配和盲法的说明评价为C级. 整体纳入文献质量较高.
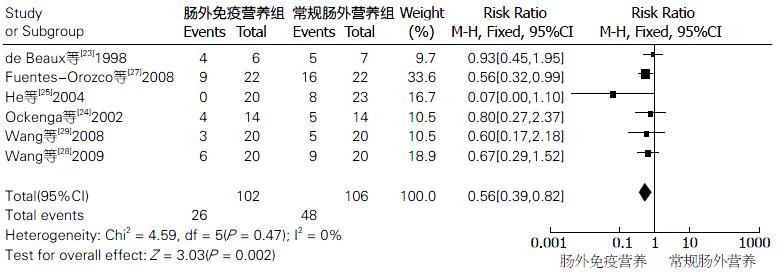
2.3.1 肠外免疫营养制剂组和常规PN制剂组感染发生率的比较: 共纳入有6篇文献, 共包含肠外免疫营养组患者102例, 常规PN组106例, Meta分析结果表明: 各纳入研究的异质性很小(I2 = 0%, P = 0.47), 遂采用固定效应模型进行分析. 结果表明: RR = 0.56, 95%CI: 0.39-0.82. 肠外免疫营养组的感染发生率与常规PN组的感染发生率的差异有统计学意义(P = 0.002). 肠外免疫营养组的感染发生率较小. 两组感染发生率比较的森林图如图2.
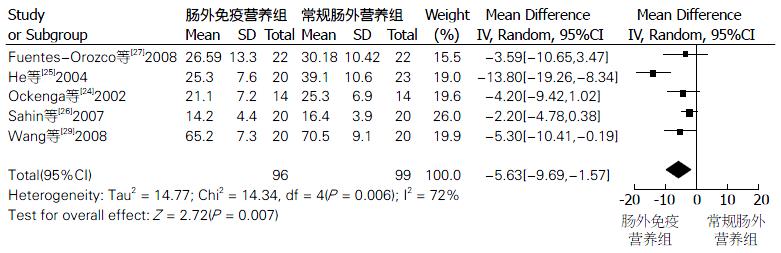
2.3.2 肠外免疫营养制剂组和常规PN制剂组住院时间的比较: 共纳入有5篇文献, 共包含肠外免疫营养组患者96例, 常规PN组99例, Meta分析结果表明: 各纳入研究有一定的异质性(I2 = 72%, P = 0.006), 遂采用随机效应模型进行分析. 结果表明: RR = -5.63, 95%CI: -9.69--1.57. 肠外免疫营养组的住院时间与常规PN组住院时间的差异有统计学意义(P = 0.007), 免疫营养组的住院时间较短. 两组住院时间比较的森林图如图3.
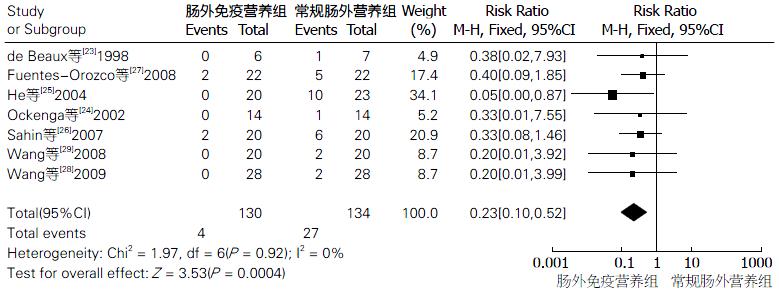
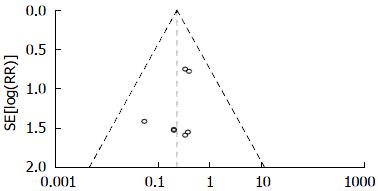
2.3.3 肠外免疫营养制剂组和常规PN制剂组病死率的比较: 共纳入有7篇文献, 共包含肠外免疫营养组患者130例, 常规PN组134例, Meta分析结果表明: 各纳入研究异质性很小(I2 = 0%, P = 0.92), 遂采用固定效应模型进行分析. 结果表明: RR = 0.23, 95%CI: 0.10-0.52. 肠外免疫营养组病死率与常规PN组病死率的差异有统计学意义(P<0.001). 肠外免疫营养组的病死率小. 两组住院时间比较的森林图如图4. 各纳入文献的漏斗图如图5. 由图5可知: 文献选择偏倚较小.
AP是一种由于胰酶被激活, 继而导致局部或者全身炎症反应的疾病, 在其治疗中, 营养支持占很重要的地位[2,4]. 对于早期的MAP, 患者仅需要短暂的禁食水即可; 对于MSAP及SAP患者, 需给予营养支持治疗. 目前对于营养支持治疗的选择, 如胃肠道能够耐受, 需及时行EN. 但是对于SAP患者或者胃肠道无法耐受EN的患者, PN成为首选的营养支持方法. 目前肠道营养制剂中添加谷氨酰胺、ω-3多不饱和脂肪酸等营养素组成的肠道免疫营养制剂[16-18]成为指南等推荐的方案, 且已有相关的系统评价[30,31]论证, 并且肯定了肠外免疫营养制剂在营养支持中的作用, 但是由于部分文献的异质性较大、研究的设计类型等原因, 其结果并不充分. 本文检索近年来的关于肠外免疫营养制剂和常规治疗方案对比的RCT研究, 进一步说明肠外免疫营养在AP营养支持治疗中的作用.
通过本文的系统评价表明: 肠外免疫营养组的住院时间较常规PN组明显的降低(P<0.05), 肠外免疫营养组的病死率及感染的发生率均较常规PN组低(P<0.05), 说明了在PN制剂中添加谷氨酰胺及ω-3多不饱和脂肪酸等组成的免疫营养制剂具有明显降低AP的住院时间、减少AP相关并发症[全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)、多器官功能障碍综合征(multiple dysfunction syndrome, MODS)等]的发生和降低死亡率等特点. 其主要原因可能是[32,33]: 谷氨酰胺等参与葡萄糖三羧酸循环氧化生成ATP供能, 并参与黏膜细胞核酸以及蛋白质的合成代谢, 促进肠黏膜细胞的更新和再生, 保持其超微结构的完整性; 谷氨酰胺可能刺激机体产生高血糖素, 增加萎缩肠黏膜中谷氨酰胺酶活性, 改善肠黏膜组织结构; SAP极易发展成为MODS, 而谷氨酰胺等可有效地升高血浆还原型谷胱甘肽浓度, 减少氧自由基的产生, 减轻氧自由基对机体的损害, 同时能显著降低SAP某些炎症介质和细胞因子释放, 从而减轻机体的炎症反应, 减轻组织损伤.
荟萃分析作为一种观察性的研究, 有一定的局限性. 本系统评价有如下局限性: (1)纳入的各文献研究病例数, 样本量较少, 导致总的样本量不足, 这可能影响试验的结果; (2)纳入文献有一定的异质性, 这会影响试验结果; (3)各纳入研究的AP或者重症胰腺炎应用PN的指征不同, 从而影响试验结果; (4)纳入人群的不同, 影响试验结果; (5)纳入文献的PN制剂的配比和剂量不同也可能影响试验结果.
总之, AP的PN治疗中, 使用肠外免疫营养制剂能明显降低相关并发症, 并改善预后, 值得临床推广. 但仍需大样本、多中心、前瞻性随机对照研究来进一步验证肠外免疫营养制剂在PN中的优点.
急性胰腺炎(acute pancreatitis, AP)是临床常见的急危重症之一, 最新治疗指南提倡在早期施行肠外营养(parenteral nutrition, PN), 待患者胃肠动力能够耐受时, 及早(发病48 h内)施行肠内营养(enteral nutrition, EN). 但是目前AP的肠外免疫营养治疗的临床随机对照试验(randomized controlled trials, RCTs)的结果仍存在争议, 目前尚无系统评价对于肠外免疫营养与传统的营养制剂进行对比.
汪波, 主任医师, 北京大学第一医院急诊科
由于AP肠外免疫营养的效果和应用存在着争议, 目前尚无系统评价对于肠外免疫营养与传统的营养制剂进行对比. 本文遂结合近年来的最新的随机对照试验进行分析, 进一步明确肠外免疫营养的临床价值, 为临床选择提供证据.
PN制剂中添加谷氨酰胺及ω-3多不饱和脂肪酸等组成的免疫营养制剂具有明显降低AP的住院时间、减少AP相关并发症[全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)、多器官功能障碍综合征(multiple dysfunction syndrome, MODS)等]的发生和降低死亡率等特点. AP肠外免疫营养制剂会逐渐成为发展方向.
本文遂结合近年来的最新的随机对照试验进行分析, 进一步明确和证实肠外免疫营养的临床价值, 为临床选择提供证据.
相比较常规的PN而言, 肠外免疫营养组能显著地降低AP的住院时间、病死率、感染率, 降低AP相关并发症的发生率, 值得在临床进一步推广.
肠道免疫制剂: 在常规肠道营养制剂中添加谷氨酰胺(Glutamine)、ω-3多不饱和脂肪酸(Omega-3 fatty acids)等营养素组成的肠道制剂, 可以在提供能量的同时, 调控机体的免疫炎症反应和保护肠黏膜屏障的功能. 肠道免疫营养治疗在重症患者和大手术术后的临床效果得到肯定.
本文应用系统评价的方法就急说明了AP的免疫营养制剂的使用在治疗AP中的作用, 结果可信, 具备相应的科学性、创新性, 有实际指导意义.
编辑: 郭鹏 电编:闫晋利
| 3. | Bank S, Singh P, Pooran N, Stark B. Evaluation of factors that have reduced mortality from acute pancreatitis over the past 20 years. J Clin Gastroenterol. 2002;35:50-60. [PubMed] [DOI] |
| 4. | Banks PA, Bollen TL, Dervenis C, Gooszen HG, Johnson CD, Sarr MG, Tsiotos GG, Vege SS. Classification of acute pancreatitis--2012: revision of the Atlanta classification and definitions by international consensus. Gut. 2013;62:102-111. [PubMed] [DOI] |
| 5. | Ong JP, Fock KM. Nutritional support in acute pancreatitis. J Dig Dis. 2012;13:445-452. [PubMed] [DOI] |
| 6. | Meier RF, Beglinger C. Nutrition in pancreatic diseases. Best Pract Res Clin Gastroenterol. 2006;20:507-529. [PubMed] [DOI] |
| 7. | Marik PE. What is the best way to feed patients with pancreatitis? Curr Opin Crit Care. 2009;15:131-138. [PubMed] [DOI] |
| 8. | Thomson A, Subramaniam K, Davies A. Nutritional therapy in acute pancreatitis--time to take stock. Nutrition. 2012;28:731-732. [PubMed] [DOI] |
| 9. | Mirtallo JM, Forbes A, McClave SA, Jensen GL, Waitzberg DL, Davies AR. International consensus guidelines for nutrition therapy in pancreatitis. JPEN J Parenter Enteral Nutr. 2012;36:284-291. [PubMed] [DOI] |
| 10. | Gianotti L, Meier R, Lobo DN, Bassi C, Dejong CH, Ockenga J, Irtun O, MacFie J. ESPEN Guidelines on Parenteral Nutrition: pancreas. Clin Nutr. 2009;28:428-435. [PubMed] [DOI] |
| 11. | Zhao G, Wang CY, Wang F, Xiong JX. Clinical study on nutrition support in patients with severe acute pancreatitis. World J Gastroenterol. 2003;9:2105-2108. [PubMed] |
| 12. | Souba WW. Glutamine: a key substrate for the splanchnic bed. Annu Rev Nutr. 1991;11:285-308. [PubMed] [DOI] |
| 13. | Fürst P, Pogan K, Stehle P. Glutamine dipeptides in clinical nutrition. Nutrition. 1997;13:731-737. [PubMed] [DOI] |
| 14. | Tremel H, Kienle B, Weilemann LS, Stehle P, Fürst P. Glutamine dipeptide-supplemented parenteral nutrition maintains intestinal function in the critically ill. Gastroenterology. 1994;107:1595-1601. [PubMed] |
| 15. | Roth E. [Amino acid and protein metabolism in critically ill patients]. Infusionsther Klin Ernahr. 1985;12:270-280. [PubMed] |
| 16. | Martin JM, Stapleton RD. Omega-3 fatty acids in critical illness. Nutr Rev. 2010;68:531-541. [PubMed] [DOI] |
| 17. | Fetterman JW, Zdanowicz MM. Therapeutic potential of n-3 polyunsaturated fatty acids in disease. Am J Health Syst Pharm. 2009;66:1169-1179. [PubMed] [DOI] |
| 18. | Jafari T, Fallah AA, Azadbakht L. Role of dietary n-3 polyunsaturated fatty acids in type 2 diabetes: a review of epidemiological and clinical studies. Maturitas. 2013;74:303-308. [PubMed] [DOI] |
| 19. | Pradelli L, Mayer K, Muscaritoli M, Heller AR. n-3 fatty acid-enriched parenteral nutrition regimens in elective surgical and ICU patients: a meta-analysis. Crit Care. 2012;16:R184. [PubMed] [DOI] |
| 20. | Bollhalder L, Pfeil AM, Tomonaga Y, Schwenkglenks M. A systematic literature review and meta-analysis of randomized clinical trials of parenteral glutamine supplementation. Clin Nutr. 2013;32:213-223. [PubMed] [DOI] |
| 22. | Moher D, Liberati A, Tetzlaff J, Altman DG. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. Int J Surg. 2010;8:336-341. [PubMed] [DOI] |
| 23. | de Beaux AC, O'Riordain MG, Ross JA, Jodozi L, Carter DC, Fearon KC. Glutamine-supplemented total parenteral nutrition reduces blood mononuclear cell interleukin-8 release in severe acute pancreatitis. Nutrition. 1998;14:261-265. [PubMed] [DOI] |
| 24. | Ockenga J, Borchert K, Rifai K, Manns MP, Bischoff SC. Effect of glutamine-enriched total parenteral nutrition in patients with acute pancreatitis. Clin Nutr. 2002;21:409-416. [PubMed] [DOI] |
| 25. | He XL, Ma QJ, Lu JG, Chu YK, Du XL. Effect of total parenteral nutrition (TPN) with and without glutamine dipeptide supplementation on outcome in severe acute pancreatitis (SAP). Clin Nutr. 2004;1:43-47. [DOI] |
| 26. | Sahin H, Mercanligil SM, Inanç N, Ok E. Effects of glutamine-enriched total parenteral nutrition on acute pancreatitis. Eur J Clin Nutr. 2007;61:1429-1434. [PubMed] [DOI] |
| 27. | Fuentes-Orozco C, Cervantes-Guevara G, Muciño-Hernández I, López-Ortega A, Ambriz-González G, Gutiérrez-de-la-Rosa JL, Gómez-Herrera E, Hermosillo-Sandoval JM, González-Ojeda A. L-alanyl-L-glutamine-supplemented parenteral nutrition decreases infectious morbidity rate in patients with severe acute pancreatitis. JPEN J Parenter Enteral Nutr. 2008;32:403-411. [PubMed] [DOI] |
| 28. | Wang X, Li W, Zhang F, Pan L, Li N, Li J. Fish oil-supplemented parenteral nutrition in severe acute pancreatitis patients and effects on immune function and infectious risk: a randomized controlled trial. Inflammation. 2009;32:304-309. [PubMed] [DOI] |
| 29. | Wang X, Li W, Li N, Li J. Omega-3 fatty acids-supplemented parenteral nutrition decreases hyperinflammatory response and attenuates systemic disease sequelae in severe acute pancreatitis: a randomized and controlled study. JPEN J Parenter Enteral Nutr. 2009;32:236-241. [PubMed] [DOI] |
| 30. | Palmer AJ, Ho CK, Ajibola O, Avenell A. The role of ω-3 fatty acid supplemented parenteral nutrition in critical illness in adults: a systematic review and meta-analysis. Crit Care Med. 2013;41:307-316. [PubMed] [DOI] |
| 31. | Wirtitsch M, Wessner B, Spittler A, Roth E, Volk T, Bachmann L, Hiesmayr M. Effect of different lipid emulsions on the immunological function in humans: a systematic review with meta-analysis. Clin Nutr. 2007;26:302-313. [PubMed] [DOI] |
| 32. | De Caterina R, Liao JK, Libby P. Fatty acid modulation of endothelial activation. Am J Clin Nutr. 2000;71:213S-223S. [PubMed] |
| 33. | Avenell A. Glutamine in critical care: current evidence from systematic reviews. Proc Nutr Soc. 2006;65:236-241. [PubMed] [DOI] |