修回日期: 2014-09-09
接受日期: 2014-09-15
在线出版日期: 2014-10-28
目的: 探讨脑局部微透析-高效液相色谱(high performance liquid chromatography, HPLC)法测定谷氨酸(glutamate, Glu)、甘氨酸(glycine, Gly)、γ-氨基丁酸(γ-aminobutyric acid, γ-GABA)、牛磺酸(taurine, Tau)含量的可行性, 便秘主导型肠易激综合征[irritable bowel syndrome (IBS) with constipation, IBS-C]和腹泻主导型肠易激综合征(IBS with diarrhea, IBS-D)大鼠脑组织中氨基酸类神经递质含量及γ-氨基丁酸受体A(γ-aminobutyric acid receptor A, GABAAα1)蛋白的表达情况, 初步探讨IBS-C、IBS-D的共性发病机制.
方法: 以体外相对回收率和体内相对损失率为考察指标, 分析Glu、Gly、Tau和γ-GABA的脑局部微透析采样可行性, 建立荧光高效液相色谱分析方法; 采用冰水灌胃法建立IBS-C动物模型, 番泻叶灌胃结合束缚刺激法建立IBS-D动物模型, 并检测各组大鼠脑内氨基酸类神经递质含量; 采用Western blot法测定各组大鼠脑组织中GABAAα1蛋白的表达情况.
结果: 脑局部微透析-HPLC法可用于脑内Glu、γ-GABA的含量测定, 体外相对回收率分别约为21.6%、24.5%, 体内相对损失率分别约为41.8%、32.5%; 与正常组大鼠相比, IBS-C组和IBS-D组大鼠脑内Glu/γ-GABA比值均显著性升高(P<0.05), GABAAα1蛋白表达显著增加(P<0.05); 与IBS-C组大鼠比较, IBS-D组大鼠脑内GABAAα1受体蛋白表达显著增加(P<0.05).
结论: IBS-C、IBS-D的发病可能与脑内兴奋性氨基酸Glu和抑制性氨基酸GABA含量比值、GABAAα1蛋白表达量有关, 存在共性基础.
核心提示: 本研究探讨了氨基酸神经递质及其受体在两种亚型肠易激综合征(irritable bowel syndrome, IBS)中的变化, 从腹泻主导型肠易激综合征(IBS with diarrhea, IBS-D)、便秘主导型肠易激综合征(IBS with constipation, IBS-C)模型大鼠脑组织谷氨酸(glutamate)/γ-氨基丁酸(γ-aminobutyric acid, γ-GABA)含量和GABAAα1受体蛋白表达均显著升高, 揭示了脑-肠轴参与IBS的共性发病机制; 且GABAAα1受体蛋白表达在IBS-D中升高较IBS-C更明显, 揭示了脑-肠轴参与IBS-C、IBS-D发病机制的差异性.
引文著录: 唐洪梅, 涂星, 柴玉娜, 张庆业, 黄育生, 张棋. 两种亚型肠易激综合征中氨基酸神经递质及其受体变化. 世界华人消化杂志 2014; 22(30): 4559-4565
Revised: September 9, 2014
Accepted: September 15, 2014
Published online: October 28, 2014
AIM: To explore the feasibility of using in vivo cerebral microdialysis and high performance liquid chromatography (HPLC) to determine the contents of glutamate (Glu), glycine (Gly), γ-aminobutyric acid (γ-GABA) and taurine (Tau), and to observe the protein expression of γ-aminobutyric acid receptor A (GABAAα1) in irritable bowel syndrome with diarrhea (IBS-D) and irritable bowel syndrome with constipation (IBS-C) to investigate the preliminary pathogenesis of these two subtypes.
METHODS: Using in vitro relative recovery and in vivo relative loss ratio as monitoring indicators, the feasibility of using cerebral microdialysis and HPLC to determine the contents of Glu, Gly, Tau and γ-GABA was first explored. IBS-C was induced by cold water administration and IBS-D by folium sennae combined with restraint. Cerebral microdialysis and HPLC were then used to determine the contents of Glu, Gly, Tau and γ-GABA in the rat brain. Western blot was used to detect the expression of GABAAα1 protein in brain tissue.
RESULTS: In vivo cerebral microdialysis and HPLC were feasible for determining the contents of Glu and γ-GABA; the in vitro relative recovery rates were 21.6% and 24.5%, respectively; in vivo relative loss rates were 41.8% and 32.5%. Compared with rats in the normal group, the ratio of Glu/γ-GABA in the IBS-C and IBS-D groups significantly increased (P < 0.05). GABAAα1 protein expression in both IBS-C and IBS-D groups were significantly higher than that in the normal group (P < 0.05). In addition, GABAAα1 protein expression in the IBS-D group was significantly higher than that in the IBS-C group (P < 0.05).
CONCLUSION: The pathogenesis of IBS-C and IBS-D may be related with Glu/GABA ratio and GABAAα1 in the brain.
- Citation: Tang HM, Tu X, Chai YN, Zhang QY, Huang YS, Zhang Q. Contents of amino acid neurotransmitters and expression of γ-aminobutyric acid receptor in two subtypes of irritable bowel syndrome. Shijie Huaren Xiaohua Zazhi 2014; 22(30): 4559-4565
- URL: https://www.wjgnet.com/1009-3079/full/v22/i30/4559.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i30.4559
肠易激综合征(irritable bowel syndrome, IBS)是一种临床最为常见的慢性功能紊乱疾病, 该病缺乏可解释症状的形态学改变和生化异常[1,2], 根据其临床主要症状分为腹泻主导型肠易激综合征(IBS with diarrhea, IBS-D)、便秘主导型肠易激综合征(IBS with constipation, IBS-C)、腹泻便秘交替型(mixed IBS, IBS-M)和未定型肠易激综合征(unsubtyped IBS, IBS-U), 其中以IBS-C、IBS-D较为常见[2].
目前有研究[3-5]表明, 谷氨酸(glutamate, Glu)、天冬氨酸(aspartic acid, Asp)是兴奋性神经递质, 甘氨酸(glycine, Gly)、γ-氨基丁酸(γ-aminobutyric acid, γ-GABA)、牛磺酸(taurine, Tau)是抑制性神经递质, 且与IBS的发病机制存在一定的关系. γ-GABA作为神经系统内重要的抑制性神经递质, 通过γ-GABA受体GABAA、GABAB、GABAC等发挥重要的调节作用[6,7]. 本课题组前期研究表明[8,9], 氨基酸类神经递质在IBS-D的发病中具有一定的调节作用, 其含量可用荧光高效液相色谱法进行检测分析. 但迄今为止, 尚未见系统报道氨基酸类神经递质在IBS两个亚型IBS-C、IBS-D发病中的可能机制, 重要抑制性神经递质γ-GABA在IBS-C、IBS-D中表达变化尚不清楚. 本研究拟建立IBS-C、IBS-D大鼠模型, 应用脑微透析测定IBS大鼠脑组织中氨基酸类神经递质的含量, 并采用Western blot法检测GABAA受体的表达变化, 以探讨氨基酸类神经递质在IBS-C、IBS-D发病中的共性机制.
SPF级SD大鼠, 雌雄不限, 购自广州中医药大学动物中心, [SCXK(粤)2013-0020]. 动物饲养及造模在广州中医药大学第一附属医院实验动物中心屏障动物实验设施进行[SYXK(粤)2013-0092], 饲养温度22 ℃±3 ℃, 湿度55%-75%, 自然光节律, 并按实验动物使用的3R原则给予人道关怀. Glu、Gly、γ-GABA、Tau标准品, 纯度99.99%, 邻苯二甲醛、β-巯基乙醇、TRIzol等均为Sigma公司产品; 抗GABAAα1R单克隆抗体(美国Millipore公司); β肌动蛋白单克隆抗体(美国Santa Cruz公司); 辣根过氧化酶标记的兔抗羊(北京中杉金桥生物技术有限公司); 甲醇(HPLC级, 天津四有生物医学科技有限公司); 其他试剂均为分析纯. MD-1001微量注射泵、脑探针、血液探针均购自BAS公司; Agilent 1100荧光检测器高效液相系统; 电泳仪、全能凝胶成像分析仪垂直电泳槽、转染电泳槽(BIO-RAD公司)等.
1.2.1 动物的分组和模型的建立: 将SD大鼠随机分为IBS-C组、IBS-D组和正常组, 每组20只. 参考本项目前期研究基础[10], 采用番泻叶结合束缚应激法建立IBS-D大鼠模型; 参考文献[11], 采用冰水灌胃法建立IBS-C大鼠模型; 正常组不作任何处理. 根据Bristol粪便分型积分[12]对模型进行评价, 以平均积分>6分者为成功的IBS-D大鼠模型, 以平均积分<3分者为成功的IBS-C大鼠模型.
1.2.2 脑微透析探针套管埋植: 于造模结束后, 随机取成功IBS-C、IBS-D模型大鼠各10只, 正常大鼠15只, 腹腔注射水合氯醛(0.4 g/kg), 利用三维立体脑定位仪将脑微透析探针套管定位于海马组织(海马位点[13]: AP = -5.8, L = 5.0, H = -3.0). 手术后大鼠恢复7 d, 排除探针套管刺激干扰.
1.2.3 荧光高效液相色谱检测方法的建立: 参考文献[9]配制混合氨基酸标准液(Glu、Gly、Tau和γ-GABA浓度分别为0.1006、0.1013、0.1005、0.1003 mg/mL)及邻苯二甲醛(o-Phthalaldehyde, OPA)衍生剂, 同法制备标准曲线.
1.2.4 微透析探针的体外回收率测定: 将微透析探针置于1:10、1:20、1:50稀释的混合氨基酸标准溶液中, 以32 ℃人工脑脊液(138 mol/L NaCl, 11 mmol/L Na2HCO3, 5 mmol/L KCl, 1 mmol/L CaCl2, 1 mmol/L MgCl2, 1 mmol/L NaPHO4, pH 7.4)以1 µL/min流速灌流, 每20 min收集1次, 收集7次接收液, 弃去前两次接收液, 剩余接收液参考文献[9]以荧光高效液相色谱法检测各组分浓度, 按公式RR = Cdialysate/Cmedium计算体外相对回收率.
1.2.5 微透析探针体内损失率的测定: 取正常组大鼠, 将探针插入可自由活动大鼠的海马脑区(图1), 用人工脑脊液以1.0 µL/min流速灌流1.5 h, 使探针周围组织恢复正常, 然后更换1:10、1:20、1:50稀释的混合氨基酸标准液作为灌流液, 平衡1.5 h后, 每20 min收集1次, 收集5次接收液, 参考文献[9]以荧光高效液相色谱法检测接收液中Glu和γ-GABA浓度, 按公式RL = (Cperfusate-Cdialysate)/Cperfusate计算体内相对损失率.
1.2.6 IBS-C、IBS-D及正常大鼠脑内氨基酸含量的测定: 分别于造模结束后第1、2、4、6、8、12、16、20、30、40天取各组大鼠1只, 于同一时间在可自由活动大鼠的海马脑区植入脑微透析探针, 用人工脑脊液以1.0 µL/min流速灌流, 平衡1.5 h后开始采样, 每30 min收集1次, 收集5次接收液, 以荧光高效液相色谱法检测接收液中Glu和γ-GABA浓度, 然后按照体内相对损失率计算脑海马组织中实际Glu和γ-GABA含量(C实际量 = C测得量/RL). 以氨基酸含量为纵坐标, 以观察天数为横坐标, 制作曲线, 观察并分析IBS-C、IBS-D和正常大鼠脑内氨基酸含量变化差异.
1.2.7 Western blot法检测IBS-C、IBS-D及正常大鼠脑内GABAAα1蛋白表达: 于造模结束后第16天, 分别取正常大鼠、IBS-C、IBS-D模型大鼠各5只脱颈椎处死, 分离出海马组织, 并于-80 ℃液氮中保存. 取海马组织约100 mg, 加入蛋白裂解液1 mL, 冰上超声破碎, 高速离心15 min, 获得组织蛋白匀浆液, 采用二辛可宁酸(bicinchonininc acid, BCA)法测定蛋白浓度. 定量后, 采用5%浓缩胶和12%分离胶进行浓缩和分离, 并转置于聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜上(0.06 A恒流, 60 min), 此后5%脱脂牛奶室温震荡2-3 h. 取出PVDF膜, 加入一抗(GABAAα1R 1:3000), 4 ℃过夜孵育. TBST常温震荡清洗6 min, 加二抗(辣根酶素标记的兔抗羊IgG 1:2000)室温振荡1 h, 用TBST常温震荡清洗6 min. 化学发光、显影、定影、曝片、洗片. 胶片扫描后, 用Quantityone软件将图片上每个特异条带灰度值数字化, 以β肌动蛋白为内标, 计算GABAAα1蛋白的表达.
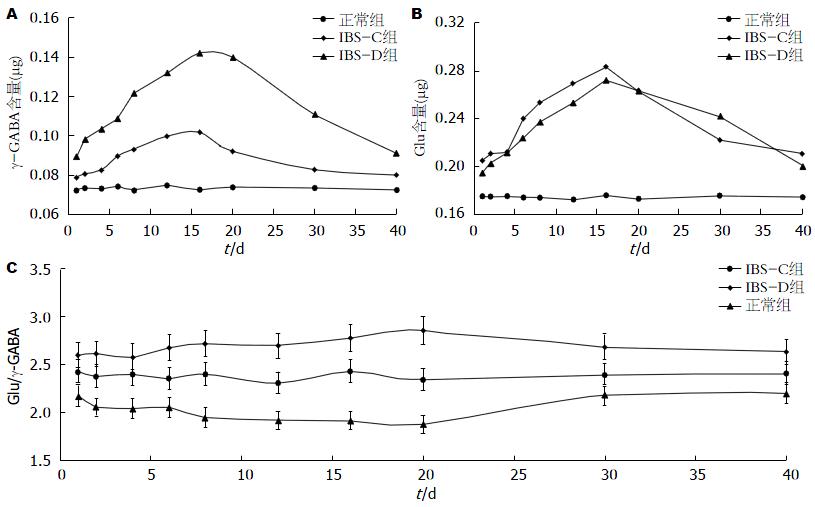
造模结束后获得IBS-C模型大鼠16只, IBS-D大鼠20只, 正常组20只. 植入脑微透析探针套管过程无大鼠死亡, 如图1. 标准曲线结果如表1. 由表1可知, Glu、Gly、Tau和γ-GABA的线性关系良好.
| 氨基酸 | 标准曲线方程 | 相关系数(r) | 线性范围(μg/mL) |
| Glu | Y = 193.56X+5.6532 | 0.99997 | 0.0503-10.06 |
| Gly | Y = 298.82X+11.9073 | 0.99986 | 0.0506-10.13 |
| Tau | Y = 221.08X+3.3768 | 0.99991 | 0.0502-10.05 |
| γ-GABA | Y = 189.33X+8.1744 | 0.99993 | 0.0501-10.03 |
由表2可知, Gly和Tau的浓度对微透析探针的相对回收率有较大影响(P<0.05), 而Glu和γ-GABA的浓度对微透析探针的回收率影响较小(P>0.05), 故脑局部微透析技术可用于Glu和γ-GABA的脑组织液取样.
| 分组 | 体外相对回收率 | F 值 | P值 | ||
| 1:10稀释液 | 1:20稀释液 | 1:50稀释液 | |||
| Glu | 21.686±0.513 | 21.656±1.267 | 21.628±2.478 | 0.002 | 0.9976 |
| Gly | 16.974±0.638 | 14.640±1.370 | 12.494±1.102 | 21.254 | 0.0001 |
| Tau | 26.328±1.301 | 24.030±1.465 | 19.874±0.982 | 33.403 | 0.0000 |
| γ-GABA | 24.564±0.676 | 24.494±1.072 | 24.418±0.962 | 0.032 | 0.9689 |
由表3可知, Glu和γ-GABA浓度对体内相对损失率基本无影响, 可用于在体微透析实验的校正. 取Glu和γ-GABA体内相对损失率校正值RL分别为41.8%、32.5%.
| 分组 | 体内相对损失率 | F 值 | P值 | ||
| 1:10稀释液 | 1:20稀释液 | 1:50稀释液 | |||
| Glu | 41.708±0.410 | 41.880±1.423 | 41.9380±0.986 | 0.163 | 0.8517 |
| γ-GABA | 32.542±0.891 | 32.694±1.386 | 32.8380±0.170 | 0.115 | 0.8924 |
如图2A, B. 结果发现, 与正常组比较, IBS-C、IBS-D组大鼠的Glu和γ-GABA含量均显著升高, 在造模结束后第16天左右达到峰值, 且IBS两亚型之间Glu和γ-GABA含量差异无统计学意义, 两者无明显变化规律. 故取兴奋性氨基酸Glu和抑制性氨基酸γ-GABA比值作为比较, 结果如图2C. 由图2C可以看出, 从造模结束当天到第40天, 与正常组大鼠比较, IBS-C组、IBS-D组大鼠脑内Glu/γ-GABA比值均显著性升高(P<0.05). 造模结束后20 d左右, IBS-C、IBS-D组大鼠Glu/γ-GABA比值均逐渐向正常水平恢复, 提示所建立的动物模型可自我恢复.
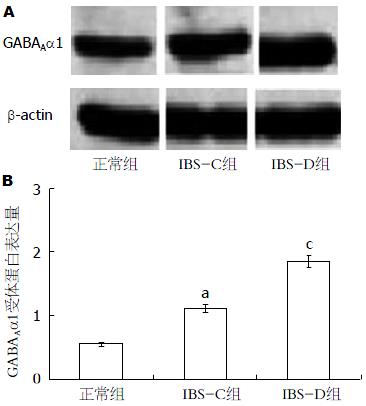
由图3可知, 与正常组大鼠比较, IBS-C组和IBS-D组大鼠脑内GABAAα1蛋白表达显著增加(P<0.05); 与IBS-C组大鼠比较, IBS-D组大鼠脑内GABAAα1蛋白表达显著增加(P<0.05).
大量临床及流行病学调查表明, 精神心理异常与IBS可互为因果, IBS的患者更具有神经质、情绪易激动、不安、焦虑和抑郁[13]等症状. 应激可引起脑内氨基酸水平的改变, 尤其是脑内Glu、γ-GABA与Tau水平的变化[14,15]. 海马组织处于边缘系统, 与情绪反应关系十分密切.
脑微透析液为脑细胞间液, 能准确地反映出神经元的外环境, 相比脑组织匀浆而言排除了突触中未释放的神经递质的影响, 更加准确、真实地反映了递质的释放. 微透析取样技术创伤小, 在动物清醒状态下取样, 排除了麻醉对药物代谢、内分泌等过程的干扰, 更加真实地模拟了病理状态. 此外, 脑微透析技术还具有连续时间点取样, 样品无蛋白干扰, 可直接分析, 减少实验动物数量等优点[16].
目前研究证明脑内γ-GABA与Glu有着密切的关系. 本研究采用脑微透析技术采集脑细胞间液, 采用荧光高效液相色谱法检测其中Glu和γ-GABA含量, 发现Glu和γ-GABA水平均有上调, 不能反映此时中枢以兴奋或抑制占优势, 因此以Glu/γ-GABA值作为评定中枢兴奋或抑制的指标, 结果发现与正常组大鼠相比, IBS-C组大鼠与IBS-D组大鼠海马组织中Glu/γ-GABA值均显著升高. 研究认为γ-GABA能促进或者抑制其他神经递质从而发挥调节胃肠道运动的作用, 而IBS-C时肠道动力功能降低, 而IBS-D时肠道运动加快[17,18], 二者同时表现出腹痛的症状, 结合本实验结果, 推测Glu与γ-GABA的比例失衡, 使得肠道神经功能增强或者减弱, 从而诱发IBS发病的机制.
GABAA受体是γ-GABA三种受体中最为重要的一种, 广泛分布于整个神经系统, 富含于海马和大脑皮质中[19], 在控制神经元兴奋性方面发挥重要作用, 其功能障碍与神经和精神紊乱如抑郁症、失眠、焦虑、癫痫等密切相关[20-23], 是配体门控的氯离子通道, 能够增强或者减弱γ-GABA作用于受体的效能. 且据文献报道, GABAA受体配体能影响生理节律、生育、食欲、食物吸收、运动神经功能、识别和记忆等, GABAAα1受体与镇静和肌肉松弛有密切关系[20,24]. Moloney等[7]研究发现GABAB受体参与早期母婴分离所导致的内脏敏感性升高机制, 其机理与GABAB受体与疼痛反射有关. Sabbatini等[25]证实胃肠道刺激可激活神经元, 从而使脑细胞核中GABAA受体的α1和α2亚型受体差异表达. 本实验通过进一步研究发现, GABAAα1在两种亚型IBS中的表达均有升高, 并且在IBS-D中升高较IBS-C中有明显优势, 提示GABAAα1受体在不同亚型IBS的发病中可能具有重要作用.
中医认为IBS属于"肠郁"范畴, 主张从肝脾论治IBS, 提出IBS-C和IBS-D均可采用疏肝健脾法进行干预和治疗[26], 提示两者之间可能存在着某些共同的物质基础, 其发病上可能存在某些共性机制. 而神经胃肠病学研究发现[27-29], 脑-肠轴在IBS的发病中具有重要地位, 即胃肠道功能受自主神经-肠神经的调控, 而该神经系统通过交感和副交感神经径路与中枢神经连接, 形成一个包含感觉神经元、中间神经元和运动(包括兴奋性和抑制性)神经元的巨大网络, 可通过各种神经递质的释放和传递把内脏与中枢神经系统连接起来. 本研究发现IBS-C、IBS-D大鼠脑内氨基酸神经递质Glu/γ-GABA和GABAAα1受体蛋白均显著升高, 提示可能是外界刺激(应激束缚)或饮食习惯改变(灌胃番泻叶、冰水)引起脑内脑内氨基酸神经递质Glu/γ-GABA和GABAAα1受体蛋白的释放或表达改变, 导致脑-肠轴异常, 从而引起肠道功能紊乱. 但Glu/γ-GABA和GABAAα1受体蛋白是否是IBS-C和IBS-D的共性发病机制, 是否是疏肝健脾法治疗IBS-C、IBS-D的靶点, 尚有待进一步研究.
中医认为肠易激综合征(irritable bowel syndrome, IBS)属于"肠郁"范畴, 主张从肝脾论治IBS, 提出便秘主导型肠易激综合征(IBS with constipation, IBS-C)和腹泻主导型肠易激综合征(IBS with diarrhea, IBS-D)均可采用疏肝健脾法进行干预和治疗, 现代医学认为脑-肠轴可通过各种神经递质的释放和传递把内脏与中枢神经系统连接起来, 从而参与了IBS的发生和发展.
阴赪宏, 研究员, 首都医科大学附属北京友谊医院感染与急救医学
本研究从脑内谷氨酸(glutamate, Glu)、γ-氨基丁酸(γ-aminobutyric acid, γ-GABA)含量及其受体蛋白的表达水平, 采用脑微透析-高效液相色谱(high performance liquid chromatography, HPLC)法动态测定氨基酸递质含量, Western blot法测定γ-GABAA受体α1亚型蛋白的表达量, 探讨上述指标与IBS-C、IBS-D的关系, 为疏肝健脾法干预两种亚型IBS的靶点提供参考.
相关文献报道, GABAA受体配体能影响生理节律、生育、食欲、食物吸收、运动神经功能、识别和记忆等, GABAAα1受体与镇静和肌肉松弛有密切关系. Sabbatini等证实胃肠道刺激可激活神经元, 从而使脑细胞核中GABAA受体的α1和α2亚型受体差异表达.
本研究首次从Glu/γ-GABA的含量变化和GABAAα1受体表达角度探讨IBS-C、IBS-D的共性发病机制, 并采用在体脑微透析法作为样品采集手段, 避免了动物个体差异的干扰.
研究发现, IBS-C、IBS-D大鼠脑内氨基酸神经递质Glu/γ-GABA含量和GABAAα1受体蛋白均显著升高, 提示Glu/γ-GABA含量和GABAAα1受体蛋白可能是两种亚型IBS的共性发病机制, 为疏肝健脾法治疗IBS-C、IBS-D提供了合理的证据.
肠易激综合征(irritable bowel syndrome, IBS): 为一种与胃肠功能改变有关, 以慢性或复发性腹痛、腹泻、排便习惯和大便性状异常为主要症状而又缺乏胃肠道结构或生化异常的综合征.
本文具有一定的创新性.
编辑: 韦元涛 电编:闫晋利
| 1. | Drossman DA. The functional gastrointestinal disorders and the Rome III process. Gastroenterology. 2006;130:1377-1390. [PubMed] [DOI] |
| 3. | Palma-Cerda F, Auger C, Crawford DJ, Hodgson AC, Reynolds SJ, Cowell JK, Swift KA, Cais O, Vyklicky L, Corrie JE. New caged neurotransmitter analogs selective for glutamate receptor sub-types based on methoxynitroindoline and nitrophenylethoxycarbonyl caging groups. Neuropharmacology. 2012;63:624-634. [PubMed] [DOI] |
| 4. | Zinellu A, Sotgia S, Deiana L, Carru C. Analysis of neurotransmitter amino acids by CE-LIF detection in biological fluids. Methods Mol Biol. 2013;919:35-42. [PubMed] [DOI] |
| 5. | Xiong G, Zhang L, Mojsilovic-Petrovic J, Arroyo E, Elkind J, Kundu S, Johnson B, Smith CJ, Cohen NA, Grady SM. GABA and glutamate are not colocalized in mossy fiber terminals of developing rodent hippocampus. Brain Res. 2012;1474:40-49. [PubMed] [DOI] |
| 7. | Moloney RD, O'Leary OF, Felice D, Bettler B, Dinan TG, Cryan JF. Early-life stress induces visceral hypersensitivity in mice. Neurosci Lett. 2012;512:99-102. [PubMed] [DOI] |
| 8. | 唐 洪梅. 肠激安胶囊制剂学及干预腹泻型肠易激综合征机理研究. 广州: 广州中医药大学 2007; . |
| 12. | O'Donnell LJ, Virjee J, Heaton KW. Detection of pseudodiarrhoea by simple clinical assessment of intestinal transit rate. BMJ. 1990;300:439-440. [PubMed] |
| 18. | Posserud I, Ersryd A, Simrén M. Functional findings in irritable bowel syndrome. World J Gastroenterol. 2006;12:2830-2838. [PubMed] |
| 21. | Seifi M, Brown JF, Mills J, Bhandari P, Belelli D, Lambert JJ, Rudolph U, Swinny JD. Molecular and Functional Diversity of GABA-A Receptors in the Enteric Nervous System of the Mouse Colon. J Neurosci. 2014;34:10361-10378. [PubMed] [DOI] |
| 22. | Loddenkemper T, Talos DM, Cleary RT, Joseph A, Sánchez Fernández I, Alexopoulos A, Kotagal P, Najm I, Jensen FE. Subunit composition of glutamate and gamma-aminobutyric acid receptors in status epilepticus. Epilepsy Res. 2014;108:605-615. [PubMed] [DOI] |
| 23. | Matsuura K, Nakamura-Hirota T, Takano M, Otani M, Kadoyama K, Matsuyama S. Proteomic analysis of time-dependent changes in proteins expressed in mouse hippocampus during synaptic plasticity induced by GABAA receptor blockade. Neurosci Lett. 2013;555:18-23. [PubMed] [DOI] |
| 24. | Heldt SA, Ressler KJ. Amygdala-specific reduction of alpha1-GABAA receptors disrupts the anticonvulsant, locomotor, and sedative, but not anxiolytic, effects of benzodiazepines in mice. J Neurosci. 2010;30:7139-7151. [PubMed] [DOI] |
| 25. | Sabbatini M, Molinari C, Grossini E, Piffanelli V, Mary DA, Vacca G, Cannas M. GABAA receptors expression pattern in rat brain following low pressure distension of the stomach. Neuroscience. 2008;152:449-458. [PubMed] [DOI] |
| 28. | Alonso C, Vicario M, Pigrau M, Lobo B, Santos J. Intestinal barrier function and the brain-gut axis. Adv Exp Med Biol. 2014;817:73-113. [PubMed] [DOI] |
| 29. | Julio-Pieper M, O'Connor RM, Dinan TG, Cryan JF. Regulation of the brain-gut axis by group III metabotropic glutamate receptors. Eur J Pharmacol. 2013;698:19-30. [PubMed] [DOI] |