修回日期: 2013-11-20
接受日期: 2013-12-05
在线出版日期: 2014-01-28
目的: 观察替吉奥(S-1)联合顺铂(cisplatin, DDP)方案(S-1+DDP, SP方案)治疗晚期食管癌的疗效及安全性.
方法: 57例入组患者被随机分为2组, 观察组28例采用替吉奥加顺铂治疗, 替吉奥100 mg/d[体表面积(body surface area, BSA)<1.5 m2者]或120 mg/d(BSA>1.5 m2者), 2次/d于早晚餐后顿服, 连服14 d后停药7 d; DDP 75 mg/m2, 静脉滴注d1-3. 对照组29例采用氟尿嘧啶(flurouracil, 5-FU)联合顺铂(FP方案)治疗, 亚叶酸钙(leucovorin, LV)200 mg/m2, 静脉滴注d1-5, 5-FU 600 mg/m2, 连续静滴d1-5; DDP 75 mg/m2, 静脉滴注d1-3. 以上化疗方案21 d为1个周期, 每2个周期评价疗效. 观察并比较临床疗效、不良反应、疾病进展时间(time to progression, TTP)及生存期(overall survival, OS)等指标.
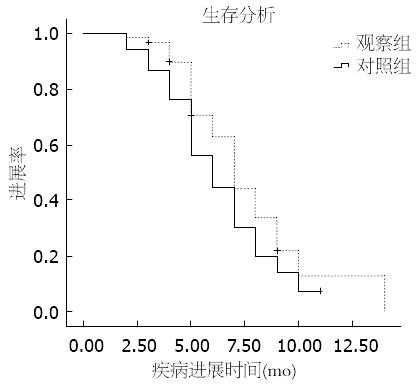
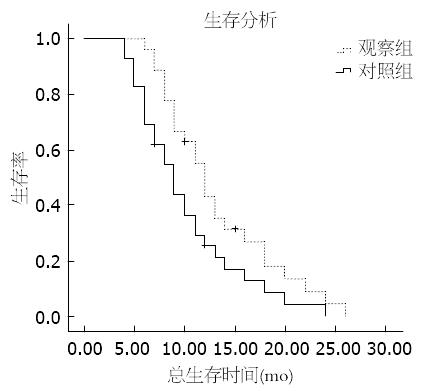
结果: 观察组和对照组总有效率 = 完全缓解(complete remission, CR)+部分缓解(partial remission, PR), 分别为55.6%和27.6%, 两组比较差异有显著性(P<0.05). 临床获益率[CR+PR+疾病稳定(stable disease, SD)]分别为81.5%和55.2%, 两组比较差异有显著性(P<0.05). 不良反应方面观察组血小板减少及肝功能损害的发生率高于对照组, 两组比较差异有显著性(P<0.05), 恶心呕吐、口腔黏膜炎及手足综合征等不良反应差异均无统计学意义. 中位无疾病进展生存时间观察组和对照组分别为7 mo和6 mo; 中位生存时间两组分别为12 mo和9 mo, 差异均有显著性(P<0.05).
结论: 替吉奥联合顺铂治疗晚期食管癌可显著提高近期疗效和延长生存期, 不良反应可耐受, 可替代标准FP方案成为治疗晚期食管癌的首选.
核心提示: 替吉奥联合顺铂治疗晚期食管癌可显著提高近期疗效, 增加生存时间. 同时也增加了血液系统毒性及肝损害的可能, 但绝大部分不良反应以轻中度为主, 且均为可逆性, 患者耐受性好, 依从性高, 临床实用价值高. 为广大临床医师提供了新的选择.
引文著录: 庞丽娜, 王峰, 何炜, 周然, 曹蕾, 樊青霞. 替吉奥或氟尿嘧啶联合顺铂治疗晚期食管癌疗效和安全性的比较. 世界华人消化杂志 2014; 22(3): 383-388
Revised: November 20, 2013
Accepted: December 5, 2013
Published online: January 28, 2014
AIM: To evaluate the efficacy and safety of S-1 plus cisplatin in the treatment of patients with advanced esophagus cancer.
METHODS: Fifty-seven patients with advanced esophagus cancer were randomly divided into either an observation group (n = 28) or a control group (n = 29). The observation group was treated with S-1 capsule 100 mg/d [if the body surface area (BSA) is < 1.5 m2] or 120 mg/d (if the BSA was not less than 1.5 m2), twice daily for 14 d and cisplatin 75 mg/m2 intravenously from days 1-3. The control group was treated with leucovorin (LV) 200 mg/m2 and fluorouracil (5-FU) 600 mg/m2 intravenously from days 1-5, and cisplatin just the same as the observation group. Chemotherapy was repeated every 21 d. Curative effect was evaluated every 2 cycles. Clinical effect, adverse reactions, time to progression (TTP) and overall survival (OS) were observed and compared between the two groups.
RESULTS: The response rate and disease control rate were significantly higher in the observation group than in the control group (55.6% vs 27.6%, P < 0.05; 81.5% vs 55.2%, P < 0.05). The incidences of thrombocytopenia and liver function damage in the observation group were significantly higher than those in the control group (P < 0.05 for both). There were no statistically significant difference in the incidences of nausea and vomiting, oral mucositis or hand-foot syndrome between the two groups. The median TTP and OS were significantly longer in the observation group than in the control group (7 mo vs 6 mo, 12 mo vs 9 mo, P < 0.05 for both).
CONCLUSION: Compared to flurouracil combined with cisplatin, S-1 plus cisplatin can increase short-term effect and prolong survival period in patients with advanced esophagus cancer, and most of the toxicities can be tolerated. S-1 plus cisplatin may become the first choice instead of FP for advanced esophagus cancer.
- Citation: Pang LN, Wang F, He W, Zhou R, Cao L, Fan QX. Efficacy and safety of S-1 or flurouracil combined with cisplatin in treatment of advanced esophagus cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(3): 383-388
- URL: https://www.wjgnet.com/1009-3079/full/v22/i3/383.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i3.383
中国是食管癌的高发国家, 据国际癌症研究署统计, 2008年我国食管癌的新发病比例占世界的53.82%, 同期死亡比例占51.92%[1]. 我国食管癌患者约半数确诊时已是晚期, 治疗为以全身化疗为主的综合治疗[2]. 传统的化疗药物, 如氟尿嘧啶、阿霉素等因不良反应大、缓解周期短等原因使临床使用受限制. 近年来, 新药替吉奥胶囊的问世, 使得结直肠癌、胃癌患者从中获益, 但在食管癌中应用较少, 国内宋子琰等[3]采用吉西他滨联合替吉奥治疗晚期食管癌疗效肯定, 但骨髓抑制发生率较高. 本文为探索晚期食管癌患者在替吉奥联合顺铂方案治疗中是否获益, 对我院2011-01/2011-12收治的晚期食管癌患者57例随机分为观察组和对照组, 观察组28例采用国产替吉奥胶囊联合顺铂顺铂(cisplatin, DDP)方案(S-1+DDP, SP方案)治疗, 对照组29例采用标准方案顺铂联合氟尿嘧啶(DDP+5-FU, FP方案)治疗, 观察并比较两组在临床疗效、不良反应、疾病进展时间(time to progression, TTP)及生存期(overall survival, OS)等指标方面的差异. 现将观察搜集的结果分析报告如下.
晚期食管癌患者57例, 其中男43例, 女14例, 男女比例为3.07:1. 年龄分布范围为36-78岁, 平均年龄为59岁. 病理类型均为鳞癌(表1).
| 临床资料 | 观察组 | 对照组 | P值 |
| 性别 | 0.490 | ||
| 男 | 20 | 23 | |
| 女 | 8 | 6 | |
| 年龄(岁) | 0.689 | ||
| ≤60 | 15 | 14 | |
| >60 | 13 | 15 | |
| 分化程度 | 0.797 | ||
| 高分化 | 9 | 7 | |
| 中分化 | 12 | 14 | |
| 低分化 | 7 | 8 | |
| KPS评分(分) | 0.670 | ||
| ≤80 | 3 | 2 | |
| >80 | 25 | 27 | |
| 既往治疗情况 | 0.672 | ||
| 初治 | 17 | 16 | |
| 复治 | 11 | 13 |
1.2.1 入组标准: (1)经病理学或细胞学诊断确诊的晚期食管癌患者, 具有可测量的肿瘤病灶; (2)KPS评分≥70分; (3)预计生存期>3 mo; (4)血常规、肝肾功能、电解质、心电图、心脏彩超均在正常范围. 无活动性出血、穿孔, 无合并第二肿瘤, 无合并其他化疗禁忌的疾病; (5)复治病例出现复发或转移等进展倾向, 且本次治疗距此前最后一次治疗间隔时间>4 wk.
1.2.2 治疗: 本研究经过我院科研伦理委员会批准, 对所有符合入组条件的患者均事先签署知情同意书, 采用计算机产生随机数的方法随机分为观察组和对照组. 观察组28例采用替吉奥联合顺铂方案, 具体方法为: 体表面积(body surface area, BSA)<1.5 m2者, 替吉奥60、40 mg分别于早晚餐后顿服; BSA>1.5 m2者, 替吉奥60 mg/次, 2次/d, 早晚餐后顿服, 连服14 d后停药7 d. DDP 75 mg/m2, 静脉滴注d1-3. 对照组: DDP 75 mg/m2, 静脉滴注d1-3; 亚叶酸钙(leucovorin, LV) 200 mg/m2, 静脉滴注d1-5, 氟尿嘧啶(flurouracil, 5-FU)600 mg/m2, 连续静滴d1-5. 顺铂应用期间给予水化、碱化及利尿药物应用. 化疗药物应用期间给予地塞米松、苯海拉明、托烷司琼、甲氧氯普胺等药物应用, 以减少可能出现的消化系反应. 治疗期间每周复查血常规、肝肾功能, 若出现Ⅱ度以上的骨髓抑制, 给予粒细胞集落刺激因子或白介素11等生物制剂对症治疗, 白细胞<1.0×109/L、血小板<30×109/L时应停止应用以上化疗药物, 立即给予升血、预防感染及出血等对症治疗. 每周期用药之前均应复查血常规、肝肾功能、电解质、心脏彩超及心电图. 以上化疗方案21 d为1个周期, 每2个周期评价疗效, 具体方法为胸腹部CT、浅表淋巴结彩超、上消化道造影和肿瘤标志物, 评价有效或稳定者化疗4-6个周期. 所有病例均进行安全性评定. 定期随访1年以上, 对失访病例或死亡病例均说明原因.
1.2.3 评价标准: 近期疗效按WHO推荐的实体瘤客观疗效标准分为完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、稳定(stable disease, SD)和疾病进展(progressive disease, PD). 有效率(response rate, RR)为CR+PR, 临床获益率为CR+PR+SD. 不良反应按抗癌药物急性与亚急性毒性表现及分级标准分为0-Ⅳ度.
统计学处理 采用SPSS18.0统计学软件进行数据处理, 计数资料率的比较采用χ2检验, 对于不符合χ2检验标准的则采用Fisher确切概率法. 应用Kaplan-Meier法比较两组的生存期并绘制生存曲线. P<0.05为差异有统计学意义.
观察组及对照组在年龄、性别、病理类型、分化程度及KPS评分等方面差异均无统计学意义, 即基线具有可比性(表1). 另外, 为探讨使用白介素11或粒细胞集落刺激因子等生物制剂对化疗疗效是否产生影响, 将两组患者按使用生物制剂与否分为2组, 并对其进行统计学分析, 结果显示差异没有显著性(P = 0.706>0.05). 57例患者共完成238个周期化疗(平均周期数为4.2). 观察组中1例复诊患者化疗第一周期即出现不可耐受的消化系反应, 主要为持续腹泻, 经积极治疗后症状消失. 但因患者拒绝继续任何治疗于5 mo后死于疾病进展. 观察组中1例患者化疗4周期后出现Ⅳ度骨髓抑制(血小板数目 = 13×109/L), 经纠正后给予S-1减量应用并完成6周期化疗. 余患者均未再出现严重的不良反应.
因观察组中1例患者中断治疗, 故目前可评价近期疗效的病例数为56例(SP组27例, FP组29例). 总有效率(CR+PR)观察组为55.6%, 对照组为27.6%, 两组比较差异有显著性(χ2 = 4.519, P = 0.034<0.05). 临床获益率(CR+PR+SD)观察组为81.5%, 对照组为55.2%, 两组比较差异有显著性(P = 0.035<0.05, 表2).
| 分组 | n | CR | PR | SD | PD | 有效率(%) | 临床获益率(%) |
| 观察组 | 27 | 1 | 14 | 7 | 5 | 55.6 | 81.5 |
| 对照组 | 29 | 0 | 8 | 8 | 13 | 27.6 | 55.3 |
主要不良反应为消化系反应及骨髓抑制. 观察组血小板减少及肝功能损害的发生率高于对照组, 两组比较差异有显著性(P<0.05). 恶心呕吐、口腔黏膜炎、白细胞减少及手足综合征等不良反应两组比较差异均无统计学意义. 不良反应经对症处理或停药后可消失, 均为可逆性反应. 本研究没有化疗相关性死亡事件发生(表3).
| 不良反应 | 观察组(SP方案组) | 对照组(FP方案组) | P值 | ||||
| 0度 | I-II | III-IV | 0度 | I-II | III-IV | ||
| 恶心呕吐 | 6 | 19 | 3 | 4 | 21 | 4 | 0.775 |
| 口腔黏膜炎 | 17 | 9 | 2 | 13 | 11 | 5 | 0.398 |
| 腹泻 | 20 | 7 | 1 | 16 | 10 | 3 | 0.396 |
| 白细胞减少 | 11 | 13 | 4 | 9 | 17 | 3 | 0.696 |
| 血小板减少 | 12 | 14 | 2 | 22 | 6 | 1 | 0.025 |
| 肝功能损害 | 15 | 13 | 0 | 23 | 6 | 0 | 0.039 |
| 手足综合征 | 16 | 11 | 1 | 16 | 13 | 0 | 0.790 |
| 色素沉着 | 9 | 14 | 5 | 7 | 16 | 6 | 0.850 |
全身化疗自六七十年代开始应用于食管癌治疗以来, 现已成为该疾病重要的治疗手段[4]. 目前认为治疗晚期食管癌的一线方案为顺铂联合5-FU[5]; FP方案具有有效率低、中位生存期短及不良反应大等劣势[6]; 主要原因为5-FU静脉滴注半衰期较短, 从而大大影响了抗肿瘤效果; 为增加其作用时间临床上常采用持续滴注的方式, 但也因此出现了不良反应大、实际采用受限制等的难题. 故目前寻找安全有效的替代方案是迫切需要解决的问题. 替吉奥作为一种口服氟尿嘧啶衍生物类抗肿瘤复方制剂, 其主要成分为替加氟(Tegafur, FT)、吉美嘧啶(Gimeracil, CDHP)和奥替拉西(Potassium oxonate, Oxo). FT口服吸收后经细胞色素P-450酶转化成活性产物氟尿嘧啶, CDHP通过抑制其分解代谢中的二氢嘧啶脱氢酶而延长药物体内作用时间, 而Oxo通过阻断氟尿嘧啶的磷酸化而使其集中分布于胃肠道. 同时有研究表明, Oxo还具有降低氟尿嘧啶引起的胃肠道不良反应的作用[7-10]. 另外口服给药方式简便易行, 患者易于接受. 实验研究表明FT的化疗指数是FU的2倍, 毒性则是FU的1/7-1/4[11]. 由此可见, 替吉奥已经从理论上成功克服了静脉滴注氟尿嘧啶的上述不足.
本临床试验结果显示, FP方案组有效率为27.6%, 临床获益率为55.3%, 中位无疾病进展生存期为6 mo, 中位生存时间为9 mo, 结果与既往文献报道的相近[12,13]. SP方案组有效率为55.6%, 临床获益率为81.5%, 中位无疾病进展生存期为7 mo, 中位生存时间为12 mo, 以上数据均较对照组有显著的增加, 且差异均具有统计学意义, 表明替吉奥联合顺铂治疗晚期食管癌可显著提高近期疗效和生存期. 不良反应方面, 两组主要不良反应均为消化系反应与骨髓抑制, 且大多为轻到中度. 两组在消化系反应、手足综合征及色素沉着等不良反应方面比较差异均无显著性, 提示SP方案组不增加以上不良反应. 消化系反应的出现主要与使用顺铂有关, 另外, 部分患者术后消化系重建, 复治患者多次内科治疗史也可能加重消化系反应. 但SP方案组血小板下降程度较对照组加重, 且差异具有显著性, 这可能与口服给药时间长、作用持久有关. 肝功能损害较对照组亦有所增加, 且差异具有统计学意义. 原因或为吉美嘧啶抑制其分解代谢酶活性, 导致氟尿嘧啶灭活减少, 蓄积于肝脏产生肝损害[14]. 另外或与部分患者同时患有脂肪肝、肝炎或肝转移相关. 故广大临床工作者使用SP方案时应注意监测血象和肝功能, 以防化疗相关性事件的发生.
本研究采用随机对照的实验方法, 入组患者在年龄、性别、病理类型、分化程度及KPS评分等方面均具有可比性. 观察组和对照组患者在使用白介素11或粒细胞集落刺激因子等生物制剂与否方面差异无统计学意义(P = 0.706>0.05), 提示差异没有显著性, 不会对本研究结果造成干扰, Saitoh等[15]观察了单用白介素11及其联用3种抗癌药物时对肺癌细胞增殖的影响, 结果显示白介素11可成功防治血小板减少而不改变化疗药物的抗癌活性. 上述各方面均尽可能减少了实验误差或偏移, 增加了结果的可信度.
总之, 替吉奥联合顺铂治疗晚期食管癌可显著提高近期疗效, 增加生存时间. 同时也增加了血液系统毒性及肝损害, 但绝大部分不良反应以轻中度为主, 且均为可逆性, 患者耐受性好, 依从性高, 临床实用价值高. 可替代FP方案成为治疗晚期食管癌的首选方案.
我国食管癌患者约半数确诊时已是晚期, 治疗以全身化疗为主的综合治疗. 传统的化疗药物因不良反应大、缓解周期短等原因使临床使用受限制. 替吉奥使结直肠癌、胃癌患者从中获益, 但在食管癌中研究应用较少.
姜春萌, 教授, 主任, 大连医科大学附属第二医院消化科
目前替吉奥成为食管癌内科治疗的研究热点, 本文对比标准治疗方案顺利联合氟尿嘧啶, 新药替吉奥联合顺铂治疗晚期食管癌取得更显著的近期疗效, 同时也增加了生存时间, 且不良反应可耐受.
Shirasaka详实报道了口服化疗药物替吉奥胶囊的临床应用价值及前景. 国内宋子琰等采用吉西他滨联合替吉奥治疗晚期食管癌疗效肯定, 但骨髓抑制发生率较高, 且未设计平行对照组.
本文在前人的基础上结合临床实践, 采用随机对照实验的方法进行研究, 观察组和对照组除治疗方案不同之外, 一般情况均具有可比性, 使得结果更加详实可信. 同时更为新药替吉奥在食管癌中的应用提供了科学依据.
本研究表明替吉奥联合顺铂治疗晚期食管癌可显著提高近期疗效和延长生存期, 不良反应可耐受, 可替代标准氟尿嘧啶联合顺铂方案成为治疗晚期食管癌的首选.
本文通过对替吉奥或氟尿嘧啶联合顺铂治疗晚期食管癌的比较, 显示出替吉奥联合顺铂治疗晚期食管癌的显著疗效及良好的安全性. 对于晚期食管癌的内科治疗具有重要的实际意义, 为扩大新药替吉奥的应用范围有重要的探索价值.
编辑: 郭鹏 电编:鲁亚静
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | van Meerten E, Eskens FA, van Gameren EC, Doorn L, van der Gaast A. First-line treatment with oxaliplatin and capecitabine in patients with advanced or metastatic oesophageal cancer: a phase II study. Br J Cancer. 2007;96:1348-1352. [PubMed] |
| 5. | Yamazaki K, Hironaka S, Boku N, Yasui H, Fukutomi A, Yoshino T, Onozawa Y, Hasuike N, Inui T, Yamaguchi Y. A retrospective study of second-line chemotherapy for unresectable or recurrent squamous cell carcinoma of the esophagus refractory to chemotherapy with 5-fluorouracil plus platinum. Int J Clin Oncol. 2008;13:150-155. [PubMed] [DOI] |
| 7. | Shirasaka T. Development history and concept of an oral anticancer agent S-1 (TS-1): its clinical usefulness and future vistas. Jpn J Clin Oncol. 2009;39:2-15. [PubMed] [DOI] |
| 8. | Koizumi W, Boku N, Yamaguchi K, Miyata Y, Sawaki A, Kato T, Toh Y, Hyodo I, Nishina T, Furuhata T. Phase II study of S-1 plus leucovorin in patients with metastatic colorectal cancer. Ann Oncol. 2010;21:766-771. [PubMed] [DOI] |
| 9. | Yoshisue K, Hironaga K, Yamaguchi S, Yamamoto A, Nagayama S, Kawaguchi Y. Reduction of 5-fluorouracil (5-FU) gastrointestinal (GI) toxicity resulting from the protection of thymidylate synthase (TS) in GI tissue by repeated simultaneous administration of potassium oxonate (Oxo) in rats. Cancer Chemother Pharmacol. 2000;46:51-56. [PubMed] [DOI] |
| 10. | Yoshisue K, Masuda H, Matsushima E, Ikeda K, Nagayama S, Kawaguchi Y. Tissue distribution and biotransformation of potassium oxonate after oral administration of a novel antitumor agent (drug combination of tegafur, 5-chloro-2,4-dihydroxypyridine, and potassium oxonate) to rats. Drug Metab Dispos. 2000;28:1162-1167. [PubMed] |
| 11. | Diaz-Canton E, Pazdur R. Preoperative combined oral UFT plus leucovorin and radiation therapy for rectal cancer. Oncology (Williston Park). 1997;11:58-60. [PubMed] |
| 12. | Enzinger PC, Ilson DH, Kelsen DP. Chemotherapy in esophageal cancer. Semin Oncol. 1999;26:12-20. [PubMed] |
| 13. | Bleiberg H, Conroy T, Paillot B, Lacave AJ, Blijham G, Jacob JH, Bedenne L, Namer M, De Besi P, Gay F. Randomised phase II study of cisplatin and 5-fluorouracil (5-FU) versus cisplatin alone in advanced squamous cell oesophageal cancer. Eur J Cancer. 1997;33:1216-1220. [PubMed] [DOI] |
| 15. | Saitoh M, Taguchi K, Momose K, Suga K, Yamazaki N, Ono C, Suzuki T, Takeuchi O, Yasuda S, Miyata K. Recombinant human interleukin-11 improved carboplatin-induced thrombocytopenia without affecting antitumor activities in mice bearing Lewis lung carcinoma cells. Cancer Chemother Pharmacol. 2002;49:161-166. [PubMed] [DOI] |