修回日期: 2013-11-11
接受日期: 2013-11-19
在线出版日期: 2014-01-28
目的: 探讨内镜窄带成像技术(narrow-band imaging, NBI)对诊断Barrett食管(Barrett's esophagus, BE)伴特殊肠上皮化生(specialized intestinal metaplasia, SIM)的临床应用价值.
方法: 选择2012-01/2012-12经胃镜检查诊断为内镜BE的患者47例, 按普通内镜、NBI顺序进行观察, 对图像的清晰度进行比较; 放大观察BE黏膜的腺管开口形态及浅表毛细血管结构形态, 并对腺管开口形态进行Goda分型, 于改变最显著部位取活检进行病理检查, 将诊断结果与最终病理诊断结果进行对比分析, 统计SIM检出率.
结果: 两者对鳞-柱状上皮交界处病变轮廓、BE黏膜的腺管开口形态及毛细血管结构的显示有统计学差异, NBI明显优于普通内镜. NBI下根据Goda分型, 其Ⅳ型及Ⅴ型检出SIM的准确性、敏感性及特异性分别达92%、85%及94%.
结论: NBI对病变轮廓、BE黏膜腺管开口及浅表毛细血管结构形态显示更加清晰, 能提高SIM的检出率, 具有良好的临床实用价值.
核心提示: 本研究对Barrett食管(Barrett's esophagus, BE)病灶在普通白光模式及内镜窄带成像技术(narrow band imaging, NBI)模式下观察, 发现NBI对病变轮廓、BE黏膜腺管开口及浅表毛细血管结构形态显示更加清晰, 能提高特殊肠上皮化生(specialized intestinal metaplasia)的检出率, 且操作简便, 患者痛苦减少, 具有良好的临床实用价值.
引文著录: 齐艳荣, 高建新, 钱晶瑶, 王文静, 贾卫江, 王邦茂. NBI诊断Barrett食管伴特殊肠化生的临床价值. 世界华人消化杂志 2014; 22(3): 371-374
Revised: November 11, 2013
Accepted: November 19, 2013
Published online: January 28, 2014
AIM: To evaluate the role of narrow-band imaging (NBI) endoscopy in diagnosis of specialized intestinal metaplasia (SIM) in Barrett's esophagus (BE).
METHODS: From January to December 2012, a total of 47 patients endoscopically diagnosed with BE were enrolled. They underwent both ordinary endoscopy and NBI endoscopy. The image quality of the two kinds of endoscopies was compared. The pit patterns and capillary forms of BE were observed by narrow-band imaging system with magnifying endoscopy (NBI-ME). The BE mucosal pit pattern was classified based on Goda type and biopsies from the abnormal regions were taken. The detection rate of SIM was calculated.
RESULTS: Visualization of squamo-columnar epithelium and observation of pit patterns and epithelium capillary by NBI were much clearer than by ordinary endoscopy. The accuracy, sensitivity and specificity of NBI based on Goda type for diagnosis of SIM were 92%, 85% and 94%, respectively.
CONCLUSION: NBI can not only capture the optimal images of BE, but also show the pit pattern and capillary form. NBI can improve the detection rate of SIM.
- Citation: Qi YR, Gao JX, Qian JY, Wang WJ, Jia WJ, Wang BM. Narrow-band imaging endoscopy for diagnosis of specialized intestinal metaplasia in Barrett's esophagus. Shijie Huaren Xiaohua Zazhi 2014; 22(3): 371-374
- URL: https://www.wjgnet.com/1009-3079/full/v22/i3/371.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i3.371
Barrett食管(Barrett's esophagus, BE)是由英国胸外科医生Norman Barrett于1950年首先报告提出, 并以他的名字命名. BE是指食管下段的复层鳞状上皮被单层柱状上皮替代的一种病理现象, 伴或不伴肠上皮化生, 而特殊肠上皮化生(specialized intestinal metaplasia, SIM)属于食管腺癌(esophagcal adenocarcinoma, EAC)的癌前病变. 随着EAC发病率的逐年升高, 做为其明确危险因素的BE伴SIM的发病率也呈上升趋势[1]. 因此早期发现早期干预对降低EAC的发病率具有重要意义[2].
内镜窄带成像技术(narrow band imaging, NBI)是一种近年来使用的新兴内镜下成像诊断技术, 本研究对内镜诊断为BE的患者先后行普通内镜模式及NBI模式进行观察, 并与病理结果对比, 旨在探讨NBI在BE伴SIM诊断中的临床应用价值.
选择2012-01/2012-12经胃镜检查诊断为BE患者47例, 其中男30例, 女17例, 年龄23-70岁, 中位年龄51岁. 根据BE形态分型: 岛型(39处), 舌型(16处), 全周型(1处). 所有患者均采用日本奥林巴斯公司生产的OLYMPUS GIF-H260Z放大内镜及CV-260SL电子处理器和CLV-260SL NBI氙气冷光源系统进行检查.
1.2.1 术前准备: 检查前禁食6-8 h, 向患者详细了解病史及检查原因, 解释操作过程, 尽量消除患者的紧张心理, 所有患者均签署特殊检查知情同意书. 排除标准: 食管狭窄、食管下段癌、贲门癌累及食管下段及贲门癌术后等. 进镜前常规服用盐酸利多卡因胶浆10 mL做咽喉部局部麻醉.
1.2.2 操作步骤: 患者由一名高年资内镜医师进行操作, 首先完成普通胃镜全程检查, 记录结果并保存图像. 完毕后将内镜置于食管下端鳞-柱状上皮交界处, 按照普通内镜模式、NBI模式进行观察: (1)BE与正常食管交界处, 对图像清晰度进行评分; (2)放大观察BE腺管开口形态与毛细血管结构, 顺序为: 普通内镜放大、窄带成像联合放大内镜(narrow band imaging system with magnifying endoscopy, NBI-ME); (3)对BE上皮的腺管开口进行分型, 于改变最异常的部位进行定向取检, 与病理结果进行对比.
1.2.3 对图像的评价: 由操作医师和另一名内镜医师共同对图片进行分析, 对鳞-柱状上皮交界处轮廓、BE病灶腺管开口形态、毛细血管结构清晰度进行评分: 看不清: 1分; 模糊可见: 2分; 较清晰: 3分; 非常清晰: 4分. 腺管开口类型采用Goda分型[3]. BE黏膜的腺管开口形态及毛细血管结构形态分为5型: 1型圆点或椭圆形, 2型为长分支形, 3型为指状或叶片状绒毛样形, 4型为脑回形, 5型为不规则形. 血管形态分为Ⅰ-Ⅴ型: Ⅰ型为蜂窝状, Ⅱ型为藤状, Ⅲ型为卷曲状, Ⅳ型为常青藤型, Ⅴ型为不规则形.
1.2.4 常规内镜BE诊断标准: 食管胃交界处齿状线明显上移或消失, 即食管黏膜被橘红色柱状上皮黏膜代替. 其形态可为全周型、舌型和岛型. 经病理学证实, 活检组织中存在柱状上皮即可确诊BE[4].
统计学处理 统计分析采用SPSS13.0统计软件进行分析, 统计学方法采用χ2检验, P<0.05为差异有统计学意义.
NBI与普通内镜图像相比, 两者对鳞-柱状上皮交界处病变轮廓、BE黏膜的腺管开口形态及毛细血管结构的显示差异有统计学意义(P<0.01), NBI明显优于普通内镜(表1).
| 观察项目及检查方法 | 1分 | 2分 | 3分 | 4分 | 总分 |
| 鳞柱状上皮交界处 | |||||
| 普通内镜 | 3 | 24 | 20 | 0 | 111 |
| 内镜窄带成像技术 | 0 | 0 | 3 | 44 | 185 |
| 腺管开口形态 | |||||
| 普通内镜放大 | 6 | 41 | 0 | 0 | 88 |
| 窄带成像联合放大内镜 | 0 | 0 | 23 | 24 | 165 |
| 毛细血管结构 | |||||
| 普通内镜放大 | 3 | 43 | 1 | 0 | 92 |
| 窄带成像联合放大内镜 | 0 | 0 | 23 | 24 | 165 |
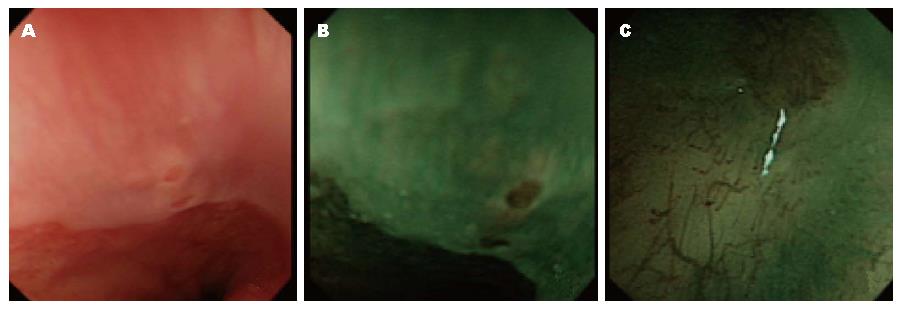
根据BE黏膜形态可分为岛型、舌型和全周型, 47例由普通内镜模式诊断为BE患者, 发现56处病灶, 其中岛型39处, 舌型16处, 全周型1处; 而转换为NBI模式后, 发现了78处病灶, 其中岛型58处, 舌型19处, 全周型1处. 在不同类型的病灶中, 岛型病灶在NBI模式下的检出率明显高于普通内镜(P<0.05), 且清晰度明显高于普通内镜模式(图1).
根据Goda分型将BE上皮腺管开口分为5型, 47例BE患者中Ⅰ型6例, Ⅱ型11例, 这两型中均未发现SIM, Ⅲ型17例, 其中2例病理检出SIM, Ⅳ型8例, 病理检出SIM6例, Ⅴ型5例, 病理证实均存在SIM, 结果显示Ⅳ型及Ⅴ型腺管开口检出SIM的准确性为92%, 特异性及敏感性分别为94%及85%, 阳性预测值、阴性预测值分别为85%、94%, 阳性似然比、阴性似然比分别为14.4和0.
BE病理分为3型: 胃底型、贲门型和肠上皮化生型. 而特殊肠化生型(SIM)又称为Ⅲ型肠化生或不完全小肠化生型, 表面有微绒毛和隐窝, 杯状细胞是其特征性细胞. 多项研究显示, BE伴SIM与EAC关系密切, 是与EAC高度相关的癌前病变[5,6]. 我国是食管癌的高发区, 其中鳞状细胞癌约占90%, 少数为EAC, 后者多起源于BE或食管异位胃黏膜的柱状上皮[7]. BE作为一种公认的癌前病变, 其EAC发生率较正常人高30-50倍[8]. 近年来, 在一些西方国家, 胃贲门部及食管下段腺癌的发病率明显增加, 病死率高, 且预后极差, 其5年生存仅为13%左右[9,10]. 研究发现, BE癌变通常经历SIM-低度异型增生-高度异型增生-原位癌-浸润性腺癌[11,12]. 故早期诊治BE伴SIM至关重要.
长期以来把常规内镜加病理活检, 做为诊断BE的主要方法, 传统的四象限活检法是诊断和监测BE的主要标准[13]. 但此法存在取材部位盲目、活检数目过多、重复活检后出血影响视野观察等缺点, 从而影响其活检的精确度, 且随机取样, 存在取样误差, 故诊断价值有限[14]. 为提高BE检出率, 以往还经常采用色素内镜检查, 如复方碘溶液染色, 但因碘溶液含乙醇, 会刺激黏膜, 可能导致胸骨后疼痛、不适、化学性食管炎、喉炎、支气管肺炎[15], 而且对于食管入口、颈段食管及下咽部均无法应用碘染色观察, 因而它的应用受到限制. 而NBI则无上述弊端.
NBI利用滤光器对红、绿、蓝3种不同波长的光进行窄化, 仅留下415、540和600 nm波长的窄带光波, 使光线主要集中在黏膜表层, 降低了光的散射, 使图像更加清晰. 由于血红蛋白吸收的波长在415 nm左右, 所以蓝光可以很好地被血红蛋白吸收, 从而能更清晰地显示消化道黏膜表面的微细腺管形态及微血管形态[16]. NBI内镜自2004年被Kuznetsov等[17]首次用于BE诊断以来, 其在诊断BE方面的优势日渐明显. NBI操作简便, 通过一个按钮即可与普通内镜进行模式转换. 在本研究中, 我们对47例BE患者进行普通内镜及NBI模式观察, 通过对比发现, NBI模式对鳞柱状上皮交界处轮廓的清晰度明显优于普通内镜, NBI-ME能更清晰观察到BE黏膜腺管开口形态及浅表毛细血管结构形态, 具有绝对优势, 指导镜下靶向活检, 明显提高BE伴SIM的检出率, Ⅳ型及Ⅴ型腺管开口检出SIM的准确性为92%, 特异性及敏感性分别为94%及85%. 这与Singh等[18]通过前瞻对照研究得出的结论相似. 另据Singh等[19]文献报道, NBI-ME对重度异型增生及早期癌变病灶的识别也具优势, 其敏感性可达94%-100%, 而特异性为76%-99%, 此类病灶会出现腺管开口形态和毛细血管结构形态的不规则改变.
总之, NBI不需染料即可实现对病变部位的"电子染色", 无色素内镜的合并症, 能更清晰地显示黏膜表面形态和微血管结构, 结合放大功能对病变的微细结构进行更细致的观察, 进一步提高了BE伴SIM的检出率, 在临床实践中势必会得到越来越广泛的应用. 本研究的病例数较少, 且为开放性研究, 尚需进一步的样本量更大、设计更加良好的研究予以证实. 目前国内NBI, 尤其是NBI-ME的临床应用时间相对较短, 缺乏大规模的临床随机对照试验, 且NBI-ME下BE的血管形态分类尚无统一标准, 其临床价值尚需进一步大样本研究.
近年来, 食管腺癌发病率逐年上升, 预后差, Barrett食管(Barrett's esophagus, BE)伴特殊肠上皮化生(specialized intestinal metaplasia, SIM)作为其公认的癌前病变, 越来越受到关注, 如何早期发现及干预成为研究热点. 内镜窄带成像技术(narrow band imaging, NBI)做为一种新兴技术, 在临床中显示出了优越性, 有望成为替代传统四象限法的方法之一.
戈之铮, 教授, 上海交通大学医学院附属仁济医院消化科
本文研究提示NBI对BE病变轮廓、黏膜腺管开口及浅表毛细血管结构形态显示更加清晰, 能进一步提高BE伴SIM的检出率. 但目前国内NBI, 尤其是NBI-ME的临床应用时间相对较短, 缺乏大规模的临床随机对照试验, 且NBI-ME下BE的血管形态分类尚无统一标准, 其临床价值尚需进一步大样本研究.
NBI内镜自2004年被Hamamoto等首次用于BE诊断以来, 其在诊断BE方面的优势日渐明显. 许多文献报道了NBI对BE诊断的优越性. 另外, 也有一些文献报道了FICE、复方碘染色、乙酸染色等检查对BE的诊断价值.
本文详细阐述了BE的分型及镜下表现, 尤其是BE伴SIM, NBI模式显示了其优越性, 提高了临床对该病的认识, 对提高检出率, 降低食管腺癌(esophagcal adenocarcinoma)发病率起到积极作用.
编辑: 田滢 电编:鲁亚静
| 1. | Zhang Y. Epidemiology of esophageal cancer. World J Gastroenterol. 2013;19:5598-5606. [PubMed] [DOI] |
| 3. | Goda K, Tajiri H, Ikegami M, Urashima M, Nakayoshi T, Kaise M. Usefulness of magnifying endoscopy with narrow band imaging for the detection of specialized intestinal metaplasia in columnar-lined esophagus and Barrett's adenocarcinoma. Gastrointest Endosc. 2007;65:36-46. [PubMed] [DOI] |
| 5. | Wu X, Ajani JA, Gu J, Chang DW, Tan W, Hildebrandt MA, Huang M, Wang KK, Hawk E. MicroRNA expression signatures during malignant progression from Barrett's esophagus to esophageal adenocarcinoma. Cancer Prev Res (Phila). 2013;6:196-205. [PubMed] [DOI] |
| 6. | De Palma GD. Management strategies of Barrett's esophagus. World J Gastroenterol. 2012;18:6216-6225. [PubMed] [DOI] |
| 9. | Wang KK, Sampliner RE. Updated guidelines 2008 for the diagnosis, surveillance and therapy of Barrett's esophagus. Am J Gastroenterol. 2008;103:788-797. [PubMed] [DOI] |
| 10. | Switzer-Taylor V, Schlup M, Lübcke R, Livingstone V, Schultz M. Barrett's esophagus: a retrospective analysis of 13 years surveillance. J Gastroenterol Hepatol. 2008;23:1362-1367. [PubMed] [DOI] |
| 11. | Zhang HY, Spechler SJ, Souza RF. Esophageal adenocarcinoma arising in Barrett esophagus. Cancer Lett. 2009;275:170-177. [PubMed] [DOI] |
| 12. | Pohl H, Wrobel K, Bojarski C, Voderholzer W, Sonnenberg A, Rösch T, Baumgart DC. Risk factors in the development of esophageal adenocarcinoma. Am J Gastroenterol. 2013;108:200-207. [PubMed] [DOI] |
| 13. | Ajumobi A, Bahjri K, Jackson C, Griffin R. Surveillance in Barrett's esophagus: an audit of practice. Dig Dis Sci. 2010;55:1615-1621. [PubMed] [DOI] |
| 14. | Yantiss RK. Diagnostic challenges in the pathologic evaluation of Barrett esophagus. Arch Pathol Lab Med. 2010;134:1589-1600. [PubMed] [DOI] |
| 15. | Ide E, Carneiro FO, Frazão MS, Chaves DM, Sallum RA, de Moura EG, Sakai P, Cecconello I, Maluf-Filho F. Endoscopic Detection of Early Esophageal Squamous Cell Carcinoma in Patients with Achalasia: Narrow-Band Imaging versus Lugol's Staining. J Oncol. 2013;2013:736756. [PubMed] [DOI] |
| 16. | Savarino E, Corbo M, Dulbecco P, Gemignani L, Giambruno E, Mastracci L, Grillo F, Savarino V. Narrow-band imaging with magnifying endoscopy is accurate for detecting gastric intestinal metaplasia. World J Gastroenterol. 2013;19:2668-2675. [PubMed] [DOI] |
| 17. | Kuznetsov K, Lambert R, Rey JF. Narrow-band imaging: potential and limitations. Endoscopy. 2006;38:76-81. [PubMed] [DOI] |
| 18. | Singh R, Karageorgiou H, Owen V, Garsed K, Fortun PJ, Fogden E, Subramaniam V, Shonde A, Kaye P, Hawkey CJ. Comparison of high-resolution magnification narrow-band imaging and white-light endoscopy in the prediction of histology in Barrett's oesophagus. Scand J Gastroenterol. 2009;44:85-92. [PubMed] [DOI] |
| 19. | Singh R, Mei SC, Sethi S. Advanced endoscopic imaging in Barrett's oesophagus: a review on current practice. World J Gastroenterol. 2011;17:4271-4276. [PubMed] [DOI] |