修回日期: 2014-08-22
接受日期: 2014-09-03
在线出版日期: 2014-10-18
目的: 讨论从延龄草总皂苷中分离获得的重楼皂苷Ⅵ(polyphyllin Ⅵ, PPLⅥ)对结肠炎相关的结肠癌发生的影响及其机制.
方法: 将♂5周龄ICR小鼠50只, 随机分为5组: 模型组、3个给药组和对照组. 模型组与给药组小鼠腹腔注射15 mg/kg的1,2-二甲肼(1,2-dimethylhydrazine, DMH). 1 wk后, 饮用2%右旋葡聚糖苷钠(dextran sodium sulfate, DSS)蒸馏水溶液1 wk, 间隔1 wk后, 再次饮用2%DSS蒸馏水溶液1 wk. 第9周时, 给药组小鼠通过腹腔注射给予PPLⅥ(2.5、5.0、10.0 mg/kg), 1次/3 d. 20 wk乙醚麻醉, 处死所有小鼠, 收集小鼠肠道样本, 用于病理学检测及Western blot实验.
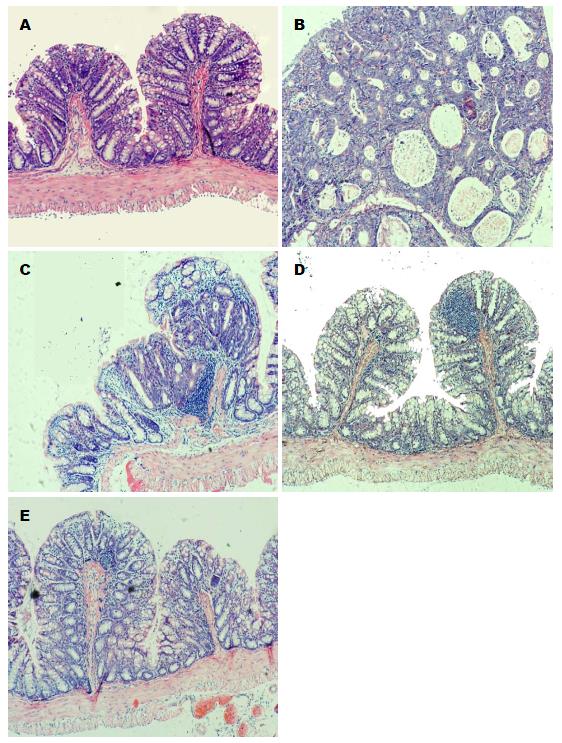
结果: HE染色显示: 模型组中, 90%的小鼠肠道发生结肠腺癌和/或结肠腺瘤. PPLⅥ治疗各组, 小鼠结/直肠肿瘤发生率依次下降为: 40%、20%与10%. PPLⅥ可促进小鼠肠道黏膜活化型Caspase3, 9及Bax的表达, 降低Bc1-2的表达, 且均呈剂量依赖性.
结论: PPLⅥ能有效地预防小鼠结肠炎癌变. 其可能机制是PPLⅥ通过线粒体途径诱导小鼠肠道细胞凋亡.
核心提示: 从延龄草总皂苷中分离获得重楼皂苷Ⅵ(polyphyllin Ⅵ, PPLⅥ), 观察到PPLⅥ能有效预防1,2-二甲肼/右旋葡聚糖苷钠(1,2-dimethylhydrazine/dextran sodium sulfate, DMH/DSS)诱导的结肠炎相关的结肠癌发生; 可能机制与其诱导DMH/DSS处理后的异常肠道黏膜细胞发生线粒体途径的凋亡有关.
引文著录: 李志泉, 陈晓艳, 岳正刚, 周慧萍, 陈永春, 熊春四, 郑洪南, 李宇华. 重楼皂苷Ⅵ预防结肠炎癌变的作用及机制. 世界华人消化杂志 2014; 22(29): 4393-4398
Revised: August 22, 2014
Accepted: September 3, 2014
Published online: October 18, 2014
AIM: To investigate the effect of polyphyllin Ⅵ (PPLⅥ) on colitis associated colorectal carcinogenesis in mice and the underlying mechanisms.
METHODS: Fifty male Institute of Cancer Research (ICR) mice were randomly divided into five groups: a model group, three PPLⅥ-treated groups and a control group. The mice in the model group and three PPLⅥ-treated groups were given a single intraperitoneal injection of 1,2-dimethylhydrazine (DMH) at a dose of 15 mg/kg body weight. One week later, the mice were treated with 2% (w/v) dextran sodium sulfate (DSS) in their drinking water for 1 wk. This was followed by no further treatment for 1 wk. After another 1 wk of 2% DSS treatment, normal water was given for an additional 15 weeks. At week 9, the mice in PPLⅥ-treated groups were intraperitoneally injected with PPLⅥ (2.5, 5.0 and 10.0 mg/kg, respectively) every 3 d, for 12 wk. All mice were sacrificed at week 20 by ether overdose and colon samples were collected for histopathological examinations and Western blot analysis.
RESULTS: HE staining showed that the incidence of tumor formation was 90% in the mice treated with DMH/DSS; it decreased to 40% (4/10), 20% (2/10), and 10% (1/10) in mice treated with DMH/DSS plus 2.5, 5.0 and 10.0 mg/kg of PPLⅥ, respectively. PPLⅥ treatment increased the expression of cleaved Caspase3, Caspase9 and Bax and decreased the expression of Bcl-2 in colonic epithelial cells.
CONCLUSION: PPLⅥ can inhibit DMH/DSS-induced colon tumor formation in ICR mice partly through inducing apoptosis of abnormal colonic epithelial cells via the intrinsic pathway of apoptosis.
- Citation: Li ZQ, Chen XY, Yue ZG, Zhou HP, Chen YC, Xiong CS, Zheng HN, Li YH. Polyphyllin Ⅵ inhibits colitis associated colorectal carcinogenesis in mice: Possible mechanisms. Shijie Huaren Xiaohua Zazhi 2014; 22(29): 4393-4398
- URL: https://www.wjgnet.com/1009-3079/full/v22/i29/4393.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i29.4393
结/直肠癌是最为常见的恶性肿瘤之一. 2013年, 在美国, 其发病率及死亡率均位居肿瘤发病率和死亡率的第3位[1]. 近年来, 由于国人饮食结构的日渐西化, 结/直肠癌的发病率也呈逐年升高趋势: 已经成为我国发病率第4位, 死亡率第5位的恶性肿瘤, 其年增长率远超国际水平[2]. 我国南方一些发达城市, 例如上海, 其死亡率已跃居恶性肿瘤死亡率的第2位. 结/直肠癌的发生、发展与结肠炎症的反复发作密切相关[3-6]. 因此, 寻找高效低毒的结肠癌预防、治疗药物具有重要意义.
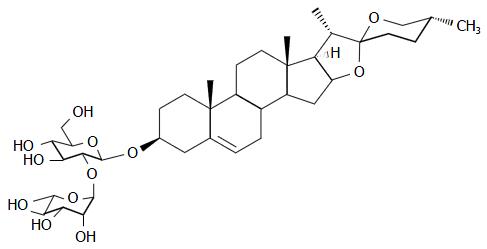
从天然产物中寻找抗肿瘤药物是药物研发的热点. 延龄草(Trillium tschonoskii Maxim.)是传统的名贵中药. 主要含甾体皂苷, 有降压、镇痛、溶血作用, 对镇静安神、祛风活血有良效[7-10]. 我们已经发现: 延龄草总皂苷可有效抑制结肠癌细胞的增殖[11]. 为进一步阐明延龄草总皂苷抗肿瘤的机制, 我们对延龄草总皂苷进行了分离提取、纯化、鉴定和筛选, 得到了单体皂苷: 重楼皂苷Ⅵ(polyphyllin Ⅵ, PPLⅥ), 采用结肠炎相关的结肠癌模型对观察其结肠癌的预防作用.
50只5周龄♂ICR小鼠, 购于上海斯莱克实验动物中心. 小鼠购回后, 5只一组, 饲养于中国人民解放军第四军医大学实验动物中心, 给予自由饮水、饲以普通的颗粒饲料. 饲养环境: 湿度50%±10%, 光照12 h照明, 12 h黑暗交替, 温度23 ℃±2 ℃. 适应饲养7 d后, 按照体质量被随机分为4个实验组和1个对照组. 1,2-二甲肼(1,2-dimethylhydrazine, DMH)购于Sigma公司; 右旋葡聚糖苷钠(dextran sodium sulfate, DSS), 相对分子质量为36000-50000, 购于美国MP公司. Caspase3, 9抗体(CST公司), Bcl-2、Bax、β-actin抗体(Santa Cruz公司). Caspase3活性检测试剂盒(碧云天生物有限公司).
1.2.1 PPLⅥ的提取: 提取步骤参见本实验室文献[12], 简述如下: 延龄草干燥根及根茎20 kg, 经体积分数为700 mL/L的乙醇水溶液加热回流提取3次, 每次2 h, 减压回收溶剂得醇提浸膏; 将醇提浸膏加适量水分散, 经D101大孔吸附树脂柱, 依次用体积分数为0、200、600、950 mL/L的乙醇水溶液洗脱, 减压浓缩得各部位浸膏, 其60%部位浸膏经硅胶柱色谱凝胶SephadexLH-20柱色谱ODS柱色谱中低压液相色谱及高效液相色谱, 分离得到化合物PPLⅥ(图1).
1.2.2 小鼠结肠癌模型复制: 造模方法参照文献[13-16], 简述如下: 用生理盐水配置终浓度为1.5 g/L、pH 6.5的DMH溶液. 实验组小鼠单次腹腔注射15 mg/kg的DMH. 1 wk后令实验组小鼠连续饮用2%DSS纯水溶液1 wk, 间隔1 wk(饮用正常普通饮水). 上述2 wk为一个DSS处理循环, 一共重复2次. 正常对照组用生理盐水代替DMH溶液腹腔注射1次, 饮用水为不含DSS的纯水. 第9周时, 将4个实验组随机分为: 1个模型组和3个治疗组. PPLⅥ腹腔注射给药, 每隔3 d给药1次, 给药剂量分别为: 2.5、5.0和10.0 mg/kg. 在整个造模和给药过程中密切观察并记录小鼠的便血、脱肛数.
1.2.3 采集标本: 在第20周时采用乙醚麻醉法处死所有小鼠, 打开腹腔, 截取其从肛门到回盲部的所有大肠. 纵向剖开整个肠道, 用PBS溶液冲洗干净. 从肛门上方3 cm处截取4 cm长度的结肠标本, 置于40 g/L多聚甲醛溶液中固定. 将固定好的样本石蜡包埋后切片, 用于组织学检测. 将剩余结肠组织的黏膜用玻片小心刮下后迅速置于液氮中速冻, 保存于-80 ℃低温冰箱中, 以备Western blot检测以及Caspase3活性测定.
1.2.4 蛋白提取及检测: 将小鼠肠道黏膜加入RIPA(含PMSF蛋白酶抑制剂)细胞裂解液后匀浆提取总蛋白, 用Bio-Rad酶标仪进行蛋白定量. 蛋白变性后进行聚丙烯酰胺凝胶电泳, 转膜. NC膜用5%脱脂牛奶室温封闭3 h, 加一抗Caspase3(1:500)、Caspase9(1:500)、Bc1-2(1:500)、Bax(1:500)、β-actin(1:1000)室温孵育30 min, 后4 ℃过夜, TBST洗膜后加1:5000稀释的相应HRP标记二抗室温孵育1 h, TBST及TBS洗膜后, 进行化学发光.
1.2.5 Caspase3活性检测: 按照说明书步骤操作: 每3-10 mg组织加入100 µL裂解液的比例加入裂解液, 在冰浴上用玻璃匀浆器匀浆. 然后把匀浆液转移到1.5 mL离心管中, 冰浴再裂解5 min. 4 ℃ 16000-20000 g, 离心10-15 min. 把上清转移到冰浴预冷的离心管中. 立即测定Caspase3的酶活性.
统计学处理 采用SPSS17.0统计软件中的单因素方差分析(ANOVA)以及χ2检验进行数据统计, P<0.05示差异具有统计学意义.
所有DMH/DSS处理的ICR小鼠在造模过程中均出现稀便体征. 如表1所示: 第3周和第6周时, DMH/DSS处理后小鼠的血便率分别为60%(24/40)和50%(20/40); 在第9周和第15周时, DMH/DSS模型组小鼠的脱肛率分别为60%(6/10)和80%(8/10). 给予小鼠PPLⅥ腹腔注射治疗后, 第15周时小鼠的脱肛率显著降低, 分别为40%、30%和10%. 在第20周处死小鼠, 解剖后肉眼观察可见: DMH/DSS模型组小鼠结肠中末端出现了息肉状新生物. 而PPLⅥ治疗组小鼠结肠虽然可见不同程度的黏膜红肿, 但仅有部分小鼠肠道发生息肉状增生.
肠道组织病理切片染色后镜下观察可见: DMH/DSS模型组肠道黏膜细胞核分裂象明显, 腺体排列紊乱, 增生明显(图2). 而PPLⅥ治疗各组, 肿瘤发生率分别降至40%(4/10)、20%(2/10)与10%(1/10). 病理切片显示: 黏膜层有程度不等的淋巴细胞浸润, 黏膜下层发生程度不等的增生, PPLⅥ能将小鼠肠道有效控制在炎症状态(图2).
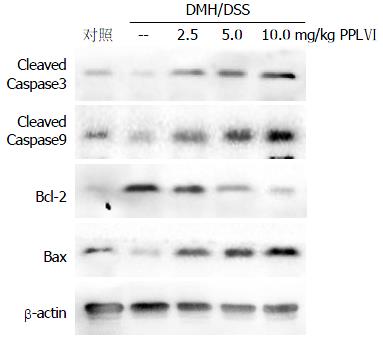
如图3所示, 与正常对照组相比, DMH/DSS模型组小鼠肠道黏膜中活化Caspase3, 9及Bax明显降低, Bcl-2明显升高. 而PPLⅥ治疗后, 活化的Caspase3, 9及Bax的表达增加, 活化的Caspase8无显著变化(未展示), 而Bc1-2的表达减弱.
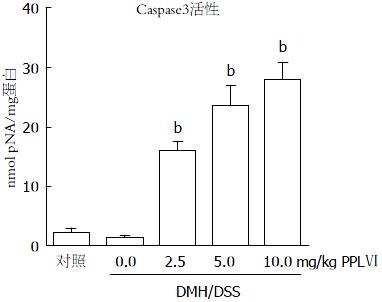
Caspase3活性检测结果(图4)与Western blot结果相符. 提示: PPLⅥ可诱导Caspase3依赖的线粒体途径(内部途径)凋亡.
本实验中, 我们发现PPLⅥ能有效抑制DMH/DSS引起的结肠炎癌变, 模型组中, 90%的小鼠肠道发生结肠腺癌和/或结肠腺瘤. 腹腔注射给予2.5、5.0及10.0 mg/kg的PPLⅥ, 小鼠结/直肠肿瘤发生率依次下降为: 40%、20%与10%. 且多数肠道病理表现为淋巴细胞浸润, 黏膜层、黏膜下层增生等急性、慢性炎症特征性改变.
细胞凋亡对于维持机体的正常生理功能具有重要意义, 体内衰老或是分裂异常的细胞可以通过凋亡机制被清除, 反之, 当凋亡调控机制失调时, 体内异常细胞不能被及时清除并逐渐积累, 就可能诱发恶性肿瘤. 研究表明, 细胞凋亡调控紊乱是结肠癌发生发展的重要原因[17,18]. 因此, 我们刮取小鼠肠道黏膜, 采用Caspase3活性检测试剂盒以及Western blot方法, 观察PPLⅥ是否通过诱导凋亡发挥结肠炎癌变的预防作用. 结果显示PPLⅥ可剂量依赖性地增加DMH/DSS处理小鼠肠道黏膜细胞中Caspase3的活性. 引起细胞凋亡的途径主要有三条: 线粒体途径、内质网信号途径和细胞表面死亡受体途径[19]. 细胞凋亡途径之间相互联系、相互作用, 共同参与了细胞的凋亡过程. 在所有细胞凋亡途径中, 线粒体是凋亡启动的"主开关" [20].
Caspases, 是细胞凋亡重要的调节因子. Caspase9主要参与线粒体途径, 而Caspase8则主要参与死亡受体途径的调节, 两者在激活后均能引起下游通路的Caspase3活化, 进而降解细胞骨架蛋白和核蛋白[21,22], Caspase9在线粒体程序化死亡信号的作用下切割激活后, 可对执行酶Caspase3进行切割并激活. PPLⅥ可剂量依赖性地增加DMH/DSS处理小鼠肠道黏膜细胞中cleaved-Caspase3和cleaved-Caspase9蛋白表达量(cleaved-Caspase8未发生明显变化, 数据未提供). 表明PPLⅥ可能通过依赖于Caspases的程序化死亡途径诱导肿瘤细胞凋亡.
线粒体介导的细胞凋亡过程中, Bcl-2蛋白家族具有重要的调控作用. 研究发现Bcl-2蛋白家族表达量异常可能是影响癌症包括结肠癌发生发展的重要因素之一[23-30]. 在肿瘤细胞中, 抗凋亡蛋白Bcl-2的表达量升高而促凋亡蛋白Bax表达量下降, 导致肿瘤细胞对促凋亡刺激因素的反应性下降. 在给予PPLⅥ处理后, 肠道黏膜细胞中抗凋亡蛋白Bcl-2的表达量下降而促凋亡蛋白Bax的表达量上升, 且呈剂量依赖性, 说明PPLⅥ诱导肿瘤细胞凋亡的作用与其影响Bcl-2蛋白家族抗凋亡和促凋亡蛋白的比例有关.
据此我们推测PPLⅥ预防DMH/DSS诱导的结肠炎相关的结肠癌发生的原因之一与其诱导DMH/DSS处理后的异常肠道黏膜细胞发生线粒体途径的凋亡有关. PPLⅥ具体的作用及相关机制尚需进一步研究, 不过, 上述数据部分解释了延龄草总皂苷具有抑制结肠癌细胞增殖的作用, 同时提示: PPLⅥ具有预防结肠炎癌变的作用.
结/直肠癌是最为常见的恶性肿瘤之一. 近年来, 由于国人饮食结构的日渐西化, 结/直肠癌的发病率也呈逐年升高趋势: 已经成为我国发病率第4位, 死亡率第5位的恶性肿瘤, 其年增长率远超国际水平. 寻找高效低毒的结肠癌预防、治疗药物具有重要意义.
刘宝林, 教授, 中国医科大学附属盛京医院
从天然产物中寻找抗肿瘤药物是药物研发的热点. 延龄草是传统的名贵中药. 主要含甾体皂苷, 有降压、镇痛、溶血作用, 对镇静安神、祛风活血有良效.
研究者们观察到: 延龄草皂苷可以有效抑制肺癌、乳腺癌等肿瘤细胞的增殖. 我们前期的研究发现: 延龄草总皂苷可有效抑制结肠癌细胞的增殖, 对正常肠道上皮细胞无明显毒性..
我们观察到从延龄草总皂苷中分离的重楼皂苷Ⅵ(polyphyllin Ⅵ, PPLⅥ)能有效预防1,2-二甲肼/右旋葡聚糖苷钠(1,2-dimethylhydrazine/dextran sodium sulfate, DMH/DSS)诱导的结肠炎相关的结肠癌发生. 可能机制与其诱导DMH/DSS处理后的异常肠道黏膜细胞发生线粒体途径的凋亡有关.
为延龄草总皂苷的结肠癌细胞增殖抑制作用提供了物质基础, 同时提示: PPLⅥ具有预防结肠炎癌变的作用. 为延龄草在结肠癌预防中的使用提供依据.
课题选题合理, 结合临床实际, 设计科学合理, 研究手段先进, 数据分析可靠, 结论可信, 是一篇较好的研究课题.
编辑: 郭鹏 电编:都珍珍
| 1. | Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin. 2014;64:9-29. [PubMed] [DOI] |
| 2. | Sung JJ, Lau JY, Goh KL, Leung WK. Increasing incidence of colorectal cancer in Asia: implications for screening. Lancet Oncol. 2005;6:871-876. [PubMed] [DOI] |
| 11. | 周 慧萍, 岳 正刚, 李 志泉, 梅 其炳, 陈 晓艳, 陈 永春, 孙 阳, 李 宇华. 延龄草总皂苷抑制结肠癌细胞增殖作用及机制研究. 华南国防医学杂志. 2013;5:310-312. |
| 13. | Tanaka T, Kohno H, Suzuki R, Yamada Y, Sugie S, Mori H. A novel inflammation-related mouse colon carcinogenesis model induced by azoxymethane and dextran sodium sulfate. Cancer Sci. 2003;94:965-973. [PubMed] [DOI] |
| 14. | Kim JH, Hue JJ, Kang BS, Park H, Nam SY, Yun YW, Kim JS, Lee BJ. Effects of selenium on colon carcinogenesis induced by azoxymethane and dextran sodium sulfate in mouse model with high-iron diet. Lab Anim Res. 2011;27:9-18. [PubMed] [DOI] |
| 15. | Kohno H, Suzuki R, Sugie S, Tanaka T. Beta-Catenin mutations in a mouse model of inflammation-related colon carcinogenesis induced by 1,2-dimethylhydrazine and dextran sodium sulfate. Cancer Sci. 2005;96:69-76. [PubMed] [DOI] |
| 16. | 李 宇华, 刘 莉, 冯 娟, 王 庆伟, 孙 阳, 曹 蔚, 王 志鹏, 张 蓉, 刘 振国, 梅 其炳. 一种结肠炎相关的结肠癌模型的复制. 世界华人消化杂志. 2007;3:234-239. |
| 17. | Zeestraten EC, Benard A, Reimers MS, Schouten PC, Liefers GJ, van de Velde CJ, Kuppen PJ. The prognostic value of the apoptosis pathway in colorectal cancer: a review of the literature on biomarkers identified by immunohistochemistry. Biomark Cancer. 2013;5:13-29. [PubMed] [DOI] |
| 18. | Wu WK, Wang XJ, Cheng AS, Luo MX, Ng SS, To KF, Chan FK, Cho CH, Sung JJ, Yu J. Dysregulation and crosstalk of cellular signaling pathways in colon carcinogenesis. Crit Rev Oncol Hematol. 2013;86:251-277. [PubMed] [DOI] |
| 19. | Debatin KM. Apoptosis pathways in cancer and cancer therapy. Cancer Immunol Immunother. 2004;53:153-159. [PubMed] [DOI] |
| 20. | 林 其谁. 线粒体与细胞凋亡. 生物化学与生物物理学报. 1999;31:8-10. |
| 21. | Khan N, Afaq F, Mukhtar H. Apoptosis by dietary factors: the suicide solution for delaying cancer growth. Carcinogenesis. 2007;28:233-239. [PubMed] [DOI] |
| 22. | Green DR, Kroemer G. The pathophysiology of mitochondrial cell death. Science. 2004;305:626-629. [PubMed] [DOI] |
| 23. | Koehler BC, Scherr AL, Lorenz S, Urbanik T, Kautz N, Elssner C, Welte S, Bermejo JL, Jäger D, Schulze-Bergkamen H. Beyond cell death - antiapoptotic Bcl-2 proteins regulate migration and invasion of colorectal cancer cells in vitro. PLoS One. 2013;8:e76446. [PubMed] [DOI] |
| 24. | Hector S, Prehn JH. Apoptosis signaling proteins as prognostic biomarkers in colorectal cancer: a review. Biochim Biophys Acta. 2009;1795:117-129. [PubMed] |
| 25. | Krajewska M, Krajewski S, Epstein JI, Shabaik A, Sauvageot J, Song K, Kitada S, Reed JC. Immunohistochemical analysis of bcl-2, bax, bcl-X, and mcl-1 expression in prostate cancers. Am J Pathol. 1996;148:1567-1576. [PubMed] |
| 26. | Krajewska M, Moss SF, Krajewski S, Song K, Holt PR, Reed JC. Elevated expression of Bcl-X and reduced Bak in primary colorectal adenocarcinomas. Cancer Res. 1996;56:2422-2427. [PubMed] |
| 27. | Krajewski S, Blomqvist C, Franssila K, Krajewska M, Wasenius VM, Niskanen E, Nordling S, Reed JC. Reduced expression of proapoptotic gene BAX is associated with poor response rates to combination chemotherapy and shorter survival in women with metastatic breast adenocarcinoma. Cancer Res. 1995;55:4471-4478. [PubMed] |
| 28. | Krajewski S, Chatten J, Hanada M, Reed JC. Immunohistochemical analysis of the Bcl-2 oncoprotein in human neuroblastomas. Comparisons with tumor cell differentiation and N-Myc protein. Lab Invest. 1995;72:42-54. [PubMed] |
| 29. | Kroemer G, Galluzzi L, Brenner C. Mitochondrial membrane permeabilization in cell death. Physiol Rev. 2007;87:99-163. [PubMed] [DOI] |