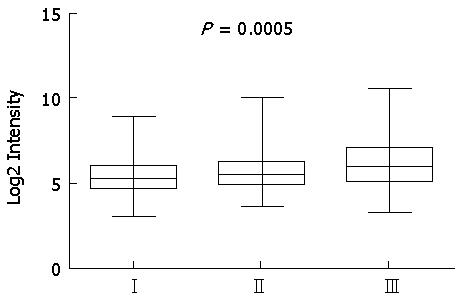修回日期: 2014-07-11
接受日期: 2014-07-28
在线出版日期: 2014-08-28
目的: 通过基因表达汇编(Gene Expression Omnibus, GEO)公共数据库, 探讨6-磷酸果糖激酶2(6-phosphofructo-2-kinase, PFKFB3)在肝细胞癌中的表达情况, 并进一步探索其与肝细胞癌临床病理特征的关系, 评价PFKFB3对肝细胞癌术后患者预后评价的意义, 预测PFKFB3推动肝细胞癌发展的机制.
方法: 检索、下载美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)的肿瘤公共数据集, 对表达谱资料及临床信息进行分析; 利用基因集富集分析(gene set enrichment analysis, GSEA)方法, 分析受PFKFB3调控的相关基因.
结果: PFKFB3在高T分期肿瘤中高表达(P<0.05); 在不同年龄、谷丙转氨酶(alanine transaminase, ALT)、肿瘤大小、肿瘤结节数目、T分期、肝细胞癌巴塞罗那分期(Barcelona Clinic Liver Cancer stage, BCLC stage)、意大利肝细胞癌项目分期(Cancer Liver Italian Program stage, CLIP stage)的肝细胞癌患者中, PFKFB3的表达均有显著性差异(P<0.05); PFKFB3的表达状态与肝细胞癌患者术后的总体生存和复发相关(P<0.05); PFKFB3高表达样本富集了与细胞增殖、抗凋亡、代谢相关的基因集.
结论: PFKFB3与肝细胞癌多个病理指标相关, 且可以做为潜在的判断肝细胞癌患者预后的标志物和治疗肿瘤的靶标.
核心提示: 目前研究6-磷酸果糖激酶2(6-phosphof
ructo-2-kinase, PFKFB3)表达与肿瘤患者预后关系的文章非常少, 本文首次利用了生物信息学手段证实PFKFB3与肝细胞癌患者术后预后的关系并初步分析了其可能机制. 不仅对于理解瓦博格效应的意义和机制有一定意义, 还进一步为PFKFB3抑制剂的研发和临床应用提供了依据和参考.
引文著录: 丁千山, 孙荣泽, 王笑臣, 沈世强. 使用GEO数据集分析PFKFB3在肝细胞癌中的表达及临床意义. 世界华人消化杂志 2014; 22(24): 3675-3680
Revised: July 11, 2014
Accepted: July 28, 2014
Published online: August 28, 2014
AIM: To investigate the expression of 6-phosphofructo-2-kinase (PFKFB3) in multiple tumors, to clarify the relationship between PFKFB3 expression and clinicopathological characteristics of hepatocellular carcinoma, and to evaluate the possibility of using PFKFB3 as a prognosis marker in hepatocellular carcinoma.
METHODS: GEO datasets were collected and expression profile and clinical information were analyzed. Gene set enrichment analysis (GSEA) was conducted to explore the gene sets enriched in samples with high PFKFB3 expression.
RESULTS: The expression of PFKFB3 was up-regulated in high grade tumors (P < 0.05). PFKFB3 expression was significantly associated with age, alanine transaminase (ALT), tumor volume, the number of nodules, T stage, Barcelona Clinic Liver Cancer (BCLC) stage and Cancer Liver Italian Program (CLIP) stage. Higher expression of PFKFB3 indicated poor prognosis in hepatocellular carcinoma. GSEA indicated that PFKFB3 regulates gene sets associated with anti-apoptosis, negative regulation of programmed cell death, and positive regulation of cell proliferation and cellular metabolic process.
CONCLUSION: PFKFB3 is highly expressed in multiple tumors and functions as a potential marker and target for diagnosis and treatment of hepatocellular carcinoma.
- Citation: Ding QS, Sun RZ, Wang XC, Shen SQ. Analysis of clinical significance of expression of 6-phosphofructo-2-kinase in hepatocellular carcinoma utilizing GEO datasets. Shijie Huaren Xiaohua Zazhi 2014; 22(24): 3675-3680
- URL: https://www.wjgnet.com/1009-3079/full/v22/i24/3675.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i24.3675
肿瘤细胞的能量代谢不同于正常细胞: 正常情况下, 细胞使用葡萄糖在线粒体内进行氧化磷酸化, 而肿瘤细胞能量代谢的特点是活跃地摄取葡萄糖, 主要通过有氧糖酵解为细胞的生命活动功能, 也就是瓦博格效应(Warburg effect). 低氧是肿瘤微环境的显著特征之一. 低氧诱导因子-1α(hypoxia inducible factor-1, HIF-1α)信号通路在上调有氧糖酵解以适应低氧环境起了重要作用, 其重要途径之一就是通过在转录水平上上调6-磷酸果糖激酶2(6-phosphofructo-2-kinase, PFKFB3)的表达促进葡萄糖的摄入和酵解. 所以PFKFB3的异常表达被认为是导致肿瘤细胞瓦博格效应的重要原因[1]. 虽然有不少研究证实, PFKFB3可以调控肿瘤细胞的增殖和凋亡, 但是其表达水平与肿瘤患者预后的研究还很少. 美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)的基因表达汇编(Gene Expression Omnibus, GEO)计划致力于建立一个基因表达数据仓库和在线资源, 支持公共使用和散布基因表达数据, 用于从任何物种的来源检索基因表达数据, 是生物信息学依赖的重要资源. 本研究通过对GEO公共数据集GSE14520分析, 探索PFKFB3在肝细胞癌预后中的评价作用, 并依靠基因集富集分析(gene sets enrichment analysis, GSEA), 预测在肝细胞癌细胞中可能受PFKFB3调控的基因集, 为进一步研究其在肿瘤发生发展中的作用机制提供线索和思路.
我们从NCBI的GEO数据库(http://www.ncbi.nlm.nih.gov/geo)中下载基因表达谱肝细胞癌样本数据集GSE14520[2]. 上述所有数据集的数据导入dChip软件还原原始芯片扫描图像, 以总荧光强度为中位数的芯片N2为基准进行标准化后, 方进行后续计算和进一步的分析.
1.2.1 数据集筛选和临床相关性研究样本数据分组:GSE14520基因样本量大且附带临床信息. 其中临床资料缺失的样本被排除. 根据表达谱数据, 对样本的PFKFB3的表达进行由高到低排序后, 高于信号log2平均值的样本作为高表达组, 低于信号log2平均值的样本作为低表达组.
1.2.2 GSEA挖掘样本富集基因: 采用GSEA 2.0.14版本进行分析. GSE14520被纳入GSEA. 肿瘤组织样本根据PFKFB3的表达水平被分为高低表达两组, 之后通过GSEA分析PFKFB3的表达水平对各种生物通路基因集的影响. 我们从GSEA网站MsigDB数据库中获得的基因集作为参照基因集, 按default weighted enrichment statistic的方法, 每次分析重复1000次.
1.2.3 作图: 作图软件使用GraphPad Prism 6.
统计学处理 统计学处理软件使用GraphPad Prism 6. 不同T分期中表达量的组件比较采用ANOVA检验; 回顾性研究中, 组间比较采用联列表法, 采用χ2检验; 生存期研究中, Log-rank(Mantel-Cox)法用于生存分析. P<0.05为差异有统计学意义; 在GSEA中, P<0.05及错误发现率(false discovery rates, FDR)<0.25的基因集作为显著富集基因集.
2.1 不同T分期肝细胞癌样本中PFKFB3的表达
我们首先比较了不同美国肿瘤研究联合委员会(American Joint Committee on Cancer, AJCC) T分期中, PFKFB3的表达差异. 在肝细胞癌样本数据集GSE14520中, T分期为Ⅰ、Ⅱ、Ⅲ的肿瘤样本的PFKFB3的表达逐次升高, 且组件有统计学差异(P = 0.0005), 提示PFKFB3的表达与肝细胞癌的进展有关(图1).
2.2 PFKFB3与肝细胞癌的临床病理相关性
我们接下来研究了PFKFB3的表达与肿瘤临床病理资料的相关性, 我们利用GSE14520中的临床资料进行了回顾性分析. 在肝细胞癌样本数据集GSE14520中, 在不同年龄(P = 0.0263)、ALT(P = 0.0092)、肿瘤大小(P = 0.0453)、肿瘤结节数目(P = 0.0150)、T分期(P = 0.0018)、BCLC分期(P = 0.0433)、CLIP分期(P = 0.0009)中, PFKFB3的表达均有显著性差异(表1).
| 病理指标 | n | PFKFB3表达 | χ2值 | P值 | |
| 高 | 低 | ||||
| 年龄(岁) | 4.94 | 0.0263 | |||
| ≤55 | 166 | 73 | 93 | ||
| >55 | 76 | 22 | 54 | ||
| 性别 | 1.24 | 0.2649 | |||
| 男 | 211 | 80 | 131 | ||
| 女 | 31 | 15 | 16 | ||
| AFP(ng/mL) | 2.18 | 0.1396 | |||
| ≤200 | 128 | 45 | 83 | ||
| >200 | 110 | 49 | 61 | ||
| ALT(U/L) | 6.79 | 0.0092 | |||
| ≤50 | 142 | 46 | 96 | ||
| >50 | 100 | 49 | 51 | ||
| 肝硬化 | 0.51 | 0.4753 | |||
| 是 | 223 | 89 | 134 | ||
| 否 | 19 | 6 | 13 | ||
| 肿瘤大小(cm) | 4.01 | 0.0453 | |||
| <5 | 153 | 53 | 100 | ||
| ≥5 | 88 | 42 | 46 | ||
| 结节数目 | 5.91 | 0.0150 | |||
| 单结节 | 190 | 67 | 123 | ||
| 多结节 | 52 | 28 | 24 | ||
| AJCCT分期 | 12.63 | 0.0018 | |||
| T1 | 96 | 26 | 70 | ||
| T2 | 78 | 31 | 47 | ||
| T3 | 51 | 29 | 88 | ||
| BCLC分期 | 6.28 | 0.0433 | |||
| 0 | 20 | 7 | 13 | ||
| A | 152 | 51 | 101 | ||
| B/C | 53 | 28 | 25 | ||
| CLIP分期 | 14.09 | 0.0009 | |||
| 0 | 98 | 25 | 73 | ||
| 1 | 79 | 34 | 45 | ||
| 2-5 | 48 | 27 | 21 | ||
| PRMS分类 | 60.32 | <0.0001 | |||
| 高 | 121 | 77 | 44 | ||
| 低 | 121 | 18 | 103 | ||
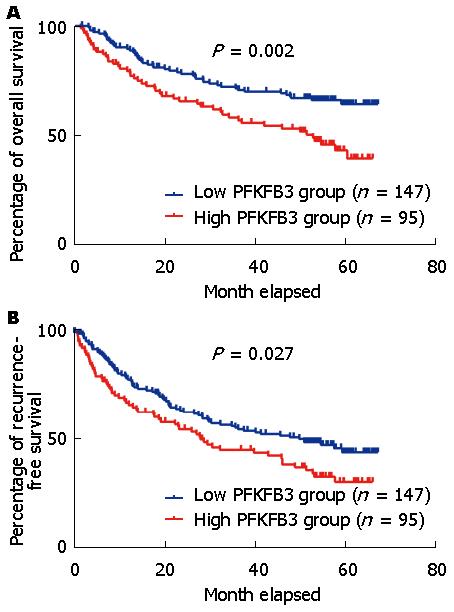
接下来我们又进行了生存期分析以判断PFKFB3是否能作为肿瘤预后的评价分子. 在肝细胞癌样本数据集GSE14520中, PFKFB3高表达组患者和低表达组患者的5年生存率分别为43.659%和64.523%, Log-rank = 9.652, P = 0.002(图2A). 5年无病生存率分别为30.715%和44.083%, Log-rank = 4.897, P = 0.027(图2B). 以上结果说明PFKFB3的高表达与肝细胞癌患者术后早期死亡和早期复发有关.
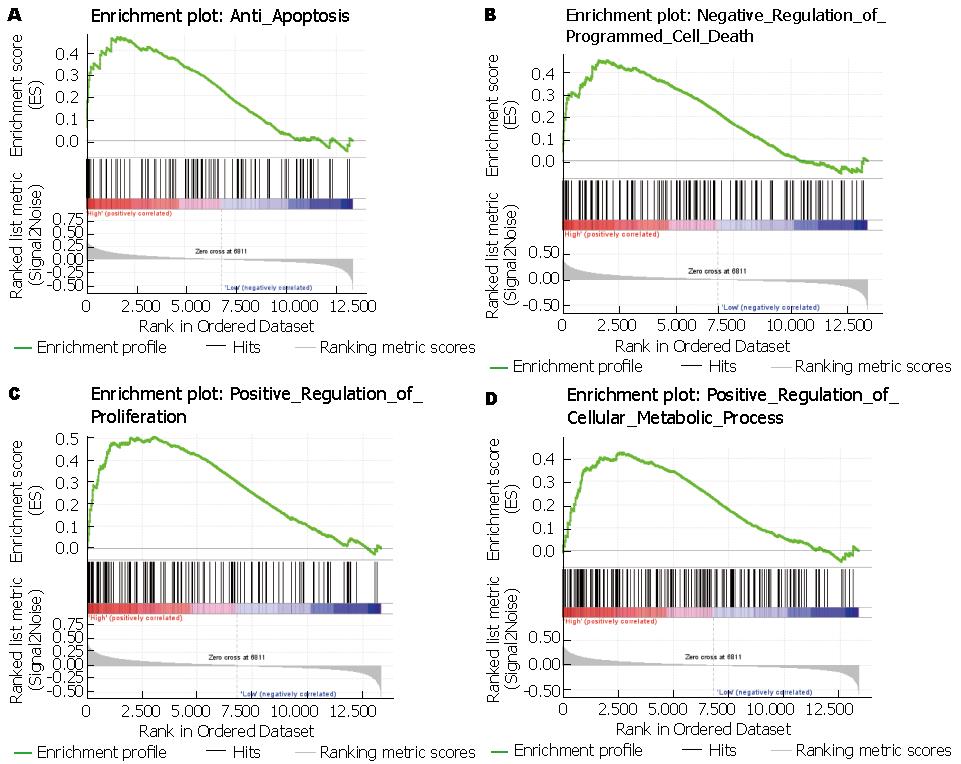
明确PFKFB3与肝细胞癌的临床相关性之后, 我们继而对PFKFB3推动肿瘤发生的可能机制进行的初步探究. 我们利用肝细胞癌样本数据集GSE14520, 使用GSEA方法, 分析PFKFB3的表达水平对各种生物通路基因集的影响. 我们使用"curated genes sets"作为参照基因集, 可见PFKFB3高表达的肿瘤样本富集了与抗凋亡、促进细胞增殖、正向调节细胞代谢强度的基因(图3A), 说明PFKFB3高表达肿瘤细胞对凋亡信号有更强的抵抗力, 有更高的增殖潜力, 代谢更加旺盛. 说明PFKFB3可能通过调节肿瘤的增殖和耐药等方式, 影响肿瘤的发生和发展.
PFKFB3是一种能够激活磷酸果糖激酶1(phosphofructo kinase-1)的酶, 可以促进果糖形成果糖2,6-二磷酸的形成. 由于磷酸果糖激酶1是糖酵解过程的限速酶, 所以PFKFB3被认为对于调解细胞糖代谢具有重要意义. PFKFB3的启动子区域包含着低氧反应元件(hypoxia response element, HRE), 可以与HIF-1α结合, 在低氧条件下PFKFB3的表达因而得以上调. 由于PFKFB3在糖代谢中的重要作用, 其由低氧导致的过表达被认为是肿瘤效应瓦博格效应的重要原因[3,4].
PFKFB3表达、活性异常导致的代谢异常, 会造成肿瘤细胞的不同表型. 如PFKFB3在关键氨基酸位置的甲基化, 可以稳定PFKFB3的结构和功能, 若甲基化降低, 则会造成PFKFB3泛素化依赖途径的降解, 进而导致肿瘤细胞的糖代谢由糖酵解转化为磷酸戊糖途径, 伴随着肿瘤细胞对氧化应激和抗肿瘤药物的敏感性增强[5]. 而肿瘤细胞在过度增殖过程中, 常常产生过量的活性氧自由基(reactive oxygen species, ROS), 若过量ROS不能及时清除, 将破坏肿瘤细胞的氧化还原稳态. 有研究证实PFKFB3在维持这一稳态过程中扮演了重要角色: ROS可以通过对PFKFB3第206的半胱氨酸进行蛋白质谷胱甘肽化(S-glutathionylation), 这种共价的、可逆的修饰, 使得PFKFB3的催化活性显著下降, 进而导致肿瘤细胞的糖代谢由糖酵解转化为磷酸戊糖途径, 引起谷胱甘肽的水平增加, 从而最终消耗掉ROS. 这一负反馈机制确保了肿瘤细胞在旺盛的代谢下也能保持氧化还原稳态的稳定[6].
除了能影响肿瘤细胞的糖代谢, PFKFB3本身也是众多癌相关蛋白重要的上游或者下游分子: 如细胞外信号调节激酶(extracellular signal regulated kinase, ERK)/核糖体S6激酶(ribosomal S6 kinase, RSK)的激活不仅会导致PFKFB3的转录活性增高, 还会导致PFKFB6在461位丝氨酸的磷酸化, 使得其活性增强[7]; 肿瘤细胞在外界应激下, 可以通过早期的PFKFB3基因转录增强, 激活p38/MK2信号通路[8]; 雌二醇可以促进雌激素受体阳性的肿瘤的发展, 雌二醇可以激活雌激素受体, 后者可以从转录水平上增强PFKFB3的表达, 而PFKFB3表达的增加可以导致后续的葡萄糖摄入和糖酵解的增强, 从而推动乳腺癌的发展[9].
也正因为上述原因, PFKFB3被认为是肿瘤治疗的潜在靶标. 使用siRNA干扰PFKFB3的表达, 伴随着糖酵解的下降, 果糖2,6-二磷酸、乳酸、ATP的水平下降, 肿瘤细胞的增殖减慢, 细胞周期出现阻滞, 凋亡细胞比例增加[10]. 有研究单位合成了PFKFB3的抑制性化合物N4A和YN1, 这两种化合物可以抑制糖酵解过程, 诱导肿瘤细胞凋亡[11]. 另一个研究单位合成的特异性抑制剂PFK15在细胞实验和动物实验中都表现出了良好的抗增殖特性, 并且已经于2013年进入一期的临床试验[12]. 更有意义的是, 抑制PFKFB3并不仅限于影响肿瘤细胞的增殖和凋亡: 通过设计药物拮抗血管内皮生长因子(vascular endothelial growth factor, VEGF)从而抑制肿瘤血管形成是肿瘤治疗的新思路, 但是这类药物的应用并不顺利. 而有研究报道, 小分子化合物3-(3-pyridinyl)-1-(4-pyridinyl)-2-propen-1-one (3PO)可以通过抑制PFKFB3, 造成Notch信号通路的活性下降, 使得内皮细胞的增殖和迁移被抑制, 进而阻遏血管生成[13,14].
虽然PFKFB3在肿瘤治疗领域的研究已经开展已有多年, 但是其在肿瘤预后评价中的研究还十分少. 之前有研究报道, 在高级别星形细胞瘤中, PFKFB3的表达水平更高, 剪接变异体UBI2K4的表达水平下降[15,16]. 但是在其他肿瘤中, PFKFB3的表达与肿瘤病理指标、患者预后的研究尚未见报道.
本研究利用GEO数据集, 结合生物信息学, 证实PFKFB3在高T分期肿瘤样本中表达更高; 在不同年龄、ALT、肿瘤大小、肿瘤结节数目、T分期、BCLC分期、CLIP分期的肝细胞癌患者中, 其表达均有显著性差异; PFKFB3高表达的肝细胞癌患者术后复发更快、生存期更短. 以上结果证实了PFKFB3在肝细胞癌中可以作为评价临床预后的指标. 另外我们还证实, PFKFB3高表达的肿瘤样本富集了与细胞抗凋亡、细胞增殖和代谢相关的基因, 提示PFKFB3可能通过影响肝细胞癌细胞的耐药、增殖和代谢组, 推动了肝细胞癌的发生发展.
肿瘤的特征性的代谢变化一直是肿瘤学研究的热点. 肿瘤细胞的瓦博格效应(Warburg effect)的意义和机制直到今天也未完全阐明. 6-磷酸果糖激酶2(6-phosphofructo-2-kinase, PFKFB3)的表达促进葡萄糖的摄入和酵解. 所以PFKFB3的异常表达被认为是导致肿瘤细胞瓦博格效应的重要原因.
程树群, 副教授, 中国人民解放军第二军医大学东方肝胆外科医院综合治疗三科
虽然有研究证实PFKFB3在多种肿瘤中都是起促进癌症发生和进展的作用, 并且其特异性的抑制剂可以抑制肿瘤的恶化. 但是大多数实验都是基于细胞水平或者动物模型.
目前研究PFKFB3表达与肿瘤患者预后关系的文章非常少. 之前有研究报道, 在高级别星形细胞瘤中, PFKFB3的表达水平更高. 但是在其他肿瘤中, PFKFB3的表达与肿瘤病理指标、患者预后的研究尚未见报道.
首次利用了生物信息学手段证实PFKFB3与肝细胞癌患者术后预后的关系并初步分析了其可能机制.
PFKFB3与肝细胞患者术后预后的显著相关性, 提示其可以作为协助临床医师判断肝细胞癌患者的肿瘤良恶性. 并且为PFKFB3抑制剂的研发和进一步的临床实验, 提供了新的依据.
基因集富集分析: 一个利用全基因组表达谱数据的分析方法, 他根据已有的对基因的定位性质功能生物学意义, 首先确立了一系列分子标签数据库, 数据库中包含了多个功能基因集, 通过分析一组处于两个生物学状态的基因表达谱杂交数据, 他们在特定的功能基因集中的表达状况, 以及这种表达状况是否存在某种统计学显著性.
本研究通过生物信息学分析, 探索PFKFB3在肝细胞癌预后中的评价作用. 论文有一定新意, 方法正确, 结论可靠.
编辑: 郭鹏 电编:闫晋利
| 1. | Yalcin A, Clem BF, Imbert-Fernandez Y, Ozcan SC, Peker S, O'Neal J, Klarer AC, Clem AL, Telang S, Chesney J. 6-Phosphofructo-2-kinase (PFKFB3) promotes cell cycle progression and suppresses apoptosis via Cdk1-mediated phosphorylation of p27. Cell Death Dis. 2014;5:e1337. [PubMed] [DOI] |
| 2. | Roessler S, Jia HL, Budhu A, Forgues M, Ye QH, Lee JS, Thorgeirsson SS, Sun Z, Tang ZY, Qin LX. A unique metastasis gene signature enables prediction of tumor relapse in early-stage hepatocellular carcinoma patients. Cancer Res. 2010;70:10202-10212. [PubMed] [DOI] |
| 3. | Minchenko A, Leshchinsky I, Opentanova I, Sang N, Srinivas V, Armstead V, Caro J. Hypoxia-inducible factor-1-mediated expression of the 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase-3 (PFKFB3) gene. Its possible role in the Warburg effect. J Biol Chem. 2002;277:6183-6187. [PubMed] [DOI] |
| 4. | Obach M, Navarro-Sabaté A, Caro J, Kong X, Duran J, Gómez M, Perales JC, Ventura F, Rosa JL, Bartrons R. 6-Phosphofructo-2-kinase (pfkfb3) gene promoter contains hypoxia-inducible factor-1 binding sites necessary for transactivation in response to hypoxia. J Biol Chem. 2004;279:53562-53570. [PubMed] [DOI] |
| 5. | Yamamoto T, Takano N, Ishiwata K, Ohmura M, Nagahata Y, Matsuura T, Kamata A, Sakamoto K, Nakanishi T, Kubo A. Reduced methylation of PFKFB3 in cancer cells shunts glucose towards the pentose phosphate pathway. Nat Commun. 2014;5:3480. [PubMed] [DOI] |
| 6. | Seo M, Lee YH. PFKFB3 regulates oxidative stress homeostasis via its S-glutathionylation in cancer. J Mol Biol. 2014;426:830-842. [PubMed] [DOI] |
| 7. | Novellasdemunt L, Obach M, Millán-Ariño L, Manzano A, Ventura F, Rosa JL, Jordan A, Navarro-Sabate A, Bartrons R. Progestins activate 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase 3 (PFKFB3) in breast cancer cells. Biochem J. 2012;442:345-356. [PubMed] [DOI] |
| 8. | Novellasdemunt L, Bultot L, Manzano A, Ventura F, Rosa JL, Vertommen D, Rider MH, Navarro-Sabate À, Bartrons R. PFKFB3 activation in cancer cells by the p38/MK2 pathway in response to stress stimuli. Biochem J. 2013;452:531-543. [PubMed] [DOI] |
| 9. | Imbert-Fernandez Y, Clem BF, O'Neal J, Kerr DA, Spaulding R, Lanceta L, Clem AL, Telang S, Chesney J. Estradiol stimulates glucose metabolism via 6-phosphofructo-2-kinase (PFKFB3). J Biol Chem. 2014;289:9440-9448. [PubMed] [DOI] |
| 10. | Calvo MN, Bartrons R, Castaño E, Perales JC, Navarro-Sabaté A, Manzano A. PFKFB3 gene silencing decreases glycolysis, induces cell-cycle delay and inhibits anchorage-independent growth in HeLa cells. FEBS Lett. 2006;580:3308-3314. [PubMed] [DOI] |
| 11. | Seo M, Kim JD, Neau D, Sehgal I, Lee YH. Structure-based development of small molecule PFKFB3 inhibitors: a framework for potential cancer therapeutic agents targeting the Warburg effect. PLoS One. 2011;6:e24179. [PubMed] [DOI] |
| 12. | Clem BF, O'Neal J, Tapolsky G, Clem AL, Imbert-Fernandez Y, Kerr DA, Klarer AC, Redman R, Miller DM, Trent JO. Targeting 6-phosphofructo-2-kinase (PFKFB3) as a therapeutic strategy against cancer. Mol Cancer Ther. 2013;12:1461-1470. [PubMed] [DOI] |
| 13. | De Bock K, Georgiadou M, Schoors S, Kuchnio A, Wong BW, Cantelmo AR, Quaegebeur A, Ghesquière B, Cauwenberghs S, Eelen G. Role of PFKFB3-driven glycolysis in vessel sprouting. Cell. 2013;154:651-663. [PubMed] [DOI] |
| 14. | Schoors S, De Bock K, Cantelmo AR, Georgiadou M, Ghesquière B, Cauwenberghs S, Kuchnio A, Wong BW, Quaegebeur A, Goveia J. Partial and transient reduction of glycolysis by PFKFB3 blockade reduces pathological angiogenesis. Cell Metab. 2014;19:37-48. [PubMed] [DOI] |
| 15. | Kessler R, Bleichert F, Warnke JP, Eschrich K. 6-Phosphofructo-2-kinase/fructose-2,6-bisphosphatase (PFKFB3) is up-regulated in high-grade astrocytomas. J Neurooncol. 2008;86:257-264. [PubMed] [DOI] |
| 16. | Zscharnack K, Kessler R, Bleichert F, Warnke JP, Eschrich K. The PFKFB3 splice variant UBI2K4 is downregulated in high-grade astrocytomas and impedes the growth of U87 glioblastoma cells. Neuropathol Appl Neurobiol. 2009;35:566-578. [PubMed] [DOI] |