修回日期: 2014-06-17
接受日期: 2014-07-01
在线出版日期: 2014-08-28
目的: 观察P38MAPK抑制剂SB203580对急性肝衰竭大鼠肝组织Caspase12蛋白表达及肝细胞凋亡的影响, 探讨其对急性肝衰竭大鼠肝脏保护作用的机制.
方法: 72只健康Wistar大鼠随机分3组: 对照组(注射生理盐水)、模型组(注射D-Gal/LPS)、抑制剂组(D-Gal/LPS+SB203580). 按时间点分为3个亚组, 每亚组8只. 取血检测丙氨酸氨基转移酶(alanine aminotransferase, ALT)、总胆红素(total bilirubin, TBIL); HE染色观察肝组织病理学变化; 免疫组织化学法检测Caspase12蛋白; 二苯胺法检测细胞凋亡率. SPSS18.0统计分析.
结果: 抑制组12 h肝功、Caspase12蛋白表达和细胞凋亡率均低于模型组; 18 h Caspase12蛋白表达与模型组差异无统计学意义, 细胞凋亡率高于模型组; 模型组12 h出现坏死, 抑制组18 h出现坏死.
结论: P38MAPK抑制剂SB203580能减少肝衰竭大鼠Caspase12蛋白表达和肝细胞凋亡率, 减轻肝细胞坏死, 对急性肝衰竭大鼠的肝脏具有保护作用.
核心提示: 急性肝衰竭起病急、进展快、病情复杂、病死率高. 我们研究发现P38MAPK抑制剂SB203580能减少肝衰竭大鼠Caspase12蛋白表达和肝细胞凋亡率, 减轻肝细胞坏死, 对急性肝衰竭大鼠的肝脏具有保护作用, 可以成为治疗急性肝衰竭的一个新靶点.
引文著录: 刘晓珺, 刘北彦, 孔俊英, 王凤平, 孙辉, 谢文媛, 王宏微, 沈滨, 杜雅菊. P38MAPK抑制剂对急性肝衰竭大鼠内质网应激反应性凋亡的作用. 世界华人消化杂志 2014; 22(24): 3625-3631
Revised: June 17, 2014
Accepted: July 1, 2014
Published online: August 28, 2014
AIM: To observe the effect of P38MAPK inhibitor SB203580 on Caspase12 protein expression and apoptosis of hepatocytes in rats with acute hepatic failure, and to explore the mechanism underlying its protective effect on acute hepatic failure.
METHODS: Seventy-two healthy Wistar rats were randomly divided into three groups: a control group (injected with normal saline), a model group (injected with D-galactosamine/lipopolysaccharide, D-Gal/LPS), and an inhibitor group (injected with D-Gal/LPS + SB203580). Each group was further divided into three subgroups for testing at different time points, with 8 rats in each subgroup. Blood samples were collected for the determination of alanine aminotransferase (ALT) and total bilirubin (TBIL). HE staining was performed to observe the liver pathological changes. Immunohistochemical assay was performed to detect the expression of Caspase12 protein. The diphenylamine method was used to detect the apoptosis rate.
RESULTS: The liver function, Caspase12 protein expression and apoptosis rate in the inhibitor group at 12 h were lower than those in the model group. Caspase12 protein expression at 18 h in the inhibitor group had no significant difference with that in the model group, while the apoptosis rate was significantly higher in the inhibitor group than in the model group. Necrosis occurred in the model group at 12 h, and in the inhibitor group at 18 h.
CONCLUSION: P38MAPK inhibitor SB203580 can reduce the expression of Caspase12 protein, inhibit the endoplasmic reticulum stress-mediated hepatocyte apoptosis, reduce the necrosis of liver cells and play a protective effect against acute hepatic failure.
- Citation: Liu XJ, Liu BY, Kong JY, Wang FP, Sun H, Xie WY, Wang HW, Shen B, Du YJ. Effect of P38MAPK inhibitor on endoplasmic reticulum stress-induced hepatocyte apoptosis in rats with acute liver failure. Shijie Huaren Xiaohua Zazhi 2014; 22(24): 3625-3631
- URL: https://www.wjgnet.com/1009-3079/full/v22/i24/3625.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i24.3625
急性肝衰竭(acute hepatic failure, AHF)具有起病急、进展快、病情复杂、病死率高等特点, 虽有包括药物, 人工肝支持系统及肝移植, 细胞移植等多种治疗措施, 死亡率仍然非常高[1-3]. AHF以大量细胞死亡为主要表现, 细胞凋亡在这一过程中有重要作用[4-6]. 国内外许多研究证实了内质网应激相关性的肝细胞凋亡参与了急性肝衰竭的发生、发展过程[7]. 其中Caspase12是内质网应激性细胞凋亡途径的特异性标志物, 既往研究显示D-Gal/LPS诱导小鼠急性肝衰竭早期Caspase12 mRNA表达水平逐渐升高, 后期降低, 与肝细胞凋亡发生的时相性呈显著正相关[8]. 丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)级联是细胞内重要的信号传导系统之一, 其将细胞外刺激信号传递到细胞核引起一系列细胞生物学反应[9], 而P38MAPK作为MAPK家族的重要信号通路, 在细胞炎症、增殖、应激、凋亡、细胞周期和生长等多种生理和病理过程中起着重要作用[10]. 本实验目的是应用P38MAPK抑制剂(SB203580)对急性肝衰竭大鼠模型进行干预, 观察Caspase12蛋白的表达及肝细胞凋亡情况, 探讨P38MAPK抑制剂对Caspase12介导的内质网应激相关性肝细胞凋亡的影响, 为急性肝衰竭的发病机制及其治疗寻求新的靶点.
♂Wistar大鼠72只, 体质量180-200 g, 购自哈尔滨医科大学附属第二医院动物实验中心. 氨基半乳糖D-Gal(购自DAKO公司); 内毒素/脂多糖LPS(购自美国Sigma公司); SB203580(购自Calbiochem公司); Caspase12(购自英国Abcam公司); 二抗(购自武汉博士德公司) .
1.2.1 动物模型的建立: 72只大鼠随机分成3组, 每组24只. 即正常对照组: 腹腔注射生理盐水2 mL; 模型组: 腹腔联合注射400 mg/kg D-Gal及100 μg/kg LPS共2 mL; SB203580组: 于造模完成后给予1 mg/(kg·d)SB203580腹腔注射. 每组随机分为6、12、18 h 3个亚组, 每亚组8只. 实验前禁食水12 h, 以1%戊巴比妥钠(40 mg/kg)腹腔注射麻醉, 取胸腹正中线切口, 充分暴露心脏和肝脏. 心脏采血2 mL, 全自动生化分析仪检测丙氨酸氨基转移酶(alanine aminotransferase, ALT)、总胆红素(total bilirubin, TBIL). 取肝组织, 以40 g/L甲醛固定, 用于HE染色和免疫组织化学; 另一块用PBS液清洗, 以二苯胺法测细胞凋亡率.
1.2.2 病理学检查: 取新鲜肝脏组织用10%甲醛固定, 常规石蜡包埋, 切片HE染色, 光学显微镜观察肝组织损伤情况.
1.2.3 二苯胺法定量测定肝细胞凋亡率: 取新鲜肝组织, Hank's液冲洗2-3次, 眼科剪剪组织块约2-3 mm, 加入30倍体积的胰蛋白酶消化液, 37 ℃水浴箱消化1 h, 过滤留取细胞液, 按照二苯胺法定量测定肝细胞凋亡率[11,12]进行细胞凋亡的DNA片段化百分率分析.
1.2.4 免疫组织化学法检测Caspase12蛋白表达: 取甲醛固定的肝组织, 依次进行包埋、切片、脱蜡和水化、抗原修复(热修复)、一抗孵育、二抗孵育、DAB显色、复染、蓝化、脱水、封片等程序, 烘干后进行镜下观察. 结果判定: 根据染色面积来界定蛋白的表达, 同等倍数下的肝小叶图片按照9×9等分, 然后查表格中阳性表达的表格数, 计算出阳性表达百分比.
统计学处理 各组数据连续型变量服从正态分布, 采用mean±SD; 3组之间的比较采用方差分析, 任意两组间的比较采用LSD检验. 所有数据采用SPSS18.0统计软件处理, P<0.05为差异有统计学意义.
正常对照组大鼠活动及反应灵活; 模型组大鼠6 h开始出现活动减少, 12 h出现明显反应迟钝, 毛发干枯发黄, 眼神失去光亮, 18 h亚组于15 h死亡1例; 2例出现呼吸急促; 1例出现周身不自主颤抖; SB203580组于18 h出现懒动, 毛发干枯发黄, 眼神失去光亮等表现; 正常对照组和SB203580组无死亡病例.
2.2.1 肝脏大体变化: 正常对照组肝脏红润、表面光滑、边缘整齐. 模型组: 6 h部分大鼠肝脏略饱满; 12 h肝脏肿胀, 表面见散在出血点或瘀斑; 18 h肝脏高度充血水肿, 表面瘀血呈片状, 部分肝脏缩小, 呈暗红色, 肝包膜紧张无光泽. SB203580组大鼠肝脏在12 h出现充血水肿; 18 h肝脏明显肿胀, 表面可见散在出血点或瘀斑.
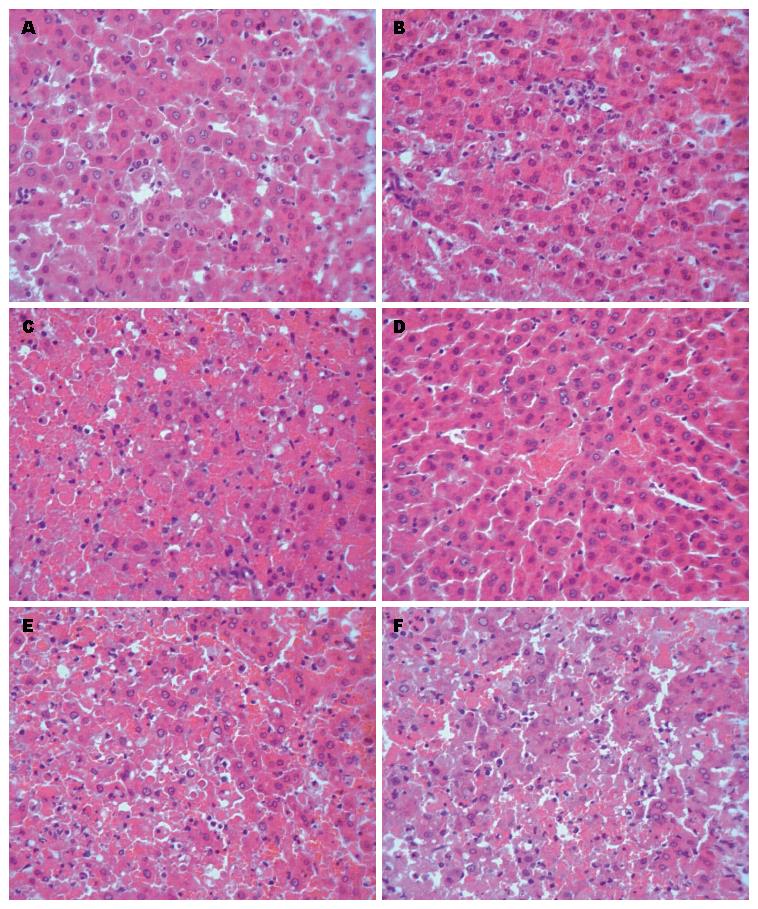
2.2.2 病理学变化: HE染色, 正常对照组肝小叶结构完整, 无炎细胞浸润, 无肝细胞变性及坏死现象. 模型组6 h显示肝细胞肿胀, 中性粒细胞细胞浸润, 出现散在的肝细胞凋亡, 核固缩, 染色质浓聚, 胞核呈棕褐色; 12 h弥漫性肝细胞凋亡, 出现点片状出血及坏死现象; 18 h肝小叶结构破坏, 肝细胞大片变性坏死和出血. SB203580组相比较模型组6 h无明显差别, 12 h凋亡现象明显少于模型组; 18 h发生片状坏死, 程度均较模型组轻(图1).
模型组ALT与TBIL的值与正常对照组相比从6 h开始升高, 12和18 h显著升高(P<0.05); SB203580组ALT与TBIL的值从12 h开始高于正常组相对应时间点的值(P<0.05), 但低于模型组(P<0.05)(表1).
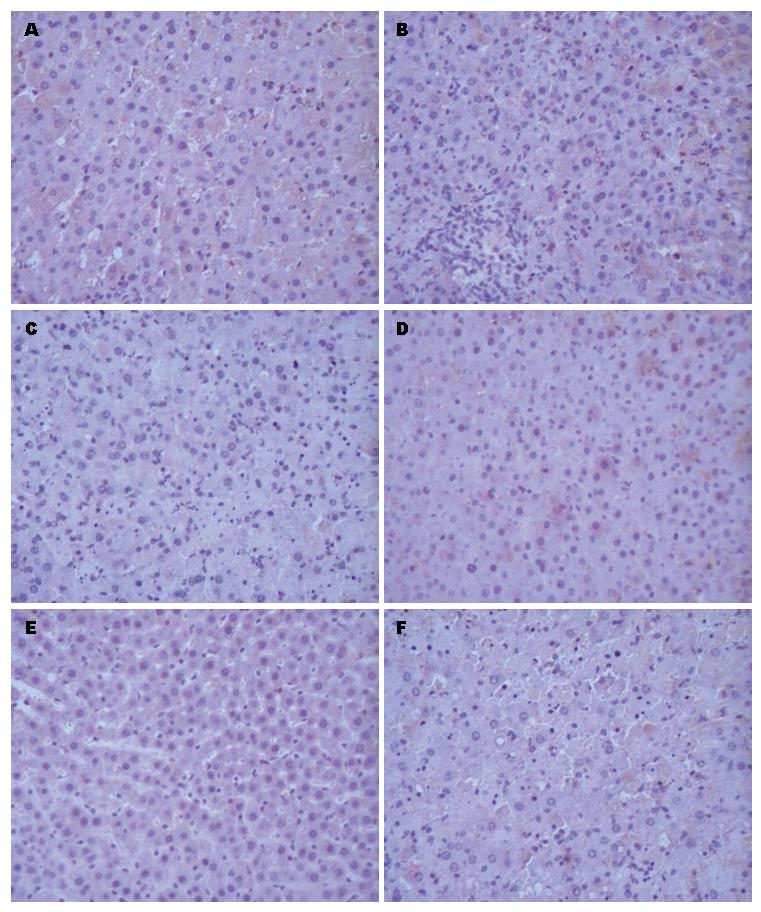
Caspase12蛋白表达于肝细胞胞质内. 模型组Caspase12蛋白在3个时间点均高于对照组(P<0.05); 12、18 h阳性表达高于6 h(P<0.05), 而18和12 h两组间差异无统计学意义(P>0.05). SB203580组Caspase12蛋白表达量12 h表达高于6 h组(P<0.05), 18与12 h组无统计学差异(P>0.05); 与模型组相比, 6 h亚组Caspase12蛋白表达量无明显统计学差异(P>0.05); 12和18 h阳性表达量低于模型组(P<0.05)(表2, 图2).
模型组6、12 h肝细胞凋亡率明显高于正常对照组(P<0.05), 18 h组与正常对照组无差异(P>0.05); 12 h高于6 h(P<0.05); 而18 h的细胞凋亡率低于12 h组(P<0.05). SB203580组与模型组比较, 6、12 h的细胞凋亡率明显低于模型组(P<0.05), 而18 h肝细胞凋亡率高于模型组(表3).
急性肝衰竭可在多种疾病的过程中发生[13], 其进展迅速, 病情复杂, 死亡率极高, 治疗困难[14,15]. 因此, 如何保护肝脏功能, 减轻肝脏病变程度, 有效控制或延缓疾病的进展成为研究的难点. 内质网是细胞内功能十分活跃和重要的细胞器, 与蛋白质的合成、储存、加工修饰、折叠、组装和运输密切相关, 同时对钙离子的储存也起到重要作用. 内质网这些极其重要的功能紊乱将导致未折叠或者错误折叠的蛋白质在内质网中的堆积, 从而引发内质网应激(endoplasmic reticulum stress, ERS)[16]. 研究显示, ERS及其介导的细胞凋亡途径与许多肝脏疾病的发生发展都有密切的关系[17-19]. ERS既是细胞抵抗应激的重要机制, 也是应激损伤细胞的重要机制, 被认为发生在各种损伤的早期阶段. 因此, 对内质网应激反应的干预有可能成为防治急性肝衰竭的有效手段.
Caspase12是内质网应激介导的细胞凋亡特异性的标志物[20,21]. 研究显示, D-Gal/LPS诱导小鼠急性肝功能衰竭早期Caspase12 mRNA表达水平逐渐升高, Caspase12蛋白因内质网应激而被大量活化, 后期降低, 与肝细胞凋亡的发生在时相保持一致, 提示Caspase12介导的内质网应激相关性肝细胞凋亡参与急性肝功能衰竭的发生发展, 是急性肝功能衰竭中肝细胞损伤的重要机制之一. 本实验应用D-Gal/LPS制造肝衰竭模型[22], HE染色显示6 h肝细胞出现散在的肝细胞凋亡, 12 h肝细胞凋亡明显, 并出现点片状出血及坏死现象, 18 h肝小叶结构破坏, 肝细胞大片变性坏死和出血. 二苯胺法定量测定的肝细胞凋亡率也显示12 h组凋亡率最高, 为31.7%, 而18 h反而呈降低趋势, 肝细胞凋亡率低于12 h组(P<0.05). 实验表明大鼠急性肝衰竭模型成功, 随着时间的延长肝损伤的程度加重, 早期以肝细胞凋亡为著, 18 h主要表现为坏死. 模型组Caspase12蛋白表达在3个时间点均高于对照组(P<0.05), 12、18 h阳性表达高于6 h(P<0.05), 而18和12 h两组间差异无统计学意义(P>0.05). 由此可见Caspase12凋亡通路参与了大鼠肝衰竭的发病过程, 但是Caspase12蛋白表达并没有随着肝衰竭程度加重呈现出持续升高, 18 h亚组Caspase12蛋白表达与肝细胞凋亡率显示出不一致性, 我们分析可能的原因是: (1)18 h组坏死明显, Caspase12蛋白的结构可能被破坏, 影响检测结果; (2)在肝衰竭的病理变化过程中其他因素作用于Caspase12蛋白, 并抑制其合成表达; (3)内质网应激相关的凋亡通路可能是肝衰竭早期病理变化的原因.
p38MAPK是细胞应激反应的重要信号分子, 其动态平衡对维持细胞功能状态稳定具有重要意义[23], 并且在细胞炎症反应、细胞凋亡和免疫调节等过程中起重要作用[24]. 文献报道, p38MAPK在ERS中诱导GRP78等上调[25,26]. 抑制p38MAPK活性可阻断ERS特异性刺激诱导的CRT表达上调[27]. 因此, 我们应用p38MAPK抑制剂SB203580进行干预, 观察抑制p38MAPK活性是否可以影响急性肝衰竭大鼠肝细胞Caspase12蛋白的表达及肝细胞凋亡, 从而延缓肝衰竭的发生.
我们于造模完成后给予SB203580腹腔注射, 大鼠肝脏的大体标本, 病理组织学及TBIL、ALT值均显示肝脏损伤程度较模型组减轻, 抑制p38MAPK活性可以保护急性肝衰竭大鼠肝脏组织. SB203580组6、12 h的肝细胞凋亡率分别为10.7%和22.5%, 低于模型组(P<0.05), 而18 h肝细胞凋亡率高于模型组; 组内12、18 h亚组的凋亡率高于6 h, 但12 h和18 h之间差异无统计学意义(P>0.05). Caspase12蛋白表达量12 h表达高于6 h组(P<0.05), 18与12 h组差异无统计学意义异(P>0.05); 与模型组相比, 6 h亚组Caspase12蛋白表达量无明显差异(P>0.05); 12和18 h阳性表达量低于模型组(P<0.05). 在SB203580组Caspase12蛋白表达与肝细胞凋亡呈相似的变化, 与模型组比较细胞凋亡减少、肝功能和组织学表现改善, 其可能机制为SB203580抑制p38MAPK活性, 抑制Caspase12蛋白表达及活化, 减轻内质网应激相关性凋亡. 另外, 本实验发现模型组肝细胞坏死出现时间在12 h, 而抑制剂组18 h才出现明显的肝细胞坏死, 且坏死程度较模型组轻, 提示p38MAPK抑制剂在抑制细胞凋亡的同时也通过某种机制推迟了肝细胞坏死的时间. 机制可能为模型组细胞凋亡未受局限, 持续的、广泛的、弥漫性的细胞凋亡后续引发大量炎症因子释放, 促进肝细胞坏死[28], 而p38MAPK抑制剂组抑制凋亡引起的后续炎症级联放大反应, 从而推迟了坏死的时间和程度. 可见, SB203580除了可减少急性肝衰竭发病中内质网应激介导的细胞凋亡, 也可以推迟急性肝衰竭肝细胞发生坏死的时间.
总之, 应用SB203580抑制后可以有效地减少内质网应激介导的细胞凋亡, 改善肝功能, 并通过某种机制推迟肝坏死的时间, 因此他对急性肝衰竭具有保护性的作用, 可以成为治疗急性肝衰竭的一个新靶点, 并为肝移植争取时间. 但是SB203580的作用时间、半衰期以及体内的代谢过程还有待进一步的研究. 此外, 在急性肝衰竭细胞凋亡中SB203580是直接抑制Caspase12表达及活化, 从而减轻内质网应激相关性肝细胞凋亡, 还是先作用于其他配件, 如GRP78等再引起Caspase12的变化, 都需要进一步实验证实.
急性肝衰竭具有起病急、进展快、病情复杂、病死率高等特点, 以大量细胞死亡为主要表现, 细胞凋亡在这一过程中有重要作用. 国内外许多研究证实了内质网应激相关性的肝细胞凋亡参与了急性肝衰竭的发生发展过程.
范学工, 教授, 中南大学湘雅医院感染病科
ERS既是细胞抵抗应激的重要机制, 也是应激损伤细胞的重要机制, 被认为发生在各种损伤的早期阶段, 因此, 对内质网应激反应的干预有可能成为防治急性肝衰竭的有效手段. 本实验的目的是应用P38MAPK抑制剂(SB203580)对急性肝衰竭大鼠模型进行干预, 探讨P38MAPK抑制剂对Caspase12介导的内质网应激相关性肝细胞凋亡的影响, 为急性肝衰竭的发病机制及其治疗寻求新的靶点.
Luo等报道p38MAPK在ERS中诱导GRP78等上调. GRP78为内质网应激反应的元件.
急性肝衰竭是临床上常见的急危重症之一, 如何保护肝脏功能, 减轻肝脏病变程度, 有效控制或延缓疾病的进展成为研究的难点. 我们研究发现P38MAPK抑制剂SB203580能减少肝衰竭大鼠Caspase12蛋白表达和肝细胞凋亡率, 减轻肝细胞坏死, 对急性肝衰竭大鼠的肝脏具有保护作用.
应用SB203580抑制后可以有效地减少内质网应激介导的细胞凋亡, 改善肝功能, 推迟肝坏死的时间, 可以成为治疗急性肝衰竭的一个新靶点, 并为肝移植争取时间.
本文对从内质网的角度理解肝衰竭的机制有一定科学意义.
编辑: 田滢 电编:闫晋利
| 1. | Lee WM, Stravitz RT, Larson AM. Introduction to the revised American Association for the Study of Liver Diseases Position Paper on acute liver failure 2011. Hepatology. 2012;55:965-967. [PubMed] |
| 2. | Fábrega E, Mieses MÁ, Terán A, Moraleja I, Casafont F, Crespo J, Pons-Romero F. Etiologies and outcomes of acute liver failure in a spanish community. Int J Hepatol. 2013;2013:928960. [PubMed] |
| 4. | Malhi H, Gores GJ, Lemasters JJ. Apoptosis and necrosis in the liver: a tale of two deaths? Hepatology. 2006;43:S31-S44. [PubMed] |
| 6. | Ramachandran A, McGill MR, Xie Y, Ni HM, Ding WX, Jaeschke H. Receptor interacting protein kinase 3 is a critical early mediator of acetaminophen-induced hepatocyte necrosis in mice. Hepatology. 2013;58:2099-2108. [PubMed] |
| 7. | Chen L, Ren F, Zhang H, Wen T, Piao Z, Zhou L, Zheng S, Zhang J, Chen Y, Han Y. Inhibition of glycogen synthase kinase 3β ameliorates D-GalN/LPS-induced liver injury by reducing endoplasmic reticulum stress-triggered apoptosis. PLoS One. 2012;7:e45202. [PubMed] |
| 8. | Zhou HJ, Xie Q, Jiang S, Li GM, Zhou XQ, Liu HF, Yu H, Guo Q. [Caspase-12 expression and activation in the pathogenesis of acute hepatic failure induced by lipopolysaccharide and D-galactosamine]. Zhonghua Ganzangbing Zazhi. 2005;13:685-688. [PubMed] |
| 9. | Wen J, Watanabe K, Ma M, Yamaguchi K, Tachikawa H, Kodama M, Aizawa Y. Edaravone inhibits JNK-c-Jun pathway and restores anti-oxidative defense after ischemia-reperfusion injury in aged rats. Biol Pharm Bull. 2006;29:713-718. [PubMed] |
| 10. | Sosa MS. [Long-term results of intermittent massive therapy (protocol HIM-T.M.I.) in children with acute lymphoblastic leukemia]. Bol Med Hosp Infant Mex. 1976;33:1151-1163. [PubMed] |
| 11. | 刘 艳红, 刘 先洲, 邓 兆群, 王 焰山, 汤 纪路, 白 瑞珍. 二苯胺法定量检测细胞凋亡. 武汉大学学报(医学版). 2002;23:63-65. |
| 12. | Gercel-Taylor C. Diphenylamine assay of DNA fragmentation for chemosensitivity testing. Methods Mol Med. 2005;111:79-82. [PubMed] |
| 13. | White H. Neurologic manifestations of acute and chronic liver disease. Continuum (Minneap Minn). 2014;20:670-680. [PubMed] |
| 15. | Stravitz RT. Critical management decisions in patients with acute liver failure. Chest. 2008;134:1092-1102. [PubMed] |
| 16. | Schröder M, Kaufman RJ. ER stress and the unfolded protein response. Mutat Res. 2005;569:29-63. [PubMed] |
| 17. | Asselah T, Bièche I, Mansouri A, Laurendeau I, Cazals-Hatem D, Feldmann G, Bedossa P, Paradis V, Martinot-Peignoux M, Lebrec D. In vivo hepatic endoplasmic reticulum stress in patients with chronic hepatitis C. J Pathol. 2010;221:264-274. [PubMed] |
| 19. | Wei Y, Wang D, Topczewski F, Pagliassotti MJ. Saturated fatty acids induce endoplasmic reticulum stress and apoptosis independently of ceramide in liver cells. Am J Physiol Endocrinol Metab. 2006;291:E275-E281. [PubMed] |
| 20. | Malhi H, Kaufman RJ. Endoplasmic reticulum stress in liver disease. J Hepatol. 2011;54:795-809. [PubMed] |
| 21. | Curry SE. Clinician-educators in academic medical centers. N Engl J Med. 2000;342:139. [PubMed] |
| 22. | Eipel C, Kidess E, Abshagen K, Leminh K, Menger MD, Burkhardt H, Vollmar B. Antileukoproteinase protects against hepatic inflammation, but not apoptosis in the response of D-galactosamine-sensitized mice to lipopolysaccharide. Br J Pharmacol. 2007;151:406-413. [PubMed] |
| 23. | Wada T, Penninger JM. Mitogen-activated protein kinases in apoptosis regulation. Oncogene. 2004;23:2838-2849. [PubMed] |
| 24. | Jameel NM, Thirunavukkarasu C, Wu T, Watkins SC, Friedman SL, Gandhi CR. p38-MAPK- and caspase-3-mediated superoxide-induced apoptosis of rat hepatic stellate cells: reversal by retinoic acid. J Cell Physiol. 2009;218:157-166. [PubMed] |
| 25. | Luo S, Lee AS. Requirement of the p38 mitogen-activated protein kinase signalling pathway for the induction of the 78 kDa glucose-regulated protein/immunoglobulin heavy-chain binding protein by azetidine stress: activating transcription factor 6 as a target for stress-induced phosphorylation. Biochem J. 2002;366:787-795. [PubMed] |
| 26. | Feaver RE, Hastings NE, Pryor A, Blackman BR. GRP78 upregulation by atheroprone shear stress via p38-, alpha2beta1-dependent mechanism in endothelial cells. Arterioscler Thromb Vasc Biol. 2008;28:1534-1541. [PubMed] |
| 27. | Yamazaki T, Muramoto M, Nishimura S, Kita Y. Suppressive effects of FR167653, an inhibitor of p38 mitogen-activated kinase, on calreticulin mRNA expression induced by endoplasmic reticulum stresses. Eur J Pharmacol. 2004;484:147-156. [PubMed] |
| 28. | Tabas I, Ron D. Integrating the mechanisms of apoptosis induced by endoplasmic reticulum stress. Nat Cell Biol. 2011;13:184-190. [PubMed] |