修回日期: 2014-06-18
接受日期: 2014-07-05
在线出版日期: 2014-08-28
目的: 探讨腹泻型肠易激综合征(diarrhea irritable bowel syndrome, D-IBS)重叠功能性消化不良(functional dyspepsia, FD)患者白介素-10(interleukin-10, IL-10)基因启动子区域多态性及其血浆水平与疾病易感性的关系.
方法: 对164例D-IBS重叠FD患者和200例健康对照者抽血提取其白细胞DNA, 应用聚合酶反应-限制性片段多态性(polymerase chain reaction-restriction fragment length polymorphism, PCR-RFLP)分析方法以及扩增受阻突变系统-聚合酶链反应(amplification refractory mutation system-polymerase chain reactions, ARMS-PCR)结合DNA测序法, 对IL-10基因启动子区-592与-1082位点进行多态性分析, 并使用酶联免疫吸附法测定血浆IL-10水平.
结果: D-IBS重叠FD病例组与正常对照组相比, IL-10启动子区域592位点基因型分布与等位基因频率无显著差异, 592CC基因频率显著下降, 基因型频率风险相关分析表示, AA基因型是CC基因型患病风险的1.989倍; A等位基因携带型(AA+AC基因型)为CC型纯合子的1.808倍; -1082位点基因型分布与等位基因频率均无显著差异; -592位点与-1082位点组合基因型分布与等位基因频率也无显著差异; 不同IL-10分泌水平基因型分布无显著差异. D-IBS重叠FD病例组血浆IL-10平均水平为14.60 pg/mL±7.14 pg/mL, 对照组为22.86 pg/mL±10.62 pg/mL, 两组比较, 病例组显著低于正常对照组(P<0.001). D-IBS重叠FD病例组592位点AA、AC、CC、AA+AC基因型血浆IL-10水平分别为14.50 pg/mL±6.37 pg/mL、14.85 pg/mL±7.75 pg/mL、13.92 pg/mL±7.63 pg/mL, 14.68 pg/mL±7.10 pg/mL, 病例组各基因型之间血浆IL-10水平无显著差异, 592位点AA+AC与CC基因型血浆IL-10水平也无显著差异.
结论: IL-10-592位点A和IL-10血浆水平降低可能与罹患D-IBS重叠FD的相关, 但这二者之间并无关联.
核心提示: 白介素-10(interleukin-10, IL-10)592位点A和IL-10血浆水平降低是罹患腹泻型肠易激综合征(diarrhea-irritable bowel syndrome, D-IBS)重叠功能性消化不良(functional dyspepsia, FD)的风险因素, 抑炎因子IL-10的失衡导致胃肠高敏感性及动力异常, 从而引起两病重叠发生. 在D-IBS重叠FD的病理机制下, IL-10血浆水平显著降低与IL-10-592位点基因多态性无关联, 而可能是一种多因素的调控, 其调控的具体机制及-592A位点基因多态性是否存在其他作用机制影响D-IBS重叠FD, 有待于日后的进一步研究.
引文著录: 黄瑶, 赵梁, 张瑜, 周乐, 卜平. 白介素-10基因启动子多态性及其血浆水平与腹泻型肠易激综合征重叠功能性消化不良的关系. 世界华人消化杂志 2014; 22(24): 3580-3586
Revised: June 18, 2014
Accepted: July 5, 2014
Published online: August 28, 2014
AIM: To investigate the relationship between interleukin-10 (IL-10) promoter gene polymorphisms and plasma levels and susceptibility to overlap syndrome of diarrhea irritable bowel syndrome (D-IBS) and functional dyspepsia (FD).
METHODS: Blood samples were collected from 164 patients and 200 healthy controls and genomic DNA was extracted. Polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) was used to determine the genotypes in the -592A/C site, and amplification refractory mutation system polymerase chain reactions (ARMS-PCR) and DNA sequencing were performed to detect the polymorphism of the -1082G/A site. IL-10 plasma levels were determined by enzyme-linked immunosorbent assay (ELISA).
RESULTS: The -592A/C site in the IL-10 gene showed no significant differences in genotypes or allele frequency between the D-IBS-FD overlap syndrome group and control group, but the frequency of -592 CC genotype was significantly decreased in the D-IBS-FD overlap syndrome group. Compared with the CC genotype, the AA genotype and the AA+AC genotypes increased the risk of D-IBS-FD overlap syndrome 1.989 and 1.808 times, respectively. There were no significant differences in the distribution or the allele frequency of -1082 genotypes, the genotypes of the combination of -592 and -1082, and the distribution of the genotypes of different IL-10 levels between the D-IBS-FD overlap syndrome and healthy control groups. The average plasma IL-10 levels were significantly lower in patients with D-IBS-FD overlap syndrome than in healthy controls (14.60 pg/mL ± 7.14 pg/mL vs 22.86 pg/mL ± 10.62 pg/mL, P < 0.001). Among patients with D-IBS-FD overlap syndrome, the average plasma IL-10 levels in patients with -592 AA, -592 AC, -592 CC, and -592 AA+AC genotypes were 14.50 pg/mL ± 6.37 pg/mL, 14.85 pg/mL ± 7.75 pg/mL, 13.92 pg/mL ± 7.63 pg/mL, 14.68 pg/mL ± 7.10 pg/mL, respectively, which showed no significant differences. Plasma IL-10 levels showed no significant difference between the carriers of A allele and non-carriers.
CONCLUSION: The -592A site in IL-10 gene promoter and lower IL-10 plasma level may be associated with susceptibility to overlap syndrome of D-IBS and FD, but there is no association between them.
- Citation: Huang Y, Zhao L, Zhang Y, Zhou L, Bo P. Relationship between IL-10 promoter gene polymorphisms and plasma level and susceptibility to overlap syndrome of diarrhea irritable bowel syndrome and functional dyspepsia. Shijie Huaren Xiaohua Zazhi 2014; 22(24): 3580-3586
- URL: https://www.wjgnet.com/1009-3079/full/v22/i24/3580.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i24.3580
肠易激综合征(irritable bowel syndrome, IBS)与功能性消化不良(functional dyspepsia, FD)属于功能性胃肠病(functional gastrointestinal disorders, FGIDs)中发病率较高的两种, 研究表明两病发生重叠的现象非常普遍[1-6], 发生重叠的几率可高达50%[1], 被认为有共同的生理病理基础, 与内脏感觉异常、胃肠动力异常、细菌过度生长、脑肠轴的异常、社会心理因素、遗传易感性等多种因素有关[7-10], 因此有学者认为FD和IBS有时不能完全分开[11]. 目前研究表明[12,13], 遗传因素可能使某些个体的白介素-10(interleukin-10, IL-10)水平降低, 造成体内抗炎因子失衡, 引起胃肠高敏感性及动力异常, 而易发生FGIDs. 本研究旨在探讨IL-10启动子区域基因多态性及其血浆水平与腹泻型肠易激综合征(diarrhea irritable bowel syndrome, D-IBS)和重叠FD之间的关系.
选择2011-03/2012-12在扬州大学附属医院消化科门诊就诊的D-IBS重叠FD患者164例作为研究对象, 其中男75例, 女89例, 年龄25-74岁, 平均年龄49.15岁±13.16岁; 正常对照组选择扬州市疾病预防控制中心体检健康人群共200例, 其中男96例, 女104例, 年龄20-72岁, 平均年龄46.13岁±12.15岁, 无IBS样症状及其他器质性疾病. 两组间性别、年龄等比较差异无统计学意义(P>0.05). 所有入组对象均通过扬州大学医学伦理委员会审查, 并签署知情同意书. DNA提取试剂为天根公司的RelaxGene血液基因组DNA提取系统(DP-318), PCR引物由上海生工合成, 限制性内切酶RsaⅠ购自NEB, PCR Mix购自博尔迪公司, IL-10检测试剂盒购自北京达科维生物科技公司. 酶标仪为瑞士泰肯公司SUNRISE型号, 洗板机为瑞士泰肯公司hydroFlex型号.
1.2.1 D-IBS重叠FD诊断标准及排除标准: 诊断标准: 诊断前症状出现≥6 mo, 近3 mo每月至少有3 d出现反复发作的腹痛或不适(在临床试验中, 筛选可评估的患者时, 疼痛或不适出现的频率至少为2 d/wk), 并且至少出现A类症状2项及B类症状1项, 且没有可以解释上述症状的器质性疾病的证据. A类症状: (1)排便后症状缓解; (2)发作时伴有排便频率改变; (3)发作时伴有粪便性状(外观)改变. B类症状: (1)餐后饱胀不适; (2)早饱感; (3)上腹痛; (4)上腹烧灼感. 排除标准: (1)妊娠期或哺乳期女性; (2)手术或其他应激情况下的患者; (3)合并严重肝、肾功能损害; (4)合并严重心脑血管疾病; (5)合并内分泌疾病; (6)合并各种急慢性感染性疾病.
1.2.2 血样处理: 采集受试者空腹静脉血5 mL于EDTA抗凝管中, 3000 r/min离心15 min, 取血浆分装于冻存于-80 ℃待测IL-10, 剩余细胞部分取出150 μL用于白细胞DNA提取, 其余部分冻存于-80 ℃备用. 提取DNA溶解分装于50 μL TE, 置-80 ℃冰箱保存备用. DNA纯度及浓度用紫外分光光度法检测, 计算A260/280的比值在1.75-1.85之间, DNA的纯度符合PCR扩增要求.
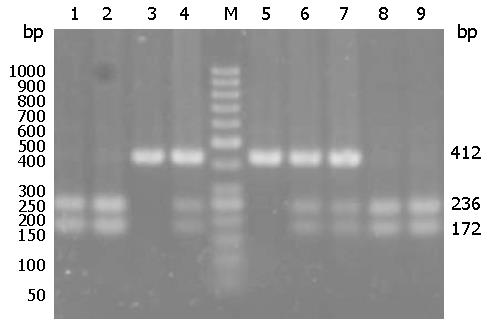
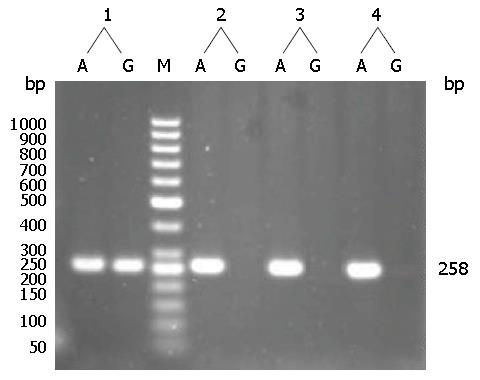
1.2.3 基因型检测: (1)聚合酶反应-限制性片段多态性(polymerase chain reaction-restriction fragment length polymorphism, PCR-RFLP)检测IL-10启动子区域592位点: 根据Genbank已知序列使用DNAstar7.0及参考文献[14]设计引物, 上游引物: 5'-GGTGAGCACTACCTGACTAGC-3'; 下游引物: 5'-CCTAGGTCACAGTGACGTGG-3', 由上海生工合成. 扩增体系为20 μL, 其中5 pmol上下游引物各1 μL, 模板2 μL, 2×Taq plus PCR Mix 10 μL. 反应条件为94 ℃ 5 min, 然后95 ℃ 30 s, 57 ℃ 40 s, 72 ℃ 30 s, 35个循环; 72 ℃ 5 min, 4 ℃保存. PCR产物经2%琼脂糖电泳检验. 酶切反应体系20 μL, 其中PCR产物5 μL, 10 U RsaⅠ0.4 μL, 10×buffer 2 μL, ddH2O 14.6 μL, 37 ℃水浴酶切8 h, 取15 μL酶切产物3%琼脂糖凝胶电泳分离, 判读基因型: CC: 412 bp, AC: 412、236、176 bp, AA: 236、176 bp; (2)扩增受阻突变系统-聚合酶链反应(amplification refractory mutation system -polymerase chain reactions, ARMS-PCR)检测IL-10启动子区域1082位点: 根据Genbank已知序列使用DNAstar7.0及参考文献[15]设计引物, 上游引物G: 5'-CTACTAAGGCTTCTTTGGGAG-3', 上游引物A: 5'-ACTACTAAGGCTTCTTTGGGA-3'; 下游引物: 5'-CAGTGCCAACTGAGAATTTGG-3'. 扩增体系为20 μL, 其中5 pmol上下游引物各1 μL, 模板2 μL, 2×Taq plus PCR Mix 10 μL. 反应条件为95 ℃ 1 min, 然后95 ℃ 1 min, 65 ℃ 50 s, 72 ℃ 50 s, 10个循环; 95 ℃ 1 min, 59 ℃ 50 s, 72 ℃ 50 s, 20个循环; 72 ℃ 5 min, 4 ℃保存. PCR产物经2%琼脂糖电泳分离, 判读基因型: 仅与-1082位点上游引物G及下游引物扩增后在258 bp处出现电泳条带为基因型GG; 仅与-1082位点上游引物A及下游引物扩增后在258 bp处出现电泳条带为基因型AA; 而与两对引物扩增后均在258 bp处出现电泳条带的为基因型GA.
1.2.4 血浆IL-10检测: 检测严格按照ELISA试剂盒说明书操作, 测定血浆IL-10浓度, 用标准品制作标准曲线. 每组标准品及样品重复2次, 取均值, IL-10浓度以pg/mL表示.
统计学处理 应用IBS SPSS Statistics21.0对数据进行统计分析, 计量资料用mean±SD表示, 组间比较采用两样本的t检验; 等位基因及基因型频率采用直接计算法, 两样本率比较、研究对象与基因遗传平衡规律(Hardy-Weinberg平衡)符合程度均采用χ2检验, 并以比值比(odds ratio, OR)及其95%可信区间(confidence interval, CI)表示相对风险度. P<0.05为差异有统计学意义.
应用拟合优度χ2检验对病例组和正常对照组进行Hardy-Weinberg遗传平衡定律检验, 病例组和健康对照组IL-10启动子区域592A/C, 1082G/A的实际基因分布与Hardy-Weinberg平衡状态下的理论分布差异无统计学意义(P>0.05), 表明均符合该平衡法则, 具有群体代表性(表1, 表2).
| 分组 | 基因型 | χ2值 | P值 | |||||
| AA | AC | CC | ||||||
| 观察值 | 期望值 | 观察值 | 期望值 | 观察值 | 期望值 | |||
| D-IBS重叠FD组 | 77 | 76.49 | 70 | 71.02 | 17 | 16.49 | 0.03 | 0.86 |
| 正常对照组 | 82 | 75.65 | 82 | 94.71 | 36 | 29.65 | 3.60 | 0.06 |
| 分组 | 基因型 | χ2值 | P值 | |||||
| AA | GA | GG | ||||||
| 观察值 | 期望值 | 观察值 | 期望值 | 观察值 | 期望值 | |||
| D-IBS重叠FD组 | 146 | 146.49 | 18 | 17.01 | 0 | 0.49 | 0.55 | 0.46 |
| 正常对照组 | 172 | 172.98 | 28 | 26.04 | 0 | 0.98 | 1.13 | 0.29 |
IL-10启动子区域592位点检测到的基因型有AA、AC和CC(图1); 1082位点检测到的基因型有AA和AG, 未检测到GG(图2), 基因型与等位基因分布结果如表3. D-IBS重叠FD与正常对照组相比, IL-10 592位点、1082位点基因型分布与等位基因频率差异均无统计学意义(P>0.05), 但592CC基因频率显著下降(χ2 = 4.221, P = 0.04). 基因型频率风险相关分析表示, IL-10启动子区域592位点AA基因型和AC基因型分别是CC基因型患病风险的1.989倍(OR = 1.989, 95%CI: 1.033-3.829)与1.808倍(OR = 1.808, 95%CI: 0.935-3.494); AC基因型是CC基因型患病A等位基因携带者(AA+AC基因型)为CC型纯合子的1.808倍(OR = 1.808, 95%CI: 1.023-3.522).
| 分组 | n | 592A/C | 1082A/G | ||||||||
| CC | AC | AA | C | A | AA | GA | GG | A | G | ||
| D-IBS重叠FD组 | 164 | 17(10.37)a | 70(42.68) | 77(46.95) | 104(31.71) | 224(68.29) | 146(89.02) | 18(10.98) | 0 | 310(94.51) | 18(5.49) |
| 正常对照组 | 200 | 36(18.00) | 82(41.00) | 82(41.00) | 154(38.50) | 246(61.50) | 172(86.00) | (14.00) | 0 | 372(93.00) | 28(7.00) |
| χ2值 | 4.40 | 3.63 | 0.75 | 0.70 | |||||||
| P值 | 0.111 | 0.057 | 0.387 | 0.403 | |||||||
病例组和正常对照组均存在5种组合, GC/AA、GC/AC、AC/AC、AA/AA及AA/AC, 均以AC/AC、AA/AC、AA/AA居多, 其次为GC/AC和GC/AA(表4). 两组比较, 基因型分布、等位基因频率差异无统计学意义(P>0.05), IL-10中分泌型GC/AA+GC/AA与低分泌性AC/AC+AA/AA+AA/AC分布也差异无统计学意义(χ2 = 2.45, P = 0.118).
| 分组 | n | 基因型 | 等位基因频率 | ||||||
| GC/AA | GC/AC | AC/AC | AA/AA | AA/AC | GC | AC | AA | ||
| D-IBS重叠FD组 | 164 | 13(7.93) | 5(3.04) | 12(7.32) | 77(46.95) | 57(34.76) | 18(5.49) | 86(26.22) | 224(68.29) |
| 正常对照组 | 200 | 13(6.50) | 15(7.50) | 21(10.50) | 82(41.00) | 69(34.50) | 28(7.0) | 126(31.50) | 246(61.5) |
| χ2值 | 5.25 | 3.67 | |||||||
| P值 | 0.263 | 0.160 | |||||||
D-IBS重叠FD病例组血浆IL-10平均水平为14.60 pg/mL±7.14 pg/mL, 对照组为22.86 pg/mL±10.62 pg/mL, 两组比较, 病例组显著低于正常对照组(P<0.001)(表5). D-IBS重叠FD病例组592位点AA、AC、CC、AA+AC基因型血浆IL-10水平差异无统计学意义(P = 0.885>0.05), 592位点AA+AC与CC基因型血浆IL-10水平差异也无统计学意义(P = 0.683>0.05).
| D-IBS重叠FD组IL-10 592位点 | n | 血浆IL-10水平 |
| AA | 77 | 14.50±6.37 |
| AC | 70 | 14.85±7.75 |
| CC | 17 | 14.85±7.75 |
| AC+AC | 147 | 14.68±7.10 |
IL-10是体内最为重要的抑炎因子, 他的水平高低可以影响肠道黏膜的神经敏感性, 因而被认为可能与FGIDs的发病相关. 研究发现[16,17]生理状态下IL-10的水平是与其启动子区域的1082、819、592位点的基因多态性密切相关的, 因而针对FGIDs与IL-10启动子区域基因多态性研究众多, 但尚无定论[18-22]. 本研究针对FGIDs中常见高发的D-IBS重叠FD这一病症研究IL-10血浆水平及其启动子区域多态性与疾病相关性研究目前尚未见有报道. 由于众多研究结果已经证实IL-10启动子区域819位点与592位点紧密连锁[16,17,23-26], 即-592C与-819C连锁存在, -592A与-819T连锁存在, 可根据-592位点基因型得出-819位点基因型, 所以本研究选取了1082位点和592位点进行多态性分析, 结果显示, 592位点基因多态性与D-IBS重叠FD患病相关, AA基因型是CC基因型患病风险的1.989倍, A等位基因携带者(AA+AC基因型)为CC型纯合子的1.808倍, 提示IL-10-592位点C突变为A增加患D-IBS重叠FD的风险. IL-10 1082G/A位点基因型本研究中显示与D-IBS重叠FD无关联, 上述结果与部分国内外关于D-IBS与IL-10基因多态性的研究结果基本一致[21-23,27,28].
592位点与1082位组合分布在对照组与病例组中无显著差异, 在研究中我们也发现-1082A与-592A连锁, 因此本研究共发现了5种基因型组合, GC/AA、GC/AC、AC/AC、AA/AA AA/AC, 和国内外报道相比[16,17,29,30]缺少GC/GC型, 这可能与地域、环境及选择样本的差异有关. 各基因型具体分布和国内报道[16,17,30]也大致一致, 以AA/AA、AA/AC居多, AC/AC、GC/AA、GC/AC较少. IL-10启动子区域的不同的基因型组合是分别对应不同的IL-10分泌水平[17], -1082位点和-592位点的基因型为GC/GC为高分泌型; GC/AC和GC/AA为中分泌型; AC/AC、AC/AA、AA/AA为低分泌型. 由于未检测到高分泌GC/GC型, 将基因组合分为中分泌型和低分泌型两类进行比较, 病例组和对照组也未出现明显差异, 可见IL-10不同分泌水平基因型分布与D-IBS重叠FD无关.
D-IBS重叠FD病例组血浆IL-10平均水平显著低于正常对照组(P<0.01), 可见IL-10水平与D-IBS重叠FD相关, 但将病例组592位点AA、AC、CC、AA+AC基因型IL-10血浆水平进行比较, 无显著差异(P>0.05), 由此推断病例组IL-10血浆水平的降低与病例组592位点基因多态性无关. 研究也证实, IL-10分泌水平主要是受-1082位点多态性影响, 592和819位点只是协助作用[17,31].
本研究初步显示: IL-10-592位点A和IL-10血浆水平降低可能与罹患D-IBS重叠FD有关, 但二者之间并无关联. 这和国内外一些针对IBS的研究结果部分一致, 但他们认为IL-10-592 A影响IL-10水平降低导致疾病发生的机制在本研究中未得到证实[18,21,28]. 我们认为, 在正常生理机制下, IL-10水平表达主要是通过-1082、-819、-592位点的共同作用, 但病理机制下, IL-10水平的调控可能是一种多因素的调控. D-IBS重叠FD的疾病发生本身就受多种因素影响, D-IBS重叠FD的患者比单一D-IBS或FD的人群受到环境与压力的影响更大, 胃肠道症状更为严重. 是否由于外在环境等因素导致IL-10启动子区域出现异常甲基化而导致IL-10血浆水平下降, 亦或由于D-IBS重叠FD人群饮食失调影响IL-10血浆水平, 592A位点基因多态性是否存在其他作用机制影响D-IBS重叠FD, 这些均有待于日后的进一步研究.
功能性消化不良(functional dyspesia, FD)和肠易激综合征(irritable bowel syndrome, IBS)是一组由多因素引起的综合性异质性疾病, 其二者重叠发病率>50%, 其病因和发病机制尚未明确, 无单一发病机制能解释所有的FD和IBS临床症状, 普遍认为和内脏高敏性、胃肠动力功能失调等相关, 近来来随着对FD和IBS研究的深入, 了解其重叠的发病机制将会为FD和IBS的治疗提供新的途径.
陈卫昌, 教授, 苏州大学附属第一医院消化内科
本研究发现白介素-10(interleukin-10, IL-10)-592位点A和IL-10血浆水平降低是罹患D-IBS重叠FD的风险因素, 其作用机制可能是抑炎因子IL-10的失衡导致胃肠高敏感性及动力异常而产生重叠症状.在D-IBS重叠FD的病理机制下, IL-10血浆水平显著降低与IL-10-592位点基因多态性无关联, 其调控的具体机制及-592A位点基因多态性是否存在其他作用机制影响D-IBS重叠FD, 有待于日后的进一步研究.
IL-10是一种人体内极为重要的免疫调节因子, 与肠道炎症及免疫系统关系密切, IL-10敲除的大鼠可发生慢性结肠炎. IL-10的分泌水平与其启动子区域遗传多态性密切相关. 功能性肠病的发生与遗传相关, 众多研究表明IBS患者抑炎细胞因子生成减少的遗传素质在IBS发病机制中具有一定作用, 但结果不完全一致, 这可能与地域、人种、样本量的不同而有所区别.
本文没有针对单一的D-IBS或FD进行研究, 而是着重于高发的二者重叠症状, 将研究对象进一步细化, 从重叠症状产生的可能机制入手, 将IL-10启动子区域基因多态性及IL-10血浆水平结合起来进行了进一步研究分析.
D-IBS重叠FD的产生与抑炎因子IL-10水平的下降相关, 这表明在重叠症的临床治疗上着重抗炎的治疗可能会产生较为显著的效果, 也为D-IBS重叠FD作用机制的研究提供一个较为明确的方向.
IBS: 肠道动力学与内脏感觉异常的胃肠功能性疾病, 是指一组包括有排便习惯改变(腹泻/便秘)、粪便性状异常(稀便、黏液便或硬结便)、腹痛及腹胀等临床表现的症候群, 症状持续存在或间歇发作. 根据排便情况, 肠易激综合征可分为腹泻型、便秘型及腹泻便秘交替型 3 种类型, 其中腹泻型最为常见.
本文具有一定的科学性与研究价值.
编辑: 郭鹏 电编:闫晋利
| 1. | Corsetti M, Caenepeel P, Fischler B, Janssens J, Tack J. Impact of coexisting irritable bowel syndrome on symptoms and pathophysiological mechanisms in functional dyspepsia. Am J Gastroenterol. 2004;99:1152-1159. [PubMed] [DOI] |
| 2. | Kaji M, Fujiwara Y, Shiba M, Kohata Y, Yamagami H, Tanigawa T, Watanabe K, Watanabe T, Tominaga K, Arakawa T. Prevalence of overlaps between GERD, FD and IBS and impact on health-related quality of life. J Gastroenterol Hepatol. 2010;25:1151-1156. [PubMed] [DOI] |
| 3. | Wang A, Liao X, Xiong L, Peng S, Xiao Y, Liu S, Hu P, Chen M. The clinical overlap between functional dyspepsia and irritable bowel syndrome based on Rome III criteria. BMC Gastroenterol. 2008;8:43. [PubMed] [DOI] |
| 4. | Park H. Functional gastrointestinal disorders and overlap syndrome in Korea. J Gastroenterol Hepatol. 2011;26 Suppl 3:12-14. [PubMed] [DOI] |
| 5. | Zhao Y, Zou D, Wang R, Ma X, Yan X, Man X, Gao L, Fang J, Yan H, Kang X. Dyspepsia and irritable bowel syndrome in China: a population-based endoscopy study of prevalence and impact. Aliment Pharmacol Ther. 2010;32:562-572. [PubMed] [DOI] |
| 6. | Matsuzaki J, Suzuki H, Fukushima Y, Hirata K, Fukuhara S, Okada S, Hibi T. High frequency of overlap between functional dyspepsia and overactive bladder. Neurogastroenterol Motil. 2012;24:821-827. [PubMed] [DOI] |
| 7. | Suzuki H, Hibi T. Overlap syndrome of functional dyspepsia and irritable bowel syndrome - are both diseases mutually exclusive? J Neurogastroenterol Motil. 2011;17:360-365. [PubMed] [DOI] |
| 8. | Gwee KA, Chua AS. Functional dyspepsia and irritable bowel syndrome, are they different entities and does it matter? World J Gastroenterol. 2006;12:2708-2712. [PubMed] |
| 9. | Outlaw WM, Koch KL. Dyspepsia and its overlap with irritable bowel syndrome. Curr Gastroenterol Rep. 2006;8:266-272. [PubMed] [DOI] |
| 10. | Park CS, Uhm JH. Polymorphisms of the Serotonin Transporter Gene and G-Protein β3 Subunit Gene in Korean Children with Irritable Bowel Syndrome and Functional Dyspepsia. Gut Liver. 2012;6:223-228. [PubMed] [DOI] |
| 11. | Frissora CL, Koch KL. Symptom overlap and comorbidity of irritable bowel syndrome with other conditions. Curr Gastroenterol Rep. 2005;7:264-271. [PubMed] [DOI] |
| 12. | Camilleri M. Genetics and irritable bowel syndrome: from genomics to intermediate phenotype and pharmacogenetics. Dig Dis Sci. 2009;54:2318-2324. [PubMed] [DOI] |
| 13. | Hotoleanu C, Popp R, Trifa AP, Nedelcu L, Dumitrascu DL. Genetic determination of irritable bowel syndrome. World J Gastroenterol. 2008;14:6636-6640. [PubMed] [DOI] |
| 14. | Xie J, Wang S, He B, Pan Y, Li Y, Zeng Q, Jiang H, Chen J. Association of estrogen receptor alpha and interleukin-10 gene polymorphisms with endometriosis in a Chinese population. Fertil Steril. 2009;92:54-60. [PubMed] [DOI] |
| 15. | Perrey C, Turner SJ, Pravica V, Howell WM, Hutchinson IV. ARMS-PCR methodologies to determine IL-10, TNF-alpha, TNF-beta and TGF-beta 1 gene polymorphisms. Transpl Immunol. 1999;7:127-128. [PubMed] [DOI] |
| 18. | Gonsalkorale WM, Perrey C, Pravica V, Whorwell PJ, Hutchinson IV. Interleukin 10 genotypes in irritable bowel syndrome: evidence for an inflammatory component? Gut. 2003;52:91-93. [PubMed] [DOI] |
| 19. | van der Veek PP, van den Berg M, de Kroon YE, Verspaget HW, Masclee AA. Role of tumor necrosis factor-alpha and interleukin-10 gene polymorphisms in irritable bowel syndrome. Am J Gastroenterol. 2005;100:2510-2516. [PubMed] [DOI] |
| 20. | Barkhordari E, Rezaei N, Mahmoudi M, Larki P, Ahmadi-Ashtiani HR, Ansaripour B, Alighardashi M, Bashashati M, Amirzargar AA, Ebrahimi-Daryani N. T-helper 1, T-helper 2, and T-regulatory cytokines gene polymorphisms in irritable bowel syndrome. Inflammation. 2010;33:281-286. [PubMed] [DOI] |
| 23. | Ma SL, Tang NL, Lam LC, Chiu HF. The association between promoter polymorphism of the interleukin-10 gene and Alzheimer's disease. Neurobiol Aging. 2005;26:1005-1010. [PubMed] [DOI] |
| 24. | Kusumoto K, Uto H, Hayashi K, Takahama Y, Nakao H, Suruki R, Stuver SO, Ido A, Tsubouchi H. Interleukin-10 or tumor necrosis factor-alpha polymorphisms and the natural course of hepatitis C virus infection in a hyperendemic area of Japan. Cytokine. 2006;34:24-31. [PubMed] [DOI] |
| 25. | Scarpelli D, Cardellini M, Andreozzi F, Laratta E, Hribal ML, Marini MA, Tassi V, Lauro R, Perticone F, Sesti G. Variants of the interleukin-10 promoter gene are associated with obesity and insulin resistance but not type 2 diabetes in caucasian italian subjects. Diabetes. 2006;55:1529-1533. [PubMed] [DOI] |
| 26. | Okayama N, Hamanaka Y, Suehiro Y, Hasui Y, Nakamura J, Hinoda Y. Association of interleukin-10 promoter single nucleotide polymorphisms -819 T/C and -592 A/C with aging. J Gerontol A Biol Sci Med Sci. 2005;60:1525-1529. [PubMed] [DOI] |
| 27. | Lee HJ, Lee SY, Choi JE, Kim JH, Sung IK, Park HS, Jin CJ. G protein beta3 subunit, interleukin-10, and tumor necrosis factor-alpha gene polymorphisms in Koreans with irritable bowel syndrome. Neurogastroenterol Motil. 2010;22:758-763. [PubMed] [DOI] |
| 29. | Tabibzadeh S, Becker JL, Parsons AK. Endometriosis is associated with alterations in the relative abundance of proteins and IL-10 in the peritoneal fluid. Front Biosci. 2003;8:a70-a78. [PubMed] [DOI] |