修回日期: 2014-06-09
接受日期: 2014-06-22
在线出版日期: 2014-08-18
目的: 观察恩替卡韦(entecavir, ETV)初治慢性乙型肝炎(chronic hepatitis B, CHB)患者体内乙型肝炎病毒(hepatitis B virus, HBV)基因型的变化情况.
方法: 选取中山大学附属第三医院随访门诊38例留有系列血清的ETV初治CHB患者为研究对象, 其中14例留有基线血清, 检测ETV初治基线、1、3、6、9、12、24 mo时间点的血清. 标本经提取HBV DNA, 巢氏PCR扩增HBV逆转录酶(reverse transcriptase, RT)区基因, 凝胶电泳鉴定后行基因测序及基因型分型.
结果: 38例患者, 100份血清纳入分析, 所测血清标本中, 基因型B型80例, C型20例, 未发现其他如A、D、E、F、G、H、I、J等基因型. 11例(28.9%)患者在ETV抗病毒治疗过程中基因型发生了改变, 6例从C型变成B型, 5例从B型变成C型. 14例留有基线血清的患者中, 5例患者基因型发生了改变, 2例从B型变为C型, 3例从C型变为B型, 进化树分析显示这些患者在基线与基因型改变时间点的基因序列的遗传距离也发生改变.
结论: ETV初治CHB患者HBV基因型可发生改变, 但其原因及意义有待于进一步研究.
核心提示: 恩替卡韦(entecavir)初治慢性乙型肝炎(chronic hepatitis B)基因型可发生改变, 不同的患者基因型改变的时间不一, 且基因型的改变表现为同一流行区内的基因型转变, 并没有改变成其他流行区的基因型.
引文著录: 罗杰, 李新华, 杜展, 林国莉, 敖云龙, 庞毅华, 吴元凯, 李向永, 崇雨田. 恩替卡韦初治慢性乙型肝炎患者HBV基因型变化情况. 世界华人消化杂志 2014; 22(23): 3484-3489
Revised: June 9, 2014
Accepted: June 22, 2014
Published online: August 18, 2014
AIM: To investigate the hepatitis B virus (HBV) genotype changes in entecavir (ETV)-naïve chronic hepatitis B (CHB) patients.
METHODS: Thirty-eight ETV-naïve CHB patients treated and followed at our hospital were retrospectively analyzed. Blood serum samples were collected at months 0, 1, 3, 6, 9, 12, and 24. HBV DNA was retrieved from those samples and subjected to amplification, sequencing, and genotyping.
RESULTS: A total of 100 serum samples were collected from 38 CHB patients included in this study. Among all detected serum samples, genotype B was detected in 80 cases, genotype C was detected in 20 cases, and genotypes A, D, E, F, G, H, I and J were not detected in those samples. HBV genotype was detected to switch among 11 ETV-naïve patients. Six patients changed from genotype C to genotype B, and 5 cases switched from genotype B to genotype C. Of 14 patients who had reserved baseline serum, HBV genotype changed in 5 patients, including 2 patients switching from genotype B to genotype C and 3 patients from genotype C to genotype B. Phylogenetic analysis showed that the genetic distance of genetic sequences changed between baseline and the time point when HBV genotype changed.
CONCLUSION: HBV genotype may change in ETV-naive CHB patients, and the mechanisms require further investigation.
- Citation: Luo J, Li XH, Du Z, Lin GL, Ao YL, Pang YH, Wu YK, Li XY, Chong YT. HBV genotype changes in entecavir-naïve chronic hepatitis B patients. Shijie Huaren Xiaohua Zazhi 2014; 22(23): 3484-3489
- URL: https://www.wjgnet.com/1009-3079/full/v22/i23/3484.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i23.3484
乙型肝炎病毒(hepatitis B virus, HBV)在复制过程中, 缺乏有效的校正酶的作用, 容易发生病毒突变, 突变的累积可产生不同的基因型. 目前鉴定的HBV基因型有A-J 10种[1], 基因型的分布有一定的地域性, 我国主要以B型和C型为主. 不同的基因型不仅影响着HBV疾病的进程, 也影响着抗病毒药物的疗效[2], 特别是对干扰素(interferon, IFN)治疗的患者而言, HBV基因型可作为IFN治疗慢性乙型肝炎(chronic hepatitis B, CHB)是否获得持续病毒学应答重要的基线预测因子之一. 同样, 相关研究提示[3,4]拉米夫定、阿德福韦酯治疗CHB过程中, 患者体内的HBV基因型会发生改变, 但其原因还不甚清楚. 恩替卡韦(entecavir, ETV)是强效高耐药屏障的口服抗HBV药物, 抗病毒疗效优于拉米夫定、阿德福韦酯, 但ETV是否会引起内患者体内HBV基因型的改变不甚清楚? 因此, 本研究目的探讨ETV初治CHB过程中患者体内HBV基因型的变化情况.
回顾性分析2006-06/2011-11中山大学附属第三医院感染科门诊CHB随访患者, 均符合《慢性乙型肝炎防治指南2010版》的诊断标准, 且使用ETV单药抗病毒治疗. 入选标准: 年龄18-65岁, 治疗前乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)阳性持续>6 mo, HBV DNA>2000 IU/mL, 丙氨酸氨基转移酶(alamine aminotransferase, ALT)>2倍正常值上限, ETV治疗3 mo以上, 选取3、6、9、12 mo时间点HBV DNA>100 IU/mL, 随访过程中保存有系列血清. 排除标准: 合并其他肝炎病毒感染, 合并人免疫缺陷病毒(human immunodeficiency virus, HIV)感染, 合并酒精性肝病、药物性肝病、自身免疫性肝病等可引起肝功能异常的情况, 排除孕妇及哺乳期妇女以及其他可能影响研究进行的情况. 患者均被详细告知治疗过程中长期服药、病毒耐药可能引起的不良反应及病情变化, 并签署知情同意书. ETV治疗总人数为385例, 其中347例患者不满足入组条件: 31例患者ETV治疗不足3 mo, 38例患者基线资料不全, 3、6、9、12 mo HBV DNA<100 IU/mL 269例, 47例患者无系列血清, 故最终38例有系列血清的患者纳入分析. 血清DNA提取试剂盒(E.Z.N.A. Viral DNA Kit试剂盒)及PCR产物纯化回收试剂盒(E.Z.N.A. Gel Extraction Kit试剂盒)均购自美国OMEGA公司; Platinum® TaqDNA聚合酶、10 mmol/L dNTP、ddH2O、Agarose、SYBR® SAFE DNA GEL STAIN均购自美国Invitrogen公司; DNA Marker 100 bp购自北京全式金生物技术有限公司; HBV DNA实时荧光定量检测试剂盒购自中山大学达安基因有限公司; ABI 3730XL测序仪、ABI Gene Amp PCR System 9700 PCR仪购自美国ABI公司; Thermo EC250-90型电泳仪购自美国Thermo公司; Milli-Q超纯水系统购自美国Millipore公司; 紫外照相分析系统购自天能科技(上海)有限公司.
1.2.1 HBV DNA水平检测: 患者随访过程中, 常规HBV DNA检测均由中山大学附属第三医院肝病实验室完成, 实时荧光定量PCR方法按照试剂盒要求进行操作.
1.2.2 巢式PCR扩增HBV RT/S区: (1)HBV DNA提取: 严格按照E.Z.N.A. Viral DNA Kit试剂盒所附说明书提取外周血病毒DNA; (2)巢式PCR扩增: 采用Primer Premier5.0软件, 设计包括HBV S区及RT区全长的扩增引物如下. 引物由英潍捷基(Invitrogen)上海贸易有限公司合成. 扩增的HBV片段长度为1202 bp(nt 56-nt 1258), 包含HBV RT基因(nt 130-nt 1161)和S基因(nt 155-nt 835). 引物序列信息如下: 外侧引物5'-CCTGCTGGTGGCTCCAGTTCCG-3'(forward, nt 56-77), 和5'-AGGAGTTCCGCAGTATGGATCGGCAG-3'(reverse, nt 1283-1258); 内侧引物5'-CCATATCGTCAATCTTCTCGA-3'(forward, nt 111-131), 和5'-CCCGTGGGGGTTGCGTCAGCAA-3'(reverse, nt 1205-1184). 巢式PCR方法: 第一轮PCR反应体系: 以外侧引物配制Supermix, 混匀后分配到反应管中, 每管25 μL, 最后加入DNA模板5 μL. 反应体系为: 10×PCR缓冲液2.5 μL、10 mmol/L dNTP混合液0.5 μL、50 mmol/L MgCl2 0.75 μL、外侧引物1(5 μmol/L) 1 μL、外侧引物2(5 μmol/L) 1 μL、Platinum® Taq DNA聚合酶0.25 μL、模板DNA 5 μL、加入灭菌蒸馏水14 μL使反应体系总体积至25 μL. 反应条件为: 95 ℃预变性5 min, 95 ℃变性15 s, 55 ℃退火30 s, 68 ℃延伸2.5 min, 30个循环. 然后以第一轮PCR产物为模板, 分别以内侧引物, 配置第二轮PCR反应体系, 反应体系除模板及引物外, 其余成分同第一轮, 反应条件同第一轮. 第二轮扩增产物用0.8%的琼脂糖胶鉴定.
1.2.3 基因分型: 对PCR产物送英潍捷基(Invitrogen)上海贸易有限公司进行双向测序, 以肝炎病毒数据库(http://www.ncbi.nlm.nih.gov/projects/genotyping/formpage.cgi)的标准序列为参照进行HBV基因分型, 应用Vector NTI 9软件的Alignx程序并结合Condoncode软件对测序结果与NCBI Genbank中参考序列进行比对, 用MEGA4软件对14例有基线血清的标本RT/S基因序列进行进化树分析.
统计学处理 采用SPSS13.0软件分析, 将测得的各组HBV DNA定量进行对数转换, 计量资料正态分布数据采用mean±SD表示, 非正态分布数据采用中位数表示, 两组比较采用t检验, 计数资料(n<40)采用Fisher精确概率法检验, 率的比较采用χ2检验. P<0.05表示差异有统计学意义.
38例CHB患者中男性33例, 占86.8%, 平均年龄38.2岁, 平均体质量指数22.6 kg/m2, 有乙型肝炎家族史29例, 占76.3%, 肝硬化3例, 占10.7%, 肝癌2例, 占5.26%. 27例乙型肝炎e抗原(hepatitis B e antigen, HBeAg)阳性患者中, 基线ALT水平163.8 U/L±285.5 U/L, 基线HBV DNA水平7.3 log10 IU/mL±1.0 log10 IU/mL, 11例HBeAg阴性患者中, 基线ALT水平和HBV DNA水平分别为158.8 U/L±151.9 U/L、7.1 log10 IU/mL±0.8 log10 IU/mL, 其一般情况如表1所示.
| 临床参数 | HBeAg阳性 | HBeAg阴性 | P值 |
| n | 27 | 11 | |
| 年龄(mean±SD, 岁) | 37.63±10.1 | 39.5±15.0 | 0.908 |
| 性别[男, n(%)] | 23(85.2) | 10(90.9) | 0.545 |
| 体质量指数(kg/m2) | 23.4±2.4 | 20.7±2.8 | 0.027 |
| 乙型肝炎家族史(%) | 21(77.8) | 7(63.6) | 0.305 |
| 随访时间(中位数, mo) | 19(3-41) | 17(3-40) | 0.823 |
| 乙型肝炎肝硬化n(%) | 2(7.4) | 5(45.5) | 0.014 |
| 肝癌n(%) | 1(3.7) | 1(9.1) | 0.501 |
| 基线ALT(U/L) | 163.8±285.5 | 158.8±151.9 | 0.998 |
| 基线HBV DNA(log10 IU/mL) | 7.3±1.0 | 7.1±0.8 | 0.697 |
38例患者留有血清110份, 提取血清标本病毒DNA后, 经两次PCR, 取第二轮PCR产物25 μL与6×上样缓冲液按照比例混合后, 用微量移液器缓慢加入凝胶样品池中, 并加入DNA Marker, 电泳鉴定, 在1200 bp附近出现阳性条带. 部分PCR产物凝胶电泳图如图1所示. 血清标本110份中, 1份血清标本(37和44号标本)重复; 4份血清标本(分别为1、3、24、106号标本)未扩增出条带; 49号、51号、81号、86号和90号标本引物测序出现双峰, 可能由于样本在实验过程中被污染, 造成样品不纯, 被剔除; 不纳入本研究, 因此最终38例患者、100份血清标本纳入分析.
38例患者全部100份标本经测序及基因型鉴定, 其中B型占80%, C型占20%, 未发现A、D、E、F、G、H、I、J等基因型. 其中11例(28.9%)患者在ETV治疗后基因型发生了改变, 6例从C型变成B型, 5例从B型变成C型. 11例HBV基因型发生改变的分布情况如表2所示. 11例基因型发生改变患者的RT区出现不同程度的点突变, 其中主要的变异位点为rtS223A/T、rtI224V、rtN238T/H、rtT128A、rtM/L145L/V, 并没有出现常见ETV耐药位点(rtM204V/I, rtI169T, rtT184A/F/G/I/L, rtS202G/I, rtL180M/C、rtM250V、rtI169T、rtS213T、rtS/C256G)的基因突变. 11例基因型改变患者逆转录酶区核苷酸变异位点如表3所示.
| 患者编号 | 样本编号 | 基因型 | ||||||
| 基线 | 1 mo | 3 mo | 6 mo | 9 mo | 12 mo | 24 mo | ||
| 2 | 26/43/54 | C | C | B | ||||
| 4 | 7/58/29/59/60 | B | C | B | B | B | ||
| 6 | 42/53 | B | C | |||||
| 10 | 78/76 | C | B | |||||
| 13 | 77/102 | C | B | |||||
| 15 | 57/36 | C | B | |||||
| 23 | 67/87/84 | C | C | B | ||||
| 28 | 20/21/31/13 | B | B | B | C | |||
| 29 | 99/71/70 | C | C | B | ||||
| 32 | 40/23 | B | C | |||||
| 34 | 69/107/73 | B | B | C | ||||
| 变异位点 | 氨基酸替换 | 频数n(%) |
| rt106 | S→C | 3(2.75) |
| rt109 | P→S | 1(0.92) |
| rt123 | N→D | 3(2.75) |
| rt124 | Y→H | 3(2.75) |
| rt127 | G→R | 1(0.92) |
| rt128 | T→A | 4(3.67) |
| rt134 | N→D | 1(0.92) |
| rt135 | S→A | 1(0.92) |
| rt145 | M/L→L/V | 4(3.67) |
| rt151 | F→Y | 1(0.92) |
| rt164 | L→F | 1(0.92) |
| rt191 | V→L | 1(0.92) |
| rt207 | V→M | 1(0.92) |
| rt219 | S→A | 1(0.92) |
| rt223 | S→A/T | 10(9.17) |
| rt224 | I→V | 7(6.42) |
| rt238 | N→T/H | 6(5.50) |
| rt250 | M→W | 1(0.92) |
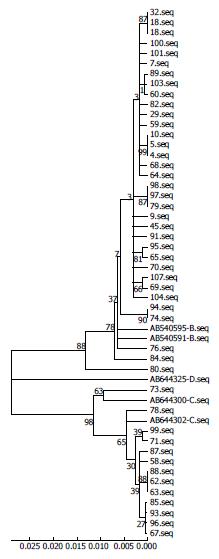
对14例有基线系列血清的患者PCR标本经测序后, 选取肝炎病毒数据库中2例基因型B(编号为AB40595、AB40591)、2例基因型C(编号为AB644300、AB644302)、1例基因型D(编号为AB644325)为对照, 进化树分析结果显示发生基因型改变的患者, 基线与基因型改变时间点的序列分支的遗传距离发生改变, 如图2所示.
HBV基因型是根据HBV全基因组核苷酸序列差异≥8%或S区基因序列差异≥4%来分类的, HBV目前已经鉴定出A-J等10个基因型[1], 基因型的分布有一定的地域性[5,6], 我国主要以B基因型和C基因型为主[7], 而且存在着混合型感染[8]. 本研究38例CHB患者100份血清标本通过检测基因型结果为基因型B或C型, 未见其他基因型, 这也进一步证实了上述观点.
本研究随访检测系列血清发现, 38例患者中有11例患者在ETV治疗过程中出现基因型改变, 6例从C型变成B型, 5例B型变成C型. 而且在治疗的不同时间发生, 其中1例在1 mo时发生改变, 4例在3 mo时发生改变, 3例在6 mo时发生改变, 3例在2年时发生基因型改变. 自然状态下, CHB患者的基因型一般是不会发生改变的[3], 由于HBV在复制过程中要积累到8%的随机突变要一定时间. 但在外力抗病毒药物的干预下, 病毒优势株发生改变, 当变异累积到一定程度, 基因型可能发生变化, 但没有引起耐药突变. 我国学者卢建溪等[4]在ADV抗HBV治疗的研究中, 观察到基因型发生转变的现象. 温志立等[9]也报道了52例ADV抗病毒的CHB患者中, 有1例患者基因型从B型转向B+C混合型. Gerner等[10]观察到IFN治疗的CHB儿童中发生基因型从A型向D型的转变. Jardi等[3]的研究也证实了抗病毒药物的作用下, 体内的基因型可发生改变. 可能是HBV在药物选择的压力下, HBV病毒株之间的突变发生, 并出现新的优势株以适应环境的改变.
本研究观察到ETV抗病毒治疗后, 不同的患者发生基因型改变的时间不同. 有患者在短时间内发生基因型的转换, 有的在较长时间内发生基因型的改变, 这可能由于不同患者对药物的敏感性不同, 或者患者的依从性影响了药物的作用. 另外, 本研究也观察到患者在抗病毒过程中, 基因型发生B-C-B的改变, 卢建溪等[4]的报道也提示了同样的结果. 究其原因, 可能与混合基因型的存在有关. 在ETV抗病毒治疗前, 患者体内存在混合基因型感染, 但以某种优势株更容易被检测出来, 经过一定时间的抗病毒治疗后, HBV复制被抑制, 体内的优势株发生改变, 导致检测出不同的基因型. 另外, HBV具有准种的特性, 经过抗病毒治疗后, HBV准种复杂性和多样性均发生改变, 从而表现为不同的基因型优势. 此外, 基因型的改变表现为同一流行区内的基因型转变, 并没有改变成其他地区的基因型, 如B型改变成C型, 并没有改变成F型D型, 这种现象的发生是否与物种的进化有关, 原因不甚清楚, 有待于更深入的研究.
HBV基因型改变是否影响到抗病毒疗效?研究表明不同的基因型抗病毒药物的疗效不一, 尤其是影响到IFN的疗效. 台湾的研究[11]结果提示IFNα-2b治疗CHB患者, 基因型B患者取得病毒学应答率(41%)高于基因型C患者(15%), Erhardt等[12]研究提示IFNα治疗CHB患者HBV基因型A较基因型D能取得更好的病毒学应答. Akuta等[13]在关于LAM的研究中发现, 不同HBV基因型患者发生耐药的几率不同. 而Zeuzem等[14]研究结果与之不同. 这亦是大多数研究者在使用核苷(酸)类似物抗HBV治疗的同时, 一般不会结合基因型的情况来决定治疗方案[15-18], 而且本研究并没有检测到ETV常见耐药变异的发生. 由于基线血清标本的数量较少, 本研究并没有比较不同基因型CHB患者之间病毒学应答的异同, 我们将在后续的研究中扩大样本量, 进一步观察HBV基因型的改变是否影响ETV抗病毒疗效.
因此, CHB患者在ETV抗病毒治疗后基因型可发生改变, 至于何种原因导致了基因型改变、基因型改变是否具有重要的生物学意义, 这些都需要更进一步的研究.
乙型肝炎病毒(hepatitis B virus, HBV)基因型分布存在地域性, 我国主要以B、C基因型为主. 自然状态下, HBV基因型一般不会发生改变, 然而在核苷(酸)类似物抗HBV治疗过程中, HBV基因型可能发生改变.
周陶友, 副教授, 四川大学华西医院感染性疾病中心.
恩替卡韦是一种高效、低耐药的抗HBV药物, 临床实践中观察到恩替卡韦治疗不同的慢性乙型肝炎(chronic hepatitis B, CHB)患者疗效不同, HBV基因型及HBV准种的变化是否影响恩替卡韦抗病毒疗效值得进一步研究.
Jardi等观察到CHB患者经过拉米夫定或/和阿德福韦酯抗病毒治疗后, HBV基因型A和G之间可发生相互转变; 温志立观察到阿德福韦酯抗病毒治疗1年后乙型肝炎病毒基因型发生变化的情况.
该研究紧密结合临床, 观察到CHB患者在恩替卡韦抗病毒治疗过程中HBV基因型发生改变.
HBV基因型的改变是否影响到恩替卡韦抗HBV疗效, 是否增加恩替卡韦耐药的几率值得进一步研究, 这将为恩替卡韦疗效预测及个体化治疗方案的实施提供新的参考价值.
HBV基因型: 根据HBV全基因组核苷酸序列差异≥8%或S区基因序列差异≥4%来分类的, HBV目前已经鉴定出A-J等10个基因型.
本研究提示恩替卡韦治疗CHB过程中, 出现HBV基因型的漂移, 该文选题紧密结合临床实践, 具有一定的新颖性和临床指导意义.
编辑 郭鹏 电编 都珍珍
| 1. | Mahtab MA, Rahman S, Khan M, Karim F. Hepatitis B virus genotypes: an overview. Hepatobiliary Pancreat Dis Int. 2008;7:457-464. [PubMed] |
| 2. | Lin CL, Kao JH. The clinical implications of hepatitis B virus genotype: Recent advances. J Gastroenterol Hepatol. 2011;26 Suppl 1:123-130. [PubMed] |
| 3. | Jardi R, Rodriguez-Frias F, Schaper M, Giggi E, Tabernero D, Homs M, Esteban R, Buti M. Analysis of hepatitis B genotype changes in chronic hepatitis B infection: Influence of antiviral therapy. J Hepatol. 2008;49:695-701. [PubMed] [DOI] |
| 5. | Kurbanov F, Tanaka Y, Mizokami M. Geographical and genetic diversity of the human hepatitis B virus. Hepatol Res. 2010;40:14-30. [PubMed] [DOI] |
| 6. | McMahon BJ. The influence of hepatitis B virus genotype and subgenotype on the natural history of chronic hepatitis B. Hepatol Int. 2009;3:334-342. [PubMed] [DOI] |
| 7. | Zhu CT, Dong CL. Characteristics of general distribution of hepatitis B virus genotypes in China. Hepatobiliary Pancreat Dis Int. 2009;8:397-401. [PubMed] |
| 8. | Araujo NM, Waizbort R, Kay A. Hepatitis B virus infection from an evolutionary point of view: how viral, host, and environmental factors shape genotypes and subgenotypes. Infect Genet Evol. 2011;11:1199-1207. [PubMed] [DOI] |
| 10. | Gerner PR, Friedt M, Oettinger R, Lausch E, Wirth S. The hepatitis B virus seroconversion to anti-HBe is frequently associated with HBV genotype changes and selection of preS2-defective particles in chronically infected children. Virology. 1998;245:163-172. [PubMed] [DOI] |
| 11. | Kao JH, Wu NH, Chen PJ, Lai MY, Chen DS. Hepatitis B genotypes and the response to interferon therapy. J Hepatol. 2000;33:998-1002. [PubMed] |
| 12. | Erhardt A, Blondin D, Hauck K, Sagir A, Kohnle T, Heintges T, Häussinger D. Response to interferon alfa is hepatitis B virus genotype dependent: genotype A is more sensitive to interferon than genotype D. Gut. 2005;54:1009-1013. [PubMed] |
| 13. | Akuta N, Suzuki F, Kobayashi M, Tsubota A, Suzuki Y, Hosaka T, Someya T, Kobayashi M, Saitoh S, Arase Y. The influence of hepatitis B virus genotype on the development of lamivudine resistance during long-term treatment. J Hepatol. 2003;38:315-321. [PubMed] |
| 14. | Zeuzem S, Gane E, Liaw YF, Lim SG, DiBisceglie A, Buti M, Chutaputti A, Rasenack J, Hou J, O'Brien C. Baseline characteristics and early on-treatment response predict the outcomes of 2 years of telbivudine treatment of chronic hepatitis B. J Hepatol. 2009;51:11-20. [PubMed] [DOI] |
| 15. | Cooksley WG. Do we need to determine viral genotype in treating chronic hepatitis B? J Viral Hepat. 2010;17:601-610. [PubMed] [DOI] |
| 16. | Raimondi S, Maisonneuve P, Bruno S, Mondelli MU. Is response to antiviral treatment influenced by hepatitis B virus genotype? J Hepatol. 2010;52:441-449. [PubMed] [DOI] |
| 17. | Lin CL, Kao JH. Hepatitis B viral factors and treatment responses in chronic hepatitis B. J Formos Med Assoc. 2013;112:302-311. [PubMed] [DOI] |
| 18. | Liu CJ, Kao JH. Global perspective on the natural history of chronic hepatitis B: role of hepatitis B virus genotypes A to J. Semin Liver Dis. 2013;33:97-102. [PubMed] [DOI] |