修回日期: 2014-06-16
接受日期: 2014-07-01
在线出版日期: 2014-08-18
目的: 探讨c-Jun氨基末端激酶(c-Jun N-terminal kinase)抑制剂-SP600125在游离脂肪酸(free fatty acids, FFA)诱导的肝星状细胞(hepatic stellate cell, HSC)凋亡中的作用.
方法: 采用MTT比色法检测FFA对HSC细胞生长的抑制作用; 流式细胞技术(flow cytometry, FCM)检测HSC细胞凋亡率; 蛋白质印迹(Western blot)法检测p-JNK、p-c-Jun蛋白表达, 比较在FFA作用下及SP600125阻断JNK信号通路情况下上述蛋白的表达水平.
结果: 与对照组比较, FFA可诱导HSC细胞凋亡, 差异具有统计学意义(P<0.05); FFA诱导HSC细胞凋亡过程中, p-JNK和p-c-Jun蛋白显著增加(P<0.05); 用SP600125预处理HSC细胞后, p-JNK和p-c-Jun蛋白含量较未处理组明显减少(P<0.05).
结论: FFA可诱导HSC细胞凋亡; 凋亡过程可能系通过JNK通路实现; JNK抑制剂-SP600125可能通过抑制JNK通路阻止HSC细胞凋亡, 有望成为治疗非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)的新型药物.
核心提示: 体外实验已经应用游离脂肪酸(free fatty acid, FFA)诱导产生非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)模型. 该过程可能系FFA诱导了肝细胞的凋亡, 但通过那条信号传导通路起作用仍不清楚. c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)能介导多种胞外刺激来诱导的细胞凋亡, 但JNK是否参与FFA诱导的肝细胞的凋亡鲜有报道. 本文旨在探讨JNK抑制剂-SP600125在FFA诱导的肝星状细胞(hepatic stellate cell)凋亡中的作用及可能机制; 为治疗NASH的新药开发奠定实验基础.
引文著录: 王珣, 王明林, 鲁新耀, 张鹏, 于红刚, 胡义奎. SP600125抑制FFA诱导的肝星状细胞凋亡及可能机制. 世界华人消化杂志 2014; 22(23): 3435-3439
Revised: June 16, 2014
Accepted: July 1, 2014
Published online: August 18, 2014
AIM: To elucidate the potential effects of c-Jun amino terminal kinase (JNK) inhibitor SP600125 on apoptosis induced by free fatty acids (FFAs) in hepatic stellate cells and the possible mechanism.
METHODS: MTT assay was used to analyze the inhibitory effect of FFAs on growth of hepatic stellate cells, and flow cytometry was used to observe the apoptotic rate of the cells. The expression of p-JNK and p-c-Jun proteins was detected by Western blot assay.
RESULTS: The growth of hepatic stellate cells was significantly inhibited by FFAs in vitro, and FFAs increased the expression of p-JNK and p-c-Jun. JNK inhibitor SP600125 suppressed FFA-induced up-regulation of p-JNK and p-c-Jun.
CONCLUSION: FFAs can inhibit the proliferation of hepatic stellate cells and induce cell apoptosis, which involves the JNK signaling pathway.
- Citation: Wang X, Wang ML, Lu XY, Zhang P, Yu HG, Hu YK. JNK inhibitor SP600125 suppresses free fatty acid-induced apoptosis of hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2014; 22(23): 3435-3439
- URL: https://www.wjgnet.com/1009-3079/full/v22/i23/3435.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i23.3435
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)以脂质代谢和炎症反应为特征[1-3]. 游离脂肪酸(free fatty acid, FFA)体内的脂质代谢物质, 研究显示[4,5]: FFA和NASH的发生关系密切, 体外实验已经应用FFA诱导产生NASH模型. 该过程可能系FFA诱导了肝细胞的凋亡, 但具体机制不清, FFA通过那条信号传导通路起作用仍需进一步深入研究[6,7]. c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)是丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)超家族成员; JNK能介导多种胞外刺激来诱导的细胞凋亡, 参与了多种细胞凋亡的发生[8-12], 但JNK是否参与FFA诱导的肝细胞的凋亡鲜有报道. 本文旨在探讨JNK抑制剂-SP600125在FFA诱导的肝星状细胞(hepatic stellate cell, HSC)凋亡中的作用及可能机制; 为治疗NASH的新药开发奠定实验基础.
人HSC购自美国标准生物品收藏中心. DMEM培养基、胎牛血清、胰酶购自北京中杉生物公司. 棕榈树(PA)购自美国Sigma公司. SP600125试剂(产品编号: S1876, 规格: 5 mg/支)购自上海浩然生物技术有限公司. p-JNK、p-c-Jun多克隆抗体购自美国Santa Cruz公司. MTT试剂盒及Western blot试剂盒购自深圳晶美生物公司.
1.2.1 细胞培养: 用含20%的胎牛血清的DMEM完全培养基稀释细胞悬液, 并留取少量的HSC细胞进行纯度及活力鉴定. 以1×105-1×106 mL的密度接种到50 mL塑料培养瓶中, 在37 ℃、体积分数为5%CO2, 95%潮湿空气的CO2恒温培养箱里进行培养. 培养瓶内HSC细胞24 h后第1次换新鲜DMEM培养液, 以后每3 d换液1次, 培养液改为含10%胎牛血清的DMEM完全培养基. 3-4 d消化传代. 选择生长状态良好的HSC细胞用于实验.
1.2.2 实验分组与处理: 将传代HSC细胞分3组: (1)对照组(NC); (2)FFA干预组(以0.5 mmol/L的棕榈酸PA进行干预); (3)FFA+SP600125组(20 μmol/L的SP600125预先孵育1 h, 再以0.5 mmol/L的PA干预).
1.2.3 MTT比色法检测HSC细胞增殖活力: 以MTT和二甲基亚砜(DMSO), 在490 nm波长下检测HSC细胞12、24、48 h生长抑制率.
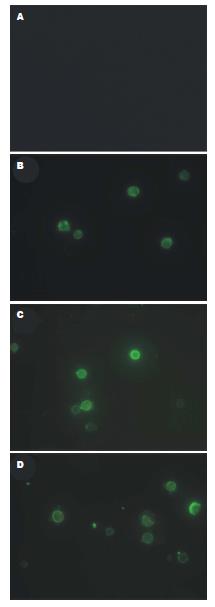
1.2.4 荧光显微镜检测HSC细胞凋亡: 收集HSC细胞数目约为106, 用冷PBS洗涤2次, 用4%甲醛4 ℃固定10 min后涂片、晾干. 以Annexin V-FITC、PI双染细胞, 荧光显微镜下观察荧光染色. AnnexinV-FITC荧光信号呈绿色, 而PI呈红色.
1.2.5 细胞凋亡定量分析: 收集HSC细胞, 加入Annexin V-FITC及PI进行双染色, 运用流式细胞技术(FCM)定量分析, 计算出双染阳性细胞百分比.
1.2.6 Western blot测定p-JNK、p-c-Jun蛋白水平: 以细胞裂解液裂解HSC细胞, 运用苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)提取蛋白. 10%SDS-PAGE分离蛋白, 转膜. 以1:300的p-JNK、p-c-Jun鼠抗人单克隆抗体, 4 ℃过夜孵育. 随后用1:2000的二抗孵育, ECL发光、照相. 条带采用BandScan分析软件测定灰度值, 以β-actin作为内参, 计算相对蛋白含量.
统计学处理 运用SPSS19.0统计软件进行分析, 正态计量资料以mean±SD表示; 细胞增殖抑制率的比较采用重复测量数据的方差分析(ANOVA); 组间比较采用单因素方差分析(one-way ANOVA); 两两比较采用SNK-q法. P<0.05为差异有统计学意义.
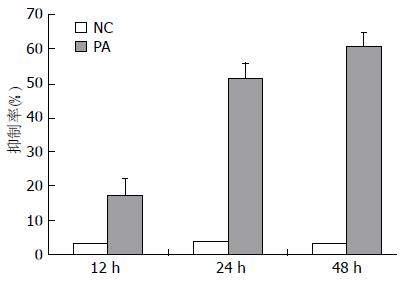
MTT比色法检测HSC细胞增殖抑制率显示, PA干预12、24、48 h后, 细胞的增殖抑制率呈时间依赖性升高, 同对照组(NC)比较, 差异均有统计学意义(P<0.05)(图1).
随着FFA干预时间的延长, HSC凋亡细胞增加(图2).
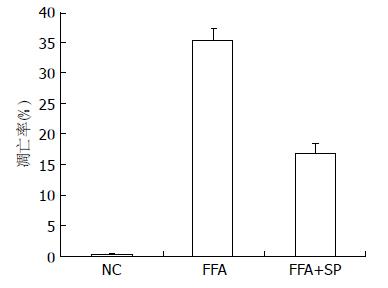
HSC细胞经FFA作用24 h后, NC、FFA、FFA+SP600125组凋亡率分别为0.28%±0.11%、35.67%±1.53%、17.18%±1.18%. FFA、FFA+SP600125组凋亡率显著高于NC组(P<0.05), 而FFA+SP600125组凋亡率显著低于FFA组(P<0.05)(图3).
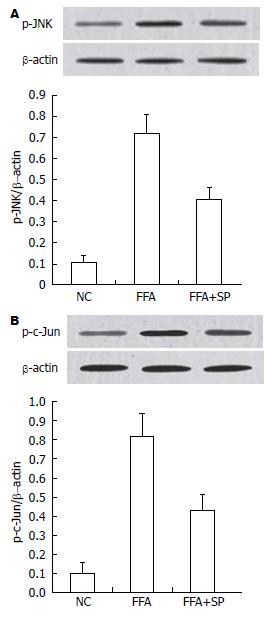
NC组、FFA组与FFA+SP600125组p-JNK蛋白表达的相对含量分别为0.11±0.03、0.72±0.09和0.41±0.05; 而p-c-Jun蛋白表达的相对含量分别为0.10±0.04、0.82±0.12和0.43±0.08. 与NC组比较, FFA组、FFA+SP600125组p-JNK及p-c-Jun蛋白表达均增多, 差异具有统计学意义(P<0.05). FFA+SP600125组较PA组明显减少, 差异有统计学意义(P<0.05)(图4).
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是一种缺乏饮酒史, 以脂肪沉积为其特征且与代谢综合征(metabolic syndrome, MS)密切相关的新型疾病[13,14]. NAFLD包括单纯性脂肪肝(nonalcoholic fatty liver, NAFL)和NASH, NASH还可进一步发展为终末期肝病甚至肝癌. 然而目前临床上有效的治疗NASH的药物较少, NASH重在预防, 针对发病机制的药物药物研制显得尤其重要, 然而NASH的发病机制尚不明确. 肝细胞的凋亡在NASH发病中的作用越来越受到关注, 成为目前NASH发病机制研究的热点.
JNK是位于细胞质内的丝氨酸/苏氨酸蛋白激酶. 目前研究发现, JNK参与某些肿瘤、神经退行性疾病、糖尿病、脂质代谢紊乱等疾病的发生[10-12]. 作用机制可能是JNK在一些外源性因子刺激作用下, 通过使蛋白激酶第63、73位丝氨酸残基发生磷酸化而活化[15]. 活化的JNK与c-Jun等蛋白的氨基末端区域结合, 使转录因子活性区域发生磷酸化, 从而对细胞凋亡、增殖、分化起到重要的调控作用等. JNK信号通路是否参与NASH发病过程中肝细胞凋亡的发生却鲜有报道.
本实验采用FFA成功诱导了HSC细胞的凋亡, 表明高FFA水平是促进HSC细胞凋亡的重要机制之一. 当HSC在高FFA条件下培养后出现了较高水平的p-JNK的表达, 而与此同时HSC细胞的凋亡率也显著增加, 结果显示JNK信号通路参与了FFA诱导的HSC细胞凋亡. 当用JNK抑制剂-SP600125抑制了JNK的激活后, HSC细胞凋亡率明显降低, 进一步证实JNK参与了HSC细胞凋亡的病理过程. 我们的结果提示: JNK有望成为NASH治疗的一个新靶点.
本实验同时发现, 通过SP600125的干预, JNK的活性被抑制后HSC细胞的凋亡虽然明显低于未干预者, 但是仍然有14.35%±1.66%的细胞发生凋亡, 因此我们认为FFA诱导HSC细胞凋亡可能是由多个通路协同完成的, JNK通路是其中一个重要组成部分. 因而JNK信号通路与其他细胞因子或通路的相互作用关系, 以及通过何种机制调节下游因子以抑制细胞凋亡, 还需进一步的实验研究.
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)是非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)一个严重亚型, 可进一步发展为终末期肝病如肝纤维化甚至肝癌. 目前临床上有效的治疗药物很少, 针对发病机制的治疗是临床上阻断该疾病进展的关键. 然而NASH的发病机制尚不清楚. 目前研究热点在于NASH的发生发展和细胞凋亡的关系.
迟宝荣, 教授, 吉林大学第一医院消化内科.
SP600125是采用高通量药物筛选技术所合成的JNK抑制剂, 已经应用于治疗心脑血管疾病以及变性疾病等方面, 但是其在NASH中的防治作用尚不清楚. 所以本课题将理论与应用相结合, 为新药研究奠定基础.
编辑 田滢 电编 都珍珍
| 1. | Chang E, Park CY, Park SW. Role of thiazolidinediones, insulin sensitizers, in non-alcoholic fatty liver disease. J Diabetes Investig. 2013;4:517-524. [PubMed] |
| 2. | Bradford V, Dillon J, Miller M. Lifestyle interventions for the treatment of non-alcoholic fatty liver disease. Hepat Med. 2014;6:1-10. [PubMed] |
| 3. | Chiu S, Sievenpiper JL, de Souza RJ, Cozma AI, Mirrahimi A, Carleton AJ, Ha V, Di Buono M, Jenkins AL, Leiter LA. Effect of fructose on markers of non-alcoholic fatty liver disease (NAFLD): a systematic review and meta-analysis of controlled feeding trials. Eur J Clin Nutr. 2014;68:416-423. [PubMed] [DOI] |
| 4. | Brenner C, Galluzzi L, Kepp O, Kroemer G. Decoding cell death signals in liver inflammation. J Hepatol. 2013;59:583-594. [PubMed] [DOI] |
| 5. | Leamy AK, Egnatchik RA, Young JD. Molecular mechanisms and the role of saturated fatty acids in the progression of non-alcoholic fatty liver disease. Prog Lipid Res. 2013;52:165-174. [PubMed] [DOI] |
| 6. | Li X, Wang R, Zhou N, Wang X, Liu Q, Bai Y, Bai Y, Liu Z, Yang H, Zou J. Quercetin improves insulin resistance and hepatic lipid accumulation in vitro in a NAFLD cell model. Biomed Rep. 2013;1:71-76. [PubMed] |
| 7. | Bian Z, Peng Y, You Z, Wang Q, Miao Q, Liu Y, Han X, Qiu D, Li Z, Ma X. CCN1 expression in hepatocytes contributes to macrophage infiltration in nonalcoholic fatty liver disease in mice. J Lipid Res. 2013;54:44-54. [PubMed] [DOI] |
| 8. | Kojima T, Yamaguchi H, Ito T, Kyuno D, Kono T, Konno T, Sawada N. Tight junctions in human pancreatic duct epithelial cells. Tissue Barriers. 2013;1:e24894. [PubMed] |
| 9. | Tournier C. The 2 Faces of JNK Signaling in Cancer. Genes Cancer. 2013;4:397-400. [PubMed] |
| 10. | Kitanaka C, Sato A, Okada M. JNK Signaling in the Control of the Tumor-Initiating Capacity Associated with Cancer Stem Cells. Genes Cancer. 2013;4:388-396. [PubMed] |
| 11. | Ebelt ND, Cantrell MA, Van Den Berg CL. c-Jun N-Terminal Kinases Mediate a Wide Range of Targets in the Metastatic Cascade. Genes Cancer. 2013;4:378-387. [PubMed] |
| 12. | Wang S, Zhang C, Sheng X, Zhang X, Wang B, Zhang G. Peripheral expression of MAPK pathways in Alzheimer's and Parkinson's diseases. J Clin Neurosci. 2014;21:810-814. [PubMed] [DOI] |
| 13. | Eslami L, Merat S, Malekzadeh R, Nasseri-Moghaddam S, Aramin H. Statins for non-alcoholic fatty liver disease and non-alcoholic steatohepatitis. Cochrane Database Syst Rev. 2013;12:CD008623. [PubMed] [DOI] |
| 14. | Valenti L, Riso P, Mazzocchi A, Porrini M, Fargion S, Agostoni C. Dietary anthocyanins as nutritional therapy for nonalcoholic fatty liver disease. Oxid Med Cell Longev. 2013;2013:145421. [PubMed] [DOI] |
| 15. | Rana A, Rana B, Mishra R, Sondarva G, Rangasamy V, Das S, Viswakarma N, Kanthasamy A. Mixed Lineage Kinase-c-Jun N-Terminal Kinase Axis: A Potential Therapeutic Target in Cancer. Genes Cancer. 2013;4:334-341. [PubMed] |