修回日期: 2014-03-24
接受日期: 2014-04-02
在线出版日期: 2014-08-18
目的: 研究采用人脐血单个核细胞(human cord blood mononuclear cell, CB-MNC)治疗肝硬化大鼠后, 其肝细胞中基因表达的变化.
方法: 首先分离CB-MNC, 利用流式细胞术分析其CD34+细胞含量; 然后利用四氯化碳(carbon tetrachloride, CCl4)联合乙醇方法建立大鼠肝硬化模型, 将CB-MNC通过尾静脉注射对肝硬化大鼠进行治疗, 通过血清学检测和组织学染色证明其治疗效果; 提取肝脏RNA, 进行表达谱芯片杂交并对结果进行统计分析.
结果: 血清学检测表明应用CCl4和乙醇造模后, 谷草转氨酶和谷丙转氨酶显著升高(P<0.05). 组织病理学染色结果表明大鼠肝硬化模型制作成功. 与对照组相比, CB-MNC治疗可以显著地降低谷草转氨酶、谷丙转氨酶和转肽酶(P<0.05), 且肝脏形态好转, 肝细胞坏死和脂肪病变减少. 基因芯片分析结果显示: 与对照组相比, 脐血单个核细胞调节了蛋白异源三聚化、氧化去甲基化、焦点黏连、白细胞跨内皮迁移、细胞外受体相互作用、补体凝血和P450对外源物代谢等相关基因.
结论: CCl4和乙醇混合法可以成功建立大鼠肝硬化模型, 而CB-MNC治疗可以显著地改善肝损伤. 在CB-MNC治疗肝硬化逆转肝损伤的过程中, 可能通过上调了补体凝血相关基因及过氧化物酶体增殖物激活受体信号通路, 下调焦点黏连、白细胞跨内皮迁移和细胞外基质受体相互作用等相关基因发挥治疗作用.
核心提示: 本文利用基因芯片阐释脐血单个核细胞在治疗大鼠肝硬化过程中, 通过上调补体凝血系统和过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors)信号通路表达, 下调白细胞跨内皮迁移、焦点黏连和细胞外基质受体相互作用等相关基因表达, 从而降低炎症反应, 抑制胶原沉着和肝星形细胞活化, 修复肝脏的凝血和免疫功能等方面改善肝脏纤维化程度, 修复肝损伤.
引文著录: 张海燕, 明奕, 刘小盾, 臧传宝, 迟令龙, 李栋. 脐血单个核细胞输注治疗大鼠肝硬化模型后肝脏基因表达谱的变化. 世界华人消化杂志 2014; 22(23): 3388-3395
Revised: March 24, 2014
Accepted: April 2, 2014
Published online: August 18, 2014
AIM: To investigate the gene expression profile changes in liver cells of a rat model after human cord blood mononuclear cell (CB-MNC) therapy for hepatic cirrhosis.
METHODS: CB-MNC was isolated from human cord blood, and the characterization of CD34+ cells in CB-MNC was performed by flow cytometry analysis. Hepatic cirrhosis in SD rats was induced by subcutaneous injection of carbon tetrachloride and oral administration of alcohol. CB-MNC or PBS were transplanted by intravenous injection. Histopathological staining and serological testing were used to compare the morphology and liver function between different groups. The gene expression alterations were compared between the PBS group and CB-MNC group by gene microarray analysis.
RESULTS: Flow cytometric analysis showed the ratio of CD34+ cells was 0.45% in CB-MNC. The results of serological assay and histopathology proved that transplantation of MNCs could improve the liver function in the animal model of hepatic cirrhosis. The levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST) and glutamyl transferase (GGT) were reduced in the CB-MNC group (P < 0.05). Gene microarray analysis showed that compared with the control group, CB-MNC therapy up-regulated the expression of genes related to complement, coagulation and peroxisome proliferator-activated receptor (PPAR), and down-regulated the expression of genes related to focal adhesion, leukocyte transendothelial migration and extracellular matrix (ECM)-receptor interaction.
CONCLUSION: CB-MNC might improve the liver function by increasing the expression of genes related to complement, coagulation and PPAR, and decreasing the expression of genes related to focal adhesion, leukocyte transendothelial migration and ECM-receptor interaction in rats with hepatic cirrhosis.
- Citation: Zhang HY, Ming Y, Liu XD, Zang CB, Chi LL, Li D. Gene expression profile changes in a rat model of liver cirrhosis after human cord blood mononuclear cell therapy. Shijie Huaren Xiaohua Zazhi 2014; 22(23): 3388-3395
- URL: https://www.wjgnet.com/1009-3079/full/v22/i23/3388.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i23.3388
肝硬化(hepatic cirrhosis)是多种慢性肝脏疾病的终末状态, 严重危害人类健康[1,2], 但目前抗纤维化的药物疗效有限, 只有少数肝硬化患者能得到肝移植治疗, 但免疫排斥反应重, 费用高[3], 因此寻求其他治疗方法非常重要. 脐血含有丰富的造血干/祖细胞, 还含有间充质干细胞和内皮前体细胞等. 研究表明脐血单个核细胞(cord blood mononuclear cell, CB-MNC)体外经诱导可分化为肝细胞样细胞[4,5], 回输体内后CB-MNC可以修复损伤肝脏, 并显著改善肝功能[6,7]. 但是, CB-MNC治疗肝硬化的分子机制目前并没有得到全面阐释. 本文旨在研究CB-MNC治疗肝硬化大鼠的肝脏基因表达谱变化, 从而进一步阐明CB-MNC治疗肝硬化的分子机制并为临床治疗提供理论依据.
25只160-200 g ♂SD[SCXK(京)2012-0001]大鼠购自北京维通利华实验动物技术有限公司并随机分为: 正常组8只和造模组17只. 造模8 wk后, 正常组和造模组各随机选择3只大鼠解剖验证造模效果. 造模成功后将造模组大鼠随机分为磷酸盐缓冲液(phosphate buffer solution, PBS)对照组和CB-MNC细胞治疗组. 所有饲养及实验流程符合《山东大学实验动物伦理审查的基本原则》的规定. TRIzol试剂购自美国Invitrogen公司; 苏木精染料和伊红购自美国Sigma公司; Masson三色染色法试剂盒购自康为世纪; 四氯化碳(carbon tetrachloride, CCl4)、橄榄油均购自国药集团; 食用白酒(52度, 散装食用级)购自山东景阳春酒业; 荧光标记鼠抗人CD34单克隆抗体及其同型对照购自英国SEROTEC公司; Cytomics™ FC500流式细胞仪系Beckman Coulter公司生产; 全自动生化仪为上海科华公司的卓越330型.
1.2.1 脐血单个核细胞的分离及CD34+细胞含量检测: 脐血标本来自山东省脐血造血干细胞库, 标本在采集后的8 h内进行梯度密度法离心, 获得单个核细胞进行台盼兰计数, 取106个细胞悬浮在100 µL含1%牛血清白蛋白的PBS中, 加入PE标记的鼠抗人CD34单克隆抗体, 在4 ℃标记20 min, PBS洗1次, 使用Cytomics™ FC500流式细胞仪检测, Cytometer1.0软件分析.
1.2.2 肝硬化大鼠模型制作[8-10]: 造模组按1.5 mL/kg给予背部皮下交替多点注射500 mL/L CCl4-橄榄油溶液, 2次/wk, 注射8 wk. 同时从第1周开始采用灭菌食用水配制的10%食用乙醇代替正常饮水. 正常组仅注射同体积橄榄油, 整个实验过程中均饮用灭菌食用水. 造模8 wk后, 随机取3只造模组大鼠和3只正常组大鼠收集肝组织和血液, 进行组织病理学染色和血液生化分析, 以验证造模效果.
1.2.3 细胞回输治疗: 肝硬化建模成功后, 将造模组大鼠再随机分为两组: PBS对照组(Ctr)5只, CB-MNC治疗组(MNC)6只. PBS对照组: 皮下注射0.5 mL PBS, 1次/wk, 注射4 wk; CB-MNC治疗组: 将细胞以1×106/mL悬浮, 按照2×106个/kg细胞经尾静脉注射, 1次/wk, 连续注射4 wk. 最后一次注射治疗1 wk后, 取肝脏组织行石蜡切片, 并提取肝脏RNA进行表达谱基因芯片杂交, 同时收集血液进行生化分析.
1.2.4 血液生化分析: 心脏取血后, 4 ℃静置4 h待血液凝固, 3000 r/min, 4 ℃离心5-10 min, 获得血清. 利用自动生化分析仪测定肝功能指标变化.
1.2.5 组织病理学染色: 取肝左叶边缘部位的肝组织, 40 g/L甲醛固定、脱水、石蜡包埋, 制作4 µm石蜡切片. 石蜡切片行HE染色和Masson染色, 观察大鼠肝脏病理学变化.
1.2.6 RNA提取与基因表达谱芯片检测: 组织用PBS洗涤后, 按操作说明保存组织. 组织总RNA提取、基因表达谱芯片杂交、检测和数据分析由上海康成生物公司进行(Affymetrix公司芯片, 4×44 K, 028282). 杂交结果用DNA芯片扫描仪扫描并通过GeneSpring GX v11.5.1 software package(Agilent Technologies)软件进行标准化分析, 与对照组相比|log2Ratio|>2(4-fold change)为差异表达, 并进行GO及KEGG信号通路分析.
统计学处理 数据采用SPSS19.0软件分析, 组间比较采用t检验, P<0.05为差异有统计学意义.
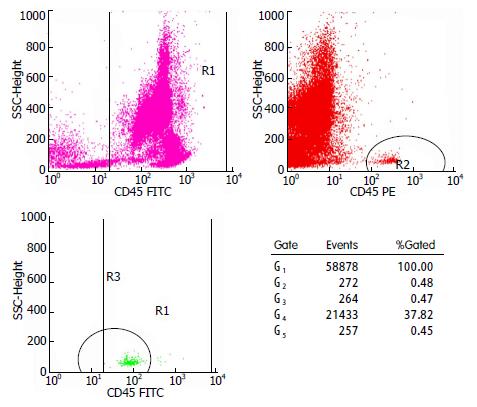
分离的脐血单个核细胞呈卵圆形(图1), 流式分析结果显示提取的脐血单个核细胞中的CD34+细胞比率平均值为0.45%(图2).
正常大鼠毛发茂密有光泽, 活动敏捷, 对外界刺激反应激烈, 食量及大便正常, 脊柱两侧肌肉层丰满; 造模组毛发蓬乱稀疏且光泽度下降, 动物精神不振, 活动减少, 对外界刺激反应迟钝, 前期体质量下降明显, 后期增长缓慢, 多数有溏泻, 用手触摸脊柱两侧肌肉层消失, 骨感明显; 经MNC静脉注射治疗后, 大鼠活动量逐渐增多, 食量提高, 体质量增加. 造模组大鼠造模期间死亡3只, 死亡率为20%; 正常对照组无1例死亡.
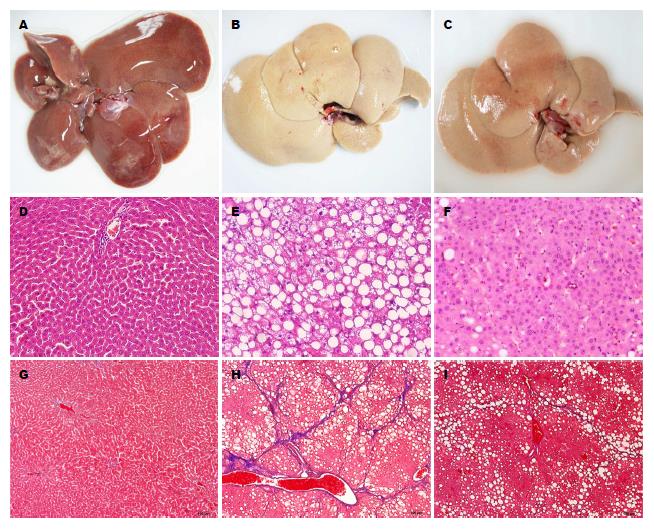
正常肝脏质地柔软光滑, 色泽均匀呈暗红(图3A). PBS对照组大鼠12 wk可见肝脏弹性消失, 肝脏表面呈颗粒状, 具有弥漫性损伤, 肝脏色泽不均匀血色消失(图3B). CB-MNC治疗组肝脏损伤状况显著改善, 肝脏色泽呈淡红色, 质地柔软有弹性(图3C). 正常肝脏肝小叶结构完整, 肝小叶中央有一条沿其长轴走行的中央静脉, 中央静脉周围是呈放射状排列的肝细胞和肝血窦细胞. 肝细胞为多角形, 细胞中央有圆形细胞核(图3D, G). 对照组肝小叶结构被破坏, 肝细胞肿胀, 胞浆疏松, 肝窦狭窄, 炎症反应加重, 细胞核着色加深, 且有多核现象, 脂肪性病变严重, 呈大空泡(图3E, H). MNC治疗组肝细胞形态接近正常大鼠, 与对照组相比肝细胞变性、坏死减少, 细胞核着色变浅, 多核现象减少, 脂肪性病变减少(图3F, I).
造模8 wk后, 正常组谷草转氨酶在250 U/L左右, CCl4造模组谷草转氨酶升高2-2.5倍. 治疗4 wk后, 与正常组相比, PBS对照组谷丙转氨酶和谷草转氨酶具有显著得升高, 而白蛋白、总蛋白和白球比都有降低, 差异有统计学意义(表1). 研究表明白球蛋白异常, 即白蛋白减低, 球蛋白升高, 血中白蛋白和球蛋白比值降低, 甚至倒置, 是早期肝硬化肝功检查的表征. CB-MNC细胞治疗组与对照组相比, 谷草转氨酶、谷丙转氨酶和转肽酶都有降低, 差异有统计学意义(P<0.05)(表1).
| 肝功能指标 | 正常组 | PBS组 | 脐血单个核细胞组 |
| 谷丙转氨酶(U/L) | 58.1±3.2a | 820.3±103.9 | 407.95±97.9a |
| 谷草转氨酶(U/L) | 254.4±16.4a | 1263.2±183.7 | 656.7±139.9a |
| 转肽酶(U/L) | 2.3±0.6 | 8.1±0.9 | 6.8±1.9a |
| 碱性磷酸酶(U/L) | 131.7±19.0 | 826.9±134.6 | 858.6±53.6 |
| 总蛋白(g/L) | 68.2±1.3a | 56.2±1.5 | 60.6±3.2 |
| 白蛋白(g/L) | 36.1±0.91a | 27.7±0.6 | 28.1±1.3 |
| 球蛋白(g/L) | 32.1±0.90 | 28.5±1.2 | 32.5±2.2 |
| 白球比 | 1.2±0.03a | 1.0±0.06 | 0.9±0.07 |
| 总胆红素(µmol/L) | 0.6±0.1 | 8.9±4.2 | 1.5±0.1 |
| 直接胆红素(µmol/L) | 0.5±0.1 | 7.6±3.9 | 1.0±0.1 |
| 间接胆红素(µmol/L) | 0.1±0.0a | 1.2±0.3 | 0.4±0.2a |
| 总胆酸汁(µmol/L) | 8.2±3.8 | 72.6±31.7 | 40.1±18.6 |
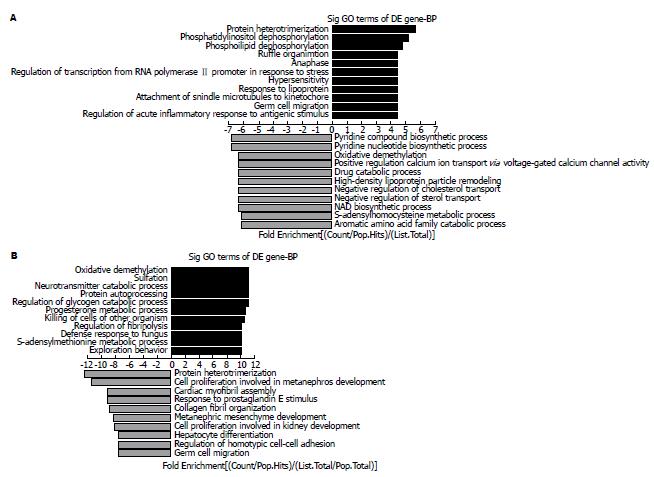
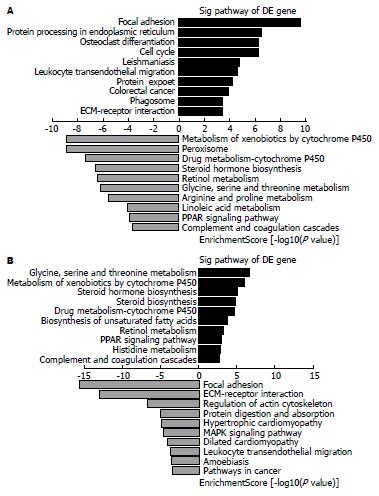
基因芯片结果GO分析显示在造模过程中上调且经MNC输注后下调的重要过程有蛋白异源三聚化和生殖细胞迁移(图4); 而在造模过程中下调且经MNC输注后上调的重要过程有氧化去甲基化和S-腺苷高半胱氨酸新陈代谢过程(图4).
通过进一步比较KEGG分析发现, 在造模过程中上调且经MNC输注后下调的重要过程有焦点黏连、白细胞跨内皮迁移和细胞外基质(extracellular matrixc, ECM)-受体相互作用过程; 而在造模过程中下调且经MNC输注后上调的重要过程有P450对外源物代谢类固醇激素合成、视黄醇代谢、甘氨酸、丝氨酸和苏氨酸代谢、过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors, PPAR)信号通路和补体和凝血系统(图5).
CCl4和酒精诱发肝硬化的机制明确、成功率高且造模时间短[8,11-13]. 本研究利用CCl4皮下注射和酒精饲喂成功得到了肝硬化模型, HE染色和Masson染色均证明造模组肝脏出现肝硬化的病征, 血清生化指标的异常结果也表明此种方法可有效地诱导肝硬化的产生.
近年来造血干细胞治疗肝病受到广泛关注, 有报道自体造血干细胞移植可以显著抑制酒精型肝硬化的纤维化程度并改善肝功[14]. 脐血也含有丰富的造血干细胞, CB-MNC中还含间充质细胞、内皮前体细胞和多种免疫细胞[15,16]. 对肝硬化失代偿期患者进行脐血输注可以显著改善贫血、白细胞减少和凝血功能障碍等症状[17]. 研究发现输注脐血间充质干细胞也可显著降低大鼠肝纤维化程度并改善肝功, 且输注的脐血间充质细胞并没有转分化为肝细胞, 而是通过分泌多种因子促进肝再生、恢复肝功[18]. 有临床报道对肝硬化患者进行静脉输注脐血间充质干细胞治疗可以显著的改善肝功并缩短病程[19].
另外, CB-MNC中含有内皮祖细胞也能参与肝组织修复和血管新生. 脐血内皮祖细胞浓度是外周血的10-20倍, 增殖能力高, 可以改善肝硬化大鼠的血管功能和门静脉高压[20]. CB-MNC中各类免疫细胞在肝硬化的治疗中也扮演着重要角色, 例如巨噬细胞可以修复慢性肝损伤, 改善肝功能[21]. 自然杀伤(natural killer, NK)细胞可以杀死激活的肝脏星形细胞从而改善肝脏的纤维化程度[22]. 目前, CB-MNC治疗肝硬化的机制并没有得到明确的阐释, 其可能通过多种细胞的联合功能发挥作用.
在本研究中, 表达谱芯片结果显示CB-MNC处理降低了大鼠肝脏细胞焦点黏连、白细胞跨内皮迁移和细胞外基质受体相互作用等相关基因的表达. 白细胞跨内皮迁移至血管壁间隙是组织损伤和炎症反应的必要步骤[23], 白细胞通过血液循环募集到肝脏中, 分泌促炎因子和细胞因子可以促进肝星形细胞的活化. 肝星形细胞增生、活化使肝细胞外基质过度纤维化增生是肝硬化的病理基础[24]. 而抑制白细胞跨内皮迁移, 从而降低炎症反应, 可以减少细胞外基质的产生和肝星形细胞的活化, 减缓肝硬化的进程. 此外, 降低焦点黏连和细胞外基质与受体相互作用也可以减少细胞外基质积累, 降低纤维化程度.
芯片结果还显示CB-MNC处理上调了补体与凝血过程的相关基因. 肝损伤会导致补体分泌不足和凝血障碍[25]. 本研究结果显示CB-MNC移植可以显著地升高补体凝血系统表达, 提示其可能通过修复肝脏的凝血和免疫功能来抑制肝硬化, 修复肝损伤. PPAR具有调节脂肪代谢, 调节炎症和免疫反应等作用[26,27]. PPAR的缺乏可以减少脂肪酸的氧化, 导致脂蛋白合成代谢障碍, 引发脂肪性肝病与肝细胞坏死具有密切关系, 在酒精性肝损伤过程中具有重要作用[28-30]. 在本篇研究中, CB-MNC输注可以上调PPAR信号通路相关基因表达, 提示其可能通过修复肝脏对脂质代谢水平和抑制炎症发挥作用.
总之, 本研究成功建立了大鼠肝硬化模型并利用脐血单个核细胞治疗. 结果显示CB-MNC输注治疗可显著地改善肝硬化, 减少胶原含量. 基因表达谱芯片分析结果表明CB-MNC可能是通过上调肝脏中补体凝血系统和PPAR信号通路表达, 下调白细胞跨内皮迁移、焦点黏连和细胞外基质受体相互作用等相关基因表达, 从而降低炎症反应, 抑制胶原沉着和肝星形细胞活化, 修复肝脏的凝血和免疫功能等方面, 综合改善了肝脏纤维化程度并修复了肝损伤.
肝硬化是多种慢性肝脏疾病的终末状态, 严重危害人类健康. 目前化学或生物药物疗效有限. 研究发现, 脐血单个核细胞(cord blood mononuclear cell, CB-MNC)输注可以显著改善肝硬化患者的肝功, 无不良反应. 但对于CB-MNC治疗肝硬化的分子机制尚不全面.
莫发荣, 副教授, 广西医科大学组织学与胚胎学教研室.
虽然研究表明干细胞疗法可以改善肝硬化的状况, 但大多数文献局限于功能研究, 对于干细胞治疗肝硬化的分子机制目前并没有得到明确的阐释. 在此生物过程中, 参与调节的信号通路和关键的介导因子需要进一步研究.
时晓鑫等对29例失代偿期肝硬化患者给予输注脐血干细胞, 移植第8周复查肝功能、凝血功能及血常规, 观察实验室指标、临床指标及不良反应情况. 结果表明, 患者临床症状、体征改善, 肝功能化验指标血清总胆红素较术前下降(P<0.05), 血浆白蛋白较术前升高(P<0.01); 血清丙氨酸氨转移酶、胆汁酸较术前有所降低, 但差异无统计学意义. 凝血酶原时间下降, 患者凝血功能改善. 29例患者术中均未发生严重并发症及不良反应.
利用高通量基因芯片杂交技术, 发现了脐血单个核细胞在治疗大鼠肝硬化过程中, 是通过上调补体凝血系统和PPAR信号通路表达, 下调白细胞跨内皮迁移、焦点黏连和细胞外基质受体相互作用等相关基因表达, 从而降低炎症反应, 抑制胶原沉着和肝星形细胞活化, 修复肝脏的凝血和免疫功能等方面改善肝脏纤维化程度, 修复肝损伤.
在未来的临床应用中, 可以通过分子生物学技术对移植前的脐血单个核细胞加以进一步的修饰, 增强其调节补体凝血系统和降解胞外基质等功能作用, 进一步增强脐血干细胞输注治疗肝硬化疗效, 并有效避免并发症.
补体: 人和动物血清中的一组球蛋白, 因在抗原抗体反应中, 有补充抗体的能力, 称为补体; 过氧化物酶体增殖物激活受体(PPAR): 一组配体激活的核转录因子, 是近年发现的一类超家族核激素受体, 在机体各组织中有广泛表达, 处于多种信号转录途径的交叉点, 具有多种生物学效应. PPAR分子含α、β、γ 3型, 分布在各不同组织, 他的功能涵盖的范围之广是现今已知的其他生物医药分子所难望其项背, 包括糖尿病、肥胖、高血压等代谢症候群, 免疫发炎疾病如类风湿性关节炎, 皮肤及伤口愈合, 以及最近发现的多种癌症的治疗, PPAR分子都参与其中, 并且扮演非常重要及突破性的角色. 而这些疾病正是二十一世纪人类面临的主要医药卫生问题.
本文利用多项实验技术去研究CB-MNC治疗肝硬化大鼠的肝脏基因表达谱变化, 可补充阐明CB-MNC治疗肝硬化的分子机制并为临床治疗提供理论依据. 学术价值好.
编辑 郭鹏 电编 都珍珍
| 1. | Possamai LA, Antoniades CG, Anstee QM, Quaglia A, Vergani D, Thursz M, Wendon J. Role of monocytes and macrophages in experimental and human acute liver failure. World J Gastroenterol. 2010;16:1811-1819. [PubMed] [DOI] |
| 2. | Sáez-Lara MJ, Frecha C, Martín F, Abadía F, Toscano M, Gil A, Fontana L. Transplantation of human CD34+ stem cells from umbilical cord blood to rats with thioacetamide-induced liver cirrhosis. Xenotransplantation. 2006;13:529-535. [PubMed] [DOI] |
| 3. | O'Grady JG. Acute liver failure. Postgrad Med J. 2005;81:148-154. [PubMed] [DOI] |
| 4. | 傅 京力, 曾 妍, 龙 则灵, 唐 晓鹏. 当归枸杞制剂诱导脐血单个核细胞分化为肝细胞后人白蛋白的表达. 中国组织工程研究与临床康复. 2011;15:8418-8423. |
| 5. | Bassiouny AR, Zaky AZ, Abdulmalek SA, Kandeel KM, Ismail A, Moftah M. Modulation of AP-endonuclease1 levels associated with hepatic cirrhosis in rat model treated with human umbilical cord blood mononuclear stem cells. Int J Clin Exp Pathol. 2011;4:692-707. [PubMed] |
| 9. | 仲 来福, 张 瑾岗, 张 富勤, 夏 元洵. 四氯化碳致大鼠肝损伤的机理. 中华药理学与毒理学杂志. 1989;3:298-303. |
| 10. | Zhao W, Li JJ, Cao DY, Li X, Zhang LY, He Y, Yue SQ, Wang DS, Dou KF. Intravenous injection of mesenchymal stem cells is effective in treating liver fibrosis. World J Gastroenterol. 2012;18:1048-1058. [PubMed] [DOI] |
| 12. | De Minicis S, Candelaresi C, Marzioni M, Saccomano S, Roskams T, Casini A, Risaliti A, Salzano R, Cautero N, di Francesco F. Role of endogenous opioids in modulating HSC activity in vitro and liver fibrosis in vivo. Gut. 2008;57:352-364. [PubMed] [DOI] |
| 13. | De Groot H, Sies H. Cytochrome P-450, reductive metabolism, and cell injury. Drug Metab Rev. 1989;20:275-284. [PubMed] [DOI] |
| 14. | Burganova GR. [Effectiveness of autologous hematopoietic stem cells transplantation in patients with liver cirrhosis]. Eksp Klin Gastroenterol. 2012;91-97. [PubMed] |
| 15. | Kim MH, Zhang HZ, Kim SW. Combined growth factors enhanced angiogenic potential of cord blood-derived mononuclear cells transplanted to ischemic limbs. J Mol Cell Cardiol. 2011;51:702-712. [PubMed] [DOI] |
| 18. | Jung KH, Shin HP, Lee S, Lim YJ, Hwang SH, Han H, Park HK, Chung JH, Yim SV. Effect of human umbilical cord blood-derived mesenchymal stem cells in a cirrhotic rat model. Liver Int. 2009;29:898-909. [PubMed] [DOI] |
| 20. | Sakamoto M, Nakamura T, Torimura T, Iwamoto H, Masuda H, Koga H, Abe M, Hashimoto O, Ueno T, Sata M. Transplantation of endothelial progenitor cells ameliorates vascular dysfunction and portal hypertension in carbon tetrachloride-induced rat liver cirrhotic model. J Gastroenterol Hepatol. 2013;28:168-178. [PubMed] [DOI] |
| 21. | Thomas JA, Pope C, Wojtacha D, Robson AJ, Gordon-Walker TT, Hartland S, Ramachandran P, Van Deemter M, Hume DA, Iredale JP. Macrophage therapy for murine liver fibrosis recruits host effector cells improving fibrosis, regeneration, and function. Hepatology. 2011;53:2003-2015. [PubMed] [DOI] |
| 22. | Radaeva S, Sun R, Jaruga B, Nguyen VT, Tian Z, Gao B. Natural killer cells ameliorate liver fibrosis by killing activated stellate cells in NKG2D-dependent and tumor necrosis factor-related apoptosis-inducing ligand-dependent manners. Gastroenterology. 2006;130:435-452. [PubMed] [DOI] |
| 23. | Winquist RJ, Kerr S. Cerebral ischemia-reperfusion injury and adhesion. Neurology. 1997;49:S23-S26. [PubMed] [DOI] |
| 25. | Inai S, Kitamura H, Fujita T, Kojima J, Nagaki K. Differences between plasma and serum complement in patients with chronic liver disease. Clin Exp Immunol. 1976;25:403-409. [PubMed] |
| 28. | Kondo Y, Uno K, Machida K, Terajima M. PPARs and Liver Disease. PPAR Res. 2013;2013:896412. [PubMed] [DOI] |
| 29. | Nan YM, Kong LB, Ren WG, Wang RQ, Du JH, Li WC, Zhao SX, Zhang YG, Wu WJ, Di HL. Activation of peroxisome proliferator activated receptor alpha ameliorates ethanol mediated liver fibrosis in mice. Lipids Health Dis. 2013;12:11. [PubMed] [DOI] |