修回日期: 2014-07-03
接受日期: 2014-07-15
在线出版日期: 2014-08-18
目的: 应用基因二代测序技术检测肝星状细胞(hepatic stellate cell, HSC)在压力作用后基因表达谱改变及可能机制.
方法: 分离培养原代肝星状细胞, 培养14 d加载10 mmHg的压力1 h, 提取总RNA, 逆转录cDNA, 用DEG-Seq对实验组与对照组进行比较, 筛选得到差异基因.
结果: 肝星状细胞中979条基因出现差异表达, 其中14条基因表达差异最为显著, 10条基因表达上调, 4条基因表达下调, 这些基因功能与合成代谢、免疫应答、细胞凋亡等相关.
结论: 应用基因二代测序技术筛选出压力作用下肝星状细胞差异表达的基因, 其可能通过调控这些基因来适应外界压力刺激.
核心提示: 分离培养原代肝星状细胞(hepatic stellate cell), 培养14 d加载10 mmHg的压力1 h, 提取总RNA, 逆转录cDNA, 应用基因二代测序技术对实验组与对照组进行比较, 筛选得到差异基因, 并通过Real-time PCR验证筛选的差异基因.
引文著录: 齐峰, 胡江峰, 唐丹, 刘保海, 朱樑. 应用二代测序技术筛选压力作用下肝星状细胞的差异表达基因. 世界华人消化杂志 2014; 22(23): 3380-3387
Revised: July 3, 2014
Accepted: July 15, 2014
Published online: August 18, 2014
AIM: To identify the gene expression profile of hepatic stellate cells (HSCs) subjected to pressurization by next-generation sequencing.
METHODS: Primary HSCs were isolated and cultured. After cultivation for 14 d, cells were subjected to a pressure of 10 MMHG (millimeters of mercury) for 1 h. Total RNA was then extracted and reverse transcribed into cDNA to screen differential genes between HSCs subjected to pressurization and non-treated HSCs using DEG-Seq.
RESULTS: A total of 979 differentially expressed genes were expressed in HSCs, of which 14 showed the most significant difference, including 10 up-regulated and 4 down-regulated genes. These genes were found to be related to anabolism, immune response, cell apoptosis, etc.
CONCLUSION: Differentially expressed genes could be identified in HSCs subjected to pressurization, indicating that HSCs respond to external pressure stimulation by regulating the expression of these genes.
- Citation: Qi F, Hu JF, Tang D, Liu BH, Zhu L. Identification of differential gene expression profile of HSCs subjected to pressurization by next-generation sequencing. Shijie Huaren Xiaohua Zazhi 2014; 22(23): 3380-3387
- URL: https://www.wjgnet.com/1009-3079/full/v22/i23/3380.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i23.3380
肝硬化门脉高压症是一种以门静脉系统血液动力学异常变化为主要特点的综合征, 临床症状多表现为胃底食管静脉曲张、腹水和脾肿大, 并伴有上消化道大出血、肝性脑病及肝肾综合征等严重并发症[1]. 肝星状细胞(hepatic stellate cell, HSC)的持续活化是肝硬化门脉高压症发生发展的关键环节[2]. 同时, 肝硬化门脉高压反过来又对HSC的活化有着重要的影响. 门脉高压时, 肝窦内压力急剧增加, 肝窦明显扩张, HSC受到了肝窦压力直接或间接的作用[3]. 活化的HSC合成大量细胞外基质参与肝纤维化的形成和肝内结构的重建, 造成门脉循环压力不可逆增高[4-6]. 目前对于门脉高压的治疗, 外科主要采用分流术或断流术, 内科主要采用普萘洛尔、消心痛或生长抑素等减少门脉血流的药物, 但这些治疗手段又会产生许多严重的并发症, 如外科手术中的肝性脑病, 药物治疗对降低门静脉压力又很有限. 因此本实验应用基因二代测序技术筛选压力作用HSC后差异表达的基因[7], 对肝硬化门脉高压症的发病机制进行深入研究和探讨并提供一种新的治疗策略与思路.
原代HSC(primary HSCs)提取自♂SD(Sprague-Dawley)大鼠(体质量400-600 g), 购自中国人民解放军第二军医大学动物实验中心[8]. Desmin和α平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)抗体购自美国Abeam公司. 压力加载设备的构建遵循之前的描述[9]. 总RNA提取试剂TRIzol购自Invitrogen公司, mRNA纯化试剂盒Dynabeads、离子总RNA-Seq工具包v2、离子PI™模板OT2200工具包和离子PI测序200工具包均购自Lifetech公司, 安捷伦生物分析仪2200购自美国Agilent Technologies公司, PCR逆转录与扩增试剂盒均购自TaKaRa公司.
1.2.1 原代细胞培养与鉴定: 将分离的原代细胞悬浮于含20%胎牛血清(fetal bovine serum, FBS)的DMEM培养液中. 取细胞计数板计数后, 以1×105 cells/cm2接种于10 cm的培养皿中, 置CO2培养箱中培养. 48 h后更换为10%FBS的DMEM培养液, 隔天换液. 培养2 d为原代细胞静息期, 14 d为活化期. 原代细胞纯度鉴定通过自发免疫荧光和抗Desmin和α-SMA的细胞免疫荧光.
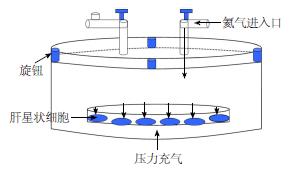
1.2.2 压力加载: 压力作用参照文献[10,11]的方法进行. 另外, 由慢性肝病发展到肝硬化, 活化的HSC起到更为重要的作用. 因此, 取14 d培养的活化期原代HSC置于压力装置内, 分别连接氮气和血压计, 并开启血压计缓慢注入氮气, 压力上升至10 mmHg后, 关闭阀门密封容器, 加载1 h可用于后续实验(图1).
1.2.3 总RNA提取和mRNA纯化: 用TRIzol试剂从细胞中提取总RNA(分别标记为压力组和对照组), RNA的质量由安捷伦2200芯片生物分析仪保持在-80 ℃进行检测. RNA完整值(RNA integral number, RIN)>7.0的RNA是适合cDNA文库建设的. 用Dynabeads® mRNA纯化试剂盒提纯mRNA. mRNA样本随后用于cDNA文库建设和离子质子测序.
1.2.4 基因组结构分析: 将测得RNA原始数据序列进行质量控制并进行过滤, 将得到的clean Reads进行mapping, 统计测序数据的基因在染色体上的分布和基因组结构的分析.
1.2.5 基因表达量及差异表达分析: 采用RPKM及Counts进行基因表达定量. 用DEG-Seq对实验组与对照组进行比较, 筛选得到差异基因, 筛选标准为: 差异倍数Fold Change≥8或Fold Change≤0.125, 错误发现率(false discovery rate, FDR)<0.05. 对差异基因进行功能显著分析(GO-Analysis)并对显著的GO条目进行功能调控网络构建. 对差异基因进行信号转导通路的显著分析并进行信号通路调控网络构建.
1.2.6 采用Real-time PCR对差异基因进行验证: 按1.2.3提取总RNA, 用分光光度计检测RNA样品浓度(µg/µL) = A260值×稀释倍数×40/1000. 设计扩增用引物(表1), 取压力组与对照组根据TaKaRa试剂盒说明书20 µL分别进行逆转录, 逆转录反应37 ℃ 15 min, 85 ℃ 5 s. 20 µL PCR体系: 上下游引物各0.5 µL(10 µmo1), 2×Mix 10 µL(包括反应缓冲液、dNTP、MgCl2、SYBRGreen Ⅰ、Taq酶), 双蒸水8 µL, cDNA模板1 µL. 将压力组与对照组进行PCR, 采取2步法(预变性95 ℃ 60 s, PCR变性95 ℃ 15 s, 延伸60 ℃ 60 s, 结束4 ℃), 循环40次, 将得到的Ct值, 以2-∆∆Ct作图, 每组实验重复3次[12-15].
| 引物名称 | 序列 | 扩增大小(bp) |
| Oas1a | F: 5'-CGGAGGTCATGGAGCAGGAACT-3' | 253 |
| R: 5'-AACACCACCAGGTCAGCGTCT-3' | ||
| Mx2 | F: 5'- TGCCTGCCATCGCTGTCATC-3' | 159 |
| R: 5'-TGCCTTTCCACTCCTCTCCCT-3' | ||
| Apol9a | F: 5'- GCCTCCGACATCCTGAACCTCT-3' | 221 |
| R: 5'-ACACTTGTGCCAGCTTCCTCCA-3' | ||
| Lpl | F: 5'- AGGTCAGAGCCAAGAGAAGCAGT-3' | 297 |
| R: 5'-ACCAGCGGAAGTAGGAGTCGTT-3' | ||
| Mmp12 | F: 5'- CTGGGCAACTGGACACCTCAAC-3' | 159 |
| R: 5'- CCGCACGCTTCATGTCTGGA-3' |
统计学处理 采用SPSS17.0统计学软件进行数据分析, 采用两个独立样本均数的t检验, P<0.05为差异有统计学意义.
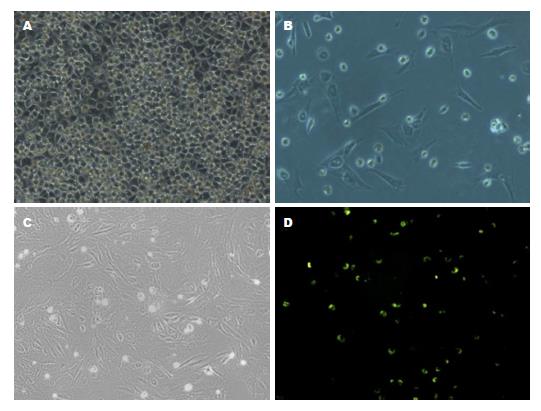
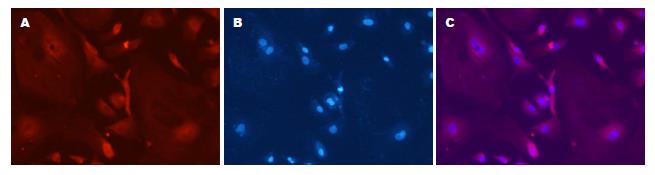
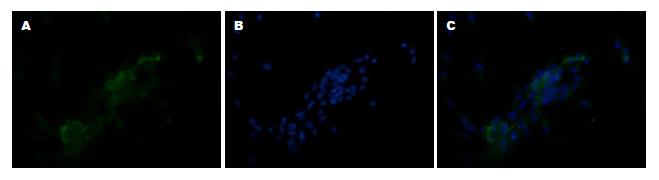
刚分离的HSC为折光很强的小圆形细胞, 形态均一, 体积远小于肝细胞. 体外培养2 d后大部分贴壁, 形态为椭圆形, 光镜下可见脂肪颗粒. 体外培养7 d后, 细胞变得细长. 体外培养14 d后, 细胞完全伸展, 可见的平行的细胞骨架. 328 nm紫外光照射下细胞会发出蓝绿色荧光, Desmin和α-SMA的细胞免疫荧光可表达阳性(图2, 图3, 图4).
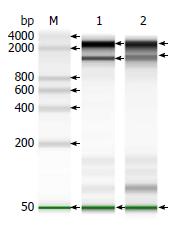
总RNA压力组检测浓度为860 ng/µL, 对照组浓度为780 ng/µL. 用安捷伦2200芯片生物分析仪检测压力组RIN为9.5, 对照组RIN为9.0. 证实已提取较高纯度的总RNA(图5).
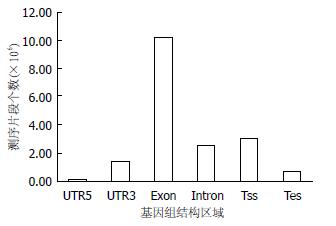
可以看到压力组和实验组测序得到的序列大部分在外显子上(图6). 压力组的Reads在chr14分布最显著, 对照组Reads在chr1分布最显著(图7).
在测序中, 如果Fold Change≥8以上, 就判断为上调基因, 研究中发现有10个基因表达水平上调(表2). 如果Fold Change≤0.125以下, 判断为下调基因, 研究中发现有4个基因表达水平下调(表3).
| 基因名称 | 相关描述 | 差异倍数 | FDR |
| LOC100364191 | hCG1994130-like | 8.579 | 1.22×10-18 |
| Tf | Transferrin | 9.081 | 2.11×10-47 |
| Oas1a | 2'-5' oligoadenylate synthetase 1A | 10.452 | 8.93×10-4 |
| Mx2 | Myxovirus (influenza virus) resistance 2 | 9.655 | 0.036 |
| Apol9a | Apolipoprotein L 9a | 15.945 | 3.19×10-5 |
| Irf7 | Interferon regulatory factor 7 | 10.474 | 2.73×10-24 |
| LOC680329 | Immunoglobulin lambda-like polypeptide 5-like | 8.161 | 0.045 |
| Ifit1 | Interferon-induced protein with tetratricopeptide repeats 1 | 17.326 | 1.06×10-4 |
| Igha | Immunoglobulin heavy chain, alpha | 20.910 | 6.39×10-6 |
| Marco | Macrophage receptor with collagenous structure | 11.405 | 1.05×10-4 |
| 基因名称 | 相关描述 | 差异倍数 | FDR |
| LOC688452 | Hypothetical protein LOC688452 | 0.081 | 1.67×10-3 |
| Lpl | Lipoprotein lipase | 0.110 | 4.22×10-3 |
| LOC682206 | Similar to Zinc finger protein 208 | 0.089 | 6.35×10-4 |
| Mmp12 | Matrix metallopeptidase 12 | 0.114 | 3.51×10-11 |
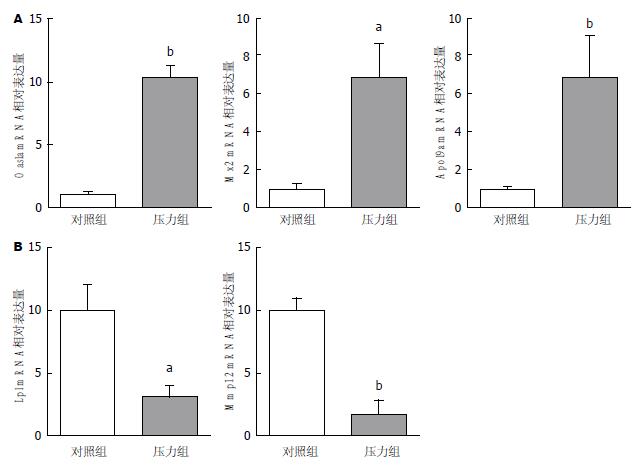
压力组基因Oasla、Mx2、Apol9a mRNA表达量均高于对照组(t = 19.01, P = 0.0028; t = 6.6, P = 0.022; t = 13.47, P = 0.0055), 分别为对照组的10.0倍、6.8倍、8.0倍; 压力组基因Lpl、Mmp12表达量均低于对照组(t = 7.0, P = 0.0198; t = 29.26, P = 0.001), 分别为对照组的0.3倍、0.17倍(图8).
HSC是一种肝非实质性细胞, 约占整个肝脏细胞数的5%-8%, 位于肝板和肝窦内皮细胞之间的Disse间隙内, Disse间隙借肝窦内皮细胞的"窗孔"与肝窦相通. 体外培养7 d细胞伸展为肌成纤维细胞, 14 d细胞完全伸展, 脂滴消失并见明显细胞骨架[16]. 在正常肝脏中, HSC处于静息状态, 主要参与维生素A的代谢, 储存脂肪的功能, HSC的活化又受到炎症、机械损伤多种因素的调节. 生物力学因素是多种哺乳动物细胞功能的重要调节因素之一, 其中, 压力及牵拉力是多种细胞生长所需的刺激因素, 在维持细胞的形态和活性、增殖等方面发挥不可忽视的作用[17-21]. 国内外多项研究显示, 生物力学对HSC功能具有重要的调节作用: Sakata等[22]研究显示, 机械拉伸能显著促进HSC转化生长因子β(transforming growth factor β, TGF-β) mRNA和蛋白表达增高, 并认为Rho与在机械拉伸引起的TGF-β合成关系密切. Goto等[23]研究发现, 在门脉高压早期, 机械拉伸可使HSC MMP1合成增加, 导致基质金属蛋白酶组织抑制剂-1(tissue inhibitor of matrix metalloproteinase-1, TIMP-1)和TIMP2合成减少进而抑制细胞外基质的降解.
目前, 国内外围绕肝纤维化的研究绝大部分都集中在如何抑制HSC的活化上, 但鲜有研究从另一个角度去关注如何消除门脉高压给予HSC持续活化的影响及其机制.
本研究主要采用基因二代测序技术, 通过压力作用下HSC进行差异表达基因的筛选. 其中共有14个基因出现显著变化, 其中10个基因表达上调, 4个基因表达下调. 表达的基因功能与合成代谢、免疫应答、细胞凋亡等相关: Tf为转铁蛋白, 参与体内铁离子的运输[24]; Lpl为脂蛋白脂肪酶, 参与体内脂质、甘油三酯及脂蛋白的调节和代谢[25]; Oas1a是人体先天性免疫系统的组成成分, 有研究报道称他具有抗病毒的作用并与丙型肝炎的发生具有相关性[26]; Apol9a是一种脂质运输相关基因, 而铁缺乏也会引起十二指肠细胞内该基因的优先表达[27]; Irf7为一种干扰素(interferon, IFN)调节因子, 他可以诱导IFN-α/β的表达, 而IFN-α/β又在抗病毒中发挥着重要的作用[28]; LOC682206为一种锌指蛋白, 他被Arabidopsis lsd1基因编码, 参与负反馈调节植物细胞的死亡[29]; Ifit1也是一种抗病毒相关基因, 他是通过作用于病毒核酸来发挥抗病毒作用[30]; 在相关研究中表明Mmp12为肺气肿发生的一种标志性基因, 他的表达可能与整合素介导的TGF-β缺乏有关[31].
总之, 压力作用于HSC后, 通过基因二代测序筛选出表达差异的基因, 提示HSC可能通过这些基因的表达来适应压力这种外界刺激.
肝星状细胞的活化受多种因素的调控作用, 如力学因素、病毒感染等肝内环境的改变都可能诱发肝星状细胞(hepatic stellate cell, HSC)的活化. 肝硬化门脉高压时肝窦压力和肝窦扩张后牵拉力直接或间接地作用于HSC并促进其活化. 然而, 通过生物力学促进HSC活化过程中基因的调控作用, 目前国内外均尚未见报道.
任技师, 博士生导师, 南京医科大学附属南京医院科教处.
本文研究采用最新的二代测序技术, 通过对压力处理后的HSC与对照组进行比较, 得到显著差异表达的基因, 并对差异表达的基因进行筛选分析, 得到HSC在受到力学因素刺激表达活化作用时的作用机制.
国内外多项研究显示, 生物力学对HSC功能具有重要的调节作用: Sakata研究显示, 机械拉伸能显著促进HSC转化生长因子β(trans-forming growth factor β, TGF-β) mRNA和蛋白表达增高, 并认为Rho与在机械拉伸引起的TGF-β合成关系密切. Goto等研究发现, 在门脉高压早期, HSC MMP1合成增加, 导致TIMP1和TIMP2合成减少进而抑制细胞外基质的降解.
应用二次测序技术检测肝星状细胞压力加载前后的基因表达, 筛选出肝星状细胞压力应答的基因, 为以后研究者进行肝星状细胞生物力学相关基因的研究提供了重要的参考依据.
筛选压力差异基因, 为门脉高压的防治提出新的思路和策略, 为相关基因在肝硬化门脉高压防治上提供了理论基础和应用的可能性.
基因二代测序: 指一次对几十万到几百万条DNA分子进行序列测定, 是对一个物种的转录组和基因组进行细致全面的分析, 所以又称为深度测序.
本文具有较强的创新性, 结果可靠, 但仍需大量实验验证结果.
编辑 郭鹏 电编 都珍珍
| 1. | de Franchis R, Dell'Era A, Iannuzzi F. Diagnosis and treatment of portal hypertension. Dig Liver Dis. 2004;36:787-798. [PubMed] [DOI] |
| 2. | Reynaert H, Thompson MG, Thomas T, Geerts A. Hepatic stellate cells: role in microcirculation and pathophysiology of portal hypertension. Gut. 2002;50:571-581. [PubMed] [DOI] |
| 3. | Maass-Moreno R, Rothe CF. Distribution of pressure gradients along hepatic vasculature. Am J Physiol. 1997;272:H2826-H2832. [PubMed] |
| 4. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 5. | Török NJ. Recent advances in the pathogenesis and diagnosis of liver fibrosis. J Gastroenterol. 2008;43:315-321. [PubMed] [DOI] |
| 6. | Soon RK, Yee HF. Stellate cell contraction: role, regulation, and potential therapeutic target. Clin Liver Dis. 2008;12:791-803, viii. [PubMed] [DOI] |
| 9. | Watanabe S, Nagashio Y, Asaumi H, Nomiyama Y, Taguchi M, Tashiro M, Kihara Y, Nakamura H, Otsuki M. Pressure activates rat pancreatic stellate cells. Am J Physiol Gastrointest Liver Physiol. 2004;287:G1175-G1181. [PubMed] [DOI] |
| 10. | Wu HJ, Zhang ZQ, Yu B, Liu S, Qin KR, Zhu L. Pressure activates Src-dependent FAK-Akt and ERK1/2 signaling pathways in rat hepatic stellate cells. Cell Physiol Biochem. 2010;26:273-280. [PubMed] [DOI] |
| 11. | Okada Y, Tsuzuki Y, Hokari R, Miyazaki J, Matsuzaki K, Mataki N, Komoto S, Watanabe C, Kawaguchi A, Nagao S. Pressure loading and ethanol exposure differentially modulate rat hepatic stellate cell activation. J Cell Physiol. 2008;215:472-480. [PubMed] |
| 12. | Aellen S, Que YA, Guignard B, Haenni M, Moreillon P. Detection of live and antibiotic-killed bacteria by quantitative real-time PCR of specific fragments of rRNA. Antimicrob Agents Chemother. 2006;50:1913-1920. [PubMed] [DOI] |
| 13. | Nygard AB, Jørgensen CB, Cirera S, Fredholm M. Selection of reference genes for gene expression studies in pig tissues using SYBR green qPCR. BMC Mol Biol. 2007;8:67. [PubMed] [DOI] |
| 14. | Romanowski T, Markiewicz A, Bednarz N, Bielawski KP. [Housekeeping genes as a reference in quantitative real-time RT-PCR]. Postepy Hig Med Dosw (Online). 2007;61:500-510. [PubMed] |
| 15. | Shamanina MIu, Vavilin VA, Mordvinov VA, Katokhin AV, Kuznetsova TN, Liakhovich VV. [Real-time polymerase chain reaction and its potential clinical application]. Vestn Ross Akad Med Nauk. 2007;37-46. [PubMed] |
| 16. | Lafdil F, Chobert MN, Couchie D, Brouillet A, Zafrani ES, Mavier P, Laperche Y. Induction of Gas6 protein in CCl4-induced rat liver injury and anti-apoptotic effect on hepatic stellate cells. Hepatology. 2006;44:228-239. [PubMed] [DOI] |
| 17. | Jaalouk DE, Lammerding J. Mechanotransduction gone awry. Nat Rev Mol Cell Biol. 2009;10:63-73. [PubMed] [DOI] |
| 18. | Hahn C, Schwartz MA. Mechanotransduction in vascular physiology and atherogenesis. Nat Rev Mol Cell Biol. 2009;10:53-62. [PubMed] [DOI] |
| 19. | Chalfie M. Neurosensory mechanotransduction. Nat Rev Mol Cell Biol. 2009;10:44-52. [PubMed] [DOI] |
| 20. | Shin HY, Schwartz EA, Bizios R, Gerritsen ME. Receptor-mediated basic fibroblast growth factor signaling regulates cyclic pressure-induced human endothelial cell proliferation. Endothelium. 2004;11:285-291. [PubMed] |
| 21. | Iizuka K, Morita N, Murakami T, Kawaguchi H. Nipradilol inhibits atmospheric pressure-induced cell proliferation in human aortic smooth muscle cells. Pharmacol Res. 2004;49:217-225. [PubMed] [DOI] |
| 22. | Sakata R, Ueno T, Nakamura T, Ueno H, Sata M. Mechanical stretch induces TGF-beta synthesis in hepatic stellate cells. Eur J Clin Invest. 2004;34:129-136. [PubMed] [DOI] |
| 23. | Goto T, Mikami KI, Miura K, Ohshima S, Yoneyama K, Nakane K, Watanabe D, Otaka M, Watanabe S. Mechanical stretch induces matrix metalloproteinase 1 production in human hepatic stellate cells. Pathophysiology. 2004;11:153-158. [PubMed] [DOI] |
| 24. | Ponka P, Beaumont C, Richardson DR. Function and regulation of transferrin and ferritin. Semin Hematol. 1998;35:35-54. [PubMed] |
| 25. | Eckel RH. Lipoprotein lipase. A multifunctional enzyme relevant to common metabolic diseases. N Engl J Med. 1989;320:1060-1068. [PubMed] [DOI] |
| 26. | Li CZ, Kato N, Chang JH, Muroyama R, Shao RX, Dharel N, Sermsathanasawadi R, Kawabe T, Omata M. Polymorphism of OAS-1 determines liver fibrosis progression in hepatitis C by reduced ability to inhibit viral replication. Liver Int. 2009;29:1413-1421. [PubMed] [DOI] |
| 27. | Yeh KY, Yeh M. Iron deficiency induces epas1 and iron transport gene expression in the duodenal cells located at the crypt-villus bottom. BioFormosa. 2010;45:11-29. |
| 28. | Honda K, Yanai H, Negishi H, Asagiri M, Sato M, Mizutani T, Shimada N, Ohba Y, Takaoka A, Yoshida N. IRF-7 is the master regulator of type-I interferon-dependent immune responses. Nature. 2005;434:772-777. [PubMed] [DOI] |
| 29. | Dietrich RA, Richberg MH, Schmidt R, Dean C, Dangl JL. A novel zinc finger protein is encoded by the Arabidopsis LSD1 gene and functions as a negative regulator of plant cell death. Cell. 1997;88:685-694. [PubMed] [DOI] |
| 30. | Pichlmair A, Lassnig C, Eberle CA, Górna MW, Baumann CL, Burkard TR, Bürckstümmer T, Stefanovic A, Krieger S, Bennett KL. IFIT1 is an antiviral protein that recognizes 5'-triphosphate RNA. Nat Immunol. 2011;12:624-630. [PubMed] |