修回日期: 2014-07-01
接受日期: 2014-07-15
在线出版日期: 2014-08-08
目的: 研究调节性T细胞(regulatory T cells, Tregs)在肝纤维化发展中的作用.
方法: 实验小鼠分为 3组: 肝纤维化组、肝纤维化+CD25抗体组(下调Tregs)、对照组. 用四氯化碳(carbon tetrachloride, CCl4)诱导小鼠肝纤维化, 30%CCl4腹腔注射4 wk后, 选取部分小鼠腹腔注射纯化的CD25单克隆抗体(PC61培养上清), 下调体内Tregs水平. 对照组小鼠腹腔注射等体积生理盐水. 流式细胞分析检测肝内CD4+CD25+ T细胞水平, 用免疫荧光法标记肝星状细胞活化标志α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)的表达, Real-time PCR检测肝内Foxp3以及Ⅰ型胶原和Ⅲ型胶原的表达.
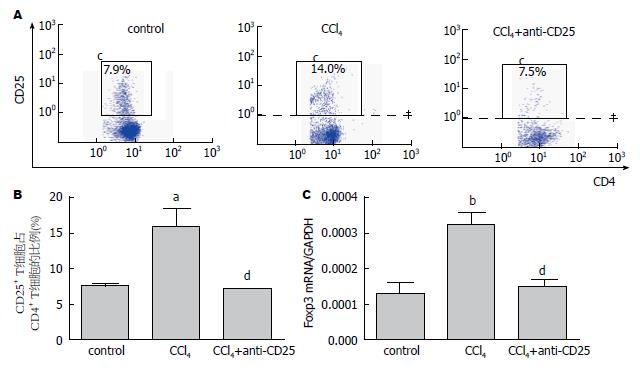
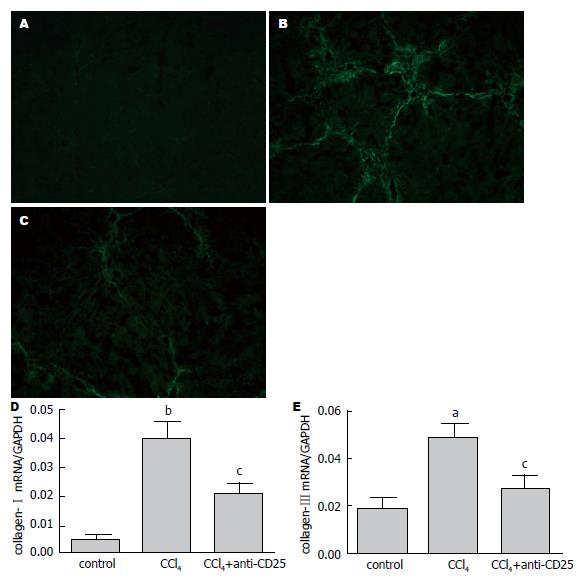
结果: 流式细胞分析显示肝纤维化小鼠肝内Tregs明显高于对照组, 注射CD25抗体后, 肝内CD4+CD25+ T细胞下降50%以上, 同时Real-time PCR显示Foxp3表达比纤维化组也明显下降. 免疫荧光显示下调体内Tregs水平后, α-SMA表达较肝纤维化小鼠显著减少, 同时Ⅰ型胶原和Ⅲ型胶原也减少.
结论: Tregs对小鼠肝纤维化发展具有促进作用.
核心提示: 调节性T细胞(regulatory T cell)介导免疫耐受, 他虽然不是引发肝纤维化的原始病因, 但对四氯化碳诱导的小鼠肝纤维化的维持和发展起重要作用, 从另一个角度解释了肝纤维化为何难以消除, 增加了人们对肝纤维化的认识.
引文著录: 张晓慧, 娄金丽, 白丽, 郑素军, 陈煜, 段钟平. 调节性T细胞对小鼠肝纤维化的促进作用. 世界华人消化杂志 2014; 22(22): 3264-3269
Revised: July 1, 2014
Accepted: July 15, 2014
Published online: August 8, 2014
AIM: To investigate the role of regulatory T cells (Tregs) in the development of liver fibrosis in mice.
METHODS: Experimental mice were divided into three groups: a liver fibrosis group, a liver fibrosis + anti-CD25 group and a control group. Liver fibrosis was induced by intraperitoneal injection of 30% carbon tetrachloride (CCl4). Four weeks later, mice in the liver fibrosis + anti-CD25 group were intraperitoneally injected with the purified CD25 monoclonal antibody (PC61 culture supernatant) to deplete Tregs. The mice injected with the same volume of saline were used as controls. Flow cytometry was used to detect the level of liver CD4+CD25+ T cells, immunofluorescence was used to stain the activated hepatic stellate cells (α-SMA), and real-time PCR was used to detect the expression of Foxp3 and type-Ⅰ and -Ⅲ collagen in the liver.
RESULTS: Flow cytometry analysis showed that the number of Tregs was significantly higher in liver fibrosis mice; after injection of CD25 antibody, CD4+CD25+ T cells in the liver were decreased by 50%. Real-time PCR showed that Foxp3 mRNA expression was significantly decreased compared to the fibrosis group. Immunofluorescence results showed that α-SMA was significantly reduced after Tregs depletion, compared to liver fibrosis mice. The mRNA levels of type-Ⅰand type-Ⅲ collagen were also decreased after Tregs depletion.
CONCLUSION: Tregs can promote liver fibrosis in mice.
- Citation: Zhang XH, Lou JL, Bai L, Zheng SJ, Chen Y, Duan ZP. Regulatory T cells promote liver fibrosis in mice. Shijie Huaren Xiaohua Zazhi 2014; 22(22): 3264-3269
- URL: https://www.wjgnet.com/1009-3079/full/v22/i22/3264.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i22.3264
调节性T细胞(regulatory T cell, Tregs)是一种公认的免疫抑制性细胞, 占CD4+ T细胞的 5%-10%, 在人和鼠类的外周血及脾脏中含量相对丰富, 在炎症、自身免疫性疾病及肿瘤免疫中起重要作用[1]. Tregs表型多为CD4+CD25+, 其中CD25为IL-2受体α链, 参与Tregs的生长发育. 多数Tregs为CD25高表达, 但也有一些非Tregs也表达CD25, 因此, 多数研究者认为有负向调节活性的CD4+CD25high为其主要标记[2]. 后来研究发现翼状螺旋转录因子Foxp3在Tregs的发生和功能中行使重要作用, 现在被认为是Tregs的特异性标志[1]. 肝纤维化是各种原因导致的肝细胞坏死、炎症细胞浸润和肝内细胞外基质过度沉积, 他发展的最后阶段往往是肝硬化及其并发症, 严重危害患者的生命和健康. 临床研究发现慢性乙型肝炎和丙型肝炎患者[3,4]以及肝炎后肝硬化患者[5]的外周血中Tregs水平明显高于健康人; 肝癌患者的CD4+CD25+Tregs水平也明显升高[6,7]. 有学者认为这种高水平的Tregs会影响效应T细胞等的功能, 从而减少免疫细胞对肝脏的炎症损伤, 限制肝纤维化发展[8]. 但也有学者认为这种Tregs高表达会使致病因素长期存在, 不利于机体对其的清除, 造成慢性损伤, 使其成为促进疾病发展的重要原因[9]. 那么Tregs在肝纤维化发展中扮演怎么样的角色, 目前仍无定论. 本研究针对此问题, 采用Tregs低表达的模型观察Tregs在小鼠肝纤维化发展中的作用.
健康♂C57BL/6J小鼠, 20-25 g, 来自中国人民解放军军事医学科学院实验动物中心, 按照实验动物福利委员会许可, 动物在室温条件下, 正常昼夜更替的光照, 24 h食水供应. 四氯化碳(carbon tetrachloride, CCl4)购自国药集团化学试剂有限公司; Protein G Agarose购自碧云天公司; Ⅳ型胶原酶、DNaseⅠ均购自美国Sigma公司; TRIzol购自Invitrogen公司, TakaRa PCR Kit(AMV)Ver. 3.0和TakaRa SYBR Premix EX TaqTM试剂盒均购自大连宝生物工程有限公司; DMEM/F12培养基购自Hyclone公司; 流式细胞分析和免疫荧光中所用抗体均购自eBioscience公司.
1.2.1 CD25单克隆抗体制备: PC61细胞在含血清的DMEM/F12中悬浮培养, 定期收集上清液, 用50%饱和硫酸铵沉淀过夜, 3500 g 15 min低温离心. 之后用透析液溶解, 装入透析袋中透析过夜. 之后12000 r/min 5 min离心, 滤膜过滤. 根据Protein G Agarose说明书纯化抗体, 选取吸光度最高的抗体用流式细胞分析法进行浓度检测.
1.2.2 肝纤维化小鼠模型: CCl4可诱导肝损伤, 是目前公认的、应用广泛的肝纤维化模型. 其至肝纤维化的机理主要是直接溶解肝细胞膜, 经肝细胞细胞色素P450依赖性混合功能氧化酶的代谢, 生成活性的三氯甲基自由基和氯甲基自由基, 启动脂质过氧化作用, 导致肝细胞损伤. 本实验给予小鼠腹腔注射30%CCl4(溶于矿物油中), 0.1 mL/10 g, 2次/wk, 共 6 wk.
1.2.3 Tregs低表达肝纤维化小鼠模型: CCl4注射4 wk的肝纤维化小鼠给予CD25抗体腹腔注射, 0.5 mg/只, 1次/wk, 同时给予小剂量CCl4(20 μL/只)维持纤维化过程. 3 wk后用流式细胞分析检测Tregs的下降水平.
1.2.4 流式细胞仪检测: 用生理盐水将新鲜的小鼠肝脏经下腔静脉冲洗, 尽可能将肝脏内血液冲掉. 将肝组织研磨后, 用Ⅳ型胶原酶(终浓度0.5 mg/mL)和DNaseⅠ(终浓度50-100 U/mL)进行消化, 放入震荡孵箱孵育37 ℃, 40 min. 将消化好细胞的进行离心并用PBS进行冲洗后, 用Ficoll分离液分离, 取雾状白膜层细胞, 洗后计数细胞稀释至106/mL以备进行流式检测. 依据试剂盒说明书程序取约105个细胞进行胞内Foxp3染色. 染色结束后上机检测(FC500, Beckman Coulter).
1.2.5 RNA提取及实时荧光定量PCR检测(Real-time PCR): 将适量肝组织加入1 mL TRIzol研磨至无可见颗粒物, 根据试剂说明书进行RNA提取. 经紫外分光光度仪检测, 保证总RNA的A260/280在1.8-2.0之间. 按照TakaRa PCR Kit(AMV)Ver. 3.0和TakaRa SYBR Premix EX TaqTM试剂盒说明书进行反转录和Real-time PCR. 实验中所用引物序列如表1. 扩增程序如下: 95 ℃变性10 min, 95 ℃15 s, 60 ℃退火1 min, 72 ℃延伸30 s, 以上过程经历40个循环. 内参为GAPDH, 结果分析以2(Ct GAPDH-Ct gene)的方式统计, 使用软件为StepOne software 2.0(Applied Biosystems公司).
| 名称 | 序列 |
| Foxp3 | F: 5'-CCC AGG AAA GAC AGC AAC CTT-3' |
| R: 5'-TTC TCA CAA CCA GGC CAC TTG-3' | |
| Collagen-Ⅰ | F: 5'-GAG CGG AGA GTA ATG GAT CG-3' |
| R: 5'-TCT CCA AAT GGG ATC TCT GG-3' | |
| Collagen-Ⅲ | F: 5'-GCA CAG CAG TCC AAC GTA GA-3' |
| R: 5'-GCT TCT TTT CCT TGG GGT TC-3' | |
| GAPDH | F: 5'-AAC TTT GGC ATT GTG GAA GG-3' |
| R: 5'-ACA CAT TGG GGG TAG GAA CA-3' |
1.2.6 免疫荧光染色: 将新鲜分离的肝组织用组织包埋剂包埋, 冰冻切片机切片0.5 μm厚, 风干过夜. 用冷的丙酮固定10 min, PBS冲洗2次(5 min/次), 10%山羊血清室温固定30 min. FITC直接标记的抗小鼠α平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)抗体(1:500)4 ℃孵育过夜. PBS冲洗3次(5 min/次)后封片, 置于荧光显微镜下观察.
统计学处理 所有数据用Graphpad Prism 4.0软件处理, 以mean±SD表示. 组间差异比较采用One-way ANOVA分析. P<0.05视为差异有统计学意义.
流式分析结果显示肝纤维化小鼠肝内CD4+CD25+Tregs表达明显高于正常小鼠, 当注射了CD25抗体后, 小鼠肝内Tregs水平下降50%以上(n = 4)(图1A), 表明CD25抗体封闭结果良好. 同时我们用Real-time PCR检测Foxp3的表达(n = 9), 结果显示其变化与流式分析结果一致(图1B).
为了研究Tregs在肝纤维化中的作用, 我们将Tregs进行了下调, 并与肝纤维化小鼠作比较. 免疫荧光结果显示在肝纤维化小鼠肝内α-SMA主要分布于肝内纤维组织间, 明显高于对照组小鼠; 降低Tregs后, α-SMA表达减少(图2A-C), 表明纤维化程度减轻. 我们同时用Real-time PCR检测了Ⅰ型胶原(n = 4)和Ⅲ型胶原(n = 4), 发现两者在肝纤维化小鼠肝内表达增高, 降低Tregs后表达均显著下降(图2D, E), 差异具有统计学意义.
肝脏是一个免疫器官, 含有众多种类的免疫细胞. 肝纤维化的发生及发展主要源于多次的免疫损伤及纤维修复所致. 近年来Tregs日益引起人们的重视. 作为一类重要的免疫抑制性调节细胞, Tregs在控制免疫平衡中扮演重要角色. 已有大量研究表明Tregs与众多的肝脏疾病关系密切[10]. 本研究发现虽然Tregs不是引发肝纤维化的原始病因, 但他对肝纤维化的维持起重要作用.
一项关于肺纤维化的研究给了我们很好的启示, 人为降低小鼠体内的CD4+CD25+Tregs水平, 可延缓由硅颗粒导致的肺纤维化过程[11]; 而且最新研究进一步表明降低CD4+CD25+Tregs对早期肺纤维化有抑制作用[12]. 我们发现肝纤维化小鼠肝内Ⅰ型、Ⅲ型胶原和肝星状细胞活化标志α-SMA高表达, 提示肝纤维化已经形成, 此时 Tregs水平显著升高, 这与临床肝硬化患者活检结果一致[5]. 下调Tregs后, 不仅小鼠肝内Ⅰ型、Ⅲ型胶原降低, α-SMA也降低, 提示肝纤维化程度减轻. 因此, 我们认为Tregs对肝纤维化发展有一定的促进作用.
众所周知, Tregs介导免疫耐受, 其典型特征为免疫无能和免疫抑制. 在对丙型肝炎的研究中发现Tregs对CD8+ T细胞的增殖和功能都有抑制作用[13]. Tregs还和Kupffer细胞共同诱导免疫耐受微环境, 从而影响T细胞的功能[14]. 此外, Tregs抑制NK细胞的活性也被证实[15]. 这些免疫细胞都对感染细胞或肝星状细胞有直接清除能力, 与肝纤维化关系密切. 因此, Tregs可能通过影响这些有杀伤能力的免疫细胞从而使纤维组织不易被清除, 实现其对肝纤维化发展的促进作用. 具体机制有待于进一步研究.
调节性T细胞(regulatory T cells, Tregs)介导免疫耐受. 研究发现许多肝硬化患者体内Tregs表达升高. 有学者认为Tregs会抑制免疫反应, 限制肝纤维化发展; 也有学者认为他不利于致病因素的清除, 促进疾病发展. 那么Tregs在肝纤维化中发挥什么作用, 目前仍无定论.
刘绍能, 主任医师, 中国中医科学院广安门医院消化科
Tregs是一类具有免疫抑制性的T淋巴细胞, 在肿瘤的免疫逃逸方面发挥重要作用, 研究较为深入. 近些年, 其在慢性肝病中的作用也陆续被发现, 包括自身免疫性肝病、酒精性肝病、肝硬化等, 日益引起大家的重视.
本文发现人为降低小鼠体内的CD4+CD25+Tregs水平, 可延缓由硅颗粒导致的肺纤维化过程; 而且最新研究进一步表明降低CD4+CD25+Tregs对早期肺纤维化有明显抑制作用.
本文针对已发生的肝纤维化, 之后给予降低Tregs水平干预, 反向研究Tregs在肝纤维化中的作用, 让人们对肝纤维化的形成和发展有了新的认识.
本文通过降低肝纤维化小鼠体内Tregs水平, 明确其在肝纤维化中的促进作用, 为肝纤维化的治疗提供了一定的实验依据.
本研究说明Tregs对肝纤维化发展有一定的促进作用. 实验设计合理, 资料详细, 结果可信, 有一定的参考价值.
编辑 郭鹏 电编 闫晋利
| 1. | Vignali DA, Collison LW, Workman CJ. How regulatory T cells work. Nat Rev Immunol. 2008;8:523-532. [PubMed] [DOI] |
| 2. | Fontenot JD, Rasmussen JP, Gavin MA, Rudensky AY. A function for interleukin 2 in Foxp3-expressing regulatory T cells. Nat Immunol. 2005;6:1142-1151. [PubMed] [DOI] |
| 3. | El-Badawy O, Sayed D, Badary MS, Abd-Alrahman ME, El-Feky MA, Thabit AG. Relations of regulatory T cells with hepatitis markers in chronic hepatitis B virus infection. Hum Immunol. 2012;73:335-341. [PubMed] [DOI] |
| 4. | Yoshizawa K, Abe H, Kubo Y, Kitahara T, Aizawa R, Matsuoka M, Aizawa Y. Expansion of CD4(+)CD25(+)FoxP3(+) regulatory T cells in hepatitis C virus-related chronic hepatitis, cirrhosis and hepatocellular carcinoma. Hepatol Res. 2010;40:179-187. [PubMed] [DOI] |
| 5. | Li WY, Jiang YF, Jin QL, Zhang H, Feng XW, Niu JQ. Immunologic characterization of posthepatitis cirrhosis caused by HBV and HCV infection. J Biomed Biotechnol. 2010;2010:138237. [PubMed] [DOI] |
| 6. | Fu J, Xu D, Liu Z, Shi M, Zhao P, Fu B, Zhang Z, Yang H, Zhang H, Zhou C. Increased regulatory T cells correlate with CD8 T-cell impairment and poor survival in hepatocellular carcinoma patients. Gastroenterology. 2007;132:2328-2339. [PubMed] [DOI] |
| 7. | Yang XH, Yamagiwa S, Ichida T, Matsuda Y, Sugahara S, Watanabe H, Sato Y, Abo T, Horwitz DA, Aoyagi Y. Increase of CD4+ CD25+ regulatory T-cells in the liver of patients with hepatocellular carcinoma. J Hepatol. 2006;45:254-262. [PubMed] |
| 8. | Claassen MA, de Knegt RJ, Tilanus HW, Janssen HL, Boonstra A. Abundant numbers of regulatory T cells localize to the liver of chronic hepatitis C infected patients and limit the extent of fibrosis. J Hepatol. 2010;52:315-321. [PubMed] [DOI] |
| 9. | Cabrera R, Tu Z, Xu Y, Firpi RJ, Rosen HR, Liu C, Nelson DR. An immunomodulatory role for CD4(+)CD25(+) regulatory T lymphocytes in hepatitis C virus infection. Hepatology. 2004;40:1062-1071. [PubMed] |
| 10. | Liu F, Liu J, Weng D, Chen Y, Song L, He Q, Chen J. CD4+CD25+Foxp3+ regulatory T cells depletion may attenuate the development of silica-induced lung fibrosis in mice. PLoS One. 2010;5:e15404. [PubMed] [DOI] |
| 11. | Boveda-Ruiz D, D'Alessandro-Gabazza CN, Toda M, Takagi T, Naito M, Matsushima Y, Matsumoto T, Kobayashi T, Gil-Bernabe P, Chelakkot-Govindalayathil AL. Differential role of regulatory T cells in early and late stages of pulmonary fibrosis. Immunobiology. 2013;218:245-254. [PubMed] [DOI] |
| 12. | Speletas M, Argentou N, Germanidis G, Vasiliadis T, Mantzoukis K, Patsiaoura K, Nikolaidis P, Karanikas V, Ritis K, Germenis AE. Foxp3 expression in liver correlates with the degree but not the cause of inflammation. Mediators Inflamm. 2011;2011:827565. [PubMed] [DOI] |
| 13. | Sturm N, Thélu MA, Camous X, Dimitrov G, Ramzan M, Dufeu-Duchesne T, Bonorino P, Guillermet C, Brambilla E, Arvers P. Characterization and role of intra-hepatic regulatory T cells in chronic hepatitis C pathogenesis. J Hepatol. 2010;53:25-35. [PubMed] [DOI] |
| 14. | Breous E, Somanathan S, Vandenberghe LH, Wilson JM. Hepatic regulatory T cells and Kupffer cells are crucial mediators of systemic T cell tolerance to antigens targeting murine liver. Hepatology. 2009;50:612-621. [PubMed] [DOI] |