修回日期: 2014-06-05
接受日期: 2014-06-11
在线出版日期: 2014-08-08
目的: 通过观察红牛饮料对慢性酒精性肝损伤大鼠肝功能的保护作用, 为预防和保护酒精性肝损伤提供实验依据.
方法: 采用56度白酒灌胃, 建立慢性酒精性肝损伤大鼠模型. 阳性组给予白酒, 空白组给予0.9%生理盐水, 实验组给予白酒同时给予相应红牛饮料饮用. 实验末测血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、肝组织匀浆测超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malonic dialdehyde, MDA), 金属硫蛋白(metallothionein, MT). 左肝叶作常规石蜡切片, 进行HE染色, 观察肝脏病理学变化.
结果: 不同组间SOD差异有统计学意义(F = 5.793, P = 0.017), 采用LSD法进行两两比较, 结果显示空白组SOD明显高于阳性组(0.882 U/mgprot±0.044 U/mgprot vs 0.649 U/mgprot±0.154 U/mgprot, P<0.05). 实验组SOD明显高于阳性组(0.797 U/mgprot±0.097 U/mgprot vs 0.649 U/mgprot±0.154 U/mgprot, P<0.05). 空白组与实验组差异无统计学意义. 不同组间ALT、AST、MDA、MT差异均无统计学意义. 肝脏病理切片显示阳性组个别肝组织出现肝淤血, 不具有说服力.
结论: 红牛饮料对慢性酒精性肝损伤大鼠肝功能有一定的保护作用.
核心提示: 本研究中红牛饮料能显著提高酒精性肝损伤大鼠肝脏中超氧化物歧化酶(superoxide dismutase, SOD)的含量, 说明其能诱导大鼠肝组织内SOD的表达, 提高机体清除自由基的活性, 提高机体的抗氧化功能, 因此, 红牛饮料对慢性酒精性肝损伤大鼠肝功能有一定的保护作用.
引文著录: 刘敏, 郑婷, 骆彦霏, 左常茜, 王海悦, 高凌峰. 红牛饮料对慢性酒精性肝损伤大鼠肝功能的保护作用. 世界华人消化杂志 2014; 22(22): 3259-3263
Revised: June 5, 2014
Accepted: June 11, 2014
Published online: August 8, 2014
AIM: To observe whether Red Bull drinks have a protective effect against chronic alcoholic liver injury in rats.
METHODS: Chronic alcoholic liver injury was induced in rats by intragastric administration of alcohol (56°). Rats were divided into three groups and were given alcohol (positive group), 0.9% saline (control group), and alcohol plus Red Bull drinks (experimental group), respectively. Serum levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), and the activities of superoxide dismutase (SOD), malondialdehyde (MDA) and metallothionein (MT) were detected by the end of the experiment. Conventional paraffin section of the left lobe was stained with hematoxylin-eosin (HE) to observe pathological changes.
RESULTS: SOD showed significant differences among the three groups (F = 5.793, P = 0.017). SOD was significantly higher in the control group than in the positive group (0.882 ± 0.044 vs 0.649 ± 0.154, P < 0.05), and in the experimental group than in the positive group (0.797 ± 0.097 vs 0.649 ± 0.154, P < 0.05), although there was no significant difference between the positive group and experimental group. Liver pathology showed congestion in individual liver tissues in the positive group, which was not persuasive.
CONCLUSION: Red Bull drinks have an appreciated protective effect against chronic alcoholic liver injury in rats.
- Citation: Liu M, Zheng T, Luo YF, Zuo CQ, Wang HY, Gao LF. Protective effect of Red Bull drinks against chronic alcoholic injury in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(22): 3259-3263
- URL: https://www.wjgnet.com/1009-3079/full/v22/i22/3259.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i22.3259
酒精性肝病(alcoholic liver disease, ALD)是指长期过量饮酒导致的肝脏疾病, 包括酒精性脂肪肝(alcoholic fatty liver, AFL)、酒精性肝炎(alcoholic hepatitis, AH)、酒精性肝纤维化(alcoholic hepatic fibrosis, AHF)、酒精性肝硬化(alcoholic cirrhosis, AC)和肝细胞癌(hepatocellular carcinoma, HCC)[1]. 近年来研究表明酒精是肝细胞的一种凋亡诱导剂, 他在ALD的发生、发展过程中起着重要作用[2]. 目前, 在临床中, 酒精性肝损伤的发生呈现上升的趋势. 我国, 随着人民生活水平的提高, 酗酒者增多, ALD发病率迅速上升, 在饮酒者中已达到6.1%[3], 成为仅次于病毒性肝病的第二大肝病[4], 人们对肝脏的保护越来越重视. 陈震等[5]的研究表明, 咖啡因能显著降低小鼠血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)水平, 显示咖啡因对小鼠的急性酒精性肝损伤有保护作用. 刘辉等[6]的研究表明, 牛磺酸能够有效保护酒精对大鼠肝脏的损伤作用. 吴高峰等[7]的研究表明, 牛磺酸可以改善酒精对大鼠造成的机体损伤, 降低ALD大鼠血清中AST、ALT水平, 升高肝组织总蛋白含量; 提高大鼠肝组织中超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽(glutathione, GSH)活性, 降低丙二醛(malondialdehyde, MDA), 从而抑制酒精刺激所造成的肝脏脂质过氧化的发生. 红牛饮料中, 主要含有咖啡因、牛磺酸、赖氨酸等物质[8]. 而对慢性酒精性肝损伤大鼠的肝功能保护作用未见报道.
选取♂SPF级SD大鼠, 15只, 体质量180-220 g, 由湖南斯莱克景达实验动物有限公司提供, 动物质量合格证编号: 43004700001610. 适应性饲养1 wk, 随机分为3组: 空白组: 5只(1只在灌胃时意外死亡, 故去除), 阳性组: 4只(2只在灌胃时意外死亡, 故去除), 实验组: 6只. 红牛饮料(海南红牛饮料有限公司, 批号: 琼卫食证字(2006)第460000-010068号; 56度红星二锅头酒(北京红星股份有限公司, 批号: 6906785230165); SOD试剂盒: 南京建成生物工程研究所, 羟胺法; MDA试剂盒: 南京建成生物工程研究所, TBA法; MT试剂盒: 南京建成生物工程研究所, ELISA法; 全自动生化分析仪(型号: 7020, 日立公司); 分光光度计(型号: VIS-722S, 奥普勒公司); 离心机(型号: 5810, 德国Eppendorf公司); IVC-Ⅱ型(智能型)独立送风隔离笼具(型号: GA56, 苏州市冯氏实验动物设备有限公司).
1.2.1 造模及给药途径: 实验组和阳性组按每周测定体质量, 每日早晚各给予一次白酒(56度红星二锅头酒)灌胃, 2次灌胃时间间隔超过8 h. 前4 wk每日给予400 mL/L乙醇(即将56度白酒100 mL加蒸馏水至140 mL), 8 g/kg灌胃, 从第5 wk开始每日给予500 mL/L乙醇(即将56度白酒100 mL加蒸馏水至112 mL), 9 g/kg灌胃, 至8 wk末. 空白组给予等体积的0.9%生理盐水灌胃. 饲养期间实验组给予40 mL红牛饮料自由饮用(大鼠生理需水量大约为40 mL[9]), 空白组和阳性组给予40 mL蒸馏水自由饮用, 各组自由摄食, 实验周期为8 wk.
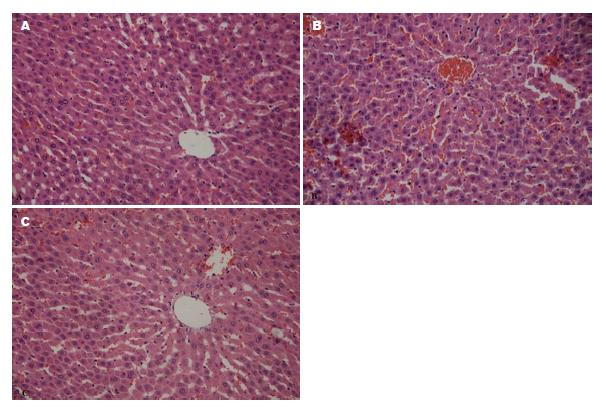
1.2.2 指标测定: (1)血清检测ALT、AST, 肝组织匀浆检测SOD、MDA、MT: 于末次灌胃, 禁食不禁水12 h后, 3%戊巴比妥钠溶液(1 mL/kg)腹腔麻醉, 心脏取血制备血清及10%肝组织匀浆, 检测上述指标; (2)肝组织切片: 处死大鼠后, 迅速剖取肝左叶, 放入40 g/L的甲醛溶液固定, 送海南省药物安全性评价研究中心, 作常规石蜡切片, 进行HE染色, 观察肝脏病理学变化, 拍摄病理切片.
统计学处理 所有呈正态分布数据以mean±SD表示, 所有对数呈正态分布数据以几何均数±几何标准差表示, 采用SPSS19.0软件进行分析, 统计分析采用完全随机设计方差分析, 两两比较采用LSD法, 检验水准为α = 0.05, P<0.05为差异有统计学意义.
表1结果显示, 空白组、阳性组及实验组3组之间ALT含量差异无统计学意义(50.36 U/L±1.93 U/L vs 73.42 U/L±1.67 U/L; 50.36 U/L±1.93 U/L vs 75.25 U/L±3.67 U/L; 73.42 U/L±1.67 U/L vs 75.25 U/L±3.67 U/L). 空白组、阳性组及实验组3组之间AST含量差异无统计学意义(159.60 U/L±44.287 U/L vs 281.00 U/L±170.368 U/L; 159.60 U/L±44.287 U/L vs 380.00 U/L±369.466 U/L; 281.00 U/L±170.368 U/L vs 380.00 U/L±369.466 U/L).
| 分组 | n | ALT | AST |
| 空白组 | 5 | 50.36±1.93 | 159.60±44.287 |
| 阳性组 | 4 | 73.42±1.67 | 281.00±170.368 |
| 实验组 | 6 | 75.25±3.67 | 380.00±369.466 |
不同组间SOD差异有统计学意义(F = 5.793, P = 0.017), 采用LSD法进行两两比较, 结果显示空白组SOD明显高于阳性组(0.882 U/mgprot±0.044 U/mgprot vs 0.649 U/mgprot±0.154 U/mgprot, P<0.05). 实验组SOD明显高于阳性组(0.797 U/mgprot±0.097 U/mgprot vs 0.649 U/mgprot±0.154 U/mgprot, P<0.05). 空白组与实验组差异无统计学意义(表2). 其余指标无显著性差异.
| 分组 | n | SOD(U/mgprot) | MDA(nmol/mL) | MT(pg/mL) |
| 空白组 | 5 | 0.882±0.044 | 0.042±0.038 | 2857.46±479.87 |
| 阳性组 | 4 | 0.649±0.154 | 0.041±0.014 | 2914.71±103.92 |
| 实验组 | 6 | 0.797±0.097 | 0.043±0.021 | 2956.98±193.39 |
肝脏是乙醇代谢的主要场所, 饮酒后, 约90%在肝内代谢, 当血液和肝组织中乙醇浓度较低时, 进入体内的乙醇大部分通过乙醇脱氢酶(ethanol dehydrogenase, ADH)代谢, 转化为乙醛, 乙醛再经乙醛脱氢酶(acetaldehyde dehydrogenase, ALDH)的作用, 代谢为无毒的乙酸, 最终进入三羧酸循环生成能量、CO2和H2O. 乙醛转化为乙酸的速度较慢, 易导致乙醛在体内蓄积[10]. 乙醛可与肝细胞中的蛋白质、DNA发生整合, 形成乙醛加合物, 如MDA-乙醛加合物等, 诸多乙醛加合物可导致受其影响的蛋白质发生变构, 失去应有的功能, 从而引起肝细胞功能受损[11]. 同时, 乙醛加合物还能使机体活性氧(reactive oxygen species, ROS)增多, 氧化应激水平升高, 导致脂质过氧化, MDA增高, 某些抗氧化物质如SOD、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-PX)大量消耗, 削弱机体多个器官特别是肝脏的抗氧化能力, 其诱导的氧化应激作用在ALD发生发展过程中扮演着重要角色[12,13].
本实验采用白酒灌胃的方法建立慢性酒精性肝损伤大鼠模型[14], 8 wk之后, 阳性组大鼠肝脏SOD水平显著下降, 阳性组SOD水平与空白组及实验组SOD水平差异有统计学意义, 阳性组低于空白组及实验组, 空白组与实验组SOD 水平差异无统计学意义. 血清的ALT和AST是反映肝细胞受损的重要指标, 但3组间ALT、AST、MDA结果无显著差异, 可能是由于实验样本量小, 实验时间短, 未能证实红牛饮料对大鼠肝损伤后是否能降低ALT、AST、MDA水平. 病理组织切片提示阳性组个别肝组织出现肝淤血, 不具有说服力.
有文献报道, ALD发病机制可能与乙醇及其代谢产物对肝脏的不良反应、氧应激、免疫诱导和细胞因子、细胞凋亡、遗传、病毒的叠加作用等有关[15]. 其发病机制主要包括以下几个方面: (1)乙醇代谢过程中代谢产物的毒害作用; (2)氧化应激作用; (3)细胞因子/炎症介质的作用; (4)内毒素介导的细胞因子作用. 其中, 由于生物体内氧化还原状态的平衡破坏而导致过量的ROS而引发的氧化应激反应, 是多种肝病发病的共同病理基础[16]. 正常生命过程中产生的超氧阴离子自由基是维持生命所必需的, 当其浓度过高时, 对机体会造成损害. 因此, 超氧化物歧化酶作为其特异清除剂, 在生物体的生命活动中具有重要意义[17], 大量研究表明, SOD活性低下可以看作是某些疾病的特征之一[18].
SOD是生物体内最为重要的抗氧化酶之一, 是清除ROS的第一道防线. 主要清除O2-及防止O2-直接或间接转变为其他形式的自由基, 防止生物膜脂质过氧化损伤. SOD是O2-的"克星", 具有抗炎、抗病毒、抗辐射、抗衰老等作用[19]. SOD作为体内唯一的O2-清除剂, 参与酒精性肝损伤的病理过程. 本研究中红牛饮料能显著提高酒精性肝损伤大鼠肝脏中SOD的含量, 说明红牛饮料能诱导大鼠肝组织内SOD的表达, 提高机体清除自由基的活性, 提高机体的抗氧化功能, 这提示红牛饮料对肝脏的保护作用可能与增强机体清除自由基及抑制自由基反应的能力, 防止过度脂质过氧化有关. 因此, 红牛饮料对慢性酒精性肝损伤大鼠肝功能有一定的保护作用.
本项目在实施过程中得到海南医学院教务部、机能学实验室、海南省药物安全性评价中心的大力支持. 组织病理学检查方面, 得到谢富生老师的无私帮助, 在数据统计学处理方面, 得到吴玲老师的无私帮助; 在此一并表示衷心感谢.
目前, 酒精性肝病(alcoholic liver disease, ALD)发病率迅速上升, 人们对肝脏的保护越来越重视. 本研究通过建立理想的动物模型, 以探究红牛饮料对慢性酒精性肝损伤大鼠的肝功能保护作用.
迟宝荣, 教授, 吉林大学第一医院消化内科
酒精对人类健康的危害已成共识. 人们对肝脏的保护越来越重视. 对肝功能保护作用的研究已刻不容缓.
咖啡因对小鼠的急性酒精性肝损伤有保护作用. 氧化应激可导致ALD的发生发展. 牛磺酸可以抑制酒精刺激所造成的肝脏脂质过氧化的发生.
本文探究红牛饮料对慢性酒精性肝损伤大鼠的肝功能保护作用, 意义重大, 对今后ALD患者的肝功能的保护具有重要作用, 是ALD患者的福音.
本文初步探讨了红牛饮料对慢性酒精性肝损伤大鼠的保护作用, 具有一定创新性. 但研究中各组样本量太少, 病理结果没有慢性酒精性肝损伤改变, 不能证实造模成功(可能与造模方法、时间有关), 导致其他结果说服力下降. 红牛饮料成分复杂, 建议今后选用国内外公认的造模方法, 增加各组样本含量, 进一步研究探讨.
编辑 郭鹏 电编 闫晋利
| 2. | Stewart S, Jones D, Day CP. Alcoholic liver disease: new insights into mechanisms and preventative strategies. Trends Mol Med. 2001;7:408-413. [PubMed] [DOI] |
| 7. | 吴 高峰. 牛磺酸对大鼠酒精性肝病防治作用及其机理的研究. 沈阳: 沈阳农业大学 2006; . |
| 11. | Setshedi M, Wands JR, Monte SM. Acetaldehyde adducts in alcoholic liver disease. Oxid Med Cell Longev. 2010;3:178-185. [PubMed] [DOI] |
| 12. | Cederbaum AI, Lu Y, Wu D. Role of oxidative stress in alcohol-induced liver injury. Arch Toxicol. 2009;83:519-548. [PubMed] [DOI] |
| 13. | 王 洪武, 李 守超, 贺 海波, 曾 晓, 狄 国杰, 张 长城, 余 枫华, 何 毓敏, 袁 丁. 竹节参提取物对小鼠急性肝损伤的保护作用. 中国临床药理学与治疗学. 2012;17:961-966. |
| 14. | 马 晓茜. 大鼠酒精性肝损伤模型的制备及观察. 山东医学高等专科学校学报. 2011;33:81-83. |
| 15. | Xu D, Thiele GM, Beckenhauer JL, Klassen LW, Sorrell MF, Tuma DJ. Detection of circulating antibodies to malondialdehyde-acetaldehyde adducts in ethanol-fed rats. Gastroenterology. 1998;115:686-692. [PubMed] [DOI] |
| 18. | 丁 书茂, 杨 旭. 超氧化物歧化酶及其模拟化合物研究进展. 高等函授学报(自然科学版). 2004;17:1-5. |
| 19. | 岳 俊杰. 镍超氧化物歧化酶模型化合物的设计、合成、表征和构效关系研究. 天津: 天津师范大学 2003; . |