修回日期: 2014-05-04
接受日期: 2014-05-06
在线出版日期: 2014-07-18
目的: 探讨尿苷二磷酸葡萄糖醛酸基转移酶1A1(UDP-glucuronsyl transferase 1A1, UGT1A1)基因多态性与中国青年人胆囊结石的关系.
方法: 收集胆囊结石患者48例作为结石组, 无胆囊结石的健康体检者45例作为对照组. 两组病例均提取外周血基因组DNA, 对其进行PCR-Sanger法测序, 检测UGT1A1基因TA盒和G71R突变, 比较两组病例的UGT1A1基因多态性.
结果: 结石组UGT1A1基因发生TATA盒插入突变15例, 突变率达31.25%, 对照组发生TATA盒突变10例, 突变率为22.22%, 两组UGT1A1基因启动子TATA盒突变无统计学差异(P>0.05). 结石组编码区发生G71R点突变14例, 突变率达29.17%, 对照组G71R点突变9例, 突变率为20%, 两组发生G71R点突变多态性无统计学差异(P>0.05). 结石组中UGT1A1基因存在TA盒或G71R突变的共有28例, 对照组为18例, 两组UGT1A1基因多态性差别无统计学意义(P>0.05).
结论: 单纯UGT1A1基因多态性与我国青年人胆囊结石的发病无明显直接关系.
核心提示: 探讨尿苷二磷酸葡萄糖醛酸基转移酶1A1(UDP-glucuronsyl transferase 1A1, UGT1A1)基因多态性与中国青年人胆囊结石的关系, 目前尚不能确定在华人范围内UGT1A1基因与胆囊结石的形成有直接关系.
引文著录: 郑德奎, 王金明, 熊刚, 张悦, 刘利平, 张燕珊. UGT1A1基因多态性与中国青年人胆囊结石的关系. 世界华人消化杂志 2014; 22(20): 2961-2965
Revised: May 4, 2014
Accepted: May 6, 2014
Published online: July 18, 2014
AIM: To explore the relationship between UDP-glucuronsyl transferase 1A1 (UGT1A1) gene polymorphisms and cholecystolithiasis in young Chinese people.
METHODS: Forty-eight patients with cholecystolithiasis and 45 healthy controls were included in the study. Peripheral blood genomic DNA was extracted and subjected to DNA sequencing for detecting the TATA box and G71R polymorphisms of the UGT1A1 gene.
RESULTS: The insertion mutations in the TATA box of the UGT1A1 gene were detected in 15 cases (15/48, 31.25%) and 10 controls (10/45, 22.22%), and the mutation rate showed no statistical difference between the two groups (P > 0.05). The point mutation G71R was detected in 14 cases (14/48, 29.17%) and 9 controls (9/45, 20.00%), and the mutation rate showed no statistical difference between the two groups (P > 0.05). The mutations in the TATA box or G71R of the UGT1A1 gene were detected in 28 cases (28/48, 58.33%) and 18 cases (18/46, 40.00%), without statistical difference between the two groups (P > 0.05).
CONCLUSION: There is no significant relationship between UGT1A1 gene polymorphisms and the onset of cholecystolithiasis in young Chinese people.
- Citation: Zheng DK, Wang JM, Xiong G, Zhang Y, Liu LP, Zhang YS. Relationship between UGT1A1 gene polymorphisms and cholecystolithiasis in young Chinese people. Shijie Huaren Xiaohua Zazhi 2014; 22(20): 2961-2965
- URL: https://www.wjgnet.com/1009-3079/full/v22/i20/2961.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i20.2961
胆石症在世界上仍然是常见病、多发病, 且随着人口年龄增长、人们生活节奏的加快及生活水平的提高, 其发病率呈上升趋势. 目前我国成年人胆囊结石的发病率约为10%, 中年妇女甚至高达15%[1]. 胆石形成因素复杂, 近年来研究表明胆红素代谢异常可能是其重要原因. 尿苷二磷酸葡萄糖醛酸基转移酶1A1(UDP-glucuronsyl transferase 1A1, UGT1A1)基因突变可导致胆红素尿苷二磷酸葡萄糖醛酸基转移酶(UGT)结构的异常, 从而使非结合胆红素变成结合胆红素功能的丧失或缺陷, 导致胆红素代谢异常[2]. 既往国外文献报道对于存在慢性溶血性疾病的患者, UGT1A1基因多态性是其形成胆囊结石的重要诱因. UGT1A1基因多态性与胆囊结石形成有直接关系[3]. 鉴于UGT1A1基因多态性在亚洲人、高加索人和非洲人种之间存在明显的种族差异[4], 本实验旨在通过检测UGT1A1基因的多态性, 探讨其与我国青年人胆囊结石的关系.
收集2010-06/2012-06深圳市人民医院门诊及住院经B超证实存在胆囊结石深圳市患者共48例, 其中男22例, 女26例, 年龄范围18-30岁, 平均年龄为25.2岁, 体质量指数(body mass index, BMI)18-25 kg/m2, 平均为22.62 kg/m2, 有慢性胆囊炎病史者15例, 无症状性胆囊结石30例, 有5例存在胆囊结石家族史; 同时随机选取经B超证实无胆囊结石健康体检者45例作为对照, 其中男22例, 女23例, 年龄均为18-30岁, 平均年龄24.8岁, BMI为17-24 kg/m2, 平均为21.78 kg/m2, 其中有2例存在胆囊结石家族史. 两组病例性别、年龄无统计学差异, 均无高血压病、糖尿病、溶血性疾病、肝脏相关疾病、克罗恩病、人工心脏瓣膜置换术、全身营养不良、雌激素替代治疗、回肠切除等疾病史, 女性病例均无妊娠史. 所入选者均知情并签订知情同意书.
抽取外周血3 mL抗凝, 使用QIAGEN公司生产试剂盒IAamp DNA Blood Mini Kit提取基因组DNA; 使用NanoDrop 2000/8000对提取的DNA进行吸光度检测, 以测定其浓度, 同时根据A260/280和A260/230的值来初步判断样本纯度将DNA在1%的琼脂糖凝胶中进行凝胶电泳, 经EB染色后进行紫外显影成像, 根据成像判断DNA纯度. 以提取的DNA为模板, 在25 μL PCR Mix体系中进行聚合酶链式反应. 体系中应包含10×buffer、dNTP、ddH2O、rTAq酶、Primer F/R. 经预变性, 30个循环的变性、退火、延伸, 再延伸等实验反应进行PCR扩增. 将PCR产物纯化. 之后使用PCR试验中的Primer F/R作为测序引物, 再加入dNTP和ddNTP的体系中进行测序扩增. 经3730测序仪处理后由电脑生成测序峰图. 在数据解读软件的界面下, 将测序峰图及正常人基因参考序列进行比对, 找出UGT1A1基因启动子区TATA 盒及p.G71R突变情况.
统计学处理 所有数据采用SPSS13.0统计软件处理, 计量资料用mean±SD表示, 数据比较采用t检验, 率的比较用χ2检验. P<0.05为差异有统计学意义.
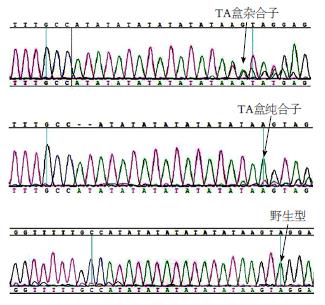
两组UGT1A1基因启动子区均存在A(TA)6TAA和A(TA)7TAA两种多态性(图1). 胆囊结石组48例中UGT1A1基因启动子区发生TATA盒插入性突变共15例(其中TA7/TA7纯合子2例, TA6/TA7杂合子13例), 对照组45例中UGT1A1基因启动子区TATA盒亦存在插入性突变, 共10例(其中TA6/TA7杂合子10例, 无TA7/TA7纯合子). 结石组与对照组中UGT1A1基因启动子TA盒多态性无统计学差异(P>0.05)(表1).
| 分组 | n | TATA盒突变(n) | 突变率n(%) | ||
| 杂合子 | 纯合子 | 野生型 | |||
| 对照组 | 45 | 10 | 0 | 35 | 10(22.22) |
| 结石组 | 48 | 13 | 2 | 33 | 15(31.25) |
| 合计 | 23 | 2 | 68 | 25(26.88) | |
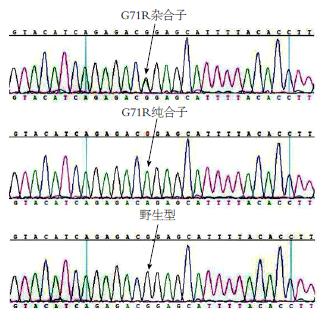
两组UGT1A1基因编码区p.Gly71Arg亦存在杂合子和纯合子两种多态性, 如图2. 结石组编码区发生p.Gly71Arg点突变纯合子1例, 杂合子13例; 对照组编码区发生p.Gly71Arg点突变纯合子0例, 杂合子9例. 结石组与对照组UGT1A1基因编码区发生p.Gly71Arg点突变无统计学差异(P>0.05)(表2).
| 分组 | n | G71A点突变(n) | 突变率n(%) | ||
| 杂合子 | 纯合子 | 野生型 | |||
| 对照组 | 45 | 9 | 0 | 36 | 9(20.00) |
| 结石组 | 48 | 13 | 1 | 34 | 14(29.17) |
| 合计 | 22 | 1 | 70 | 23(24.73) | |
正常人的胆红素经单核-巨噬细胞系统产生后与白蛋白结合, 转运到肝细胞表面后被肝细胞摄取、内化固定并转运到肝微粒体, 在关键酶胆红素-尿嘧啶二磷酸葡萄糖醛酸转移酶(bilirubin UDP-glucuronsyl transferase, B-UGT)作用下, 一个或两个葡萄糖醛酸基结合到胆红素分子的侧链上, 生成胆红素单葡萄糖醛酸酯或胆红素二葡萄糖醛酸酯, 进而被排泌到胆道系统中. B-UGT是由一个多基因家族(UGTl和UGT2)编码的一组同工酶. 先前文献报道, UGT1A1基因是肝脏中唯一具有胆红素葡萄糖醛酸化活性相关酶的编码基因[5]. UGT1A1基因定位于染色体2q3p1区, 基因长218 kb, 含有13个B-UGT基因, 每个人的UGT1A1基因都是由1个独立外显子(12p21)和4个共用外显子构成.
目前, 已发现30多个UGT1A1基因突变位点, 分别位于启动子区域和5个外显子中. 包括两种类型: (1)启动子区TATA盒TA插入型: 西方人较多见, 为常染色体隐性遗传, 在UGT1A1的启动子TATA盒中一般有TA插入, 使正常A(TA)6TAA突变为A(TA)7TAA; Matsui等[6]认为突变为A(TA)7TAA的基因型还同时含有c.3275T>G或其他多态性. 而国内最近文献报道在UGT1A1启动子区CAAT盒中发现有CAT的插入突变[7], CAT插入突变常见于Crigler-Najjar综合征; (2)单碱基突变: 为常染色体显性遗传, 东方人多为此类型, 其中UGT1A1的(p.Gly71Arg)较为多见, 其211号核苷酸发生G→A突变, 71位密码子由GGA变成AGA, 即G71R突变. 另外, UGT1A1(Pro229Gln)、第4外显子(Arg367Gly)、第5外显子(Tyr486Asp)的突变等也有报道[8]. 也有启动子上游苯巴比妥反应增强元件(PBREM)区T-3279G突变的报道[9]. 而TA盒突变和Gly71Arg点突变是最为常见的两种突变方式, 本研究对此进行了检测.
UGT1A1多态性在亚洲人、高加索人和非洲人种之间存在明显的人种差异. 其中UGT1A1*6(G71R突变) 多态性表现为211G>A, 形成3种基因型: G/G、A/G和A/A, 其突变在亚洲人群中的发生率高达13%-23%[10]. 国外文献报道, 白种人UGT1A1*28(TA盒)多态性的频率较高, UGT1A1*28杂合基因型TA6/TA7占35%-50%, UGT1A1*28纯合基因型TA7/TA7占10%-15%, 而TA6/TA6野生型只占40%-50%[11-13]. 国内文献报道UGT1A1*28基因多态性的分布情况大致是: TA盒杂合子占15%-25%; 野生型TA6/TA6占70%-85%; 纯合子不超过5%[14,15]. 本研究对照组45例中UGT1A1基因启动子区TATA盒突变TA6/TA7杂合子10例, 无纯合子TA7/TA7突变, 与上述我国分布情况基本一致, 编码区发生p.Gly71Arg点突变杂合子9例, 无纯合子突变, 与上述发生率相符.
UGT1A1基因的多态性可导致UGT酶结构的异常, 从而发生结合功能的丧失或缺陷, 引起非结合胆红素转化为结合胆红素障碍, 导致游离胆红素(unconjugated bilirubin, UCB)和单结合胆红素(monoconjugated bilirubin, MCB)增多, 而UCB和MCB难溶于胆汁中, 进而促进结石发生. Kitsiou-Tzeli等[16]通过对荷兰30例患胆囊结石儿童和40例对照组分别检测UGT1A1基因启动子区TATA盒突变多态性, 结果表明结石组儿童TATA盒突变率显著高于对照组. Tsezou等[3]也通过类似病例对照研究对希腊成年人胆囊结石进行分析, 对198例胆囊结石和152例正常人检测UGT1A1基因启动子区TATA盒突变多态性, 研究发现TATA盒突变纯合及杂合性A(TA)7TAA基因型的胆囊结石患者均与希腊成年人胆石症显著相关. 目前, 尚缺乏中国胆囊结石患者与UGT1A1基因多态性相关性的研究报道.
本研究中, 胆囊结石组48例中存在TATA盒突变15例(其中纯合子2例, 杂合子13例); 编码区发生p.Gly71Arg点突变纯合子1例, 杂合子13例. 尽管该两位点突变发生率均高于对照组, 但两组间均无统计学差异. 结石组中UGT1A1基因存在TA盒或G71R突变的有28例, 对照组有18例. 其中两组中各有1例同时存在TATA盒突变和p.Gly71Arg点突变, 且均为杂合突变. 两组UGT1A1基因TA盒或G71R突变多态性差别无统计学意义(P<0.05). 本研究表明, UGT1A1基因此两位点多态性与胆囊结石的发病无明显直接关系. 本研究与Tsezou等[3]、Kitsiou-Tzeli等[16]研究结果不同, 一方面不排除可能是因人种差异所致, 另一方面, 也不排除该基因其他位点多态性形成复合杂合形式致病. 我们下一步将检测、分析UGT1A1其他位点基因多态性与胆囊结石的相关性.
胆囊结石病目前在世界上仍然是常见病、多发病, 我国发病率高达8%-10%. 目前引起胆囊结石的原因很多, 最常见的有致石基因与遗传、脂代谢紊乱、胆囊动力学紊乱以及细菌感染等因素. 本实验旨在通过检测尿苷二磷酸葡萄糖醛酸基转移酶1A1(UDP-glucuronsytrans-ferase1A1, UG-T1A1)基因的多态性, 探讨其与中国青年人胆囊结石的成因有无关系.
孔静, 副教授, 副主任医师, 中国医科大学附属盛京医院胆道、血管外科、微创外科
胆囊结石作为常见病、多发病, 几十年来不少学者对胆囊形成的因素做了大量研究, 其中致石基因研究是热点之一. UGT1A1基因突变可导致胆红素尿苷二磷酸葡萄糖醛酸基转移酶(UGT)结构的异常, 从而使非结合胆红素变成结合胆红素功能的丧失或缺陷, 导致胆红素代谢异常. 对该基因与胆囊结石形成机制研究国外已经有相关报道, 但鉴于人种差异, 华人范围内尚无报道.
有报道提出地中海地区、欧洲部分地区UGT1A1基因多态性与胆囊结石形成有直接关系. 而对于存在慢性溶血性疾病的患者, UGT1A1基因多态性是其形成胆囊结石的重要诱因, 可以进一步提高胆囊结石发病率.
鉴于UGT1A1基因多态性在亚洲人、高加索人和非洲人种之间存在明显的种族差异, 本实验旨在通过检测UGT1A1基因的多态性, 探讨其与中国青年人胆囊结石的关系.
本研究与国外研究结果不同, 可为下一步检测、分析UGT1A1其他位点基因多态性与胆囊结石的相关性提供相关依据.
本文设计合理, 实验方法可行, 数据可靠, 为下一步的研究提出了新的思路
编辑 田滢 电编 都珍珍
| 2. | Wasmuth HE, Keppeler H, Herrmann U, Schirin-Sokhan R, Barker M, Lammert F. Coinheritance of Gilbert syndrome-associated UGT1A1 mutation increases gallstone risk in cystic fibrosis. Hepatology. 2006;43:738-741. [PubMed] [DOI] |
| 3. | Tsezou A, Tzetis M, Giannatou E, Spanos I, Roma E, Fretzayas A, Kanavakis E, Kitsiou-Tzeli S. Gilbert syndrome as a predisposing factor for cholelithiasis risk in the Greek adult population. Genet Test Mol Biomarkers. 2009;13:143-146. [PubMed] [DOI] |
| 4. | Kaniwa N, Kurose K, Jinno H, Tanaka-Kagawa T, Saito Y, Saeki M, Sawada J, Tohkin M, Hasegawa R. Racial variability in haplotype frequencies of UGT1A1 and glucuronidation activity of a novel single nucleotide polymorphism 686C>T (P229L) found in an African-American. Drug Metab Dispos. 2005;33:458-465. [PubMed] [DOI] |
| 6. | Matsui K, Maruo Y, Sato H, Takeuchi Y. Combined effect of regulatory polymorphisms on transcription of UGT1A1 as a cause of Gilbert syndrome. BMC Gastroenterol. 2010;10:57. [PubMed] [DOI] |
| 7. | 武 桂萍, 石 银月, 郝 俊贵, 颜 学兵, 王 兴田, 柳 红. 经基因型鉴定确诊为Gilbert综合征一例报道及文献复习. 中华实验和临床感染病杂志(电子版). 2012;6:464-466. |
| 8. | Iijima S, Ohzeki T, Maruo Y. Hereditary spherocytosis coexisting with UDP-glucuronosyltransferase deficiency highly suggestive of Crigler-Najjar syndrome type II. Yonsei Med J. 2011;52:369-372. [PubMed] [DOI] |
| 9. | Lee HJ, Moon HS, Lee ES, Kim SH, Sung JK, Lee BS, Jeong HY, Lee HY, Eu YJ. A case of concomitant Gilbert's syndrome and hereditary spherocytosis. Korean J Hepatol. 2010;16:321-324. [PubMed] [DOI] |
| 10. | Desai AA, Innocenti F, Ratain MJ. Pharmacogenomics: road to anticancer therapeutics nirvana? Oncogene. 2003;22:6621-6628. [PubMed] [DOI] |
| 11. | Marcuello E, Altés A, Menoyo A, Del Rio E, Gómez-Pardo M, Baiget M. UGT1A1 gene variations and irinotecan treatment in patients with metastatic colorectal cancer. Br J Cancer. 2004;91:678-682. [PubMed] [DOI] |
| 12. | Font A, Sánchez JM, Tarón M, Martinez-Balibrea E, Sánchez JJ, Manzano JL, Margelí M, Richardet M, Barnadas A, Abad A. Weekly regimen of irinotecan/docetaxel in previously treated non-small cell lung cancer patients and correlation with uridine diphosphate glucuronosyltransferase 1A1 (UGT1A1) polymorphism. Invest New Drugs. 2003;21:435-443. [PubMed] |
| 13. | Schulz C, Heinemann V, Schalhorn A, Moosmann N, Zwingers T, Boeck S, Giessen C, Stemmler HJ. UGT1A1 gene polymorphism: impact on toxicity and efficacy of irinotecan-based regimens in metastatic colorectal cancer. World J Gastroenterol. 2009;15:5058-5066. [PubMed] [DOI] |
| 15. | Zhang A, Xing Q, Qin S, Du J, Wang L, Yu L, Li X, Xu L, Xu M, Feng G. Intra-ethnic differences in genetic variants of the UGT-glucuronosyltransferase 1A1 gene in Chinese populations. Pharmacogenomics J. 2007;7:333-338. [PubMed] [DOI] |
| 16. | Kitsiou-Tzeli S, Kanavakis E, Tzetis M, Kavazarakis E, Galla A, Tsezou A. Gilbert's syndrome as a predisposing factor for idiopathic cholelithiasis in children. Haematologica. 2003;88:1193-1194. [PubMed] |