修回日期: 2014-04-02
接受日期: 2014-04-09
在线出版日期: 2014-07-18
目的: 探讨结肠癌细胞对阿霉素化疗的不敏感性是否与上皮细胞间质细胞样转化过程有关.
方法: 应用不同浓度阿霉素作用(24 h)于结肠癌HCT116细胞株以选定阿霉素作用浓度. 低剂量(50 nmol/L)阿霉素长时间(7 d)作用于结肠癌HCT116细胞株, 采用MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐]法检测阿霉素对癌细胞的生存抑制率, Western blot蛋白免疫印迹技术检测多药耐药基因糖蛋白(multidrug resistance gene glycoprotein, MDR p-gp)和上皮细胞间质细胞转化(epithelial mesenchymal transition, EMT)相关的标志物E-钙黏蛋白(E-cadherin)和波形蛋白(Vimentin)及转录因子Snail和Slug的蛋白表达水平. 同时应用免疫荧光染色技术检测上述转录因子的细胞相对表达和分布.
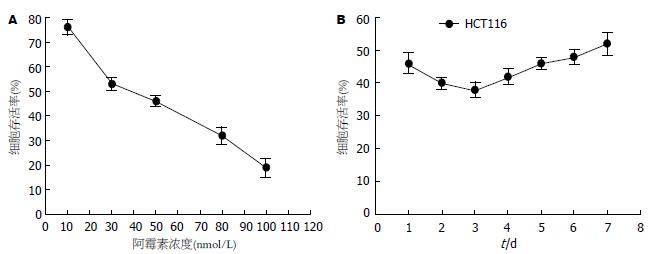
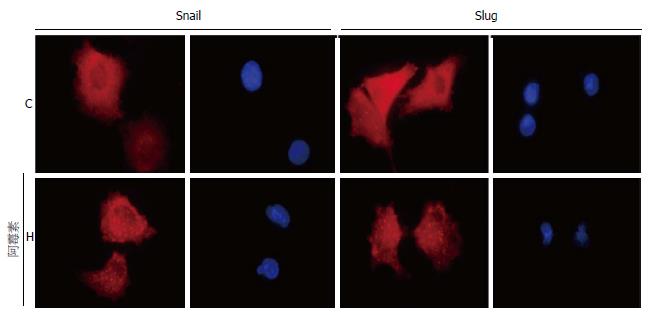
结果: MTT结果显示阿霉素对结肠癌细胞存活率的影响, 不同浓度的阿霉素处理癌细胞24 h后细胞存活率呈浓度依赖性下降. 50 nmol/L阿霉素作用于癌细胞7 d, 发现第1天到第3天细胞存活率呈逐渐下降趋势, 但从第4天开始存活率逐渐升高. Western blot提示低剂量长时间的阿霉素作用使得MDR p-gp和EMT相关的标志物和转录因子Vimentin、Snail和Slug较对照组显著高表达, 而E-cadherin白较对照组低表达. 免疫荧光结果也提示EMT相关转录因子Snail和Slug的表达阿霉素处理组高于对照组.
结论: 结肠癌对阿霉素的长时间作用效果不敏感, 可能与癌细胞发生上皮细胞间质细胞样转化过程有关.
核心提示: 低剂量阿霉素在体外实验中能诱导结肠癌细胞产生耐药性并发生上皮细胞间质细胞样转化过程(epithelial to mesenchymal transition, EMT), 逆转临床化疗过程中可能产生的EMT或许会增强化疗的效果.
引文著录: 李金鹏, 刘昊, 于皆平, 于红刚. 结肠癌阿霉素不敏感与上皮细胞间质细胞样转化的关系. 世界华人消化杂志 2014; 22(20): 2900-2904
Revised: April 2, 2014
Accepted: April 9, 2014
Published online: July 18, 2014
AIM: To evaluate whether resistance of colon cancer cells to doxorubicin is related with the epithelial-mesenchymal transition (EMT) in vitro.
METHODS: Different concentrations of doxorubicin were used in colon cancer HCT116 cells for 24 h to determine the optimal concentration of doxorubicin, and then 50 nmol/L of doxorubicin was applied to treat colon cancer HCT116 cells for 7 d. Cell viability was determined by MTT assay, and the protein expression of multidrug resistance gene encoded plasma membrane glycoprotein (MDR p-gp), EMT related markers E-cadherin, Vimentin, and related transcription factors Snail and Slug was detected by Western blot. Snail and Slug expression was verified by immunofluorescence staining.
RESULTS: Doxorubicin treatment for 24 h decreased cell viability in a concentration dependent manner. MTT assay suggested that the viability of cells treated with doxorubicin (50 nmol/L) decreased from the first to third day, but gradually increased from the fourth day. Western blot results indicated that doxorubicin significantly enhanced the expression of MDR p-gp, Vimentin, Snail and Slug and decreased the expression of E-cadherin compared with the control group. Immunofluorescence staining also revealed that Snail and Slug expression was significantly higher than that in the control cells.
CONCLUSION: Resistance of HCT116 cells to doxorubicin might be related with EMT.
- Citation: Li JP, Liu H, Yu JP, Yu HG. Relationship between resistance of colon cancer cells to doxorubicin and epithelial-mesenchymal transition. Shijie Huaren Xiaohua Zazhi 2014; 22(20): 2900-2904
- URL: https://www.wjgnet.com/1009-3079/full/v22/i20/2900.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i20.2900
结肠癌是一种常见的消化系恶性肿瘤, 在世界范围内由癌症导致的死亡排名中居第2或第3位[1]. 由于早期诊断和新的治疗方法的应用, 结肠癌的预后有了较大改善. 结肠癌的辅助化学治疗可改善患者的生存率[2], 尤其是Dukes分期Ⅲ期的患者[3]. 阿霉素是一种经典的结肠癌化疗药物, 虽然确切机制尚未明确, 但近年来其逐渐退出了结肠癌化疗的一线用药[4], 这可能与结肠癌对阿霉素的疗效不敏感和高剂量阿霉素的毒性有关. 有研究报道癌细胞获得耐药性与细胞分化过程中的表观遗传学改变有关, 上皮细胞间质细胞样转化(epithelial to mesenchymal transition, EMT)过程可能参与了这一过程[5]. 本研究拟应用低剂量阿霉素长时间作用于结肠癌HCT116细胞, 观察细胞存活率, 耐药蛋白和EMT相关蛋白的表达情况, 拟探讨结肠癌阿霉素的耐药是否与EMT过程有关.
结肠癌HCT116细胞购自中科院上海细胞库, 并由湖北省消化系疾病重点实验室传代保存; RPMI 1640培养基来源于美国Gibco公司; 多药耐药基因糖蛋白(multidrug resistance gene glycoprotein, MDR p-gp)抗体E-钙黏蛋白(E-cadherin)和波形蛋白(Vimentin)抗体和Snail、Slug抗体钩自Santa Cruz公司; 四甲基偶氮唑盐(MTT), 二甲基亚砜(DMSO)购自美国Sigma公司; 阿霉素(Doxorubicin)购自美国Alex公司; 提取总蛋白试剂盒及Western blot所需其他试剂购自碧云天生物技术研究所.
1.2.1 细胞培养: 传代培养结肠癌HCT116细胞于含100 mL/L小牛血清的RPMI 1640培养液中, 50 mL/L CO2浓度, 37 ℃培养环境下培养.
1.2.2 MTT检测细胞增殖: 用含100 mL/L胎牛血清的培养液将贴壁细胞配成单个细胞悬液, 浓度为10000-20000/mL, 每孔体积200 μL细胞接种到96孔板. 细胞贴壁后即加药. 对照(不加阿霉素处理)5个孔, 阿霉素组5个孔. 根据所加的阿霉素用量不同MTT分两组实验: 第1组, 分别用10、30、50、80和100 nmol/L作为阿霉素终浓度处理细胞24 h; 第2组, 50 nmol/L(此浓度根据第一组的结果而决定)阿霉素终浓度作用细胞7 d, 在此种情况下, 隔天更换培养液, 并再次加入等量的阿霉素继续处理, 检测每天癌细胞的存活率. 阿霉素均混匀于无血清培养基后再加入到相应孔中. 两组分别作用既定的时间后,每孔加MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐]溶液(5 g/L用PBS配制, pH 7.4)10 μL继续孵育4 h后终止培养, 小心吸弃孔内培养上清液,每孔加100 μL DMSO, 置摇床上低速振荡10 min, 使结晶物充分融解. 然后选择490 nm波长在酶联免疫监测仪上测定各孔吸光度值, 记录结果并计算细胞存活率率. 细胞存活率率 = (各浓度组吸光度值均值/空白组吸光度值均值)×100%, 并绘制直方图. 实验重复3次.
1.2.3 6孔板加药处理: 对照组设3个孔(不加任何药物), 实验组阿霉素(使终浓度为50 nmol/L)处理3个孔, 以细胞长至80%-90%孔域并处于对数生长期开始加药, 作用7 d后提取各组总蛋白(期间于隔天更换培养液, 并再次加入相同用量的阿霉素继续培养). 行Western blot检测各组蛋白(以β-actin蛋白为内对照). 具体步骤包括: 提取并测定总蛋白浓度, 计算20 μg体积下的上样量, 蛋白电泳, 纤维膜电转和X光胶片显影等. 实验重复3次.
1.2.4 免疫荧光染色: 加药和处理细胞过程同上述"6孔板加药处理", 然后行免疫荧光染色. 具体步骤包括: 4%多聚甲醛固定15 min, 0.5%非离子表面活性剂Triton穿孔15 min, 1%BSA封闭30 min, 分别加一抗Snail(1:200), Slug(1:200)4 ℃过夜, 然后加1:200稀释的二抗(FITC标记的羊抗兔IgG和TRITC标记的山羊抗小鼠IgG)室温避光反应1 h. 4,6-二脒基-2-苯基吲哚(DAPI, 10 μg/mL)作用30 s用于检测细胞核. 上述每步操作后都用PBS漂洗. 最后于荧光显微镜下观察, 拍照取图.
MTT实验检测阿霉素作用后的细胞存活率. 在第1组(图1A), 浓度梯度组分别用10、30、50、80和100 nmol/L处理HCT116细胞, 结果可以看到, 细胞的存活率呈浓度依赖性下降(从76.2%下降到19.1%), 证明了阿霉素对结肠癌细胞的杀伤作用. 随后选取中间浓度50 nmol/L作用于细胞7 d, 检测每天癌细胞的存活率. 从折线图(图1B)中可以发现, 第1天到第3天细胞存活率逐渐下降(从45.9%下降到38.3%), 然而, 从第4天开始到第7天细胞存活率呈缓慢上升趋势(从42.5%上升到51.8%) .
阿霉素处理细胞7 d后检测多药耐药基因糖蛋白MDR p-gp的表达, 从Western blot结果(图2)可以看到, 随着处理时间的延长, MDR p-gp表达量增加, 呈时间依赖性增强.
阿霉素处理细胞7 d后检测EMT相关标志物E-cadherin、Vimentin和EMT相关转录因子Snail、Slug的表达. 从Western blot结果(图3)可以看到, E-cadherin的蛋白表达量较对照组减低, 而Vimentin、Snail和Slug的蛋白表达量均较对照组增高.
阿霉素处理细胞7 d后行免疫荧光染色检测以明确EMT相关转录因子Snail和Slug的相对表达量和细胞内分布. 从图中(图4)可以看到, Snail和Slug的相对表达量均较对照组增强, 与Western blot结果一致.
阿霉素曾经是一种临床上常用于转移性恶性肿瘤的经典化疗药物, 但由于其会引起急慢性毒性和免疫抑制, 特别是化疗药物抵抗, 阻碍了他的临床应用[6,7]. 如何能够克服耐药性同时又减低使用剂量以减少不良反应成为一项重要的课题, 因为这可能有利于新的治疗方法的设计或新抗肿瘤药物的开发. 患者对化疗药物的耐药可以分为两大类: 先天性耐药和获得性耐药. 获得性耐药是在长期使用化疗药物的过程中逐渐产生的耐药性[8].
本实验应用低剂量的阿霉素(50 nmol/L)长时间地(7 d)作用于人结肠癌HCT116细胞, 观察细胞的存活率及多药耐药基因糖蛋白MDR p-gp的表达. 前期的浓度梯度实验作用24 h后, 我们发现癌细胞的存活率随浓度的增加而降低, 呈浓度依赖性. 随后选取50 nmol/L这一终浓度作用HCT116细胞, 期间隔天更换培养基并加入新的等量阿霉素以保证长时间不间断地作用. 结果发现, 第1天到第3天细胞存活率逐渐下降, 然而从第4天开始细胞存活率逐渐升高. MDR p-gp则是随着时间的推移表达量逐渐升高, 于第7天达到最高表达, 这一现象引导我们进一步深入研究其中可能的潜在机制.
上皮细胞间质细胞样转化[9](epithelial to mesenchymal transition, EMT)是指一种可逆的细胞形态学转换过程, 指上皮细胞向间质细胞样方向转化的过程, 其逆过程是间质细胞上皮细胞样转化(mesenchymal to epithelial transition, MET). EMT和MET描述的是细胞的形态学状态的改变和重塑, 起初是用来定义心脏细胞的发生过程的, 逐渐也应用于中胚层和神经鞘的分化形成过程中[10]. 在EMT过程中, 上皮细胞失去其上皮特性, 细胞间链接和细胞极性逐渐丧失, 细胞骨架重构, 在蛋白层面表现为上皮细胞标志E-Cadherin的表达降低, 而间质细胞标志蛋Vimentin的表达升高. EMT相关的转录因子Snail和Slug也参与其中. 近期研究发现[12], 某些癌细胞在分化过层中表现出上皮样细胞向间质样细胞的方向转化, 并与癌细胞的转移和耐药性有关. EMT概念在恶性肿瘤的转移侵袭和化疗药物不敏感方面有着大量的相关研究[13-15]. 因此我们推测, 结肠癌对阿霉素的化疗不敏感是否与EMT过程有关. 在低剂量长时间阿霉素处理后, 我们检测了E-cadherin、Vimentin、Snail和Slug蛋白表达情况, 结果发现具有上皮细胞特性的E-cadherin表达较对照组降低, 而Vimentin、Snail和Slug的表达量则明显高于对照组. 据此我们推测人结肠癌HCT116细胞对阿霉素的不敏感可能与癌细胞发生了上皮细胞间质细胞样转化过程有关. 文献报道EMT可诱导癌细胞向干细胞样细胞特性(stem cell-like features, CSCs)方向分化, 增强了细胞的增殖能力[16]. 这或许可以解释, 当阿霉素处理癌细胞后生存抑制率起初下降, 随着时间的延长而逐渐升高的现象. Bandyopadhyay等[17]报道, 阿霉素可异常激活人乳腺癌细胞转化生长因子β信号通路并诱导EMT转化过程, 进而产生对阿霉素的化疗耐药, 这与我们的实验结果相符.
总之, 我们推测, 低剂量的阿霉素长时间处理人结肠癌HCT116细胞株, 可诱导其产生阿霉素化疗耐药性, 其大体机制可能与阿霉素诱导了癌细胞发生上皮细胞间质细胞样转化, 这为明确阿霉素的化疗耐药的具体机制提出了一条新的思路. 但其中的确切分子生物化学机制, 尤其是启动子水平的研究尚待进一步探索和发现.
阿霉素是一种经典的结肠癌化疗药物, 虽然确切机制尚未明确, 但近年来其逐渐退出了结肠癌化疗的一线用药, 这可能与结肠癌对阿霉素的疗效不敏感和高剂量阿霉素应用后的毒性有关. 克服或逆转阿霉素的耐药性成为临床肿瘤化疗面临的重要问题.
赵春玲, 副教授, 潍坊医学院细胞生物学教研室
有研究报道癌细胞获得耐药性与细胞分化过程中的表观遗传学改变有关, 上皮细胞间质细胞样转化过程(epithelial to mesenchymal transition, EMT)可能参与了这一过程. EMT过程在近年来很多研究中发现其参与了癌细胞的侵袭, 转移和耐药性的产生.
近期研究发现, 某些癌细胞在分化过层中表现出上皮样细胞向间质样细胞的方向转化, 并与癌细胞的转移和耐药性有关. EMT概念在恶性肿瘤的转移侵袭和化疗药物不敏感方面有着大量的相关研究.
本研究在结肠癌HCT116细胞中, 应用低剂量阿霉素长时间作用成功诱导了耐药性的产生, 并发现这可能与癌细胞发生上皮细胞间质细胞样转化过程有关.
本文具有一定的新颖性, 为设计新的肿瘤治疗方法的或开发新型抗肿瘤药物提供了新的思路.
编辑: 田滢 电编:鲁亚静
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 2. | De Roock W, Piessevaux H, De Schutter J, Janssens M, De Hertogh G, Personeni N, Biesmans B, Van Laethem JL, Peeters M, Humblet Y. KRAS wild-type state predicts survival and is associated to early radiological response in metastatic colorectal cancer treated with cetuximab. Ann Oncol. 2008;19:508-515. [PubMed] [DOI] |
| 3. | André T, Boni C, Navarro M, Tabernero J, Hickish T, Topham C, Bonetti A, Clingan P, Bridgewater J, Rivera F. Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the MOSAIC trial. J Clin Oncol. 2009;27:3109-3116. [PubMed] [DOI] |
| 4. | Li L, Ahmed B, Mehta K, Kurzrock R. Liposomal curcumin with and without oxaliplatin: effects on cell growth, apoptosis, and angiogenesis in colorectal cancer. Mol Cancer Ther. 2007;6:1276-1282. [PubMed] [DOI] |
| 5. | Singh A, Settleman J. EMT, cancer stem cells and drug resistance: an emerging axis of evil in the war on cancer. Oncogene. 2010;29:4741-4751. [PubMed] [DOI] |
| 6. | Granados-Principal S, Quiles JL, Ramirez-Tortosa CL, Sanchez-Rovira P, Ramirez-Tortosa MC. New advances in molecular mechanisms and the prevention of adriamycin toxicity by antioxidant nutrients. Food Chem Toxicol. 2010;48:1425-1438. [PubMed] [DOI] |
| 7. | Barth BM, Gustafson SJ, Young MM, Fox TE, Shanmugavelandy SS, Kaiser JM, Cabot MC, Kester M, Kuhn TB. Inhibition of NADPH oxidase by glucosylceramide confers chemoresistance. Cancer Biol Ther. 2010;10:1126-1136. [PubMed] [DOI] |
| 9. | Zavadil J, Haley J, Kalluri R, Muthuswamy SK, Thompson E. Epithelial-mesenchymal transition. Cancer Res. 2008;68:9574-9577. [DOI] |
| 10. | Antman KH, Eilber FR, Shiu MH. Soft tissue sarcomas: current trends in diagnosis and management. Curr Probl Cancer. 1989;13:337-367. [PubMed] [DOI] |
| 11. | Micalizzi DS, Farabaugh SM, Ford HL. Epithelial-mesenchymal transition in cancer: parallels between normal development and tumor progression. J Mammary Gland Biol Neoplasia. 2010;15:117-134. [PubMed] [DOI] |
| 12. | Katsuno Y, Lamouille S, Derynck R. TGF-β signaling and epithelial-mesenchymal transition in cancer progression. Curr Opin Oncol. 2013;25:76-84. [PubMed] [DOI] |
| 13. | Radisky DC. miR-200c at the nexus of epithelial-mesenchymal transition, resistance to apoptosis, and the breast cancer stem cell phenotype. Breast Cancer Res. 2011;13:110. [PubMed] [DOI] |
| 14. | Chua KN, Poon KL, Lim J, Sim WJ, Huang RY, Thiery JP. Target cell movement in tumor and cardiovascular diseases based on the epithelial-mesenchymal transition concept. Adv Drug Deliv Rev. 2011;63:558-567. [PubMed] [DOI] |
| 15. | Dave B, Mittal V, Tan NM, Chang JC. Epithelial-mesenchymal transition, cancer stem cells and treatment resistance. Breast Cancer Res. 2012;14:202. [PubMed] [DOI] |
| 16. | Borovski T, De Sousa E Melo F, Vermeulen L, Medema JP. Cancer stem cell niche: the place to be. Cancer Res. 2011;71:634-639. [PubMed] [DOI] |