修回日期: 2014-05-04
接受日期: 2014-05-12
在线出版日期: 2014-07-18
目的: 观察实验性胆汁反流性胃炎(bile reflux gastritis, BRG)大鼠胃黏膜的病理变化、黏膜环氧化酶2(cyclooxygenase 2, COX-2)表达的改变及亮菌口服液对其干预作用.
方法: 将40只大鼠随机分为4组: BRG组、亮菌口服液干预组、亮菌口服液组及空白对照组. 采用自制反流液灌胃建立实验性BRG大鼠模型, 光电镜观察各组大鼠胃黏膜的改变及免疫组织化学法检测胃黏膜COX-2表达改变.
结果: BRG模型组大鼠病理切片胃黏膜下可见重度炎症占60%(24/40), 而发生轻度肠上皮化生及异型增生大鼠均占20%(8/40), 同时胃黏膜中COX-2表达强阳性率为70%(7/10), 与模型组比较, 亮菌口服液干预组可显著改善大鼠胃黏膜病理变化及COX-2表达(P<0.05). 大鼠出现重度炎症仅占20%(8/40), 发生轻度肠化生及异型增生均下降为5%(2/40), 且COX-2表达强阳性率为10%(1/10). 亮菌口服液组及正常对照组胃黏膜未见炎症及其他病理改变, COX-2为胃黏膜仅微量表达, 两组无明显差异.
结论: 胆汁反流液可导致大鼠胃黏膜发生炎症、肠上皮化生及异型增生, 而亮菌口服液可通过降低胃黏膜COX-2含量, 减轻灌流液对胃黏膜的损害, 发挥胃黏膜的保护作用.
核心提示: 胆汁反流性胃炎(bile reflux gastritis, BRG)可增加胃黏膜炎症、肠上皮化生及异型增生的发生, 而亮菌口服液可通过降低胃黏膜环氧化酶2(cyclooxygenase 2)表达, 减轻灌流液对胃黏膜的损害, 从而最终达到干预BRG的作用.
引文著录: 王冬青, 丁西平, 殷实. 实验性胆汁反流性胃炎大鼠胃黏膜改变及亮菌口服液的干预作用. 世界华人消化杂志 2014; 22(20): 2875-2880
Revised: May 4, 2014
Accepted: May 12, 2014
Published online: July 18, 2014
AIM: To observe the pathologic changes and the expression of cyclooxygenase-2 (COX-2) in gastric mucosa of rats with experimental bile reflux gastritis (BRG) and to assess the interventional effects of Liangjun Oral Liquid.
METHODS: Forty rats were divided into four groups: Ⅰ (BRG model), Ⅱ (BRG model treated with Liangjun Oral Liquid 1 mL/kg), Ⅲ (normal rats treated with Liangjun Oral Liquid 1 mL/kg) and Ⅳ (normal controls). BRG was induced using self-made reflux liquid. The changes in the gastric mucosa of rats in each group were observed by optical microscopy and transmission electron microscopy (TEM). The expression of COX-2 protein was evaluated by immunohistochemistry (IHC).
RESULTS: In group Ⅰ, 60% of rats had severe inflammation in the gastric mucosa, 20% had mild atypical hyperplasia, 20% had intestinal metaplasia; 70% had strong COX-2 protein expression. Compared with group Ⅰ, the pathological changes were improved and the expression of COX-2 was decreased (P < 0.05) in group Ⅱ: 20% of rats had severe inflammation in the gastric mucosa, 5% had mild atypical hyperplasia, 5% had intestinal metaplasia; 10% had strong COX-2 protein expression. No pathologic changes were found in the gastric mucosa of rats in groups Ⅲ and Ⅳ, and the expression of COX-2 protein was almost undetectable and there were no significant differences between the two groups.
CONCLUSION: Liangjun Oral Liquid can relieve the gastric mucosal injury in rats with experimental bile reflux gastritis by decreasing the expression of COX-2.
- Citation: Wang DQ, Ding XP, Yin S. Changes in gastric mucosa of rats with experimental bile reflux gastritis: Interventional effects of Liangjun Oral Liquid. Shijie Huaren Xiaohua Zazhi 2014; 22(20): 2875-2880
- URL: https://www.wjgnet.com/1009-3079/full/v22/i20/2875.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i20.2875
胆汁反流性胃炎(bile reflux gastritis, BRG)是由于胆汁、胰腺及十二指肠分泌物过度反流至胃内, 而增加的胃内反流物可能会增加胃黏膜的损伤. BRG多见于外科手术如胃大部切除、幽门成形术及胆囊切除术[1]及幽门括约肌功能不全所致的原发性胆汁反流. 近年来, 关于BRG与胃癌前病变(肠上皮化生及异型增生)的研究不断增多. Dixon等[2]研究表明, 十二指肠-胃胆汁反流(duodenogastric reflux, DGR)会导致胃贲门的肠上皮化生. Xu等[3]研究表明, 胆汁酸可通过法尼醇受体(farnesoid X receptor)诱导胃上皮细胞尾型同源盒转录因子(caudal-type homeobox 2, CDX2)表达, 从而导致胃黏膜的肠上皮化生及最终的肠型胃癌形成. 在日本的2283例患者的一项多中心研究[4]发现, 胆汁酸反流至胃内不会增加幽门螺杆菌(Helicobacter polyri, H. polyri)感染的慢性萎缩性胃炎发生的危险, 然而高浓度的胆汁酸反流是与患者肠上皮化生发生的风险增加有关. Zhang等[5]研究发现, 在中国46例原发性BRG儿童中, 有3例发生肠上皮化生. 此外, 在法国人中, 异型增生虽然少见但仅在DGR相关的胃炎中出现[6]. 另一项研究[7]表明, 在89例反流性胃炎中, 有10例(11.23%)发生异型增生, 有31例(34.83%)发生肠上皮化生. 一项关于Wistar大鼠实验[8]表明, 毕Ⅱ氏手术相关的十二指肠内容物反流可导致胃癌前病变, 甚至胃癌. 这些临床研究均表明BRG可增加胃癌前病变的风险, 对其预防尤为重要. 然而目前关于BRG大鼠模型研究尚不成熟, 本研究旨在建立实验性BRG大鼠模型, 并探讨BRG组大鼠胃黏膜的改变及亮菌口服液对BRG的干预作用及机制, 为BRG的临床治疗提供理论依据.
清洁级SD ♂健康大鼠40只, 体质量200-220 g, 均购自安徽医科大学动物实验中心. 亮菌口服溶液是市售试剂, 与临床患者使用的亮菌口服液成分一致. 根据《中药药理研究方法学》[大鼠剂量 = 人剂量×35(人转换因子)/6(大鼠转换因子)]计算出人鼠等效剂量为4.375 mL/(kg·d). 胆汁反流液来自市售试剂, 反流液配制: 将牛磺胆酸钠2.5 g、胰酶1.5 g、卵磷脂0.25 g溶于蒸馏水100 mL中配制而成. 兔抗大鼠COX-2多克隆抗体购自美国OriGene公司; 免疫组织化学SP试剂盒购自北京中杉金桥公司.
1.2.1 大鼠分组与给药: 大鼠随机分为4组, 每组10只, BRG组、亮菌口服液干预组、亮菌口服液组(4.375 mL/kg)及正常对照组. 亮菌口服液干预组自造模开始后第2周开始至造模结束每天给药1次.
1.2.2 模型的建立与取材: 参考杨牧祥等[9]的方法, BRG组及亮菌口服液干预组以1.5 mL/100 g反流液空腹灌胃, 1次/d, 连续35 d. 最后1次灌胃后, 禁食16 h, 水合氯醛注射处死大鼠, 无菌操作剖腹取胃, 沿胃大弯侧剪开, 用冰生理盐水漂洗胃内容物, 滤纸吸干, 展平, 初步观察胃部病理改变. 剪取部分胃窦部组织, 留作光电镜观察及免疫组织化学检测.
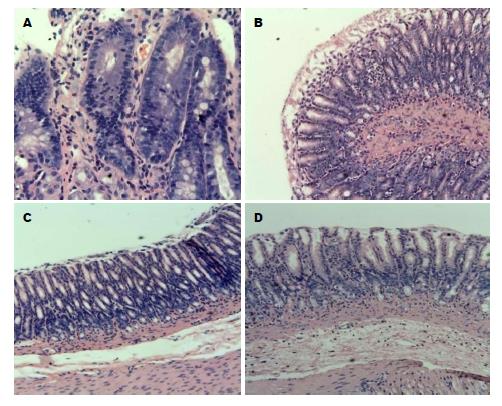
1.2.3 常规HE染色: 石蜡切片经二甲苯脱蜡, 梯度乙醇脱苯, 水洗, 苏木精染细胞核, 水洗, 1%盐酸乙醇分化, 水洗, 热水蓝化, 伊红染细胞质, 梯度乙醇脱水, 二甲苯透明, 中性树胶封片. HE染色肠上皮化生、异型增生及炎症程度的判定方法: 大鼠胃窦部组织固定后, 制成蜡块, 切片多张, HE染色. 每个蜡块随机抽取病理片4张, 每组40张, 根据参考顾庆华等[10]的方法半定量检测炎细胞浸润、腺体增生、肠上皮化生的情况. 其中: (1)炎症细胞浸润程度分级: 轻度: 炎症细胞较少并局限于黏膜浅层, 不超过黏膜层的1/3; 中度: 炎症细胞浸入黏膜全层的2/3, 数量较多; 重度: 炎症细胞密集, 浸入黏膜全层或肌层; (2)肠上皮化生: 肠化部分占腺体和表面上皮的总面积的1/3以下为轻度, 1/3-2/3为中度, 2/3以上为重度; (3)不典型增生: 根据腺管组织结构的异型性、上皮细胞的异型性及分化不成熟性, 分为轻、中、重3级.
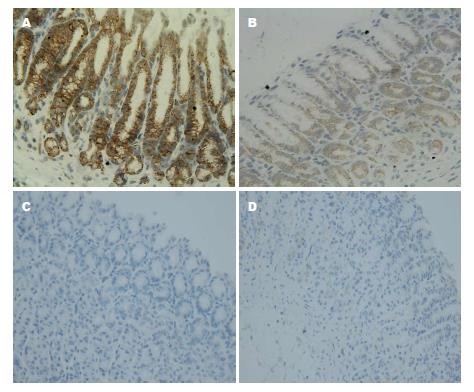
1.2.4 免疫组织化学法测定胃黏膜COX-2表达: 石蜡切片37 ℃过夜, 二甲苯脱蜡、梯度乙醇脱苯, 流水冲洗, 加入预热的0.01 mol/L柠檬酸钠缓冲液微波热修复20 min. 室温下放置20 min, 自然冷却. 流水冲洗, 并滴加3%H2O2在室温下放置5 min. 再次流水冲洗. PBS冲洗3次, 每次3 min. 除去PBS, 切片上滴加第一抗体, 室温下2 h, PBS冲洗3次, 每次3 min. 除去PBS, 切片上滴加聚合物增强剂(试剂A), 室温下孵育20 min, PBS冲洗3次, 每次3 min. 除去PBS, 切片上滴加酶标抗鼠/兔聚合物(试剂B), 室温下孵育30 min, PBS冲洗3次, 每次3 min. DAB显色, 苏木精复染, 梯度乙醇脱水, 二甲苯透明, 中性树胶封片. 免疫组织化学阳性结果及判定标准: 参照文献[11]采用半定量积分法根据阳性细胞率和阳性细胞着色强度分别记分. 阳性细胞率以计数10个高倍镜视野为准,<5%为0分, 5%-30%为1分, 31%-70%为2分,≥71%为3分. 着色强度0分为阴性, 1分为弱阳性, 2分为阳性, 3分为强阳性. 两者相乘, 0-1分为阴性, 1-2分为"+", 3-4分为"++", 5分以上为"+++".
统计学处理 数据运用SPSS17.0软件包进行处理, 等级定性资料采用秩和检验, P<0.05为差异有统计学意义.
BRG模型组大鼠毛色较暗, 食欲较差, 体质量较轻, 精神较萎靡. 亮菌干预组大鼠毛色较模型组有所改善, 食欲稍好, 体质量较重, 精神状态较好. 亮菌及空白对照组大鼠毛色鲜艳, 食欲正常, 生长迅速, 精神状态正常, 且亮菌口服液组大鼠体质量稍高于空白对照组.
光镜下观察BRG组大鼠胃黏膜下可见众多炎细胞的浸润, 部分大鼠发生肠上皮化生和异型增生; 亮菌口服液干预组小部分大鼠可见肠上皮化生或异型增生, 炎细胞的浸润较少; 亮菌口服液组及正常对照组胃黏膜均未见炎性细胞的浸润、肠上皮化生及异型增生(表1, 表2和表3, 图1).
BRG组大鼠胃黏膜COX-2表达大多为强阳性, 而亮菌口服液干预组COX-2表达较BRG组稍弱, 亮菌口服液组及正常对照组胃黏膜COX-2基本不表达(表4, 图2).
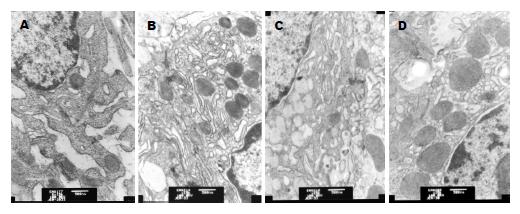
BRG组大鼠胃黏膜上皮细胞表面微绒毛短小、稀疏, 甚至消失, 细胞间紧密连接疏松. 亮菌口服液干预组大鼠胃黏膜上皮细胞间紧密连接较疏松, 微绒毛稀疏. 正常对照组胃黏膜上皮细胞胞质内有丰富的线粒体, 胞内小管清晰可见, 微绒毛较多较长, 紧密连接形态、结构正常. 亮菌口服液组超微结构变化与正常对照组基本一致(图3).
COX-2在花生四烯酸转化为前列腺素过程中发挥重要作用, 是非甾体抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)治疗的主要分子靶[12]. 他在大多数正常组织中并无表达, 但可被大量的物质诱导, 如炎性介质、细胞因子、生长因子、癌基因产物或致癌剂等因素刺激时, COX-2可在细胞内迅速产生. 近年来, 关于胆汁酸对COX-2表达的影响的研究不断增多. 此外有研究表明COX-2在多种肿瘤中表达增多, 在胃癌中更明显[13]. Park等[14]研究发现在人类胃癌细胞中胆汁酸可活化孤儿核受体(small heterodimer partner, SHP)表达, 而SHP可诱导肠特异性转录因子CDX1表达. CDX1可诱导COX-2表达, 并最终导致肠上皮化生的产生. 这表明胆汁酸可增加胃黏膜COX-2表达. 而日本学者利用Fisher344大鼠制造慢性DGR模型, 其中一组大鼠给予正常饮食, 作为对照组, 另一组给予含COX-2选择性抑制剂美洛昔康(0.3 mg/kg)的食物, 在DGR术后20、30、40、50及60 wk分批宰杀老鼠, 发现与未做手术的正常大鼠相比, 所有组COX-2 mRNA水平均显著增高, 且在20 wk达到峰值水平. 与模型组相比, 胆汁反流导致的胃炎在美洛昔康组大鼠明显减轻. 且COX-2下游产物前列腺素E2(prostaglandin E2, PGE2)表达在美洛昔康组也受到明显抑制. 模型组大鼠在60 wk发生胃腺癌率为33%(7/23), 而美洛昔康组20只大鼠无1例发生胃腺癌[15]. 这表明COX-2可能通过PGE2途径导致BRG, 而COX-2抑制剂美洛昔康在BRG进展为胃腺癌中发挥重要作用. 此外, 杨牧祥等[16]采用自制反流液灌胃建立实验性BRG大鼠模型, 发现模型组大鼠胃黏膜下可见大量炎细胞浸润, 大部分大鼠可见不典型增生及肠上皮化生. 采用RT-PCR技术发现实验性BRG大鼠胃黏膜COX-2 mRNA表达显著增高. 而胃炎饮组大鼠较模型组大鼠胃黏膜病理改变显著改善, 同时COX-2 mRNA表达显著降低. 总之, 这些均表明COX-2在BRG的形成及肠上皮化生中有重要的作用.
本研究用免疫组织化学法证实COX-2在实验性BRG组大鼠胃黏膜中表达显著增高, 但肠上皮化生及异型增生在本次实验中发生率比较低. 与前述文献报道[16], 在实验性BRG组有大部分大鼠发生肠上皮化生及异型增生, 两次实验的不一致, 可能与本次实验使用的是SD大鼠, 而文献中使用的是Wistar大鼠有关. 亮菌口服液是从一种真菌-亮菌中发酵提取而成, 内含亮菌甲素、乙素、丙素和人体所需的多种氨基酸、多糖、蛋白质等, 对胃黏膜有重要的保护作用, 且研究发现[17], 他还可通过降低体内5-HT含量而防治顺铂化疗所诱发的恶心呕吐等胃肠道反应. 虽然, 该实验采用的自制反流液灌胃制造实验性BRG大鼠模型尚未广泛应用, 但本研究表明亮菌口服液可通过降低COX-2表达, 从而减轻胆汁反流所致的胃炎程度及肠上皮化生及异型增生的发生率, 且亮菌口服液几乎无不良反应, 这为临床治疗BRG提供理论依据, 具有重要的意义.
胆汁反流性胃炎(bile reflux-gastritis, BRG)是临床常见病及多发病, 可增加肠上皮化生及异型增生的危险, 并最终增加胃癌的发病率, 目前尚无有效的治疗方法. 故研究BRG动物模型及预防BRG已经成为人们关注的重点.
马欣, 主任医师, 甘肃省人民医院消化科
BRG多见于外科手术如胃大部切除、幽门成形术及胆囊切除术的术后并发症及幽门括约肌功能不全所致的原发性胆汁反流. 目前临床尚无有效的治疗方法, 各种药物治疗成为目前研究的热点.
大量研究报道BRG可导致肠上皮化生及异型增生,杨牧祥等研究发现, BRG大鼠胃黏膜下可见大量炎细胞浸润, 大部分大鼠可见不典型增生及肠上皮化生. 且胃黏膜环氧化酶2(cyclooxygenase 2, COX-2) mRNA表达显著增高. 而胃炎饮组大鼠较模型组大鼠胃黏膜病理改变显著改善, 同时COX-2 mRNA表达显著降低.
本实验不仅证实亮菌口服液可改善BRG导致的胃黏膜改变, 并表明亮菌口服液可能是通过降低胃黏膜COX-2水平, 从而达到预防BRG, 并最终降低胃癌前病变的发生率.
BRG为临床常见病及多发病, 而亮菌口服液可通过降低胃黏膜COX-2水平从而减轻BRG所致的胃黏膜损害, 且几乎无不良反应, 这为临床治疗BRG提供了一条新的途径, 具有重要的意义.
本研究发现胆汁反流液可导致大鼠胃黏膜发生炎症, 肠上皮化生及异型增生, 而亮菌口服液可通过降低胃黏膜COX-2含量, 减轻灌流液对胃黏膜的损害, 发挥胃黏膜的保护作用. 选题新颖, 方法科学, 结论明确, 研究符合伦理学要求.
编辑 郭鹏 电编 都珍珍
| 1. | Mason RJ, DeMeester TR. Importance of duodenogastric reflux in the surgical outpatient practice. Hepatogastroenterology. 1999;46:48-53. [PubMed] |
| 2. | Dixon MF, Mapstone NP, Neville PM, Moayyedi P, Axon AT. Bile reflux gastritis and intestinal metaplasia at the cardia. Gut. 2002;51:351-355. [PubMed] [DOI] |
| 3. | Xu Y, Watanabe T, Tanigawa T, Machida H, Okazaki H, Yamagami H, Watanabe K, Tominaga K, Fujiwara Y, Oshitani N. Bile acids induce cdx2 expression through the farnesoid x receptor in gastric epithelial cells. J Clin Biochem Nutr. 2010;46:81-86. [PubMed] [DOI] |
| 4. | Matsuhisa T, Arakawa T, Watanabe T, Tokutomi T, Sakurai K, Okamura S, Chono S, Kamada T, Sugiyama A, Fujimura Y. Relation between bile acid reflux into the stomach and the risk of atrophic gastritis and intestinal metaplasia: a multicenter study of 2283 cases. Dig Endosc. 2013;25:519-525. [PubMed] [DOI] |
| 5. | Zhang Y, Yang X, Gu W, Shu X, Zhang T, Jiang M. Histological features of the gastric mucosa in children with primary bile reflux gastritis. World J Surg Oncol. 2012;10:27. [PubMed] [DOI] |
| 6. | Diarra M, Konate A, Traore CB, Drabo M, Soukho Ae, Kalle A, Dembele M, Traore HA, Maiga MY. [Gastritis associated with duodeno-gastric reflux]. Mali Med. 2007;22:47-51. [PubMed] |
| 7. | Vere CC, Cazacu S, Comănescu V, Mogoantă L, Rogoveanu I, Ciurea T. Endoscopical and histological features in bile reflux gastritis. Rom J Morphol Embryol. 2005;46:269-274. [PubMed] |
| 8. | Zlatić A, Stojanović M, Mihailović D, Dinić BR, Protić M, Veljković R. The role of duodenogastric reflux in formation of precarcinogenic gastric lesions--an experimental study. Med Pregl. 2013;66:285-291. [PubMed] [DOI] |
| 9. | 杨 牧祥, 苏 凤哲, 于 文涛, 徐 华洲, 李 俊仙. 胃炎饮对实验性胆汁反流性胃炎大鼠胃黏膜TNF-α、IL-8含量的影响. 中国中医基础医学杂志. 2009;15:738-740. |
| 11. | Yu LZ, Gao HJ, Bai JF, Sun G, Zhao HL, Sun L, Miu K, Zhao ZQ. Expression of COX-2 proteins in gastric mucosal lesions. World J Gastroenterol. 2004;10:292-294. [PubMed] |
| 12. | Dai Y, Wang WH. Non-steroidal anti-inflammatory drugs in prevention of gastric cancer. World J Gastroenterol. 2006;12:2884-2889. [PubMed] |
| 13. | Mao XY, Wang XG, Lv XJ, Xu L, Han CB. COX-2 expression in gastric cancer and its relationship with angiogenesis using tissue microarray. World J Gastroenterol. 2007;13:3466-3471. [PubMed] |
| 14. | Park MJ, Kim KH, Kim HY, Kim K, Cheong J. Bile acid induces expression of COX-2 through the homeodomain transcription factor CDX1 and orphan nuclear receptor SHP in human gastric cancer cells. Carcinogenesis. 2008;29:2385-2393. [PubMed] [DOI] |
| 15. | Oba M, Miwa K, Fujimura T, Harada S, Sasaki S, Hattori T. Chemoprevention of glandular stomach carcinogenesis through duodenogastric reflux in rats by a COX-2 inhibitor. Int J Cancer. 2008;123:1491-1498. [PubMed] [DOI] |