修回日期: 2013-11-18
接受日期: 2013-11-29
在线出版日期: 2014-01-18
目的: 研究肉苁蓉提取物麦角甾苷对人大肠癌裸鼠移植瘤模型肿瘤生长的作用, 及对人大肠癌细胞HIPK2-P53通路的影响, 探讨麦角甾苷抑制人大肠癌的作用机制.
方法: 通过腋下接种人结肠癌HCT-116细胞, 建立人大肠癌裸鼠移植瘤模型, 随机分为: 模型组(生理盐水)、麦角甾苷低[20 mg/(kg·d)]、中[40 mg/(kg·d)]、高[80 mg/(kg·d)]剂量组和5-氟尿嘧啶(5-fluorouracil, 5-FU)组[1 mg/(kg·d)], 经腹腔分别给药0.2 mL, 连续给药2 wk. 2 wk后处死裸鼠, 分别检测裸鼠瘤体体积、瘤质量, 采用免疫组织化学法检测瘤组织中凋亡相关蛋白同源结构域相互作用蛋白激酶2(homeodomain-interacting protein kinase 2, HIPK2)、P53、Bax和Bcl-2的表达情况.
结果: 麦角甾苷低、中、高剂量及5-FU对裸鼠瘤体大小抑制率分别为: 48.41%、61.04%、63.75%和75.14%, 瘤体质量抑制率分别为: 42.79%、53.90%、60.99%、66.19%. 免疫组织化学结果显示, 裸鼠大肠癌肿瘤组织中麦角甾苷低、中、高剂量及5-FU组HIPK2的表达量分别为: 4.83±0.62、8.46±0.99、11.90±1.21、13.50±0.94; P53的表达量分别为: 14.59±0.90、17.60±1.40、23.10±2.10、22.44±2.05; Bax表达量分别为14.41±0.38、15.84±0.54、26.28±0.55、26.34±2.33; Bcl-2的表达量分别为14.08±1.04、11.93±0.93、7.48±0.86、5.46±0.67.
结论: 麦角甾苷能够抑制人大肠癌裸鼠移植瘤生长, 上调凋亡相关蛋白HIPK2、P53、Bax的表达, 下调Bcl-2表达, 其抑制大肠癌的作用与促进肿瘤细胞凋亡密切相关.
核心提示: 肉苁蓉提取物麦角甾苷能够抑制人大肠癌裸鼠移植瘤生长, 上调凋亡相关蛋白同源结构域相互作用蛋白激酶2(homeodomain-interacting protein kinase 2)、P53、Bax的表达, 下调Bcl-2表达, 其抑制大肠癌的作用与促进肿瘤细胞凋亡密切相关.
引文著录: 周利红, 胡强, 陈星竹, 刘宣, 隋华, 付晓伶, 任建琳, 李琦. 麦角甾苷调节HIPK2-P53通路对人大肠癌裸鼠移植瘤的治疗作用. 世界华人消化杂志 2014; 22(2): 171-178
Revised: November 18, 2013
Accepted: November 29, 2013
Published online: January 18, 2014
AIM: To investigate whether verbascoside exerts therapeutic effects against colorectal cancer xenografts in nude mice and the possible role of the HIPK2-P53 pathway in this process.
METHODS: An ectopic nude mice model of colorectal cancer was established by subcutaneously inoculating human colorectal carcinoma HCT-116 cells into the armpit of nude mice. The mice were then randomly divided into 5 groups: a model control group, low- [20 mg/(kg·d)], medium- [40 mg/(kg·d)], high-dose verbascoside groups [80 mg/(kg·d)], and a 5-fluorouracil (5-FU) group [1 mg/(kg·d)]. Drugs were injected intraperitoneally for two weeks. Two weeks later, the mice were sacrificed and the tumors were peeled off to measure tumor size and weight. The expression of apoptosis-related proteins HIPK2, P53, Bax, and Bcl-2 in tumor tissues was tested by immunohistochemistry.
RESULTS: Compared with the model control group, tumor size decreased by 48.41%, 61.04%, 63.75%, and 75.14% in the low-, medium-, high-dose verbascoside groups and the 5-FU group, respectively, and tumor weight decreased by 42.79%, 53.90%, 60.99%, and 66.19%. The relative expression levels of HIPK2 in tumor tissues were 4.83 ± 0.62, 8.46 ± 0.99, 11.90 ± 1.21 and 13.50 ± 0.94, in the low-, medium-, high-dose verbascoside groups and the 5-FU group, respectively. The corresponding values were 14.59 ± 0.90, 17.60 ± 1.40, 23.10 ± 2.10 and 22.44 ± 2.05 for P53, 14.41 ± 0.38, 15.84 ± 0.54, 26.28 ± 0.55 and 26.34 ± 2.33 for Bax, and 14.08 ± 1.04, 11.93 ± 0.93, 7.48 ± 0.86 and 5.46 ± 0.67 for Bcl-2.
CONCLUSION: Verbascoside can inhibit the growth of human colorectal cancer xenografts in mice, up-regulate the expression of HIPK2, P53 and Bax, and down-regulate Bcl-2 expression. The inhibition of colorectal cancer by verbascoside was closely with the promotion of tumor cell apoptosis.
- Citation: Zhou LH, Hu Q, Chen XZ, Liu X, Sui H, Fu XL, Ren JL, Li Q. Verbascoside exerts therapeutic effects against colorectal cancer xenografts in nude mice via HIPK2-P53 pathway. Shijie Huaren Xiaohua Zazhi 2014; 22(2): 171-178
- URL: https://www.wjgnet.com/1009-3079/full/v22/i2/171.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i2.171
大肠癌(colorectal cancer)是全球范围内常见的恶性肿瘤之一, 根据Global Cancer Statistics 2011最新数据显示, 大肠癌发病率居于男性癌症患者的第3位, 女性位于第2位, 2011年死亡人数占所有癌症死亡人数的8%, 为癌症中第4大常见致死恶性肿瘤[1]. 在我国, 大肠癌的发病率呈逐年上升趋势, 其上升速度远高于国际水平[2], 平均发病率居于所有恶性肿瘤第5位, 上海等沿海发达地区的发病率高居所有恶性肿瘤的第2位[3], 远高于内地其他城市, 且呈现逐年上升的趋势.
近年研究发现, 扶正中药肉苁蓉具有明显的抗肿瘤作用, 其主要活性成分麦角甾苷(verbascoside, Verb)具有调节免疫功能及抑制端粒酶活性[4-6], 对肿瘤生长有明显的抑制作用, 但其作用机制尚不清楚. 本研究通过裸鼠动物实验, 研究肉苁蓉活性成分麦角甾苷对人大肠癌裸鼠移植瘤瘤体生长及凋亡相关蛋白同源结构域相互作用蛋白激酶2(homeodomain-interacting protein kinase 2, HIPK2)、P53、Bax和Bcl-2表达的影响, 并探讨其抗大肠癌的作用机制, 为扶正中药用于临床肿瘤治疗提供理论指导和实验依据.
♂Balb/c裸小鼠30只, 4-6周龄, 体质量18 g±2 g, 购自上海西普尔-必凯实验有限公司[生产许可证号码: SCXK(沪)2008-0016], 饲养于上海中医药大学附属普陀医院SPF级动物实验室[动物实验室许可证号码: SYXK(沪)2005-0008]. 饲养条件为自由摄食饮水、通风、相对湿度50%-65%、22 ℃-24 ℃、12 h光照条件的SPF级动物室内常规饲养. 动物饲养符合动物伦理委员会相关规定. 人结肠癌HCT-116细胞(购自中国科学院上海细胞库), 细胞培养于含10%胎牛血清的RPMI 1640培养基, 置于5%CO2、37 ℃及饱和湿度的培养箱中培养. Verb, 成都瑞芬思生物科技有限公司; 5-氟尿嘧啶(5-fluorouracil, 5-FU), 上海旭东海普药业有限公司; 即用型快捷免疫组织化学MaxVision试剂盒、柠檬酸抗原修复缓冲液、3.3-二氨基联苯胺四盐酸盐(DAB)(福州迈新生物科技); 2.5%戊巴比妥钠(上海菲达工贸有限公司); RPMI 1640培养基干粉、胎牛血清(Gibco公司); 苏木素精、冰乙酸(上海凌峰化学试剂有限公司); CO2培养箱(英国RS Biotech公司, GALAXYS); 相差倒置显微镜(日本OLMYPUS公司, CKX41/U-RFLT50); 动物造模手术器材(苏州六六视觉科技公司); 转轮式病理切片机(德国LEICA公司, UC6); 病理组织包埋机、包埋冷冻台(常州中威电子仪器厂); 病理染色机(德国LEICA公司, ST5010); 高清晰度彩色医学图文分析系统(武汉千屏影像技术有限公司)电热恒温鼓风干燥箱、隔水式恒温培养箱(上海精宏实验设备有限公司).
1.2.1 人结肠癌HCT-116细胞培养: 人结肠癌HCT-116细胞培养于10%胎牛血清的RPMI 1640培养基中, 放置于5%CO2、37 ℃及饱和湿度的培养箱培养, 待细胞处于对数生长期时, 用于后续实验.
1.2.2 人大肠癌裸鼠移植瘤模型的建立: 取对数生长期的人肠癌HCT-116细胞, 0.25%的胰蛋白酶消化, 以0.01 mol/L PBS稀释成1×107 cell/mL单细胞悬液. 取4-6周龄、18-20 g Balb/c裸鼠3只. 常规消毒裸鼠近右腋侧背部皮肤, 用1 mL注射器吸取人肠癌HCT-116单细胞悬液, 按0.2 mL/只(2×106 cell), 接种到裸鼠右前肢腋部皮下后, 用乙醇棉球压迫针孔以防细胞流出, SPF条件下常规饲养. 2 wk左右, 当裸鼠皮下肿瘤长至50-100 mm3时, 选取生长状态佳瘤体无溃破的裸鼠作为供瘤鼠, 脱颈处死, 无菌条件下剥离瘤体. 以生理盐水洗净血污, 去除坏死组织和纤维组织, 取肿瘤边缘新鲜组织切成1 mm3大小, 将瘤块接种于裸鼠右前肢腋部皮下, 以此法传代3次. 3代后, 取4-6周龄、18-20 g Balb/c裸鼠30只. 选取生长状态佳、无溃破的瘤体, 接种于裸鼠右前肢腋部皮下, 常规饲养, 待裸鼠皮下肿瘤生长到50-100 mm3时, 随机分组并给药.
1.2.3 裸鼠分组及给药: 裸鼠接种皮下瘤后, 当肿瘤生长到50-100 mm3时, 随机分为5组: 模型组、麦角甾苷低、中、高剂量组、5-FU组, 每组6只. 各组裸鼠分别经腹腔给予0.2 mL/d生理盐水, 20、40、80 mg/(kg·d)麦角甾苷各0.2 mL/d, 1 mg/(kg·d) 5-FU 0.2 mL, 连续给药2 wk.
1.2.4 肿瘤抑制率的计算: 分别在给药的第1、4、7、10、14天测量肿瘤长、短径(分别用a、b表示), 计算肿瘤体积(TV = tumor volume) = 1/2×a×b2, 描绘肿瘤生长曲线, 计算肿瘤体积抑制率: 肿瘤体积抑制率% = (1-实验组平均肿瘤体积/模型组平均肿瘤体积)×100%. 在末次给药后脱颈处死裸鼠, 剥离瘤体, 剔除结缔组织, 称瘤体质量, 计算瘤质量抑制率: 瘤质量抑制率% = (1- 实验组肿瘤平均质量/模型组肿瘤平均质量)×100%.
1.2.5 SP免疫组织化学染色: 将上述取出的瘤体用40 g/L的甲醛溶液固定, 石蜡包埋, 4 μm厚连续切片, 二甲苯脱蜡, 梯度乙醇脱水. 将切片依次经内源性过氧化物酶清除、抗原修复、正常血清封闭、抗体结合、DAB染色、蒸馏水洗涤, 再经苏木素衬染, 烟酸乙醇分化, 稀氨水蓝化. 递增梯度乙醇脱水, 二甲苯透明, 常规树脂封片. 所用一抗为1:200稀释的小鼠抗人HIPK2、P53、Bax、Bcl-2, 二抗为1:200生物素标记二抗, 显色时加入1:200辣根酶标记链霉卵白素, 3种试剂均以磷酸盐缓冲液稀释.
1.2.6 阳性表达率结果判读: 光镜下观察切片, HIPK2、P53、Bax、Bcl-2四种蛋白的阳性反应均为棕黄色颗粒染色, 表达强时为深棕色染色. 其中HIPK2、P53阳性表达定位于细胞核, Bax、Bcl-2阳性表达定位于细胞浆, 少数同时可有胞核表达. 运用高清晰度彩色病理图文分析系统对免疫组织化学结果进行判定, 每张切片在400倍下随机选取5个视野, 对测定视野内棕黄色阳性信号进行图像分析, 计算平均阳性表达率, 取其均值作为该切片测量结果.
统计学处理 所有数据整理后, 应用SPSS18.0统计软件进行统计学处理. 计量资料用mean±SD表示, 若服从正态性和方差齐性分布, 采用单因素方差分析(One-Way ANOVA)进行统计推断, 组间多重性比较用LSD检验, 不服从正态性和方差齐性分布, 采用Welch检验, 组间多重性比较用Dunnett's T3检验. 等级资料用非参数检验(Wilcoxon秩和检验). 检验标准α = 0.05, P<0.05为差异具有统计学意义.
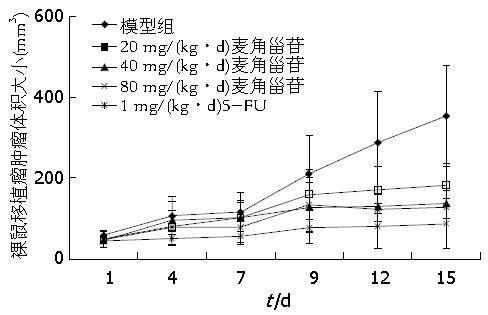
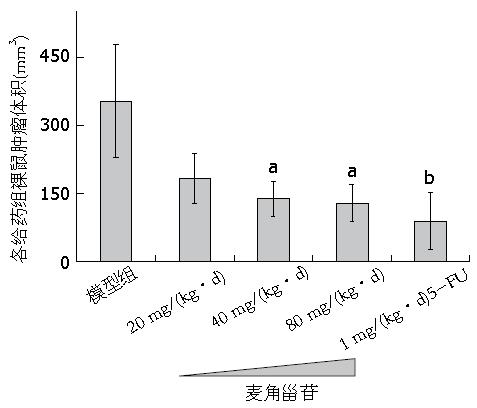
分别在给药第1、4、7、10、14天测量瘤体长径(a)、短径(b), 计算瘤体体积TV, 描绘瘤体生长曲线, 计算瘤体抑制率. 治疗前模型组、麦角甾苷低[20 mg/(kg·d)]、中[40 mg/(kg·d)]、高[80 mg/(kg·d)]剂量组、5-FU[1 mg/(kg·d)]组, 各组瘤体体积无统计学差异(P>0.05), 随着给药时间的延长, 麦角甾苷低、中、高剂量组及5-FU组均表现出不同的抑瘤效果, 肿瘤体积分别为353.44 mm3±124.75 mm3、182.37 mm3±54.50 mm3、137.72 mm3±37.51 mm3、128.14 mm3±40.16 mm3、87.90 mm3±62.04 mm3, 且除麦角甾苷低剂量组外, 中、高剂量组及5-FU组相对于模型组均有统计学意义(P<0.05). 结果显示, 治疗后麦角甾苷低、中、高剂量组及5-FU组的瘤体大小(体积)抑制率分别为48.41%、61.04%、63.75%、75.14%(表1, 图1, 图2), 说明麦角甾苷在体内能够抑制人大肠癌裸鼠移植瘤的生长, 并且呈现剂量的依赖性.
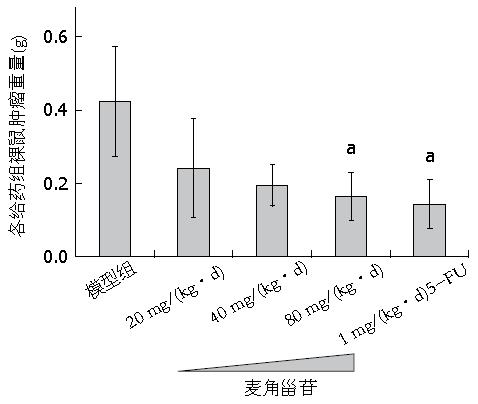
给药2 wk后, 剥离瘤体, 称质量, 计算瘤质量抑制率, 结果如表2所示. 经过麦角甾苷或5-FU治疗2 wk后, 各组瘤重相对于模型组瘤体质量明显较小, 模型组、麦角甾苷低、中、高剂量组、5-FU组的瘤体质量分别是0.423 g±0.150 g、0.242 g±0.135 g、0.195 g±0.057 g、0.165 g±0.065 g、0.143 g±0.067 g, 与模型组比较, 麦角甾苷低、中剂量虽有抑瘤作用, 但差异无统计学意义(P>0.05), 而麦角甾苷高剂量组及5-FU组与模型组比较差异明显(P<0.05). 各组瘤质量抑制率分别是42.79%、53.90%、60.99%、66.19%(表2, 图3, 图4). 说明麦角甾苷对裸鼠肿瘤瘤质量有明显的抑制作用.
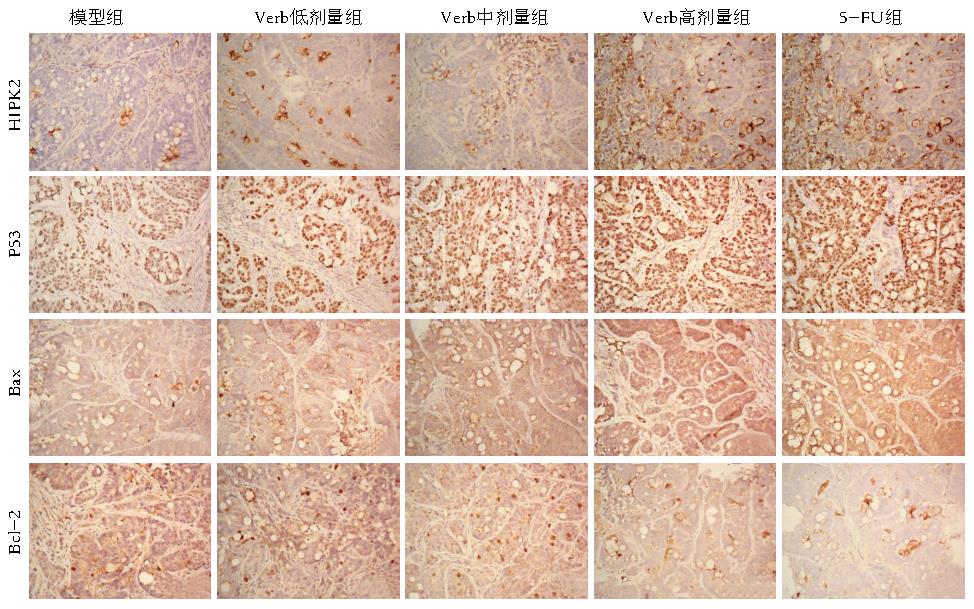
免疫组织化学结果显示, 模型组、麦角甾苷低、中、高剂量组、5-FU组HIPK2表达为3.23±0.61、4.83±0.62、8.46±0.99、11.90±1.21、13.50±0.94, 麦角甾苷中、高剂量及5-FU组表达与模型组相比表达上调, 且有统计学意义(P<0.05), 而麦角甾苷低剂量组与模型组相比表达略有上调, 但差异无统计学意义(P = 0.126). 在各组瘤体组织中P53表达分别为11.70±2.08、14.59±0.90、17.60±1.40、23.10±2.10、22.44±2.05, 麦角甾苷高剂量及5-FU组表达与模型组相比表达上调, 且差异有统计学意义(P<0.05), 低、中剂量组虽表达也略有上调, 但差异无统计学意义(P>0.05). Bax表达在模型组、麦角甾苷低、中、高剂量组、5-FU组分别为9.82±0.55、14.41±0.38、15.84±0.54、26.28±0.55、26.34±2.33, 与模型组相比, 麦角甾苷低、中、高剂量及5-FU表达明显上调, 且差异有统计学意义(P<0.05). Bcl-2表达在模型组、麦角甾苷低、中、高剂量组、5-FU组分别为17.43±1.50、14.08±1.04、11.93±0.93、7.48±0.86、5.46±0.67, 与模型组相比麦角甾苷高剂量及5-FU表达明显下调, 且差异有统计学意义(P<0.05), 低、中剂量组虽表达也略有下调, 但差异无统计学意义(P>0.05)(表3, 图5).
随着城镇化进程的发展, 人民生活水平得到很大的提高, 饮食结构也随之发生改变, 大肠癌, 已经成为严重威胁居民身体健康的重大疾病[7-9]. 目前大肠癌治疗的主要手段是手术切除, 及手术后的放化疗, 但手术后五年生存还相当低, 不能从根本上提高肠癌患者的术后生存率[10,11]. 大肠癌在体内的生长过程本身就是人体正气被癌毒不断耗损的过程. 临床上常用扶正培本的中药[12-14], 可以提高患者机体的免疫能力[15], 通过多靶点、多环节不同程度地抑制肿瘤的发生、发展与转移.
肉苁蓉是临床上常用的扶正固本类中药之一, 其味甘、咸而性温, 入肾、大肠经, 具滋肾肝精血, 润肠胃结燥之效. 《本草正义》记载其"主症瘕者, 咸能软坚, 而入血分, 且补益阴精, 温养阳气, 斯气血流利而否塞通矣". 中医典籍指出, 肉苁蓉以其甘温入肾, 补养精血; 滋阴以通阳, 阴阳双补; 咸而能软能下, 软坚散结, 润肠通便. 临床应用肉苁蓉, 一般取其双补阴阳和润肠通便, 且以咸能软坚散结. 近年来, 随着扶正固本类中药在肿瘤治疗中的应用越来越多, 肉苁蓉以"补肾精血"、"归经大肠"及"味咸软坚", 成为中医药"扶正抗癌"的重要药物. 麦角甾苷是肉苁蓉最主要的活性成分之一. 研究表明, 麦角甾苷可以通过促进淋巴细胞增殖, 提高和调节机体的非特异性细胞免疫, 进而增强机体的免疫功能[4], 在抗炎症特别是肠炎方面具有较好的作用[16,17], 但其在抗肿瘤乃至大肠癌方面的研究未见报道.
细胞凋亡是机体受到体内外生理或某些病理信号刺激时, 在多种基因调控下细胞自我毁灭的过程[18]. 研究表明, HIPK2可以通过多种途径参与细胞凋亡[19-21]. 2002年, 意大利里贾纳埃伦娜癌症研究所D'Orazi等[22]研究发现, HIPK2与p53、PML3共同定位于核小体内, 并磷酸化p53的46位丝氨酸(Ser46)而促进肿瘤细胞凋亡. Hofmann等[23]进一步利用紫外线(UV)照射活化HIPK2, 使p53的Ser46磷酸化, 促进cAMP应答元件结合蛋白导致的p53的382位赖氨酸(Lys382)乙酰化, 加强p53促进肿瘤细胞凋亡的功能活性, 而反义寡核昔酸阻断HIPK2时可以削弱UV诱发的凋亡. Wang等[24]研究发现, HIPK2可通过对p53抑制蛋白MDM2的修饰或胞内移位而降低MDM2蛋白水平, 增加p53转录活性. Di Stefano等[25]研究发现, HIPK2能阻断MDM2对p53的抑制作用而使p53的活性恢复.
细胞内β-catenin表达水平是Wnt/β-catenin信号级联和Wnt靶基因激活的中心环节, 细胞浆内β-catenin的积聚则有助于肿瘤的发生发展. Wnt/β-catenin信号通路的激活是由该途径任何一个信号分子异常而致β-catenin在胞质中累积, 继而进入核内激活T细胞因子4(T cell factor 4, TCF-4)/LEF转录因子, 启动下游靶基因(如cyclinD1、成纤维细胞生长因子18、表皮生长因子受体等)转录[26-28]. Kim等[29]发现抑制HIPK2能明显增加β-catenin的稳定性和导致细胞核内β-catenin的积聚, 但是Lee等[30]在果蝇的研究中发现, HIPK家族特别是HIPK2是Wnt信号通路的正调节因子, HIPK以激酶依赖的方式增强TCF/Arm介导的基因表达, 通过β-catenin/Arm的稳定作用和靶基因表达的刺激作用激活Wnt信号. 激活转录因子TCF-4/LEF是细胞核内重要的转录因子, Wei等[31]研究结果显示, HIPK2过表达能够抑制LEF1/β-catenin介导的Cyclin D1的转录表达, 但其抑制作用与其羧基端的YH域的功能密切相关. Puca等[32]利用HIPK2可抑制β-catenin转录活性, 采用荧光素酶活性检测VEGF报告构件, 研究了HIPK2的过表达能否下调VEGF的水平(β-catenin的一种靶基因)以及β-catenin在这种调节中的作用.
本研究通过建立裸鼠人大肠癌移植瘤模型, 采用扶正中药肉苁蓉的有效活性成分麦角甾苷进行治疗, 从体内观察麦角甾苷对人大肠癌的抑制作用及其对凋亡相关蛋白表达的影响. 根据裸鼠瘤体生长曲线, 说明麦角甾苷对动物瘤体的抑制作用比较明显, 并且呈现剂量依赖性, 证实麦角甾苷在体内能够抑制大肠癌肿瘤的生长. 同时, 我们对瘤体组织进行免疫组织化学法检测各组裸鼠瘤体组织中HIPK2、P53及凋亡相关因子Bax、Bcl-2的蛋白表达. 结果显示, 随着麦角甾苷浓度的增加, 瘤组织中促凋亡基因HIPK2、p53、Bax的表达明显增加, 而抑制凋亡基因Bcl-2的表达降低, 说明麦角甾苷能够提高裸鼠体内凋亡相关基因的蛋白表达, 促进大肠癌细胞凋亡, 从而发挥其抗肿瘤的作用.
大肠癌是临床常见的恶性肿瘤, 发病率男性居于第3位, 女性居于第2位, 2011年死亡人数占所有癌症死亡人数的8%. 中国大肠癌的发病率呈逐年上升趋势, 其上升速度远高于国际水平, 上海等沿海发达地区的发病率高居所有恶性肿瘤的第2位, 远高于内地其他城市, 且呈现逐年上升的趋势.
侯风刚, 副教授, 副主任医师, 上海中医药大学附属市中医医院肿瘤科
肉苁蓉提取物麦角甾苷具有调节免疫功能及抑制端粒酶活性, 对肝癌、胃癌、肠癌、骨肉瘤等肿瘤生长有明显的抑制作用, 可以通过促进淋巴细胞增殖, 提高和调节机体的非特异性细胞免疫, 进而增强机体的免疫功能.
意大利里贾纳埃伦娜癌症研究所D'Orazi研究发现, HIPK2与p53、PML3共同定位于核小体内, 并磷酸化p53的46位丝氨酸(Ser46)而促进肿瘤细胞凋亡. Hofmann等进一步利用紫外线(UV)照射活化HIPK2, 使p53的Ser46磷酸化, 促进CREB结合蛋白导致的p53的382位赖氨酸(Lys382)乙酰化, 加强p53促进肿瘤细胞凋亡的功能活性.
本研究通过建立裸鼠人大肠癌移植瘤模型, 采用扶正中药肉苁蓉的有效活性成分麦角甾苷进行治疗, 从体内观察麦角甾苷对人大肠癌的抑制作用及其对凋亡相关蛋白表达的影响. 根据裸鼠瘤体生长曲线, 说明麦角甾苷对动物瘤体的抑制作用比较明显, 并且呈现剂量依赖性, 证实麦角甾苷在体内能够抑制大肠癌肿瘤的生长.
通过研究肉苁蓉提取物麦角甾苷对人大肠癌裸鼠移植瘤瘤体生长及凋亡相关蛋白HIPK2、P53、Bax和Bcl-2表达的影响, 探讨麦角甾苷抗大肠癌的作用机制, 为扶正中药在临床上用于大肠癌治疗提供理论指导和实验依据.
本文具有有较好的科学性、创新性和可读性.
编辑: 田滢 电编:闫晋利
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 4. | 张 洪泉, 翁 晓静, 陈 莉莉, 李 心. 管花肉苁蓉麦角甾苷对衰老小鼠端粒酶活性和免疫功能的影响. 中国药理学与毒理学杂志. 2008;22:270-273. |
| 5. | 张 炜煜, 朴 熙绪, 金 海燕, 李 成浩, 金 爱花, 韩 红梅. 草苁蓉乙醇提取物对大鼠非酒精性脂肪性肝病的保护作用及机制. 世界华人消化杂志. 2012;20:3087-3094. [DOI] |
| 7. | Siegel R, Ward E, Brawley O, Jemal A. Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths. CA Cancer J Clin. 2011;61:212-236. [PubMed] [DOI] |
| 9. | Mäkelä JT, Kiviniemi H. Surgical treatment of colorectal cancer in patients aged over 80 years. Int J Colorectal Dis. 2012;27:1055-1060. [PubMed] [DOI] |
| 10. | Yiu HY, Whittemore AS, Shibata A. Increasing colorectal cancer incidence rates in Japan. Int J Cancer. 2004;109:777-781. [PubMed] |
| 11. | Haggar FA, Boushey RP. Colorectal cancer epidemiology: incidence, mortality, survival, and risk factors. Clin Colon Rectal Surg. 2009;22:191-197. [PubMed] [DOI] |
| 16. | Speranza L, Franceschelli S, Pesce M, Reale M, Menghini L, Vinciguerra I, De Lutiis MA, Felaco M, Grilli A. Antiinflammatory effects in THP-1 cells treated with verbascoside. Phytother Res. 2010;24:1398-1404. [PubMed] [DOI] |
| 17. | Mazzon E, Esposito E, Di Paola R, Riccardi L, Caminiti R, Dal Toso R, Pressi G, Cuzzocrea S. Effects of verbascoside biotechnologically produced by Syringa vulgaris plant cell cultures in a rodent model of colitis. Naunyn Schmiedebergs Arch Pharmacol. 2009;380:79-94. [PubMed] [DOI] |
| 18. | Schultz DR, Harrington WJ. Apoptosis: programmed cell death at a molecular level. Semin Arthritis Rheum. 2003;32:345-369. [PubMed] |
| 19. | Puca R, Nardinocchi L, Sacchi A, Rechavi G, Givol D, D'Orazi G. HIPK2 modulates p53 activity towards pro-apoptotic transcription. Mol Cancer. 2009;8:85. [PubMed] [DOI] |
| 20. | Nardinocchi L, Puca R, Givol D, D'Orazi G. Counteracting MDM2-induced HIPK2 downregulation restores HIPK2/p53 apoptotic signaling in cancer cells. FEBS Lett. 2010;584:4253-4258. [PubMed] [DOI] |
| 21. | Crone J, Glas C, Schultheiss K, Moehlenbrink J, Krieghoff-Henning E, Hofmann TG. Zyxin is a critical regulator of the apoptotic HIPK2-p53 signaling axis. Cancer Res. 2011;71:2350-2359. [PubMed] [DOI] |
| 22. | D'Orazi G, Cecchinelli B, Bruno T, Manni I, Higashimoto Y, Saito S, Gostissa M, Coen S, Marchetti A, Del Sal G. Homeodomain-interacting protein kinase-2 phosphorylates p53 at Ser 46 and mediates apoptosis. Nat Cell Biol. 2002;4:11-19. [PubMed] |
| 23. | Hofmann TG, Möller A, Sirma H, Zentgraf H, Taya Y, Dröge W, Will H, Schmitz ML. Regulation of p53 activity by its interaction with homeodomain-interacting protein kinase-2. Nat Cell Biol. 2002;4:1-10. [PubMed] |
| 24. | Wang Y, Hofmann TG, Runkel L, Haaf T, Schaller H, Debatin K, Hug H. Isolation and characterization of cDNAs for the protein kinase HIPK2. Biochim Biophys Acta. 2001;1518:168-172. [PubMed] |
| 25. | Di Stefano V, Blandino G, Sacchi A, Soddu S, D'Orazi G. HIPK2 neutralizes MDM2 inhibition rescuing p53 transcriptional activity and apoptotic function. Oncogene. 2004;23:5185-5192. [PubMed] |
| 26. | Tetsu O, McCormick F. Beta-catenin regulates expression of cyclin D1 in colon carcinoma cells. Nature. 1999;398:422-426. [PubMed] |
| 27. | Shimokawa T, Furukawa Y, Sakai M, Li M, Miwa N, Lin YM, Nakamura Y. Involvement of the FGF18 gene in colorectal carcinogenesis, as a novel downstream target of the beta-catenin/T-cell factor complex. Cancer Res. 2003;63:6116-6120. [PubMed] |
| 28. | Tan X, Apte U, Micsenyi A, Kotsagrelos E, Luo JH, Ranganathan S, Monga DK, Bell A, Michalopoulos GK, Monga SP. Epidermal growth factor receptor: a novel target of the Wnt/beta-catenin pathway in liver. Gastroenterology. 2005;129:285-302. [PubMed] |
| 29. | Kim EA, Kim JE, Sung KS, Choi DW, Lee BJ, Choi CY. Homeodomain-interacting protein kinase 2 (HIPK2) targets beta-catenin for phosphorylation and proteasomal degradation. Biochem Biophys Res Commun. 2010;394:966-971. [PubMed] [DOI] |
| 30. | Lee W, Swarup S, Chen J, Ishitani T, Verheyen EM. Homeodomain-interacting protein kinases (Hipks) promote Wnt/Wg signaling through stabilization of beta-catenin/Arm and stimulation of target gene expression. Development. 2009;136:241-251. [PubMed] [DOI] |
| 31. | Wei G, Ku S, Ma GK, Saito S, Tang AA, Zhang J, Mao JH, Appella E, Balmain A, Huang EJ. HIPK2 represses beta-catenin-mediated transcription, epidermal stem cell expansion, and skin tumorigenesis. Proc Natl Acad Sci U S A. 2007;104:13040-13045. [PubMed] |
| 32. | Puca R, Nardinocchi L, D'Orazi G. Regulation of vascular endothelial growth factor expression by homeodomain-interacting protein kinase-2. J Exp Clin Cancer Res. 2008;27:22. [PubMed] [DOI] |