修回日期: 2014-05-19
接受日期: 2014-05-29
在线出版日期: 2014-07-08
肝纤维化是由肝脏在各种慢性肝损伤条件下的损伤修复反应造成, 以细胞外基质过度沉积为主要特征. 许多证据表明NADPH氧化酶(nicotinamide adenine dinucleotide phosphate oxidase, NOX)及其产生的活性氧簇(reactive oxygen species, ROS)引起的氧化应激在肝纤维化中起关键作用. NOX是一个多亚基复合体, 在肝脏中, 吞噬细胞型和非吞噬细胞型的NOX均有功能性表达, 并对引起肝纤维化的主要细胞-肝星状细胞(hepatic stellate cells, HSCs)均具有明显的促纤维化作用. 本文就NOX家族在肝纤维化的发生、发展中的作用的近几年研究进展做一综述.
核心提示: NADPH氧化酶家族成员还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase, NADPH oxidase, NOX)1、NOX2及NOX4分别通过不同的途径直接参与肝脏纤维化的发生、发展, 抑制NOX的表达能够从发病机制阻断肝纤维化的发生, 因此研发使用NOX特异性的抑制剂有望成为肝纤维化治疗有效新方法.
引文著录: 余珊珊, 朱萱. NADPH氧化酶家族成员促肝纤维化的研究进展. 世界华人消化杂志 2014; 22(19): 2710-2715
Revised: May 19, 2014
Accepted: May 29, 2014
Published online: July 8, 2014
Liver fibrosis is one of hepatic wound-repair responses to a variety of chronic liver injuries, which is characterized by excessive deposition of extracellular matrix. Increasing evidence indicates that nicotinamide adenine dinucleotide phosphate (NADPH) oxidase and oxidative stress caused by reactive oxygen species play a key role in liver fibrosis. NADPH oxidase is a multi-subunit complex. In the liver, both phagocytic and non-phagocytic NADPH oxidases are functionally expressed. They have a significant fibrogenic effect on the hepatic stellate cells, the main cell type causing liver fibrosis. In this paper, we review the recent advances in understanding the role of the NADPH oxidase family in the occurrence and development of liver fibrosis.
- Citation: Yu SS, Zhu X. Role of NADPH oxidase family members in promoting liver fibrosis. Shijie Huaren Xiaohua Zazhi 2014; 22(19): 2710-2715
- URL: https://www.wjgnet.com/1009-3079/full/v22/i19/2710.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i19.2710
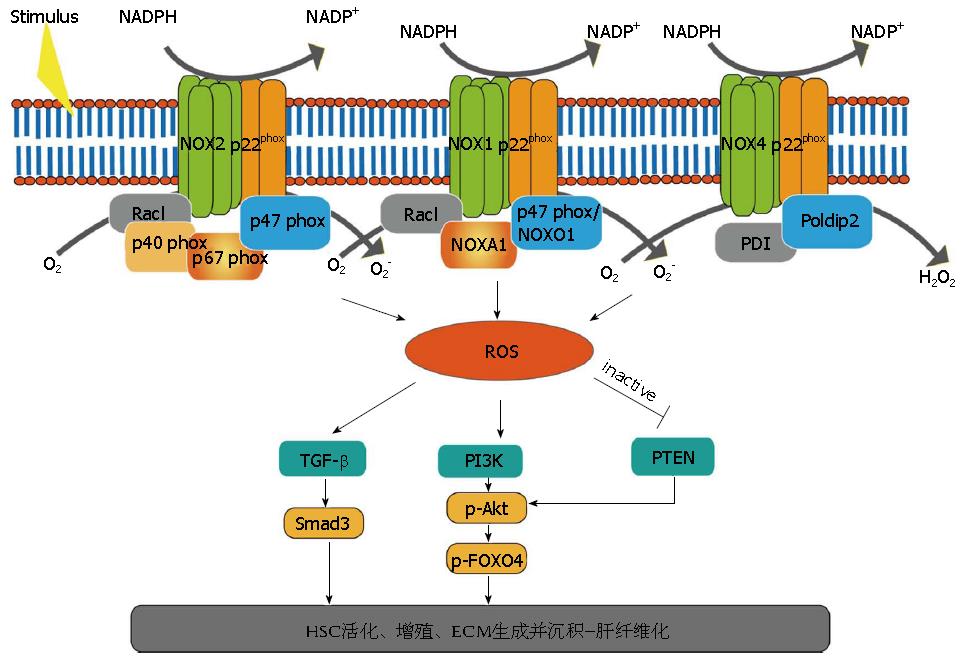
在病理组织修复过程中, 包括肝脏在内的许多脏器由于过度的损伤修复反应而发生纤维化[1]. 许多慢性肝脏疾病都可导致肝纤维化, 肝纤维化由肝细胞死亡及以Ⅰ型胶原为主的细胞外基质(extracellular matrix, ECM)沉积造成[2]. 肝星状细胞(hepatic stellate cells, HSCs)是肝纤维化反应中主要效应细胞, 也是ECM的主要来源[3]. 越来越多的研究显示, 还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase, NADPH oxidase, NOX)家族及其产生的活性氧簇(reactive oxygen species, ROS)诱导的氧化应激在肝纤维化中具有关键作用(图1).
ROS可来源于几种酶系统, 包括黄嘌呤氧化酶[4]、线粒体呼吸链[5]、脂质过氧化物酶[6]、细胞色素p450酶[7]和NADPH氧化酶. 早期学者们普遍认为ROS的主要生物学功能是对缺血再灌注的器官和组织产生氧化应激损伤[8], 近年来研究发现, 低浓度的ROS可以作为细胞对各种生理刺激产生应答的第二信使, 在许多信号通路中发挥重要作用, 如转录调节、细胞分化、癌变作用及细胞凋亡[9]等, 但是高浓度的ROS是具有细胞毒性的. 活化的HSC内表达高水平ROS, 但在HSC的活化过程中细胞内谷胱甘肽浓度也明显升高从而可以抵抗ROS毒性造成的细胞坏死, 并且细胞内的抗过氧化氢酶也能够发挥抵抗ROS引起的细胞凋亡的作用[10]. 在HSCs内, ROS利用氧化还原敏感蛋白激酶和转录因子来调节各种介质的活化与表达[11]. ROS诱导HSC向肌成纤维细胞(myofibroblast, MFB)转化[12], 并作为重要介质调控组织转化生长因子β(tissue growth factor beta, TGF-β)等的促纤维化效应和ECM沉积[13], 在肝脏纤维化中具有重要意义. 研究指出NOX是纤维化肝脏中ROS的主要来源[14].
NOX是一种多亚基的跨膜酶复合体, 最早在吞噬细胞中被发现[15]. 他利用NADPH将电子传递给O2分子从而产生O2-和H2O2[16]. NOX家族由七种成员组成, NOX1、NOX2、NOX3、NOX4、NOX5及两个双重氧化酶Duox1和Doux2[17]. 在NOX家族中, NOX1、NOX2、NOX3和NOX4在发挥酶活性前都需要与P22phox形成异二聚体, 但NOX5、DUOX1和DUOX2的功能与P22phox无关. 每种NOX在不同的组织中表达, 具有不同亚细胞定位, 甚至产生不同的ROS产物[18]. 其中, NOX1、NOX2和NOX5主要产生超氧化物, 而NOX4则主要生成H2O2[19]. Samuele等[14]使用基因敲除小鼠和野生小鼠骨髓移植等方法研究发现, 骨髓来源的和非骨髓来源的肝脏细胞内的NOX都参与了肝脏纤维化的发生, p47phox的缺失能显著降低肝脏纤维化, 同时他们指出NOX在肝脏的纤维化中发挥极其重要的作用, 但NOX对实验性肝脏脂肪变性及肝实质细胞内的ROS产生并不具有促进作用. Paik等[20]实验证明NOX家族中的NOX1、NOX2、NOX4及相关亚基p22phox、p40phox、p47phox、p67phox和Rac1在CCl4及BDL诱导肝纤维化的HSC中的mRNA水平明显高于静息态HSC中的水平. 所以, 在NOX家族中, 不论吞噬型NADPH氧化酶NOX2, 还是非吞噬型NADPH氧化酶如NOX1、NOX4等在HSC中均有表达, 并在肝脏纤维化的发病中都发挥重要作用[20,21]. NOX能够调节HSC在血小板衍生生长因子(platelet derived growth factor, PDGF)、血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)、痩素(leptin)和TGF-β等各种促纤维化因子作用下细胞的活化[22-25]. 研究表明, NOX亚基与肺脏[26]、肾脏[14]和肝脏[27]等多脏器纤维化的发生均有关, 他在各纤维化脏器中的表达均显著增加, 因此, NOX是各脏器在受到的纤维化刺激后向纤维化发展过程中的中心介质[28].
NOX2是在中性粒细胞中发现的经典吞噬型NOX. 他由位于细胞膜上的催化亚基gp91phox(又名NOX2)和调节亚基p22phox, 及位于细胞浆内的其他四个调节亚基p47phox、p40phox、p67phox和小G蛋白Rac组成, 其中Rac为NOX2活化所必需成分. 一旦受到激动剂刺激, 胞浆内的四个亚基即移位至胞膜并与其他两个亚基结合形成复合体, 激发NOX酶活性[29]. 研究显示, 吞噬型NOX2在纤维化的肝脏中表达明显上升, 他与HSCs的活化及纤维化反应的发生密切相关[20,30]. 肝细胞凋亡及HSC活化是肝纤维化的中心事件, Zhan等[31]研究证明, 肝细胞凋亡后HSC对凋亡小体的吞噬作用对纤维化反应, 如Ⅰ型胶原蛋白和TGF-β的表达上调及NOX相关超氧化物的产生均具有直接促进作用. 此后, Jiang等[30]证明, HSC对肝细胞凋亡小体的吞噬可直接活化HSC, 该过程受NOX2(gp91phox)的介导, NOX2介导产生的ROS可直接引起HSC内胶原蛋白启动子的活力. Subhadip等[32]发现长期三氧化二砷接触能诱发肝脏纤维化, 肝脏中gp91phox(NOX2)和NOX p67phox亚基表达增加明显, 他就是通过增加NOX产生的氧化应激引起枯否细胞(kuffer cell, KC)激活, 随后引起肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α)信号机制的表达, 从而导致肝细胞凋亡、HSC活化及肝脏纤维化的发生. NOX2基因敲除小鼠经CCl4注射或胆总管结扎后, 肝纤维化程度明显低于正常野生型小鼠[20,33], 这也是NOX2在肝纤维化中具有重要作用的另一间接有力证明.
在所有的NOX家族中, NOX1具有与NOX2相似的结构和功能. 尽管NOX1也具有p22phox依赖性, 但是它利用p47phox同系物NOXO1组合酶复合体, p67phox同系物NOXA1催化酶活性[34]. 纤维化的肝脏中NOX2与NOX1的表达均明显增加, 但NOX2在内源性肝脏细胞和骨髓转化肝脏细胞中均能发挥促纤维化作用, 而NOX1主要在内源性肝脏细胞, 如HSC和肝实质细胞中介导促纤维化作用[20]. 超氧化物歧化酶1(superoxide dismutase 1, SOD1)与活化的NOX复合体中的Rac1相互作用能刺激NOX的活力[35,36]. Tomonori等[36]研究表明, SOD1G37R突变型HSC可通过增加NOX1的活性, 上调NOX4的表达、增加ROS的产生, 促进肝脏纤维化, AngⅡ刺激引起的NOX4水平上调及促纤维化效应依赖于NOX1, 而TGF-β的这些效应则与NOX1无关. 用NOX1基因敲除(NOX1KO)小鼠研究NOX1在肝纤维化发展中的作用, 发现胆总管结扎术(bile duct ligation, BDL)后, NOX1KO小鼠肝脏内Ⅰ型胶原蛋白mRNA的表达水平、羟脯氨酸的含量、活化HSC的数量及肝纤维化程度均降低明显[20,21], 同时Cui等[21]还发现, NOX1来源的ROS可氧化磷脂酰肌醇-3激酶/蛋白激酶(phosphatidylinositol-3 kinase/Akt, PI3K/Akt)信号通路负性调控因子-磷酸酶和张力蛋白同系物(protein phosphatase and tension homologue, PTEN)并使其失活, 继而促进Akt/FOXO4/p27kip1信号通路的表达以促进HSCs的增殖并加速肝纤维化的发展. 除此之外, 最新研究发现NOX1还可通过与诱导型一氧化氮合酶相互作用明显上调糖尿病患者肾小球系膜内促纤维化因子TGF-β及纤连蛋白的表达[37].
NOX4是NADPH氧化酶的催化性亚基中分布最广泛的一种. NOX4在肝脏中的表达水平增加与肝脏纤维化密切相关. Jiang等[38]研究发现BDL诱导肝纤维化的小鼠HSC中, NOX4以TGF-β/Smad3依赖性机制表达上调, 促进HSC的活化, 并且NOX4在死亡配体诱导的肝细胞凋亡中也具有十分关键的作用. 同时, NOX4基因敲除肝细胞对FasL或TNF-α/放线菌素D诱导的细胞凋亡更具有抵抗力, NOX4基因缺失HSC的活化也显著减少. 越来越多的证据表明, NOX氧化还原信号的促纤维化反应受TGF-β的介导, NOX4通过TGF-β介导HSC向MFB转化及其形态的维持[39], TGF-β1以Smad3依赖形式增加NOX4的 mRNA和蛋白的表达以及NOX4来源的ROS水平[20,38], NOX4是TGF-β/Smad诱导的纤维化反应中的一个重要的下游效因子[40]. 然而NOX4又可以反馈形式调节TGF-β/Smad信号的促纤维化[41], NOX4在TGF-β诱导的纤维化反应中具有促进胶原产生等重要作用[42], 并且NOX4来源的ROS促进TGF-β介导的HSC活化[38]. 在肝细胞株内, 丙型肝炎病毒(hepatitis c virus, HCV)依赖TGF-β来增加NOX4 mRNA的表达水平, NOX4进而增加ROS的产生, 引发肝脏疾病的发生[43,44]. Remina等[45]研究发现多烯磷脂酰胆碱就是通过抑制TGF-β诱导的NOX4和ROS从而发挥抑制人类HSC活化的功能. 除此之外, Chan等[42]研究发现, 对心脏中心肌成纤维细胞转染显性负性NOX4突变体以减弱细胞内NOX4活力或是利用siRNA沉默NOX4基因表达后, TGF-β介导的H2O2的产生和Ⅰ型胶原的表达存在显著降低.
肝纤维化是现今全球范围内一个严重影响生命健康的疾病, 而有效的、可利用的治疗措施却非常的少. 有研究表明, 即使是晚期肝纤维化患者或实验性肝纤维化动物模型的肝纤维化都是可以逆转的[12,46]. 最新研究显示, 欧苷菊能诱导肝星状细胞的凋亡并发挥抗纤维化效应[47], 紫铆因抑制乙醇和乙醛诱导的HSC活化, 发挥抗氧化及抗纤维化作用[48]. 但他们仍未能从发病机制上完全逆转纤维化. NOX在肝纤维化中的重要作用为我们提供了新方向. DPI是一种广泛的黄素蛋白抑制剂, 他对各种NOX亚型都具有类似的抑制效应, 但他抑制NOX抗纤维化的同时, 也抑制了体内的黄嘌呤氧化酶和内皮型一氧化氮合酶[49]. 因此, 理想的NOX抑制剂应该具有NOX特异性. 研究发现, GKT137831是一种NOX1/NOX4高度特异性抑制剂, 对NOX4及NOX1的抑制效应优于DPI[35]. 不论预防性还是治疗性使用GKT137831后, 肝脏内ROS的生成、NOX1和NOX4基因水平和纤维化标志物的表达及肝细胞的凋亡均明显降低[36,38]. 与此同时, 研究显示基因或药理阻滞NOX4对糖尿病肾病中促炎症和促纤维化标志物的表达也具有一定的抑制作用[9]. 然而也有研究证明, NOX4能够抑制肝脏肿瘤的进展, 对NOX4抑制可能对肝癌细胞有利, 可能导致早期肿瘤形成并增加肿瘤大小[50].
NOX家族与肝脏纤维化的发生、发展密切相关, 在肝纤维化仍缺乏突破性治疗药物的情况下, NOX在肝纤维化中的作用与地位为我们提供了潜在的新治疗靶点. 研制以NOX为作用靶点的高效特异性NOX抑制剂, 阻断其ROS的产生及促纤维化效应, 将为现今肝纤维化的治疗带来重要新方向, 但他仍需要进一步的深入研究.
肝纤维化是各种病因所致慢性肝损伤的创伤愈合反应, 是多种慢性肝病向肝硬化发展的必经阶段. 近年研究发现, NADPH氧化酶在肝纤维化发病中起关键作用, NADPH氧化酶通过产生活性氧簇(reactive oxygen species, ROS)调控HSC的激活及细胞内信号转导, 被认为是防治纤维化疾病的重要新靶点.
陈红松, 研究员, 北京人民医院, 北京大学肝病研究所
明确NADPH氧化酶家族在肝纤维化中的重要作用, 以NADPH氧化酶及其调控的信号通路为靶点, 研发出能够从发病机制上逆转肝纤维化的药物具有可行性, 但仍需要我们的进一步探索研究.
GKT137831是一种特异性NOX1/4双向抑制剂, 对还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase, NADPH oxidase, NOX)的抑制效应优于DPI, 能够有效抑制肝脏炎症、纤维化反应相关细胞因子的表达及ROS的产生, 对于肝纤维化是一种新的潜在有效治疗药物.
本文全面专一地介绍NADPH氧化酶家族及其产生的ROS介导的肝星状细胞激活、细胞外基质沉积等致肝纤维化反应, 分别介绍了NOX2、NOX1和NOX4在肝纤维化过程中的突出作用, 同时总结了NOX家族参与的抗肝纤维化的多方研究成果.
本文对近几年来研究的NADPH氧化酶在肝纤维化中作用机制及重要作用做了简要综述, 为以NOX为作用靶点治疗肝纤维化这一观点提供了坚实的理论依据, 为今后抗纤维化治疗相关研究指明了另一方向.
本文就近几年学界关注的问题, 引用近几年的文献, 简明扼要地对NADPH氧化酶家族对于肝纤维化的影响进行了综述, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Ghosh AK, Quaggin SE, Vaughan DE. Molecular basis of organ fibrosis: potential therapeutic approaches. Exp Biol Med (Maywood). 2013;238:461-481. [PubMed] [DOI] |
| 2. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 3. | Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology. 2008;134:1655-1669. [PubMed] [DOI] |
| 4. | McNally JS, Davis ME, Giddens DP, Saha A, Hwang J, Dikalov S, Jo H, Harrison DG. Role of xanthine oxidoreductase and NAD(P)H oxidase in endothelial superoxide production in response to oscillatory shear stress. Am J Physiol Heart Circ Physiol. 2003;285:H2290-H2297. [PubMed] |
| 5. | Skulachev VP. Role of uncoupled and non-coupled oxidations in maintenance of safely low levels of oxygen and its one-electron reductants. Q Rev Biophys. 1996;29:169-202. [PubMed] |
| 6. | Zhang R, Brennan ML, Shen Z, MacPherson JC, Schmitt D, Molenda CE, Hazen SL. Myeloperoxidase functions as a major enzymatic catalyst for initiation of lipid peroxidation at sites of inflammation. J Biol Chem. 2002;277:46116-46122. [PubMed] |
| 7. | Fleming I, Michaelis UR, Bredenkötter D, Fisslthaler B, Dehghani F, Brandes RP, Busse R. Endothelium-derived hyperpolarizing factor synthase (Cytochrome P450 2C9) is a functionally significant source of reactive oxygen species in coronary arteries. Circ Res. 2001;88:44-51. [PubMed] |
| 8. | Elias-Miró M, Jiménez-Castro MB, Rodés J, Peralta C. Current knowledge on oxidative stress in hepatic ischemia/reperfusion. Free Radic Res. 2013;47:555-568. [PubMed] [DOI] |
| 9. | Genetic Targeting or Pharmacologic Inhibition of NADPH Oxidase Nox4 Provides Renoprotection in Long-Term Diabetic Nephropathy. J Am Soc Nephrol. 2014;25:1237-1254. [PubMed] |
| 10. | Dunning S, Ur Rehman A, Tiebosch MH, Hannivoort RA, Haijer FW, Woudenberg J, van den Heuvel FA, Buist-Homan M, Faber KN, Moshage H. Glutathione and antioxidant enzymes serve complementary roles in protecting activated hepatic stellate cells against hydrogen peroxide-induced cell death. Biochim Biophys Acta. 2013;1832:2027-2034. [PubMed] [DOI] |
| 11. | De Minicis S, Brenner DA. NOX in liver fibrosis. Arch Biochem Biophys. 2007;462:266-272. [PubMed] [DOI] |
| 12. | Fink SA, Jacobson IM. Managing patients with hepatitis B-related or hepatitis C-related decompensated cirrhosis. Nat Rev Gastroenterol Hepatol. 2011;8:285-295. [PubMed] |
| 13. | Rhyu DY, Park J, Sharma BR, Ha H. Role of reactive oxygen species in transforming growth factor-beta1-induced extracellular matrix accumulation in renal tubular epithelial cells. Transplant Proc. 2012;44:625-628. [PubMed] [DOI] |
| 14. | De Minicis S, Seki E, Paik YH, Osterreicher CH, Kodama Y, Kluwe J, Torozzi L, Miyai K, Benedetti A, Schwabe RF. Role and cellular source of nicotinamide adenine dinucleotide phosphate oxidase in hepatic fibrosis. Hepatology. 2010;52:1420-1430. [PubMed] [DOI] |
| 15. | Babior BM, Lambeth JD, Nauseef W. The neutrophil NADPH oxidase. Arch Biochem Biophys. 2002;397:342-344. [PubMed] |
| 16. | Bedard K, Krause KH. The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology. Physiol Rev. 2007;87:245-313. [PubMed] |
| 17. | Barnes JL, Gorin Y. Myofibroblast differentiation during fibrosis: role of NAD(P)H oxidases. Kidney Int. 2011;79:944-956. [PubMed] [DOI] |
| 18. | Brown DI, Griendling KK. Nox proteins in signal transduction. Free Radic Biol Med. 2009;47:1239-1253. [PubMed] [DOI] |
| 19. | Takac I, Schröder K, Zhang L, Lardy B, Anilkumar N, Lambeth JD, Shah AM, Morel F, Brandes RP. The E-loop is involved in hydrogen peroxide formation by the NADPH oxidase Nox4. J Biol Chem. 2011;286:13304-13313. [PubMed] [DOI] |
| 20. | Paik YH, Iwaisako K, Seki E, Inokuchi S, Schnabl B, Osterreicher CH, Kisseleva T, Brenner DA. The nicotinamide adenine dinucleotide phosphate oxidase (NOX) homologues NOX1 and NOX2/gp91(phox) mediate hepatic fibrosis in mice. Hepatology. 2011;53:1730-1741. [PubMed] [DOI] |
| 21. | Cui W, Matsuno K, Iwata K, Ibi M, Matsumoto M, Zhang J, Zhu K, Katsuyama M, Torok NJ, Yabe-Nishimura C. NOX1/nicotinamide adenine dinucleotide phosphate, reduced form (NADPH) oxidase promotes proliferation of stellate cells and aggravates liver fibrosis induced by bile duct ligation. Hepatology. 2011;54:949-958. [PubMed] [DOI] |
| 22. | Bataller R, Schwabe RF, Choi YH, Yang L, Paik YH, Lindquist J, Qian T, Schoonhoven R, Hagedorn CH, Lemasters JJ. NADPH oxidase signal transduces angiotensin II in hepatic stellate cells and is critical in hepatic fibrosis. J Clin Invest. 2003;112:1383-1394. [PubMed] |
| 23. | De Minicis S, Seki E, Oesterreicher C, Schnabl B, Schwabe RF, Brenner DA. Reduced nicotinamide adenine dinucleotide phosphate oxidase mediates fibrotic and inflammatory effects of leptin on hepatic stellate cells. Hepatology. 2008;48:2016-2026. [PubMed] [DOI] |
| 24. | Adachi T, Togashi H, Suzuki A, Kasai S, Ito J, Sugahara K, Kawata S. NAD(P)H oxidase plays a crucial role in PDGF-induced proliferation of hepatic stellate cells. Hepatology. 2005;41:1272-1281. [PubMed] |
| 25. | Hecker L, Vittal R, Jones T, Jagirdar R, Luckhardt TR, Horowitz JC, Pennathur S, Martinez FJ, Thannickal VJ. NADPH oxidase-4 mediates myofibroblast activation and fibrogenic responses to lung injury. Nat Med. 2009;15:1077-1081. [PubMed] [DOI] |
| 26. | Amara N, Goven D, Prost F, Muloway R, Crestani B, Boczkowski J. NOX4/NADPH oxidase expression is increased in pulmonary fibroblasts from patients with idiopathic pulmonary fibrosis and mediates TGFbeta1-induced fibroblast differentiation into myofibroblasts. Thorax. 2010;65:733-738. [PubMed] [DOI] |
| 27. | Colmenero J, Bataller R, Sancho-Bru P, Domínguez M, Moreno M, Forns X, Bruguera M, Arroyo V, Brenner DA, Ginès P. Effects of losartan on hepatic expression of nonphagocytic NADPH oxidase and fibrogenic genes in patients with chronic hepatitis C. Am J Physiol Gastrointest Liver Physiol. 2009;297:G726-G734. [PubMed] [DOI] |
| 28. | Mehal WZ, Iredale J, Friedman SL. Scraping fibrosis: expressway to the core of fibrosis. Nat Med. 2011;17:552-553. [PubMed] [DOI] |
| 29. | Leto TL, Morand S, Hurt D, Ueyama T. Targeting and regulation of reactive oxygen species generation by Nox family NADPH oxidases. Antioxid Redox Signal. 2009;11:2607-2619. [PubMed] [DOI] |
| 30. | Jiang JX, Venugopal S, Serizawa N, Chen X, Scott F, Li Y, Adamson R, Devaraj S, Shah V, Gershwin ME. Reduced nicotinamide adenine dinucleotide phosphate oxidase 2 plays a key role in stellate cell activation and liver fibrogenesis in vivo. Gastroenterology. 2010;139:1375-1384. [PubMed] [DOI] |
| 31. | Zhan SS, Jiang JX, Wu J, Halsted C, Friedman SL, Zern MA, Torok NJ. Phagocytosis of apoptotic bodies by hepatic stellate cells induces NADPH oxidase and is associated with liver fibrosis in vivo. Hepatology. 2006;43:435-443. [PubMed] |
| 32. | Ghatak S, Biswas A, Dhali GK, Chowdhury A, Boyer JL, Santra A. Oxidative stress and hepatic stellate cell activation are key events in arsenic induced liver fibrosis in mice. Toxicol Appl Pharmacol. 2011;251:59-69. [PubMed] [DOI] |
| 33. | Aram G, Potter JJ, Liu X, Wang L, Torbenson MS, Mezey E. Deficiency of nicotinamide adenine dinucleotide phosphate, reduced form oxidase enhances hepatocellular injury but attenuates fibrosis after chronic carbon tetrachloride administration. Hepatology. 2009;49:911-919. [PubMed] [DOI] |
| 34. | Bánfi B, Clark RA, Steger K, Krause KH. Two novel proteins activate superoxide generation by the NADPH oxidase NOX1. J Biol Chem. 2003;278:3510-3513. [PubMed] |
| 35. | Harraz MM, Marden JJ, Zhou W, Zhang Y, Williams A, Sharov VS, Nelson K, Luo M, Paulson H, Schöneich C. SOD1 mutations disrupt redox-sensitive Rac regulation of NADPH oxidase in a familial ALS model. J Clin Invest. 2008;118:659-670. [PubMed] [DOI] |
| 36. | Aoyama T, Paik YH, Watanabe S, Laleu B, Gaggini F, Fioraso-Cartier L, Molango S, Heitz F, Merlot C, Szyndralewiez C. Nicotinamide adenine dinucleotide phosphate oxidase in experimental liver fibrosis: GKT137831 as a novel potential therapeutic agent. Hepatology. 2012;56:2316-2327. [PubMed] [DOI] |
| 37. | Gao L, Huang W, Li J. NOX1 abet mesangial fibrogenesis via iNOS induction in diabetes. Mol Cell Biochem. 2013;382:185-191. [PubMed] [DOI] |
| 38. | Jiang JX, Chen X, Serizawa N, Szyndralewiez C, Page P, Schröder K, Brandes RP, Devaraj S, Török NJ. Liver fibrosis and hepatocyte apoptosis are attenuated by GKT137831, a novel NOX4/NOX1 inhibitor in vivo. Free Radic Biol Med. 2012;53:289-296. [PubMed] [DOI] |
| 39. | Sancho P, Mainez J, Crosas-Molist E, Roncero C, Fernández-Rodriguez CM, Pinedo F, Huber H, Eferl R, Mikulits W, Fabregat I. NADPH oxidase NOX4 mediates stellate cell activation and hepatocyte cell death during liver fibrosis development. PLoS One. 2012;7:e45285. [PubMed] [DOI] |
| 40. | Samarakoon R, Overstreet JM, Higgins PJ. TGF-β signaling in tissue fibrosis: redox controls, target genes and therapeutic opportunities. Cell Signal. 2013;25:264-268. [PubMed] [DOI] |
| 41. | Jiang F, Liu GS, Dusting GJ, Chan EC. NADPH oxidase-dependent redox signaling in TGF-β-mediated fibrotic responses. Redox Biol. 2014;2:267-272. [PubMed] |
| 42. | Chan EC, Peshavariya HM, Liu GS, Jiang F, Lim SY, Dusting GJ. Nox4 modulates collagen production stimulated by transforming growth factor β1 in vivo and in vitro. Biochem Biophys Res Commun. 2013;430:918-925. [PubMed] [DOI] |
| 43. | Boudreau HE, Emerson SU, Korzeniowska A, Jendrysik MA, Leto TL. Hepatitis C virus (HCV) proteins induce NADPH oxidase 4 expression in a transforming growth factor beta-dependent manner: a new contributor to HCV-induced oxidative stress. J Virol. 2009;83:12934-12946. [PubMed] [DOI] |
| 44. | de Mochel NS, Seronello S, Wang SH, Ito C, Zheng JX, Liang TJ, Lambeth JD, Choi J. Hepatocyte NAD(P)H oxidases as an endogenous source of reactive oxygen species during hepatitis C virus infection. Hepatology. 2010;52:47-59. [PubMed] [DOI] |
| 45. | Ikeda R, Ishii K, Hoshikawa Y, Azumi J, Arakaki Y, Yasui T, Matsuura S, Matsumi Y, Kono Y, Mizuta Y. Reactive oxygen species and NADPH oxidase 4 induced by transforming growth factor β1 are the therapeutic targets of polyenylphosphatidylcholine in the suppression of human hepatic stellate cell activation. Inflamm Res. 2011;60:597-604. [PubMed] [DOI] |
| 46. | Popov Y, Schuppan D. Targeting liver fibrosis: strategies for development and validation of antifibrotic therapies. Hepatology. 2009;50:1294-1306. [PubMed] [DOI] |
| 47. | Kim IH, Kim SW, Kim SH, Lee SO, Lee ST, Kim DG, Lee MJ, Park WH. Parthenolide-induced apoptosis of hepatic stellate cells and anti-fibrotic effects in an in vivo rat model. Exp Mol Med. 2012;44:448-456. [PubMed] [DOI] |
| 48. | Szuster-Ciesielska A, Mizerska-Dudka M, Daniluk J, Kandefer-Szerszeń M. Butein inhibits ethanol-induced activation of liver stellate cells through TGF-β, NFκB, p38, and JNK signaling pathways and inhibition of oxidative stress. J Gastroenterol. 2013;48:222-237. [PubMed] [DOI] |
| 49. | Wind S, Beuerlein K, Eucker T, Müller H, Scheurer P, Armitage ME, Ho H, Schmidt HH, Wingler K. Comparative pharmacology of chemically distinct NADPH oxidase inhibitors. Br J Pharmacol. 2010;161:885-898. [PubMed] [DOI] |
| 50. | Crosas-Molist E, Bertran E, Sancho P, López-Luque J, Fernando J, Sánchez A, Fernández M, Navarro E, Fabregat I. The NADPH oxidase NOX4 inhibits hepatocyte proliferation and liver cancer progression. Free Radic Biol Med. 2014;69:338-347. [PubMed] [DOI] |