修回日期: 2014-01-19
接受日期: 2014-02-28
在线出版日期: 2014-06-28
结肠癌变的发生率在全球范围内呈明显上升趋势. 除了与遗传、环境等因素有关, 饮食结构也起到重要作用. 流行病理学和现代分子生物学相关研究表明人体肠道内短链脂肪酸, 特别是丁酸的浓度对维持肠道内环境起到重要作用. 丁酸抑制肿瘤的首要机制是作为组蛋白去乙酰化酶(histone deacetylase)的抑制剂, 但深入的研究显示丁酸还能有效地参与细胞的代谢并起到诱导结肠癌细胞凋亡及抗增殖作用. 为此, 本文将针对丁酸对结肠细胞的作用机制进行综述.
核心提示: 结肠癌发病率趋势上升, 丁酸通过其抑制肿瘤生长, 诱导肿瘤细胞凋亡的机制, 可有效地降低结肠癌细胞的增殖. 对丁酸抑制肿瘤机制的研究, 为治疗结肠癌提供了广阔的实验研究
方向.
引文著录: 周中凯, 卜丹丹, 苏哲, 姜余梅. 丁酸降低结肠癌的潜在机制. 世界华人消化杂志 2014; 22(18): 2539-2546
Revised: January 19, 2014
Accepted: February 28, 2014
Published online: June 28, 2014
There is an increasing trend for the incidence of bowel diseases around the world. Besides the influence from family background and environment, dietary structure plays important roles in the rising rates of bowel diseases. Results from epidemiological studies and molecular biological studies showed that the concentration of short-chain fatty acids, in particular butyrate, is a key factor for maintaining a healthy colon environment. Although the primary mechanism for butyrate to depress the growth of cancer cells is acting as an inhibitor of histone deacetylases (HDACs), some studies demonstrated that butyrate is also involved in cell metabolism and induction of the death of cancer cells. This article reviews the mechanisms of action of butyrate on colon cells.
- Citation: Zhou ZK, Bu DD, Su Z, Jiang YM. Butyrate decreases risk of colonic cancer: Potential mechanisms. Shijie Huaren Xiaohua Zazhi 2014; 22(18): 2539-2546
- URL: https://www.wjgnet.com/1009-3079/full/v22/i18/2539.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i18.2539
结肠癌(colorectal cancer, CRC)在女性中的发病率占癌症发病率的第2位, 男性为第3位. 据统计, 2008年产生120万例新病例以及608700例死亡[1]. CRC发生率在地域上分布差异性较大. 在一些发达的国家, 例如澳大利亚、新西兰、欧洲、美国和英国, CRC发病率很高. 在非洲和亚洲国家则相对较低, 而日本最近报道CRC发生率急增, 并且在未来将继续保持增加的趋势[2]. 经过较长时间的跟踪研究, 在一些国家, 如韩国、新加坡和东欧, 该疾病的发生率正在与高风险国家相靠拢[3]. 流行病学的研究已表明CRC发病率与可改变的生活方式有密切的联系, 如体质量、饮食、体力活动、吸烟以及饮酒[4], 而这其间的关联性也表明对CRC预防是极有可能的, 30%-60%的病情可通过适当的营养和饮食预防[5].
膳食纤维在预防CRC发生中起到重要作用, 其功能已被流行性病学和动物实验研究的结果所证实. 然而, 研究结果存在着不一致性, 这可能受各研究模型群体数量及膳食纤维来源的影响. 最近, 欧洲癌症和营养前沿性研究显示虽然膳食纤维的摄入可减少CRC的风险高达30%, 但食物中其他成分的相互作用也至关重要[6], 例如膳食纤维主要来源于植物(如水果、蔬菜), 其同时还含有丰富的其他营养因子, 如β-胡萝卜素、番茄红素和多酚化合物. 膳食纤维为植物多糖, 在人体小肠不被消化吸收, 在大肠中会起到增加粪便体积的作用. 通过缩短粪液在肠道中停留时间(即增加肠道蠕动), 可减低肠道细胞与致癌物质及诱变剂的接触机率, 从而改善肠道环境. 大肠微生物和纤维多糖在大肠中的相互作用已成为维护结肠正常生理功的研究热点, 这是因为两者交互作用的结果会产生丰富的短链脂肪酸(short-chain fatty acid, SCFA), 主要为乙酸、丙酸和丁酸, 而SCFA的生产能力及三种酸的比例受膳食纤维的结构与来源调控, 如谷物纤维比水果蔬菜纤维的发酵更慢更不完全, 这是由于水果蔬菜中的可溶性纤维多糖含量较高(归因于其糖醛酸的成分较高), 与此相反, 谷物含有更多的阿拉伯木聚糖、葡聚糖和低聚糖. 不同结构的多糖在结肠中产丁酸的能力也大不相同, 在CRC高发病率国家的居民饮食中纤维的摄入主要来自谷物的非淀粉多糖(non-starch polysaccharides, NSP)以及相对少量的抗性淀粉(resistant starch, RS), 而在一些传统农业国家, NSP摄入量相对较低而RS摄入量增加[7], 这种饮食结构的不同可能会导致该病呈区域化分布, 这是因为RS的发酵比NSP更利于丁酸在大肠中合成. 丁酸是结肠细胞的重要能量来源, 其氧化至少提供60%的细胞能量需求, 并且在预防结肠癌中其比其他SCFA的关联性更高[8].
为此, 本文将从已发表的体内外模型研究结果, 探讨丁酸预防结肠癌的机制, 对丁酸在肠道中的代谢机制进行综述, 这对有效维持结肠正常功能, 预防CRC发生起到积极的作用.
SCFA在维持结肠黏膜的正常生理活动中起到了重要作用. 虽然乙酸在结肠中含量最丰富, 但丁酸的抗癌活性已得到证实. 在体外模型中, 丁酸可抑制CRC细胞的增殖, 诱导分化并使其凋亡, 其结果与体内试验吻合[9,10]. 在Caco2 CRC细胞株中, 丁酸抑制丙酮酸脱氢酶合成, 降低糖酵解能力, 并诱导转换丁酸氧化表型, 为丁酸抗性细胞群的发展提供一个潜在的解释. 这在大量组织中是丙酮酸脱氢酶的一个已确定的调控特征. 谷氨酰胺代谢的加快有利于脂肪酸合成的前驱体的产生, 对细胞增殖是必不可少的过程. 这进一步表明这种代谢转变的发生是丁酸对HDAC抑制造成的. 丁酸还抑制由于饮食因子所诱导的肠道细胞DNA在动物体内的损伤, 这可能是由于其具有提高基因稳定性的潜能. 动物实验表明过多红肉的摄入诱导了N-亚硝基化合物和DNA加合物的形成, 特别是O6-甲基-2'-脱氧鸟苷加合物[11]. 无法有效实施DNA修复机制或通过细胞凋亡去除这些加合物均会导致突变率的提高. 突变发生在致癌基因或者肿瘤抑制物基因上, 都会使发生CRC的风险大幅度地提高.
丁酸的作用对癌细胞具有高度选择性, 其调节大量细胞活动的能力有助于识别构成各个抗致癌成分的准确机制, 特别是诱导细胞凋亡的能力. 有关蛋白质组学和转录组学的研究有助于进一步了解丁酸诱导细胞凋亡的信号传输路径及参与丁酸抗性提升的机制[12-17]; 即一个癌细胞亚群是如何在丁酸丰富的环境下避免凋亡而形成肿瘤的[13,14,18]. 研究表明在高浓度丁酸环境下CRC细胞适应了丁酸的新陈代谢, 抗丁酸细胞具有生长优势, 潜在地形成更有侵略性的癌症[19,20]. 尽管丁酸在深层次对细胞和信号传输路径的调控机制仍不十分清楚, 但除了对HDAC抑制之外, 最近发现丁酸及其他SCFA与受体的亲和加强了丁酸诱导细胞凋亡进程.
相关丁酸促进肠癌细胞凋亡的机制的研究发现其可促使细胞质内细胞色素的快速释放以及半胱天冬酶级联反应的活化. 体外研究显示丁酸在>0.5 mmol/L时诱导CRC细胞凋亡, 据报道其可激活导致细胞凋亡的内在途径, 并通过外在途径增强癌细胞凋亡的敏感度[21]. 最近的研究发现, 丁酸可诱导自噬细胞的死亡[22-25]. 这些途径似乎被同时激活从而放大了细胞凋亡的应答. 也有丁酸处理的促凋亡与抗凋亡蛋白质表达失调的研究报道, 如属于Bcl-2蛋白家族[26,27]或者肿瘤坏死基因(tumor necrosis factor, TNF)受体[21,22].
尽管已证实上述的级联反应是通过丁酸激活的, 但诱发这些反应开始的原因仍难以确定. 在体外实验中, 丁酸(2-4 mmol/L)诱导细胞应激反应, 以基因的激活为特征, 比如属于生长停滞、DNA损伤诱导(growth arrest and DNA damage, GADD)族以及胞外信号调节激酶(mitogen-activated protein kinases, MAPK)信号传输路径的激活[28-30]. Scott等[28]发现在HCT116细胞中丁酸对MAPK的激活与生长抑制和DNA损伤诱导基因153(GADD153)的诱导相关联. 在RKO CRC细胞系中, 丁酸激活了JNK, 却不是MAPK信号传输路径的p38分支, 这与半胱天冬酶的激活和细胞凋亡有关[30]. Tong等[29]报道小鼠和人体肠道肿瘤表达的缺失, 借以进一步支持其在肠道肿瘤形成中的作用. 丁酸也被报道出其在HCT116 CRC细胞和MC27乳腺癌细胞中促进p38和其下游热休克靶蛋白质27的磷酸化[11,31]. 尽管丁酸的细胞凋亡作用对细胞系的依赖正在研究之中, 在不同情况下, MAPK信号传输的激活都发生在丁酸暴露的数分钟之内, 这表明细胞应激反应的诱导是丁酸诱导细胞凋亡的一个前期过程.
通过抑制HDAC活性调控相关基因的表达是丁酸诱导肠道细胞凋亡的首要机制. HDAC抑制剂(包括丁酸)将人体不到10%的基因组选择性地转录, 相关细胞通过调节包括转录因子、结构蛋白和参与信号传导的蛋白在内的组蛋白和非组蛋白的乙酰化作用来调节. 虽然人类对丁酸修饰非组蛋白的认知很有限, 已知Sp1和Sp3是转录因子, Sp1已被推测促进p21的表达, 并介导CRC细胞系p53-依赖性细胞周期的停滞[32], 但丁酸对Sp1和Sp3乙酰化作用的影响是未知的[32,33]. 丁酸对其他非组蛋白乙酰化的识别将会促进对丁酸作用机制的进一步认识.
体外模型一致性地显示在0.6-5 mmol/L的丁酸浓度下, 丁酸以p53-依赖性以及非依赖性两种方式诱导细胞周期阻滞和凋亡[34]. 在CRC细胞系中, 丁酸下调p53 mRNA和蛋白质的表达, 并加快p53靶基因的表达以诱导细胞周期阻滞. p53的激活和其对中心的移位被翻译后修饰调控, 其中包括组氨酸乙酰化转移酶的乙酰化作用如p300, 可提高其稳定性和p53促凋亡活性[35]. 通过HDAC抑制剂(如丁酸)使p53长期或短暂的高度乙酰化, 可能是p53依赖性凋亡的另外一个机制[36].
丁酸也会通过与抑制HDAC无关的其他基因表达调控mi-RNA的表达[37,38]. Mi-RNA是非编码蛋白, 尽管超过1000个人类的mi-RNA已被识别, 然而大量相关研究显示, 只有少数的mi-RNA, 如miR-31、miR-194/-215和miR-143/-145集群与结肠肿瘤相关联[39]. 体外试验表明, 与对照组细胞相比, 丁酸以CD133细胞表面表达为特征, 调控mi-RNA在HCT116细胞以及人体CRC干细胞中的表达[37,38]. 在基因转录的调控中建立mi-RNA的作用仍然是其初步阶段, 丁酸对mi-RNA表达的真正潜力, 或是其调控功能仍待阐明.
在患远端溃疡性结肠炎的患者中, 无论是SCFA混合物或者是丁酸单独的直肠投药均已表明可有效地改善该病的临床症状. 在肠上皮细胞中, 丁酸通过降低白介素8(interleukin-8, IL-8)的表达以及抑制可诱导的一氧化氮合酶的表达调节结肠炎症. 丁酸也缓解氧化应激, 防止CRC细胞和结肠黏膜细胞中DNA氧化损伤, 而与自由基清除关联的蛋白质表达及谷胱甘肽S-转移酶活性的提高的相关研究均进一步支持上述观点[14,40]. 此外, 4 mmol/L丁酸可有效抑制HT29细胞潜伏期中环氧合酶-2的表达和活性[41]. 然而, 丁酸在结肠癌细胞组织中的研究数据还缺乏高度一致性[42], 这可能受测试患者群体的数量、肿瘤组织的不均匀性以及临床参数的混杂性等因素影响.
NF-κB的激活是炎症相关癌变发展主要因子之一, 这其中包括CRC所产生的溃疡性结肠炎的慢性炎症. 尽管丁酸调控NF-κB的作用及其参与该过程的信号传送机制仍然未知, 研究已显示在大约40%的结肠癌肿瘤组织中NF-κB已处于激活状态[43]. 在肿瘤细胞中, NF-κB的激活提高了炎症因子调控的信号传送路线的炎症反应和调控抗凋亡基因的表达.
钠联溶质转送蛋白SLC5A8在许多不同癌症中为沉默表观遗传[44]. 此转运在结肠、肾、甲状腺被表达, 并识别一元羧酸, 包括丁酸. SLC5A8基因甲基化和他表达的附随损失被在59%的CRC腺瘤和肿瘤组中检测到[45]. SLC5A8在CRC中的沉默与突变体和非活动性腺瘤APC蛋白以及异常的Wnt信号相关[45]. 体外研究表明丁酸通过SLC5A8转运抑制HDAC活性以及肿瘤细胞的生长[45,46]. Thangaraju等[45]也报告出SLC5A8表达在CRC细胞系上的损失与细胞凋亡呈负相关, 细胞凋亡的发生是由于丁酸对HDAC活性的抑制以及对半胱天冬酶的激活.
在炎症和结肠癌中SCAF受体的参与是通过影响免疫细胞功能来增强免疫和抗炎症反应, 如趋化作用、吞噬作用、活性氧的产生以及细胞因子、趋化因子的释放等. 在激活的中性粒细胞中, 丁酸(1-6 mmol/L)可减少活性氧的产生和细胞活素的释放, 这在免疫细胞的迁移中起到重要的作用[47,48]. 最近的体内研究[49]发现, 双歧杆菌发酵产生的乙酸可以提高肠上皮细胞的免疫防御功能, 这些作用部分归因于对GPR的激活, 特别是GPR109A和GPR43. GPR40家族含有SCFA和中链脂肪酸受体, GPR41和GPR43对SCFA具有最高的亲和力, 特别是这些受体对SCFA显示了毫摩尔的亲和力, 并且这种浓度在结肠中是完全可达到的. 在葡聚糖硫酸钠诱导的慢性和急性肠炎小鼠模型中, 与野生型小鼠表达受体相比, GPR43表达的缺失, 导致严重的肠炎并损害黏膜的完整性[50-53]. 饮用水中添加醋酸可改善野生型小鼠的炎症指标而不是敲除GPR43的小鼠, 表明该受体[52]通过SCFA的激活在调节炎症反应中起到了一定的作用. 然而Sina等[53]认为, 在慢性葡聚糖硫酸钠小鼠肠炎模型中, GRP43表达缺失减少了结肠炎. 这种结果的差异性可能是由于在这两组实验中葡聚糖硫酸钠剂量以及处理时间的不同. 然而, 这两项研究均表明SCFA对GPR43[52]的刺激作用对免疫细胞功能是必不可少的, 并且这种趋化性反应是由MAPK介导的.
GPR43由于有肿瘤抑制作用, 其与CRC的预防有一定的关联[54]. 与正常的黏膜相比, GRP43表达缺失发生在结肠腺瘤组织上, 在结肠增生和良性结肠疾病如息肉等组织上检测到表达缺失减少[54]. 在9个CRC细胞系中, Tang等[54]确定GPR43仅在HT29CRC细胞系上被表达, 他们也发现在CRC细胞株中, 此受体的再表达和丁酸的激活抑制了增殖, 进一步支持GPR43在维持正常细胞功能上的作用. 研究也发现丙酸与丁酸具有相类似的生理功能, 但前者所需的浓度更高. MCF7乳腺癌细胞系也可表达GPR43, 每个SCFA对其的激活诱导细胞应激反应都通过p38MAPK信号介导[31]. 这些数据表明GPR43在激活丁酸抗肿瘤作用相关的信号传输途径上起着举足轻重的作用. 尽管如此, GPR43-介导的细胞信号活动在正常结肠、结肠炎和CRC的发展中仍需进一步确定.
GPR109A最初被确定为烟酸的受体[55-57], 属于GPR81和GPR109B的亚科受体. 虽然GPR109A和GPR109B结构类似, 并有着类似的表达模式, 他们的区别在于他们的配体特异性. GPR109A由烟酸、3-羟基丁酸酯和丁酸激活, 而GPR109B都显示出与他们较低的亲和力. 丁酸结合并激活GPR109A受体, 但是对GPR109B没有影响, 同时GPR109B受体也没有显示出对乙酸和丙酸的亲和力. GPR109A在人类结肠中被表达, 而在CRC中的表达失调. 这种表达方式在CRC小鼠模型和人体CRC细胞系上获得验证. GPR109A在CRC上的沉默是由于DNA甲基化的结果, 通过GPR109A在CRC细胞系上的再表达以及丁酸对其的激活可消除了NF-κB的活性并诱导了细胞凋亡. 细胞凋亡的发生与HDAC的抑制可独自发生, 这进一步显示存在着丁酸诱导凋亡的另外一种机制.
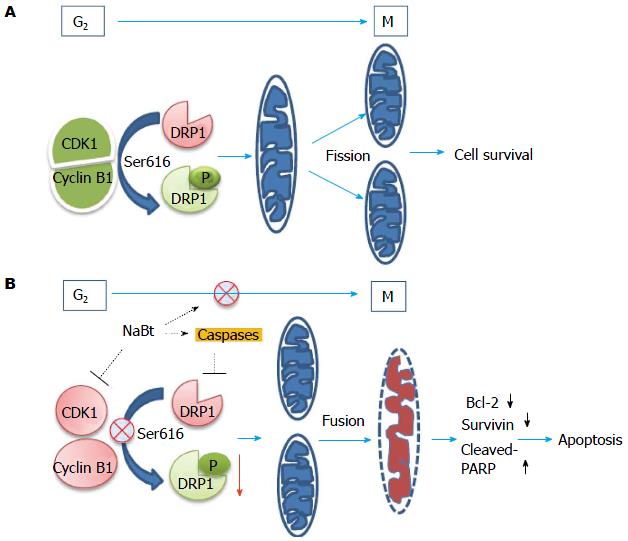
Tailor等[1]最近以一定浓度的丁酸诱导人体结肠癌细胞HCT116细胞和SW480细胞的G2-M阶段细胞分裂循环阻滞, 发现细胞周期阻滞和线粒体介导的细胞凋亡降低生长素和Bcl-2B细胞淋巴瘤的表达, 细胞周期蛋白B1-CDK1由ser616磷酸化合成, 并激活线粒体分离蛋白(dynamin-related protein 1, DRP1). 丁酸减少p-DRP1, 并降低细胞周期蛋白B1-CDK1的合成. DRP1作为泛-半胱天冬酶抑制剂, 受细胞凋亡的调控, 丁酸诱导的凋亡使DRP1反转到正常水平, 从而控制细胞增殖. 表明丁酸通过调控DRP1水平调节线粒体分裂和融合, 并诱导人体结肠癌细胞循环阻滞和细胞凋亡. 丁酸诱导结肠癌细胞凋亡的可能机制表达如下(图1)[1].
HDAC抑制剂作为化疗剂正在研究之中, 如在国际上辛二酰苯胺异羟肟酸最近被批准用于治疗皮肤T细胞淋巴瘤. 不同癌细胞系用来确定是否采用DNA甲基酶抑制剂和HDAC抑制剂的联合治疗以恢复关键肿瘤抑制基因. 这类研究的主要目的是确定联合治疗方案对癌症治疗的潜在功效. 丁酸本身不能作为口服或注射药剂用于肠道病变的治疗, 这是由于其摄入后进入身体内参与不同类型的细胞代谢, 从而缩短其半衰期. 为了克服这些局限性, 许多研究探讨了丁酸衍生物的潜能, 并发现4-苯基丁酸乙酯和三丁酸甘油酯将最有前途[58-61]. 有关体外实验对丁酸结构类似物的研究表明丁酸对细胞凋亡的特性取决于羧酸骨架上2位和3位替代的缺乏[62,63]. 此外, 这些研究证实4-苯酰丁酸和4-苯丁酸类似化合物可能最为有效, 表明庞大基团和羧基基团之间的三原子空间是丁酸药物的抗肿瘤特性必不可少的特定结构. 虽然在体外实验中还没发现比丁酸更有效的类似物, 但他们为新治疗药物的开发提供了一个出发点.
结肠癌已成为世界上最普遍的癌症之一, 占致死性癌症的第4位, 是常见的发生于结肠部位的消化道恶性肿瘤部位的消化系恶性肿瘤. 现阶段对于结肠癌的治疗, 只限于手术治疗, 化疗为辅, 而手术及化疗的费用较高. 因此, 通过摄入膳食纤维, 肠道微生物与膳食纤维成分作用, 产生的丁酸, 对抑制结肠癌的发展有广阔前景.
肖秀英, 副主任医师, 上海交通大学医学院附属仁济医院
一些结肠肿瘤是可以预防的, 膳食纤维与抗性淀粉的摄入可有效增加肠道内短链脂肪酸的浓度, 特别是丁酸可减缓结肠癌的发展, 去乙酰化酶(histone deacetylase)抑制剂的作用机制是丁酸抗癌的主要机制, 其作为化疗剂正在研究中, 丁酸将成为新型, 更加有效治疗药物.
本文集中了阐述了丁酸诱导结肠癌细胞凋亡的机制, 以及丁酸对肿瘤产生过程中的调控作用, 另外说明了NF-κB对炎症相关癌症发展的影响, SLC5A8转运蛋白对炎症和结肠癌细胞的作用.
结肠癌的致死率较高, 通过摄入膳食纤维, 在肠道中产生丁酸或使用丁酸衍生物进行治疗, 对抑制结肠癌细胞的发展有很大帮助.
本文对丁酸抗结肠癌的研究具有一定的指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Tailor D, Hahm ER, Kale RK, Singh SV, Singh RP. Sodium butyrate induces DRP1-mediated mitochondrial fusion and apoptosis in human colorectal cancer cells. Mitochondrion. 2014;16:55-64. [PubMed] [DOI] |
| 2. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] |
| 3. | Wong MT, Eu KW. Rise of colorectal cancer in Singapore: an epidemiological review. ANZ J Surg. 2007;77:446-449. [PubMed] |
| 4. | Haggar FA, Boushey RP. Colorectal cancer epidemiology: incidence, mortality, survival, and risk factors. Clin Colon Rectal Surg. 2009;22:191-197. [PubMed] [DOI] |
| 5. | Platz EA, Willett WC, Colditz GA, Rimm EB, Spiegelman D, Giovannucci E. Proportion of colon cancer risk that might be preventable in a cohort of middle-aged US men. Cancer Causes Control. 2000;11:579-588. [PubMed] |
| 6. | Bingham SA, Day NE, Luben R, Ferrari P, Slimani N, Norat T, Clavel-Chapelon F, Kesse E, Nieters A, Boeing H. Dietary fibre in food and protection against colorectal cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC): an observational study. Lancet. 2003;361:1496-1501. [PubMed] |
| 7. | Ahmed R, Segal I, Hassan H. Fermentation of dietary starch in humans. Am J Gastroenterol. 2000;95:1017-1020. [PubMed] |
| 8. | Perrin P, Pierre F, Patry Y, Champ M, Berreur M, Pradal G, Bornet F, Meflah K, Menanteau J. Only fibres promoting a stable butyrate producing colonic ecosystem decrease the rate of aberrant crypt foci in rats. Gut. 2001;48:53-61. [PubMed] |
| 9. | Clarke JM, Topping DL, Bird AR, Young GP, Cobiac L. Effects of high-amylose maize starch and butyrylated high-amylose maize starch on azoxymethane-induced intestinal cancer in rats. Carcinogenesis. 2008;29:2190-2194. [PubMed] [DOI] |
| 10. | Le Leu RK, Hu Y, Brown IL, Young GP. Effect of high amylose maize starches on colonic fermentation and apoptotic response to DNA-damage in the colon of rats. Nutr Metab (Lond). 2009;6:11. [PubMed] [DOI] |
| 11. | Lewin MH, Bailey N, Bandaletova T, Bowman R, Cross AJ, Pollock J, Shuker DE, Bingham SA. Red meat enhances the colonic formation of the DNA adduct O6-carboxymethyl guanine: implications for colorectal cancer risk. Cancer Res. 2006;66:1859-1865. [PubMed] |
| 12. | Daly K, Shirazi-Beechey SP. Microarray analysis of butyrate regulated genes in colonic epithelial cells. DNA Cell Biol. 2006;25:49-62. [PubMed] |
| 13. | Fung KY, Brierley GV, Henderson S, Hoffmann P, McColl SR, Lockett T, Head R, Cosgrove L. Butyrate-induced apoptosis in HCT116 colorectal cancer cells includes induction of a cell stress response. J Proteome Res. 2011;10:1860-1869. [PubMed] [DOI] |
| 14. | Fung KY, Lewanowitsch T, Henderson ST, Priebe I, Hoffmann P, McColl SR, Lockett T, Head R, Cosgrove LJ. Proteomic analysis of butyrate effects and loss of butyrate sensitivity in HT29 colorectal cancer cells. J Proteome Res. 2009;8:1220-1227. [PubMed] [DOI] |
| 15. | Iacomino G, Tecce MF, Grimaldi C, Tosto M, Russo GL. Transcriptional response of a human colon adenocarcinoma cell line to sodium butyrate. Biochem Biophys Res Commun. 2001;285:1280-1289. [PubMed] |
| 16. | Tan HT, Tan S, Lin Q, Lim TK, Hew CL, Chung MC. Quantitative and temporal proteome analysis of butyrate-treated colorectal cancer cells. Mol Cell Proteomics. 2008;7:1174-1185. [PubMed] [DOI] |
| 17. | Tan S, Seow TK, Liang RC, Koh S, Lee CP, Chung MC, Hooi SC. Proteome analysis of butyrate-treated human colon cancer cells (HT-29). Int J Cancer. 2002;98:523-531. [PubMed] |
| 18. | Olmo N, Turnay J, Pérez-Ramos P, Lecona E, Barrasa JI, López de Silanes I, Lizarbe MA. In vitro models for the study of the effect of butyrate on human colon adenocarcinoma cells. Toxicol In Vitro. 2007;21:262-270. [PubMed] |
| 19. | López de Silanes I, Olmo N, Turnay J, González de Buitrago G, Pérez-Ramos P, Guzmán-Aránguez A, García-Díez M, Lecona E, Gorospe M, Lizarbe MA. Acquisition of resistance to butyrate enhances survival after stress and induces malignancy of human colon carcinoma cells. Cancer Res. 2004;64:4593-4600. [PubMed] |
| 20. | Serpa J, Caiado F, Carvalho T, Torre C, Gonçalves LG, Casalou C, Lamosa P, Rodrigues M, Zhu Z, Lam EW. Butyrate-rich colonic microenvironment is a relevant selection factor for metabolically adapted tumor cells. J Biol Chem. 2010;285:39211-39223. [PubMed] [DOI] |
| 21. | Kim YH, Park JW, Lee JY, Kwon TK. Sodium butyrate sensitizes TRAIL-mediated apoptosis by induction of transcription from the DR5 gene promoter through Sp1 sites in colon cancer cells. Carcinogenesis. 2004;25:1813-1820. [PubMed] |
| 22. | Pajak B, Gajkowska B, Orzechowski A. Sodium butyrate sensitizes human colon adenocarcinoma COLO 205 cells to both intrinsic and TNF-alpha-dependent extrinsic apoptosis. Apoptosis. 2009;14:203-217. [PubMed] [DOI] |
| 23. | Shao Y, Gao Z, Marks PA, Jiang X. Apoptotic and autophagic cell death induced by histone deacetylase inhibitors. Proc Natl Acad Sci U S A. 2004;101:18030-18035. [PubMed] |
| 24. | Tang Y, Chen Y, Jiang H, Nie D. The role of short-chain fatty acids in orchestrating two types of programmed cell death in colon cancer. Autophagy. 2011;7:235-237. [PubMed] |
| 25. | Wang L, Luo HS, Xia H. Sodium butyrate induces human colon carcinoma HT-29 cell apoptosis through a mitochondrial pathway. J Int Med Res. 2009;37:803-811. [PubMed] |
| 26. | Avivi-Green C, Polak-Charcon S, Madar Z, Schwartz B. Different molecular events account for butyrate-induced apoptosis in two human colon cancer cell lines. J Nutr. 2002;132:1812-1818. [PubMed] |
| 27. | Ruemmele FM, Dionne S, Qureshi I, Sarma DS, Levy E, Seidman EG. Butyrate mediates Caco-2 cell apoptosis via up-regulation of pro-apoptotic BAK and inducing caspase-3 mediated cleavage of poly-(ADP-ribose) polymerase (PARP). Cell Death Differ. 1999;6:729-735. [PubMed] |
| 28. | Scott DW, Longpre JM, Loo G. Upregulation of GADD153 by butyrate: involvement of MAPK. DNA Cell Biol. 2008;27:607-614. [PubMed] [DOI] |
| 29. | Tong C, Yin Z, Song Z, Dockendorff A, Huang C, Mariadason J, Flavell RA, Davis RJ, Augenlicht LH, Yang W. c-Jun NH2-terminal kinase 1 plays a critical role in intestinal homeostasis and tumor suppression. Am J Pathol. 2007;171:297-303. [PubMed] |
| 30. | Zhang Y, Zhou L, Bao YL, Wu Y, Yu CL, Huang YX, Sun Y, Zheng LH, Li YX. Butyrate induces cell apoptosis through activation of JNK MAP kinase pathway in human colon cancer RKO cells. Chem Biol Interact. 2010;185:174-181. [PubMed] [DOI] |
| 31. | Yonezawa T, Kobayashi Y, Obara Y. Short-chain fatty acids induce acute phosphorylation of the p38 mitogen-activated protein kinase/heat shock protein 27 pathway via GPR43 in the MCF-7 human breast cancer cell line. Cell Signal. 2007;19:185-193. [PubMed] |
| 32. | Waby JS, Chirakkal H, Yu C, Griffiths GJ, Benson RS, Bingle CD, Corfe BM. Sp1 acetylation is associated with loss of DNA binding at promoters associated with cell cycle arrest and cell death in a colon cell line. Mol Cancer. 2010;9:275. [PubMed] [DOI] |
| 33. | White NR, Mulligan P, King PJ, Sanderson IR. Sodium butyrate-mediated Sp3 acetylation represses human insulin-like growth factor binding protein-3 expression in intestinal epithelial cells. J Pediatr Gastroenterol Nutr. 2006;42:134-141. [PubMed] |
| 34. | Janson W, Brandner G, Siegel J. Butyrate modulates DNA-damage-induced p53 response by induction of p53-independent differentiation and apoptosis. Oncogene. 1997;15:1395-1406. [PubMed] |
| 35. | Yuan ZM, Huang Y, Ishiko T, Nakada S, Utsugisawa T, Shioya H, Utsugisawa Y, Yokoyama K, Weichselbaum R, Shi Y. Role for p300 in stabilization of p53 in the response to DNA damage. J Biol Chem. 1999;274:1883-1886. [PubMed] |
| 36. | Terui T, Murakami K, Takimoto R, Takahashi M, Takada K, Murakami T, Minami S, Matsunaga T, Takayama T, Kato J. Induction of PIG3 and NOXA through acetylation of p53 at 320 and 373 lysine residues as a mechanism for apoptotic cell death by histone deacetylase inhibitors. Cancer Res. 2003;63:8948-8954. [PubMed] |
| 37. | Hu S, Dong TS, Dalal SR, Wu F, Bissonnette M, Kwon JH, Chang EB. The microbe-derived short chain fatty acid butyrate targets miRNA-dependent p21 gene expression in human colon cancer. PLoS One. 2011;6:e16221. [PubMed] [DOI] |
| 38. | Zhang H, Li W, Nan F, Ren F, Wang H, Xu Y, Zhang F. MicroRNA expression profile of colon cancer stem-like cells in HT29 adenocarcinoma cell line. Biochem Biophys Res Commun. 2011;404:273-278. [PubMed] [DOI] |
| 39. | Necela BM, Carr JM, Asmann YW, Thompson EA. Differential expression of microRNAs in tumors from chronically inflamed or genetic (APC(Min/+)) models of colon cancer. PLoS One. 2011;6:e18501. [PubMed] [DOI] |
| 40. | Ebert MN, Klinder A, Peters WH, Schäferhenrich A, Sendt W, Scheele J, Pool-Zobel BL. Expression of glutathione S-transferases (GSTs) in human colon cells and inducibility of GSTM2 by butyrate. Carcinogenesis. 2003;24:1637-1644. [PubMed] |
| 41. | Tong X, Yin L, Giardina C. Butyrate suppresses Cox-2 activation in colon cancer cells through HDAC inhibition. Biochem Biophys Res Commun. 2004;317:463-471. [PubMed] |
| 42. | Jahns F, Wilhelm A, Jablonowski N, Mothes H, Radeva M, Wölfert A, Greulich KO, Glei M. Butyrate suppresses mRNA increase of osteopontin and cyclooxygenase-2 in human colon tumor tissue. Carcinogenesis. 2011;32:913-920. [PubMed] [DOI] |
| 43. | Sakamoto K, Maeda S, Hikiba Y, Nakagawa H, Hayakawa Y, Shibata W, Yanai A, Ogura K, Omata M. Constitutive NF-kappaB activation in colorectal carcinoma plays a key role in angiogenesis, promoting tumor growth. Clin Cancer Res. 2009;15:2248-2258. [PubMed] [DOI] |
| 44. | Li H, Myeroff L, Smiraglia D, Romero MF, Pretlow TP, Kasturi L, Lutterbaugh J, Rerko RM, Casey G, Issa JP. SLC5A8, a sodium transporter, is a tumor suppressor gene silenced by methylation in human colon aberrant crypt foci and cancers. Proc Natl Acad Sci U S A. 2003;100:8412-8417. [PubMed] |
| 45. | Thangaraju M, Cresci G, Itagaki S, Mellinger J, Browning DD, Berger FG, Prasad PD, Ganapathy V. Sodium-coupled transport of the short chain fatty acid butyrate by SLC5A8 and its relevance to colon cancer. J Gastrointest Surg. 2008;12:1773-1781; discussion 1773-1781. [PubMed] [DOI] |
| 46. | Thangaraju M, Gopal E, Martin PM, Ananth S, Smith SB, Prasad PD, Sterneck E, Ganapathy V. SLC5A8 triggers tumor cell apoptosis through pyruvate-dependent inhibition of histone deacetylases. Cancer Res. 2006;66:11560-11564. [PubMed] |
| 47. | Bailón E, Cueto-Sola M, Utrilla P, Rodríguez-Cabezas ME, Garrido-Mesa N, Zarzuelo A, Xaus J, Gálvez J, Comalada M. Butyrate in vitro immune-modulatory effects might be mediated through a proliferation-related induction of apoptosis. Immunobiology. 2010;215:863-873. [PubMed] [DOI] |
| 48. | Vinolo MA, Rodrigues HG, Hatanaka E, Hebeda CB, Farsky SH, Curi R. Short-chain fatty acids stimulate the migration of neutrophils to inflammatory sites. Clin Sci (Lond). 2009;117:331-338. [PubMed] [DOI] |
| 49. | Fukuda S, Toh H, Hase K, Oshima K, Nakanishi Y, Yoshimura K, Tobe T, Clarke JM, Topping DL, Suzuki T. Bifidobacteria can protect from enteropathogenic infection through production of acetate. Nature. 2011;469:543-547. [PubMed] [DOI] |
| 50. | Le Poul E, Loison C, Struyf S, Springael JY, Lannoy V, Decobecq ME, Brezillon S, Dupriez V, Vassart G, Van Damme J. Functional characterization of human receptors for short chain fatty acids and their role in polymorphonuclear cell activation. J Biol Chem. 2003;278:25481-25489. [PubMed] |
| 51. | Aoyama M, Kotani J, Usami M. Butyrate and propionate induced activated or non-activated neutrophil apoptosis via HDAC inhibitor activity but without activating GPR-41/GPR-43 pathways. Nutrition. 2010;26:653-661. [PubMed] [DOI] |
| 52. | Maslowski KM, Vieira AT, Ng A, Kranich J, Sierro F, Yu D, Schilter HC, Rolph MS, Mackay F, Artis D. Regulation of inflammatory responses by gut microbiota and chemoattractant receptor GPR43. Nature. 2009;461:1282-1286. [PubMed] [DOI] |
| 53. | Sina C, Gavrilova O, Förster M, Till A, Derer S, Hildebrand F, Raabe B, Chalaris A, Scheller J, Rehmann A. G protein-coupled receptor 43 is essential for neutrophil recruitment during intestinal inflammation. J Immunol. 2009;183:7514-7522. [PubMed] [DOI] |
| 54. | Tang Y, Chen Y, Jiang H, Robbins GT, Nie D. G-protein-coupled receptor for short-chain fatty acids suppresses colon cancer. Int J Cancer. 2011;128:847-856. [PubMed] [DOI] |
| 55. | Soga T, Kamohara M, Takasaki J, Matsumoto S, Saito T, Ohishi T, Hiyama H, Matsuo A, Matsushime H, Furuichi K. Molecular identification of nicotinic acid receptor. B. iochem Biophys Res Commun. 2003;303:364-369. [PubMed] |
| 56. | Tunaru S, Kero J, Schaub A, Wufka C, Blaukat A, Pfeffer K, Offermanns S. PUMA-G and HM74 are receptors for nicotinic acid and mediate its anti-lipolytic effect. Nat Med. 2003;9:352-355. [PubMed] |
| 57. | Wise A, Foord SM, Fraser NJ, Barnes AA, Elshourbagy N, Eilert M, Ignar DM, Murdock PR, Steplewski K, Green A. Molecular identification of high and low affinity receptors for nicotinic acid. J Biol Chem. 2003;278:9869-9874. [PubMed] |
| 58. | Kang SN, Lee E, Lee MK, Lim SJ. Preparation and evaluation of tributyrin emulsion as a potent anti-cancer agent against melanoma. Drug Deliv. 2011;18:143-149. [PubMed] [DOI] |
| 59. | Kuroiwa-Trzmielina J, de Conti A, Scolastici C, Pereira D, Horst MA, Purgatto E, Ong TP, Moreno FS. Chemoprevention of rat hepatocarcinogenesis with histone deacetylase inhibitors: efficacy of tributyrin, a butyric acid prodrug. Int J Cancer. 2009;124:2520-2527. [PubMed] [DOI] |
| 60. | Li Y, Le Maux S, Xiao H, McClements DJ. Emulsion-based delivery systems for tributyrin, a potential colon cancer preventative agent. J Agric Food Chem. 2009;57:9243-9249. [PubMed] [DOI] |
| 61. | Miyoshi M, Sakaki H, Usami M, Iizuka N, Shuno K, Aoyama M, Usami Y. Oral administration of tributyrin increases concentration of butyrate in the portal vein and prevents lipopolysaccharide-induced liver injury in rats. Clin Nutr. 2011;30:252-258. [PubMed] [DOI] |
| 62. | Ooi CC, Good NM, Williams DB, Lewanowitsch T, Cosgrove LJ, Lockett TJ, Head RJ. Structure-activity relationship of butyrate analogues on apoptosis, proliferation and histone deacetylase activity in HCT-116 human colorectal cancer cells. Clin Exp Pharmacol Physiol. 2010;37:905-911. [PubMed] [DOI] |
| 63. | Ooi CC, Good NM, Williams DB, Lewanowitsch T, Cosgrove LJ, Lockett TJ, Head RJ. Efficacy of butyrate analogues in HT-29 cancer cells. Clin Exp Pharmacol Physiol. 2010;37:482-489. [PubMed] [DOI] |