修回日期: 2014-04-06
接受日期: 2014-04-20
在线出版日期: 2014-06-18
目的: 探讨microRNA570(miR-570)对人结肠癌细胞株HT-29生物学特性的影响, 并阐明其对Wnt/β-catenin通路的影响机制.
方法: 将miR-570 mimics转染人结肠癌细胞株HT-29后, 采用cell counting(CCK-8)法检测细胞增殖变化, 应用实时定量PCR技术检测转染后HT-29细胞中miR-570的表达, Western blot技术及实时定量PCR技术检测各组中胞核及胞浆内β-catenin的变化, 及对Wnt/β-catenin通路下游基因c-myc、cyclinD1和survivin表达的影响.
结果: HT-29细胞转染miR-570 mimics后, HT-29细胞增殖能力下降, 72 h细胞增殖抑制率最为明显, 约为53.23%±1.22%(P<0.05). 实时定量PCR结果显示miR-570表达上调20倍(20.01±0.32)(P<0.05). Western blot技术及实时定量PCR技术检测显示, β-catenin、c-myc、cyclinD1和survivin蛋白表达和mRNA表达均下降(P<0.05), 而空白对照组与阴性对照差异无统计学意义. Western blot结果进一步证实胞核内β-catenin的蛋白表达量下降明显, 而胞浆内, β-catenin的蛋白表达量无明显变化.
结论: miR-570能明显抑制人结肠癌细胞株HT-29的增殖, 并下调Wnt相关基因的表达, 其可能作为抑癌基因参与Wnt/β-catenin信号通路的调节.
核心提示: 结肠癌是危害人类健康的重大疾病之一, 在世界范围内是位居前列的常见肿瘤. Wnt/β-catenin信号通路的激活对结肠癌的发生、发展起重要作用. 而miR-570与Wnt/β-catenin信号通路的相关性文献鲜有报道. 本研究探讨上调miR-570后在结肠癌细胞株中的作用及其作用机制, 分析针对miR-570的靶向治疗对结肠癌的治疗价值.
引文著录: 叶玉兰, 周春立, 庞智, 郑家驹. MicroRNA570通过Wnt/β-catenin通路抑制人结肠癌HT-29细胞的增殖及调控机制. 世界华人消化杂志 2014; 22(17): 2439-2444
Revised: April 6, 2014
Accepted: April 20, 2014
Published online: June 18, 2014
AIM: To investigate the effect of microRNA570 (miR-570) on the proliferation and biological properties of HT-29 cells and the possible mechanisms involved.
METHODS: An miR-570 mimic was transfected into human colon cancer HT-29 cells. Cell proliferation was studied by cell counting kit-8 assay (CCK-8). Total miRNA was extracted and the relative expression of miR-570 was quantified by real-time quantitative PCR. Western blot and real-time quantitative PCR were performed to analyze the expression of β-catenin in the cytoplasm and nucleus. The expression of c-myc, cyclinD1 and survivin was also detected by real-time quantitative PCR and Western blot.
RESULTS: After transfection with the miR-570 mimic, the proliferation ability of HT-29 cells decreased. The inhibitory effect was most significant at 72 h (53.23% ± 1.22%) (P < 0.05). The expression of miR-570 was up-regulated more than 20 times (20.01 ± 0.32) (P < 0.05). The mRNA and protein expression of β-catenin, c-myc, cyclinD1 and survivin was decreased in the miR-570 mimic group, compared with blank and negative control groups. Western blot results further confirmed that the protein expression of β-catenin in the nucleus decreased significantly, although its expression in the cytoplasm did not change significantly.
CONCLUSION: MiR-570 significantly inhibits the proliferation of HT-29 cells possibly by regulation of the Wnt/β-catenin signal pathway.
- Citation: Ye YL, Zhou CL, Pang Z, Zheng JJ. MicroRNA570 inhibits human colon cancer HT-29 cell proliferation via Wnt/β-catenin pathway. Shijie Huaren Xiaohua Zazhi 2014; 22(17): 2439-2444
- URL: https://www.wjgnet.com/1009-3079/full/v22/i17/2439.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i17.2439
结肠癌是消化系常见的恶性肿瘤之一, Wnt信号通路的激活对结肠癌的发生、发展起重要作用[1]. Wnt信号通路分为"经典Wnt信号通路"及"非经典Wnt信号通路", 其中非经典Wnt信号通路是研究最深入的一支, 又称为Wnt/β-catenin信号通路. 研究表明, 90%以上人类结肠癌存在Wnt/β-catenin信号通路的激活即细胞内β-catenin的积聚[2]. MicroRNA(miRNA)是一类长约21-25个核苷酸的小分子非编码RNA, 通过与靶RNA的3端非翻译区互补结合以降解靶RNA或阻遏其转录和翻译, 由此参与基因的转录后调控[3]. 有研究显示Wnt通路受到多种基因的共同调节, 并已发现部分miRNA作为癌基因或抑癌基因调节Wnt信号通路的活性.
我们的前期研究结果显示, 塞来昔布干预结肠癌细胞株HT-29后, 芯片筛选得到差异表达的miRNAs 28种[4]. 采用文献报道的靶基因与三个靶基因预测软件(miRNAs、RNAHybrid和Targetscan)预测差异表达miRNAs可能作用的靶基因; 并采用Enrichment分析和GenGO Pathway分析探讨了靶基因参与的特异性通路分类, 从而构建了靶基因与其调控miRNAs之间的通路关系. 我们的结果进一步显示, miR570参与的通路中可能性最大的为Wnt/β-catenin信号通路, 其可能的靶基因为CTNNB1(β-catenin)等. 本实验通过将miR-570 mimics瞬时转染人结肠癌HT-29细胞中, 分析结肠癌细胞的增殖活力、miR-570的表达及对Wnt信号通路下游靶基因的影响, 以此探讨miR-570对结肠癌细胞的作用机制.
DMEM细胞培养基、OPTI-MEM细胞转染培养基和胎牛血清购自Gibco; 细胞转染试剂LipofectamineTM 2000、RNA抽提裂解液TRIzol和SYBR Green实时荧光定量PCR试剂盒均购自Invitrogen公司; β-catenin、c-myc、cyclinD1、survivin、miR-570和内参照的引物由上海吉码公司合成; 多克隆抗体购自CST公司; Western blot相关试剂、全细胞蛋白提取试剂盒、BCA法测蛋白浓度试剂盒、CCK-8试剂盒均购自上海碧云天生物公司; 人结肠癌HT-29细胞(购自苏州大学细胞生物学实验室)采用DMEM培养基和10%FBS培养.
1.2.1 细胞培养: 人结肠癌细胞HT-29在含10%胎牛血清的DMEM培养基中, 于37 ℃、5%的CO2条件下培养, 每两天换液1次, 3-4 d传代1次. 细胞融合至80%时进行转染.
1.2.2 细胞转染: miR-570 mimics和阴性对照组(NC)序列由上海吉码公司设计并合成. 实验分为3组: (1)空白对照组(BC组): 给予常规培养液; (2)阴性对照组(NC组): 细胞转染随机合成的miR-570 mimics NC片段; (3)实验组(mimics组): 细胞转染miR-570 mimics组. miR-570 mimics序列为: 正义链: 5'-UAGCACCAUUUGAAAUCAGUGUU-3', 反义链: 5'-CACUGAUUUCAAAUGGUGCUAUU-3'. miR-570 mimics阴性对照为随机合成, 正义链: 5'-UUCUCCGAACGUGUCACGUTT-3', 反义链: 5'-ACGUGACACGUUCGGAGAATT-3'. 具体方法参见Lipofectamine 2000操作手册. 取对数生长的细胞接种于六孔板, 细胞生长至占培养孔80%-85%时进行转染. 制备miRNA/LipofectamineTM 2000复合物如下: 稀释10 μL LipofectamineTM 2000至100 μL无血清培养液OPTI-MEM中; 同时用100 μL无血清培养液OPTI-MEM稀释miR-570 mimics和阴性对照; 将两种混合物轻轻混合均匀, 室温放置20 min后即得到miRNA/LipofectamineTM 2000复合物. 将miRNA/LipofectamineTM 2000复合物轻滴入6孔培养板中, 37 ℃培养箱培育18-24 h后, 每孔加入1800 μL含10%胎牛血清的RPMI 1640培养液培养细胞, 转染48 h后, 倒置荧光显微镜观察转染率, 转染率为80%, 取细胞进行实验.
1.2.3 细胞增殖抑制实验(CCK-8实验): 取对数生长的细胞按每孔1×104个细胞接种于96孔板, 每组细胞设3个平行孔. 培养24 h后进行转染, 转染后24、48、72 h, 加入浓度为10 μL的细胞计数试剂盒8(cell counting kit-8 assay, CCK-8)溶液, 酶标仪测定各孔450 nm处的吸光度(A)值. 细胞增殖抑制率 = 1-(实验组A值-空白组A值)/(对照组平均A值-空白组A值)×100%. 实验重复3次.
1.2.4 Real-time PCR检测miR-570的表达量: miR-570 TRIzol一步法提取转染率达80%细胞总RNA, 分光光度计测定总RNA的纯度, 甲醛变性凝胶电泳质检总RNA的质量. 应用miScript Reverse Transcription反转录试剂盒将其反转录为cDNA, 反应条件: 37 ℃ 1 h, 95 ℃ 5 min. 以cDNA为模板, 应用miScript SYBR Green PCR试剂盒进行实时荧光定量PCR, 以U6为内参照, 各个miRNA和U6 snRNA的特异性引物根据miRNA的序列(http://microrna.sanger.ac.uk/)及U6 snRNA序列应用Primer Express software v2.0进行设计, 引物序列为分别为U6: TTCGTGAAGCGTTCCATATTT, miRNA570: TCTCCTCTGCTGGTCTCATAC, 实时荧光定量PCR检测在7300定量PCR仪上进行. PCR反应条件: 95 ℃预热20 min 94 ℃ 10 s、60 ℃ 20 s、70 ℃ 10 s, 共40个循环. 以2-∆∆Ct表示每个miRNA的相对表达量, ∆Ct = CtmiRNA-CtU6. 实验重复3次.
1.2.5 Real-time PCR检测β-catenin, c-myc, cyclinD1, survivin mRNA表达量: 以cDNA为模板, 实时荧光定量PCR检测在7300定量PCR仪上进行, 采用管家基因GAPDH为内参照. 引物序列如下: β-catenin的上游引物为5'-GCCAGTGGATTCCGTACTGT-3', 下游引物为5'-GAGCTTGCTTTCCTGATTGC-3'; c-myc上游引物为5'-ATCACAGCCCTCACTCAC-3', 下游引物为5'-ACAGATTCCACAAGGTGC-3'; cyclinD1上游引物为5'-CCGTCCATGCGGAAGATC-3', 下游引物为5'-ATGGCCAGCGGGAAGAC-3'; survivin的上游引物为5'-TCAGTGGGGCAGTGGATG-3', 下游引物为5'-CCTGGCAGCCTTTCTCA-3'; PCR反应条件: 95 ℃预热20 min, 95 ℃ 15 s, 60 ℃ 60 s, 72 ℃ 15 s, 共40个循环. 实验重复3次.
1.2.6 免疫印迹实验(Western blot)检测β-catenin、c-myc、cyclinD1、survivin蛋白表达水平: 胞浆蛋白及胞核蛋白提取如下: 取培养细胞5×106-1×107个/mL, 离心, 收集细胞, 弃上清, 估计细胞压积(PCV), 每20 μL细胞压积中加入200 μL BufferA, 涡旋震荡, 冰浴, 加入11 μL BufferB, 继续震荡、冰浴, 离心(16000 g, 5 min), 收集上清即为胞浆蛋白. 在离心沉淀物中加入BufferC, 震荡、冰浴、离心, 再次取得上清即为核蛋(具体按照试剂盒说明书操作). 常规法提取细胞总蛋白. BCA法测定蛋白浓度. 样本加入10%SDS-PAGE电泳分离, 电转至纤维素膜上. 一抗浓度(b-catenin 1:1000, c-myc 1:1500, cyclinD1 1:2000, survivin 1:2000)室温孵育过夜, 洗膜3次. 二抗浓度为1:10000, 室温孵育2 h, 洗膜. 以β-actin为内参照. 实验重复3次.
统计学处理 数据应用SPSS12.0软件进行统计学分析, 计算数据以mean±SD表示, 两样本均属间比较采用独立分组t检验. 多组之间数据分析采用单因素方差分析(one-way ANOVA). P<0.05差异有统计学意义.
用CCK-8法分析转染24、48、72 h的细胞增殖活力, 测得mimics组与对照组相比, mimics组在转染miR-570后各时点的细胞增殖抑制率均显著升高(P<0.01), 72 h的抑制作用最明显, 细胞增殖抑制率为53.23%±1.22%(表1).
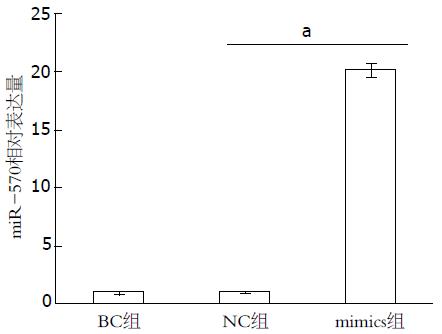
与空白对照组(1.00±0.05)相比, miR-570 mimics组(20.01±0.32)表达上调20倍(P<0.05)(图1).
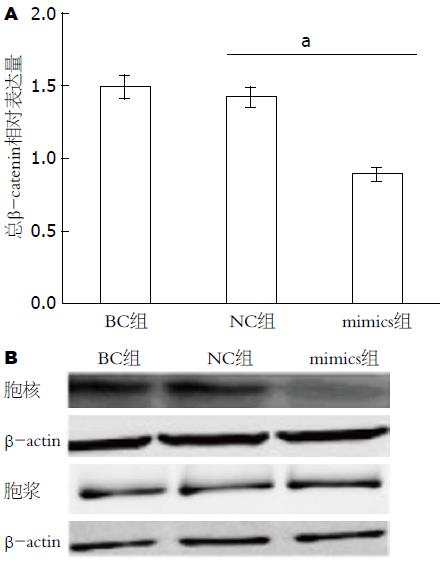
2.3.1 对β-catenin的影响: β-catenin进入细胞核是Wnt信号通路关键调节步骤, 本实验运用实时定量PCR及Western blot检测miR-570 mimics转染HT-29细胞后β-catenin表达量的变化. 实时定量PCR结果显示, 与对照组相比, miR-570 mimics组β-catenin mRNA下调约36.5%(P<0.05). Western blot结果显示细胞浆内β-catenin表达量无明显增加, 但细胞核内β-catenin的表达量明显下调(图2).
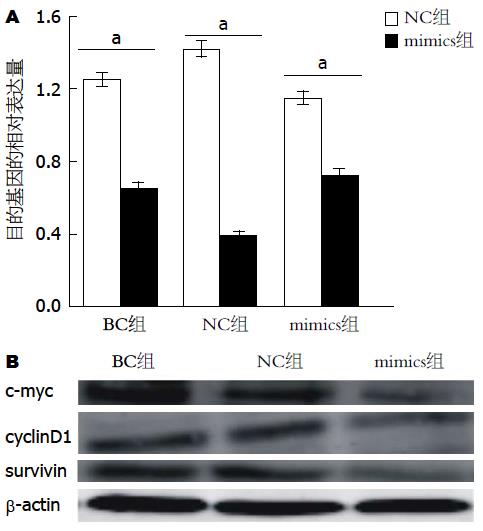
2.3.2 对c-myc、cyclinD1、survivin的表达影响: cmy-c、cyclinD1和survivin是Wnt通路的下游因子. 而本实验在转染miR-570 mimics后, cmy-c、cyclinD1和survivin mRNA表达受到抑制(P<0.05), Western blot结果与其相符, cmy-c、cyclinD1和survivin表达量下降, 空白对照组和阴性对照组差异无统计学意义(图3).
miRNA是一类长约21-25个核苷酸的小分子非编码RNA, 广泛存在于动植物中. 大量研究表明, miRNA通过调控细胞周期、细胞凋亡、细胞迁移和血管生成等肿瘤相关基因的表达, 参与肿瘤的发生发展和预后.
结肠癌的发生发展是一个多因素参与多基因改变的病变过程, 具有复杂的分子机制, 深入了解结肠癌发病的分子机制对于结肠癌的治疗有重要意义. Wnt/β-catenin通路是Wnt通路中研究最为深入的一条分支. 他主要通过激活β-catenin在核内的功能来调节靶基因.
现有研究显示miR-570在人胃癌中低表达[5], 可能具有抑癌基因的作用. 而Wang等[6]的研究也显示miR-570靶定于B7-H1基因的功能区, 调节B7-H1分子的表达, 从而促进胃癌的进一步发展. 此外miR-570对CD274也有调控作用, 且呈剂量依赖性[7].
我们的前期工作发现塞来昔布能够诱导结肠癌细胞株HT-29中miR-570高表达, 推测其可能起到抑癌基因的作用, 而对该基因进行Enrichment分析及GeneGo Pathway分析推论, miR-570靶基因参与的通路中可能性最大的是经典Wnt通路, 即Wnt/β-catenin通路[4]. 为证实这一推测, 我们通过将miR-570 mimics转染至人结肠癌细胞株HT-29中后,行Real-time PCR显示miR-570表达升高20倍. CCK-8实验显示, miR-570瞬时转染后明显抑制HT-29细胞的增殖能力, 进一步证实miR-570具有抑癌基因的作用.
近年来的大量研究显示, miRNA与肿瘤的发生发展密切相关[8], miRNA既可作为抑癌基因下调原癌基因的活性, 也可作为癌基因下调抑癌基因的活性[9,10]. 而miRNA在肿瘤中的分子机制主要是对信号途径的调控.
为探讨miR-570是否通过Wnt/β-catenin通路发挥抑癌作用, 我们检测了miR-570 mimics转染后对Wnt通路中各因子的影响. 结果显示miR-570在HT-29细胞中的过表达可明显下调β-catenin、c-myc、cyclinD1、survivin. 已知β-catenin是Wnt信号通路的枢纽分子, 核内β-catenin高表达使癌细胞具备了上皮-间质转化和干细胞形成的能力[11,12]. 这两种能力可导致肿瘤干细胞播散, 进而引起肿瘤的侵袭与增殖. 而Su等[13]研究显示miR-200a主要通过调控β-catenin及下游因子的表达来抑制胃癌细胞上皮-间质转化(epithelial-mesenchymal transition, EMT)能力, 从而调控WNT通路. c-myc、cyclinD1、survivin是Wnt/β-catenin通路的下游靶基因, 其中c-myc、cyclinD1是促进细胞增殖基因, survivin与抗细胞凋亡基因相关, 研究表明他们在结直肠中表达增高[14,15]. 而本实验表明, 外源性miR-570能促使HT-29细胞核内β-catenin表达降低, 同时使Wnt下游因子cmy-c、cyclinD1和survivin表达下调. 所以我们推测在结肠癌中miR-570通过Wnt/β-catenin信号通路影响结肠癌细胞的增殖.
总之, Wnt通路中的某个信号蛋白可受多个miRNA共同调节, 而某个miRNA可能同时调节Wnt通路中的多个信号蛋白分子, miRNA和Wnt信号途径的相互作用形成精密复杂的调控网络. 本实验通过细胞实验初步证miRNA570对HT-29细胞的抑制作用, 这有助于进一步了解结肠癌的发生发展机制, 为分子靶向治疗提供新的作用靶点.
结肠癌是消化系常见的恶性肿瘤之一, Wnt信号通路的激活对结肠癌的发生、发展起重要作用, 其中研究最深入的一支为Wnt/β-catenin信号通路. 而90%以上人结肠癌存在Wnt/β-catenin信号通路的激活即细胞内β-catenin的积聚.
卢晓梅, 教授, 研究员, 新疆医科大学第一附属医院临床医学研究院
MicroRNA是一类长约21-25个核苷酸的小分子非编码RNA, Wnt通路受到多种基因的共同调节, 并已发现部分miRNA作为癌基因或抑癌基因调节Wnt信号通路的活性. 而我们的前期研究显示miR-570靶基因参与的通路中可能性最大的是Wnt/β-catenin通路.
Li的研究显示, miR-570具有抑癌基因的作用, 他通过靶定B7-H1基因的功能区, 调节B7-H1分子的表达, 从而促进胃癌的进一步发展. 此外miR-570对CD274也有调控作用, 且呈剂量依赖性.
本研究结果显示, 通过上调miR-570的表达, 可以明显抑制结肠癌细胞的增殖,并导致Wnt通路相关因子β-catenin、c-myc、cyclinD1和survivin mRNA表达下降.
本实验有助于进一步了解结肠癌的发生发展机制, miR-570是结肠癌中有意义的生物治疗靶点, 为分子靶向治疗提供了新的方向, 而其作用机制与Wnt/β-catenin通路有关.
本文选题创新性较好, 作者以前期芯片数据的基础上做了更进一步的研究, 为结肠癌的发生发展提供了一定的理论基础, 有一定的科学意义.
编辑: 田滢 电编:鲁亚静
| 1. | Klaus A, Birchmeier W. Wnt signalling and its impact on development and cancer. Nat Rev Cancer. 2008;8:387-398. [PubMed] [DOI] |
| 2. | Giles RH, van Es JH, Clevers H. Caught up in a Wnt storm: Wnt signaling in cancer. Biochim Biophys Acta. 2003;1653:1-24. [PubMed] [DOI] |
| 3. | Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets. Cell. 2005;120:15-20. [PubMed] |
| 5. | Kunej T, Godnic I, Ferdin J, Horvat S, Dovc P, Calin GA. Epigenetic regulation of microRNAs in cancer: an integrated review of literature. Mutat Res. 2011;717:77-84. [PubMed] |
| 6. | Wang W, Li F, Mao Y, Zhou H, Sun J, Li R, Liu C, Chen W, Hua D, Zhang X. A miR-570 binding site polymorphism in the B7-H1 gene is associated with the risk of gastric adenocarcinoma. Hum Genet. 2013;132:641-648. [PubMed] [DOI] |
| 7. | Wang W, Sun J, Li F, Li R, Gu Y, Liu C, Yang P, Zhu M, Chen L, Tian W. A frequent somatic mutation in CD274 3'-UTR leads to protein over-expression in gastric cancer by disrupting miR-570 binding. Hum Mutat. 2012;33:480-484. [PubMed] [DOI] |
| 8. | Lu J, Getz G, Miska EA, Alvarez-Saavedra E, Lamb J, Peck D, Sweet-Cordero A, Ebert BL, Mak RH, Ferrando AA. MicroRNA expression profiles classify human cancers. Nature. 2005;435:834-838. [PubMed] [DOI] |
| 9. | Calin GA, Croce CM. MicroRNA-cancer connection: the beginning of a new tale. Cancer Res. 2006;66:7390-7394. [PubMed] [DOI] |
| 10. | Cho WC. OncomiRs: the discovery and progress of microRNAs in cancers. Mol Cancer. 2007;6:60. [PubMed] |
| 11. | Kikuchi A. Regulation of beta-catenin signaling in the Wnt pathway. Biochem Biophys Res Commun. 2000;268:243-248. [PubMed] [DOI] |
| 12. | Cheng XX, Wang ZC, Chen XY, Sun Y, Kong QY, Liu J, Li H. Correlation of Wnt-2 expression and beta-catenin intracellular accumulation in Chinese gastric cancers: relevance with tumour dissemination. Cancer Lett. 2005;223:339-347. [PubMed] [DOI] |
| 13. | Su J, Zhang A, Shi Z, Ma F, Pu P, Wang T, Zhang J, Kang C, Zhang Q. MicroRNA-200a suppresses the Wnt/β-catenin signaling pathway by interacting with β-catenin. Int J Oncol. 2012;40:1162-1170. [PubMed] [DOI] |
| 14. | Kim PJ, Plescia J, Clevers H, Fearon ER, Altieri DC. Survivin and molecular pathogenesis of colorectal cancer. Lancet. 2003;362:205-209. [PubMed] [DOI] |
| 15. | D'Orazio D, Muller PY, Heinimann K, Albrecht C, Bendik I, Herzog U, Tondelli P, Bauerfeind P, Müller H, Dobbie Z. Overexpression of Wnt target genes in adenomas of familial adenomatous polyposis patients. Anticancer Res. 2002;22:3409-3414. [PubMed] |