修回日期: 2014-04-15
接受日期: 2014-04-28
在线出版日期: 2014-06-18
目的: 探讨双联抗血小板药物对大鼠胃黏膜损伤及其可能发生机制.
方法: SPF级♂6-7周龄SD大鼠80只, 体质量200-220 g, 随机分为阴性对照组、阿司匹林组、氯吡格雷组、阿司匹林联合氯吡格雷组(以下简称双抗组), 每组20只, 分别予生理盐水、阿司匹林10.41 mg/(kg·d)、氯吡格雷7.81 mg/(kg·d)、阿司匹林联合氯吡格雷灌胃1次/d, 共14 d. 所有大鼠于末次给药后手术, 观察胃的损伤情况, HE染色法评估胃黏膜损伤程度, 免疫组织化学法测定肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1β(interleukin-1β, IL-1β)表达水平的变化.
结果: (1)各实验组大鼠胃黏膜的大体和病理损伤均高于阴性对照组(0.0000±0.00000)(P<0.01), 且阿司匹林组(13.4000±3.28634)损伤高于氯吡格雷组(8.8000±1.48324)(P<0.01), 双抗组(23.6000±3.57771)损伤高于阿司匹林组及氯吡格雷组(P<0.01); (2)免疫组织化学显示: 与对照组(10%)相比, 各实验组大鼠胃黏膜TNF-α蛋白均呈明显高水平表达(P<0.01); 阿司匹林组(90%)表达水平高于氯吡格雷组(85%)(P<0.01), 双抗组(100%)高于阿司匹林组及氯吡格雷组(P<0.01). 与对照组(5%)相比, 各实验组大鼠胃黏膜IL-1β蛋白均呈明显高水平表达(P<0.01); 阿司匹林组(100%)表达水平高于氯吡格雷组(80%)(P<0.01), 双抗组高于氯吡格雷组(P<0.01)
结论: 常规剂量抗血小板药物的使用可造成大鼠胃黏膜损伤, 联合用药较单一用药造成损伤程度加重, TNF-α、IL-1β表达增强, 提示这种变化可能参与黏膜的损伤.
核心提示: 我们用标准剂量阿司匹林、氯吡格雷灌服大鼠, 免疫组织化学法测定肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1β(interleukin-1β, IL-1β)表达, 结果显示, 各实验组胃黏膜中TNF-α、IL-1β均较对照组呈显著高水平表达, 且阿司匹林组与氯吡格雷组相比呈高水平表达, 双抗组较单用阿司匹林、单用氯吡格雷亦呈明显高水平表达.
引文著录: 季英兰, 陆伟, 张志广, 李熳, 张雪莲, 刘霞. 双联抗血小板药物对大鼠胃黏膜损伤的机制. 世界华人消化杂志 2014; 22(17): 2414-2420
Revised: April 15, 2014
Accepted: April 28, 2014
Published online: June 18, 2014
AIM: To investigate the effect of different antiplatelet drugs on gastric mucosal injury in rats and the possible mechanisms involved.
METHODS: Eighty 6-7-week-old male SD rats were randomly allocated into four groups. Except a negative control group, the other three groups were given clopidogrel [7.81 mg/(kg•d), n = 20], aspirin [10.41 mg/(kg•d), n = 20] and clopidogrel plus aspirin (n = 20), respectively. The drugs were intragastrically administered once daily, and the negative control group was given normal saline (n = 20). All rats received operation after the final intragastric administration to observe gastric injury. The degree of gastric and small intestinal mucosal injury was assessed by HE staining, and the expression of tumor necrosis factor-α (TNF-α) and interleukin-1β (IL-1β) in gastric mucosal cells was detected by immunohistochemistry.
RESULTS: The scores of gross and pathological lesions were significantly higher in each drug treatment group than in the negative control group (P < 0.01), in the aspirin group than in the clopidogrel group (13.4000 ± 3.28634 vs 8.8000 ± 1.48324, P < 0.01), and in the combination group than in the two monotherapy groups (P < 0.01). Immunohistochemistry analysis revealed that the expression of TNF-α and IL-1β in the gastric and small intestinal mucosa was significantly higher in each drug treatment group than in the negative control group (P < 0.01), in the aspirin group than in the clopidogrel group (P < 0.01), and in the combination group than in the two monotherapy groups (P < 0.01).
CONCLUSION: Routine doses of antiplatelet drugs can cause gastrointestinal injury in rats, and the combination of antiplatelet drugs aggravates the injury compared with monotherapy. The high expression of TNF-α and IL-1β may be involved in mucosal injury induced by antiplatelet drugs.
- Citation: Ji YL, Lu W, Zhang ZG, Li M, Zhang XL, Liu X. Gastric mucosal injury induced by dual antiplatelet drugs in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(17): 2414-2420
- URL: https://www.wjgnet.com/1009-3079/full/v22/i17/2414.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i17.2414
随着社会人口老龄化及心脑血管疾病呈现日益高发的趋势, 越来越多的患者服用抗血小板药物. 在经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)患者中, 阿司匹林联合氯吡格雷的双联抗血小板治疗已成为预防支架内血栓形成和减少缺血事件的标准治疗方案[1]. 由于PCI和植入药物洗脱支架(drug-eluting stent, DES)临床应用的增多, 人群中接受双联抗血小板治疗的患者已显著增加[2]. 大量循证医学证据已证实抗血小板药物对心脑血管疾病一级、二级预防的重要性. 由于抗血小板药物的广泛使用, 消化系不良事件也日渐增多[3]. 本实验旨在研究双联抗血小板药物对大鼠胃黏膜的损伤, 并探讨可能机制, 以期为临床的预防及治疗提供实验室依据.
SPF级♂6-7周龄SD大鼠80只, 体质量200-220 g(天津医科大学药学院动物房提供); 拜阿司匹林肠溶片(拜耳医药保健有限公司); 氢氯吡格雷片(天津腾麟发展有限公司); 依文思蓝100 mL(北京索莱宝科技有限公司); 即用型SP免疫组织化学通用试剂盒(天津市津脉基因测绘技术有限公司); 兔抗大鼠多克隆抗体肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)抗体、兔抗大鼠多克隆抗体白介素-1b(interleukin-1b, IL-1b)(武汉博士得生物工程有限公司).
1.2.1 动物分组: 将80只大鼠随机分为4组, 每组20只. A组: 阴性对照组; B组: 阿司匹林组; C组: 氯吡格雷组; D组: 阿司匹林联合氯吡格雷组.
1.2.2 动物造模: 四组分别予以生理盐水、阿司匹林10.41 mg/(kg·d)、氯吡格雷7.81 mg/(kg·d)、阿司匹林联合氯吡格雷灌胃, 1次/d, 连续14 d, 以上所有大鼠每次灌胃液体量均按10 mL/kg计算. 造模期间大鼠正常饮食饮水.
1.2.3 标本制备: 末次灌胃后所有大鼠禁食不禁水18 h, 以10%水合氯醛按3 mL/kg行腹腔注射麻醉, 分离出胃, 60 min后处死大鼠, 留取胃, 用冰生理盐水冲洗干净后, 置4%甲醛液中固定, 常规石蜡包埋, 切片厚度4 mm, 进行HE染色以及免疫组织化学检测TNF-a、IL-2b的表达.
1.2.4 检测指标: (1)胃黏膜大体观察及评分: 沿胃大弯剪开胃壁并使胃腔黏膜外翻, PBS漂洗胃黏膜3遍后, 以游标卡尺测定溃疡指数, 按Guth标准[4]累积计算损伤指数(lesion index, LI): 斑点样损伤 = 1分, 损伤直径(长度)<1 mm为2分, 损伤直径(长度)1-2 mm为3分, 损伤直径(长度)2-4 mm为4分, 损伤直径(长度)>4 mm为5分, 宽度>2 mm的损伤积分值×2; (2)胃黏膜组织学观察及评分: 以文献报道[5]为判断标准, 按照黏膜损伤的程度分为0-Ⅳ级. 0级: 黏膜组织完好无缺损, 偶见极少数上皮细胞脱落. Ⅰ级: 黏膜上皮细胞损伤, 胞质有空泡, 肿胀, 核固缩或细胞破碎, 有部分上皮细胞脱落, 但胃小凹无损伤; Ⅱ级: 除了黏膜上皮细胞广泛损伤外, 胃小凹也有破坏. 损伤区附近可有毛细血管充血, 但胃腺细胞无损伤; Ⅲ级: 胃腺细胞损伤, 可见腺细胞的胞质有空泡, 核固缩, 或有整层的坏死上皮细胞脱落, 使固有层和腺细胞直接暴露于胃腔, 并可见轻微出血; Ⅳ级: 损伤深入腺体深部, 并有部分腺体坏死脱落, 整个胃黏膜广泛出血; (3)免疫组织化学法检测胃黏膜TNF-α、IL-1b表达: 采用SABC法(按试剂盒说明书). 主要步骤: 石蜡切片常规脱蜡至水, 枸橼酸盐缓冲液中, 于微波炉中低火修复抗原, 3%H2O2封闭内源性过氧化物酶15 min, 滴加一抗(TNF-α、IL-1b均为1:200稀释) 4 ℃过夜, 37 ℃复温1 h, 滴加生物素标记二抗工作液, 37 ℃ 30 min, PBS冲洗, DAB显色3-4 min, 镜下控制显色时间, 苏木精复染、脱水、透明、中性树胶封片. PBS代替一抗作为空白对照. 定性判定: 依据阳性细胞数量计分: 阳性细胞数<10%, 计0分; 阳性细胞数10%-25%, 计1分; 阳性细胞数为26%-50%, 计2分; 阳性细胞数为51%-75%, 计3分; 阳性细胞数>75%, 计4分; 依据细胞着色强度计分 无色为0分; 淡黄色为1分; 棕黄为2分; 棕褐为3分; 细胞阳性数量和着色强度两项得分相加: 0-1分为阴性; 2-3分为弱阳性(+): 4-5分为阳性(++); 6-7分为强阳性(+++).
统计学处理 采用SPSS17.0软件进行处理及分析, 计量数据以mean±SD表示, 预先检验方差齐性, 如方差齐则多组间均数比较采用两独立样本t检验, 如方差不齐则采用秩转换的非参数检验. 免疫组织化学数据以mean±SD表示, 组间差异选用两独立样本t检验, P<0.05为差异有统计学意义. 大体及病理损伤评分以中位数及四分位间距表示, 组间比较采用两独立样本秩和检验, 统计量采用Mann-Whitney U检验; 检验水准α = 0.05, P<0.05为差异有统计学意义.
对照组未见黏膜损伤, 阿司匹林组大鼠黏膜表面出现点状糜烂、小溃疡、出血; 氯吡格雷灌胃后大鼠黏膜表面可见散在点状糜烂、出血; 双抗组灌胃后黏膜表面出现糜烂、溃疡、出血.
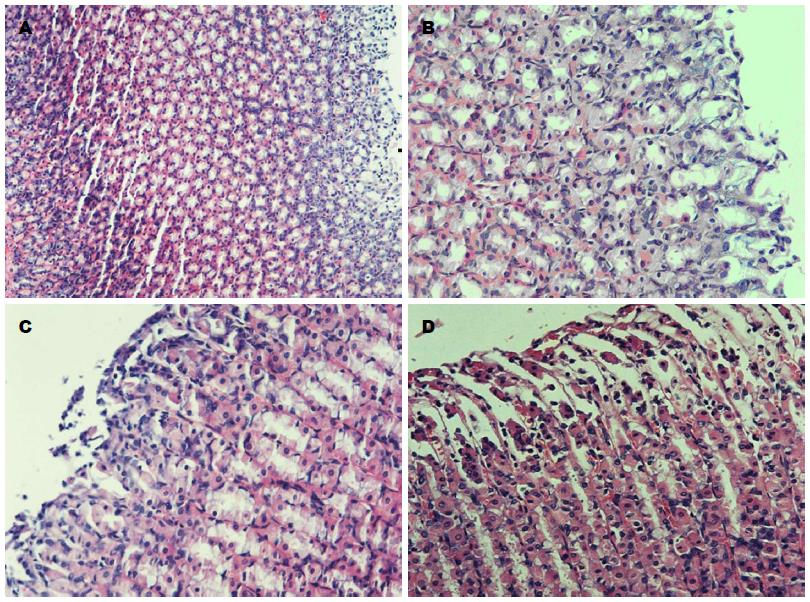
对照组大鼠胃黏膜正常, 结构层次清楚, 上皮结构完整, 无损伤, 腺体排列整齐, 腺腔整洁, 损伤程度为0级. 氯吡格雷组大鼠胃黏膜上皮基本完整、连续, 腺体排列较整齐, 部分上皮细胞脱落、破坏, 胃腺体少量表层坏死, 可见中性粒细胞浸润, 胃黏膜轻微充血, 绝大部分为Ⅰ-Ⅱ级的损伤, 极少数为Ⅲ级以上的损伤; 阿司匹林组大鼠胃黏膜部分上皮细胞脱落、破坏, 胃腺体少量表层坏死, 可见中性粒细胞浸润, 胃黏膜轻微充血, 大部分为Ⅰ-Ⅱ级的损伤, 部分为Ⅲ级以上的损伤; 双抗组大鼠胃黏膜组织结构损伤明显, 部分为Ⅰ-Ⅱ级的损伤, 大部分为Ⅲ-Ⅳ级损伤, 在Ⅲ级以上损伤的切片内伴有炎症反应, 大量上皮细胞坏死脱落, 腺体结构破坏, 组织结构损伤明显, 黏膜下或黏膜内散在广泛出血(表1, 图1).
| 分组 | 大鼠胃黏膜损伤程度 | 损伤率(%) | |||
| 0级 | Ⅰ级 | Ⅱ级 | Ⅲ-Ⅳ级 | ||
| 对照组 | 20 | 0 | 0 | 0 | 0 |
| 阿司匹林组 | 2 | 3 | 10 | 5 | 90 |
| 氯吡格雷组 | 4 | 5 | 9 | 2 | 80 |
| 双抗组 | 0 | 3 | 6 | 11 | 100 |
各实验组大体和病理评分明显高于对照组(P = 0.000); 阿司匹林组较氯吡格雷组大体和病理评分为高, 差异具有统计学意义(P<0.05), 双抗组较阿司匹林组和氯吡格雷组大体和病理评分均明显升高, 差异具有统计学意义(P<0.05)(表2).
| 分组 | 大鼠胃黏膜损伤指数 |
| 对照组 | 0.0000±0.00000 |
| 阿司匹林组 | 13.4000±3.28634 |
| 氯吡格雷组 | 8.8000±1.48324 |
| 双抗组 | 23.6000±3.57771 |
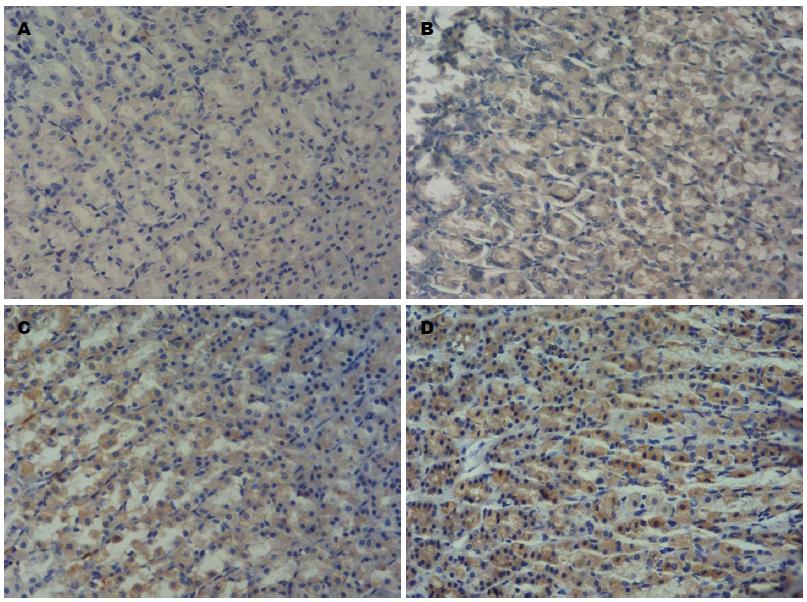
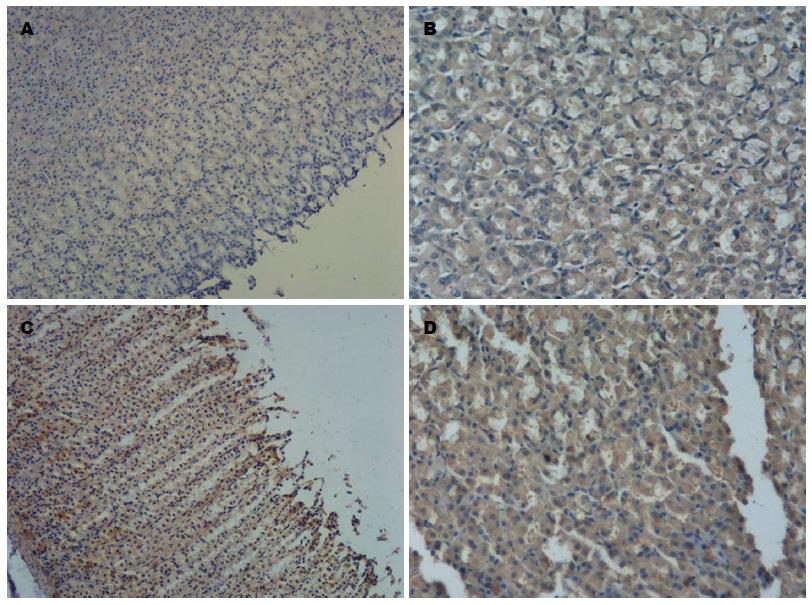
根据免疫组织化学染色结果, TNF-a表达于胃腺体部及底部的细胞浆, 呈黄色或棕黄色. IL-1β胃黏膜全层均可见表达, 主要表达于胃腺体部及底部的细胞浆, 呈黄色或棕黄色. 正常对照组大鼠病理免疫组织化学显示TNF-a、IL-1β的基本无表达(-) 或表达微弱(+), 而经阿司匹林处理组TNF-a、IL-1β表达主要呈阳性(++) 或强阳性(+++), 氯吡格雷处理组TNF-a、IL-1β表达主要呈弱阳性(+), 阿司匹林联合氯吡格雷组大鼠免疫组织化学结果主要呈强阳性(+++), 结果强于阿司匹林组及氯吡格雷组大鼠, 各实验组TNF-a、IL-1β表达与对照组相比均有显著性差异(表3, 4, 图2,3).
| 分组 | 不同实验组及对照组TNF-α表达 | 阳性率(%) | |||
| 阴性(-)/(+-) | 弱阳性(+) | 阳性(++) | 强阳性(+++) | ||
| 对照组 | 18 | 2 | 0 | 0 | 10 |
| 阿司匹林组 | 1 | 3 | 7 | 9 | 90 |
| 氯吡格雷组 | 3 | 11 | 6 | 0 | 85 |
| 双抗组 | 0 | 1 | 6 | 13 | 100 |
| 分组 | 不同实验组及对照组IL-1β表达 | 阳性率(%) | ||||
| 阴性(-)/(+-) | 弱阳性(+) | 阳性(++) | 强阳性(+++) | |||
| 对照组 | 19 | 1 | 0 | 0 | 5 | |
| 阿司匹林组 | 0 | 4 | 7 | 9 | 100 | |
| 氯吡格雷组 | 4 | 9 | 8 | 0 | 80 | |
| 双抗组 | 0 | 1 | 7 | 12 | 100 | |
抗血小板药物在缺血性心脑血管疾病的治疗中发挥着越来越重要的作用, 已作为心脑血管疾病的一级预防和二级预防药物. 虽然在多项大规模的研究[6-8]的结果中证实阿司匹林联合氯吡格雷的双联抗血小板治疗可进一步降低ACS和接受PCI治疗的患者近期和远期的心血管风险, 但同时也发现双联抗血小板治疗会增加患者出血、特别是胃肠道出血的风险. 两药联用后发生胃肠道出血的概率显著高于单药治疗[9]. 虽然目前对非甾体抗炎药(non-steroidal anti-inflammatory drug, NSAID)引起上消化道不良反应研究较多, 但是专门针对阿司匹林和/或氯吡格雷的双抗或单抗治疗与消化系统损伤的研究还甚少. 本实验旨在通过研究阿司匹林、氯吡格雷单药及联合用药对大鼠胃黏膜损伤的表现, 以期为临床的预防及治疗提供实验室依据.
阿司匹林(aspirin, ASA)是目前临床应用最为广泛的抗血小板药物, 为NSAIDs的经典代表. 既往对NSAIDs所致的消化系损伤的研究多集中在胃黏膜, 可能损伤机制包括ASA对胃黏膜直接损伤的局部作用及依赖环氧合酶途径的全身作用. 氯吡格雷是一种血小板表面二磷酸腺苷(adenosine diphosphate, ADP)受体拮抗剂, 属于噻吩吡啶类衍生物, 是不具有抗血小板活性的前体药物, 其活性代谢产物发挥抗血小板聚集作用[10], 并可抑制促血管生长因子合成, 进一步导致血小板源性生成因子和血管内皮生长因子合成减少, 从而导致新生血管形成障碍, 使得胃肠受损伤黏膜修复受阻[11]. 因此, 认为氯吡格雷不是溃疡产生的直接原因, 而是通过抑制血小板聚集及新生血管形成阻碍溃疡愈合, 诱发已存在的无临床症状的溃疡出血. 尚无确切证据表明氯吡格雷具有独立的损伤胃肠道黏膜的作用.
炎症反应在消化系损伤中的作用受到广泛关注. TNF-a是一种重要的炎症介质, 主要来源于腹膜和内脏的单核细胞、巨噬细胞和T细胞. 机体受内外环境刺激后产生的具有重要生物学功能的细胞调节蛋白, 参与机体的免疫、炎症、抗感染等过程. 通过上调中性粒细胞(polymorphonuclear, PMN)及内皮细胞上黏附分子的表达引起PMN移动[12], 而在TNF-β缺失的情况下, PMN的移动不足以产生胃黏膜损伤[13]. Santucci等[14]的研究表明, 应用消炎痛后, 鼠血清中TNF-a的水平明显升高, 与胃黏膜微循环中的中性粒细胞增高、胃黏膜的损伤进程一致; 干扰试验发现, 用已酮可可碱(pentoxifynlline)或抗TNF-a抗体治疗, 可降低TNF-a的水平, 同时减少中性粒细胞在胃黏膜微循环中的数量, 降低胃黏膜的损伤程度. 认为TNF-a是NSAIDs诱导中性粒细胞黏附及造成胃黏膜损伤的关键介质. IL-l是典型的致炎细胞因子, 几乎各种有核细胞均能产生IL-1. 按其结构分IL-a和IL-1b两种. IL-1b是重要的炎症介质, 也可通过上调PMN及内皮细胞上黏附分子的表达而引起PMN移动, 有报道腹腔注射IL-1b后, 可促进中性粒细胞浸润胃黏膜, 使已愈合的溃疡复发[15], 在机体的炎症反应中起重要作用. Shiotani等[16]对232例服用100 mg阿司匹林的心血管患者进行研究, 其中40例有消化性溃疡者作为入选病例, 检测出IL-1β -511/-31基因多态性, 尤其是IL-1β -511T等位基因, 直接影响IL-1β炎症因子的表达, 与胃十二指肠疾病发生的危险性有明显关系. Zhang等[17]通过研究显示证明, 吲哚美辛灌胃能够显著增加大鼠胃黏膜IL-1β浓度.
我们用标准剂量阿司匹林、氯吡格雷灌服大鼠, 免疫组织化学法测定TNF-a、IL-1β表达, 结果显示, 各实验组胃黏膜中TNF-a、IL-1b均较对照组呈显著高水平表达, 且阿司匹林组与氯吡格雷组相比呈高水平表达, 双抗组较单用阿司匹林、单用氯吡格雷亦呈明显高水平表达.研究显示阿司匹林相关消化系损伤呈剂量相关性. Serebruany等[18]的荟萃分析显示: <100、100-200和>200 mg/d剂量阿司匹林的总出血事件发生率分别为3.7%、11.3%和9.8%. 条件所限, 本实验仅用标准计量药物进行研究, 我们将在下一步的实验中进行药物量效关系和时效关系研究.
总之, 我们认为阿司匹林、氯吡格雷可能前期机制不同. 阿司匹林可主动引起溃疡形成, 而氯吡格雷可能由于血管形成受阻, 导致已有溃疡难以愈合, 两者最终均引起炎症因子TNF-a、IL-1b不同程度的释放, 但由于经费及时间的限制, 本实验仅在一定程度上说明了抗血小板药物对大鼠消化系的损伤及相关可能机制, 针对临床上如何预防及治疗消化系损伤, 何时恢复抗血小板药物使用时机, 仍需大量的临床研究和体内试验来解决这一令心脏科及消化科医师共同关注的临床难题.
由于经皮冠状动脉介入治疗和植入药物洗脱支架临床应用的增多, 人群中接受双联抗血小板治疗的患者已显著增加. 消化系不良事件也日渐增多. 双联抗血小板药物对胃黏膜损伤表现及机制并不完全清楚, 需要更进一步研究, 以期为临床预防及治疗提供实验室依据.
王承党, 教授, 福建医科大学附属第一医院消化内科
专门针对阿司匹林和/或氯吡格雷的双抗或单抗治疗与消化系统损伤的研究还甚少. 本实验旨在通过研究阿司匹林、氯吡格雷单药及联合用药对大鼠胃黏膜损伤的表现, 以期为临床的预防及治疗提供实验室依据.
以往研究阿司匹林与氯吡格雷损伤机制以及肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素在炎症损伤中的表达情况, 但对双联抗血小板引起胃黏膜损伤研究少.
本文不仅研究阿司匹林、氯吡格雷对胃黏膜损伤大体表现、损伤指数及TNF-α、IL-1b的表达情况, 对双抗联合应用组也进行了相应的研究.
在双联抗血小板药物的应用的过程中, 对胃黏膜损伤临床的预防及治疗提供实验室依据.
本文瞄准前沿, 具有一定临床指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Sabatine MS, Cannon CP, Gibson CM, López-Sendón JL, Montalescot G, Theroux P, Claeys MJ, Cools F, Hill KA, Skene AM. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST-segment elevation. N Engl J Med. 2005;352:1179-1189. [PubMed] [DOI] |
| 2. | Hallas J, Dall M, Andries A, Andersen BS, Aalykke C, Hansen JM, Andersen M, Lassen AT. Use of single and combined antithrombotic therapy and risk of serious upper gastrointestinal bleeding: population based case-control study. BMJ. 2006;333:726. [PubMed] [DOI] |
| 3. | Luk HH. Use of gastroprotective drugs in patients receiving low-dose aspirin. J Chin Med Assoc. 2009;72:356-361. [PubMed] [DOI] |
| 4. | Guth PH, Paulsen G. Aspirin-induced gastric injury in the rat: histologic changes and sucralfate cytoprotection. Proc Soc Exp Biol Med. 1987;184:423-428. [PubMed] |
| 5. | Campo R, Montserrat A, Brullet E. Transnasal gastroscopy compared to conventional gastroscopy: a randomized study of feasibility, safety, and tolerance. Endoscopy. 1998;30:448-452. [PubMed] [DOI] |
| 6. | Steinhubl SR, Berger PB, Mann JT, Fry ET, DeLago A, Wilmer C, Topol EJ. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA. 2002;288:2411-2420. [PubMed] [DOI] |
| 7. | Yusuf S, Zhao F, Mehta SR, Chrolavicius S, Tognoni G, Fox KK. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med. 2001;345:494-502. [PubMed] [DOI] |
| 8. | Bertrand ME, Rupprecht HJ, Urban P, Gershlick AH. Double-blind study of the safety of clopidogrel with and without a loading dose in combination with aspirin compared with ticlopidine in combination with aspirin after coronary stenting: the clopidogrel aspirin stent international cooperative study (CLASSICS). Circulation. 2000;102:624-629. [PubMed] [DOI] |
| 9. | Diener HC, Bogousslavsky J, Brass LM, Cimminiello C, Csiba L, Kaste M, Leys D, Matias-Guiu J, Rupprecht HJ. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients (MATCH): randomised, double-blind, placebo-controlled trial. Lancet. 2004;364:331-337. [PubMed] [DOI] |
| 10. | Mega JL, Close SL, Wiviott SD, Shen L, Hockett RD, Brandt JT, Walker JR, Antman EM, Macias W, Braunwald E. Cytochrome p-450 polymorphisms and response to clopidogrel. N Engl J Med. 2009;360:354-362. [PubMed] [DOI] |
| 11. | Bhatt DL, Scheiman J, Abraham NS, Antman EM, Chan FK, Furberg CD, Johnson DA, Mahaffey KW, Quigley EM, Harrington RA. ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use: a report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 2008;52:1502-1517. [PubMed] [DOI] |
| 12. | Appleyard CB, McCafferty DM, Tigley AW, Swain MG, Wallace JL. Tumor necrosis factor mediation of NSAID-induced gastric damage: role of leukocyte adherence. Am J Physiol. 1996;270:G42-G48. [PubMed] |
| 13. | Fiorucci S, Antonelli E, Migliorati G, Santucci L, Morelli O, Federici B, Morelli A. TNFalpha processing enzyme inhibitors prevent aspirin-induced TNFalpha release and protect against gastric mucosal injury in rats. Aliment Pharmacol Ther. 1998;12:1139-1153. [PubMed] [DOI] |
| 14. | Santucci L, Fiorucci S, Giansanti M, Brunori PM, Di Matteo FM, Morelli A. Pentoxifylline prevents indomethacin induced acute gastric mucosal damage in rats: role of tumour necrosis factor alpha. Gut. 1994;35:909-915. [PubMed] [DOI] |
| 15. | Watanabe T, Higuchi K, Tominaga K, Fujiwara Y, Arakawa T. Acid regulates inflammatory response in a rat model of induction of gastric ulcer recurrence by interleukin 1beta. Gut. 2001;48:774-781. [PubMed] [DOI] |
| 16. | Shiotani A, Sakakibara T, Yamanaka Y, Nishi R, Imamura H, Fujita M, Tarumi K, Kamada T, Hata J, Haruma K. The preventive factors for aspirin-induced peptic ulcer: aspirin ulcer and corpus atrophy. J Gastroenterol. 2009;44:717-725. [PubMed] [DOI] |
| 17. | Zhang X, Tajima K, Kageyama K, Kyoi T. Irsogladine maleate suppresses indomethacin-induced elevation of proinflammatory cytokines and gastric injury in rats. World J Gastroenterol. 2008;14:4784-4790. [PubMed] [DOI] |
| 18. | Serebruany VL, Steinhubl SR, Berger PB, Malinin AI, Baggish JS, Bhatt DL, Topol EJ. Analysis of risk of bleeding complications after different doses of aspirin in 192,036 patients enrolled in 31 randomized controlled trials. Am J Cardiol. 2005;95:1218-1222. [PubMed] [DOI] |