修回日期: 2014-03-21
接受日期: 2014-03-28
在线出版日期: 2014-05-28
目的: 构建人Cdc25C基因的克隆载体和原核表达载体, 并诱导其在大肠杆菌中表达.
方法: 从人肝癌细胞株Bel-7404中提取总RNA, 经RT-PCR法扩增人Cdc25C cDNA后, 将其正确插入克隆载体pMD18-T和表达载体pET-32a(+), 并转化至BL21(DE3)、BL21(DE3)pLysS和Transetta(DE3)三种感受态大肠杆菌中, 分别采用0.25 mmol/L IPTG和ArtMediaTM Protein Expression自动诱导表达培养基诱导表达, 并对纯化的融合蛋白进行考马斯亮蓝染色和质谱分析鉴定.
结果: 成功扩增了Cdc25C基因, 并获得pMD18-T-Cdc25C克隆载体和pET-32a(+)-Cdc25C表达载体; 重组质粒在BL21(DE3)、BL21(DE3)pLysS和Transetta(DE3)三种感受态大肠杆菌中均诱导表达出TRx-His-Cdc25C融合蛋白; 考马斯亮蓝染色和蛋白质谱分析结果显示基因重组蛋白与目的蛋白相符.
结论: 获得肿瘤相关抗原Cdc25C重组蛋白, 为后续研究奠定基础.
核心提示: 本文从肝癌cDNA文库成功扩增了肝癌相关抗原Cdc25C基因, 并正确插入pMD18-T克隆载体和pET-32a(+)表达载体. 原核表达出TRx-His-Cdc25C融合蛋白, 经蛋白质谱分析显示与目的蛋白相符.
引文著录: 卓少元, 陈承晓, 钟卫干, 农蔚霞, 黄天明, 马步国, 莫发荣. 人Cdc25C基因克隆及其原核表达载体的构建与表达. 世界华人消化杂志 2014; 22(15): 2140-2144
Revised: March 21, 2014
Accepted: March 28, 2014
Published online: May 28, 2014
AIM: To clone the human Cdc25C gene and construct a recombinant prokaryotic system to express this protein.
METHODS: Total RNA were isolated from human hepatocellular carcinoma Bel-7404 cells and reverse transcribed, and the resulting cDNA was used as a template to amplify the human Cdc25C gene by RT-PCR. The amplified PCR product was cloned into pMD18-T and pET-32a (+) vectors and sequenced. Next, pET-32a(+)-Cdc25C was transformed into chemically competent E. coli strains, including BL21 (DE3), BL21 (DE3) pLysS and Transetta (DE3), to express the protein after induction with 0.25 mmol/L IPTG and ArtMediaTM protein expression, respectively. The fusion protein was identified by Coomassie staining and mass spectrometry analysis.
RESULTS: The Cdc25C gene and pMD18-T-Cdc25C and pET-32a(+)-Cdc25C vectors were obtained successfully. Three strains of E. coli which harbored the recombinant plasmid could express the TRx-His-Cdc25C fusion protein. The expressed protein was identical to the Cdc25C protein as revealed by Coomassie staining and mass spectrometry.
CONCLUSION: The recombinant protein of tumor-associated antigen Cdc25C has been successfully obtained.
- Citation: Zhuo SY, Chen CX, Zhong WG, Nong WX, Huang TM, Ma BG, Mo FR. Cloning and prokaryotic expression of human Cdc25C. Shijie Huaren Xiaohua Zazhi 2014; 22(15): 2140-2144
- URL: https://www.wjgnet.com/1009-3079/full/v22/i15/2140.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i15.2140
Cdc25C(cell division cyclin 25 homolog C)是一种细胞分裂周期蛋白质, 在真核生物细胞有丝分裂中起重要调节作用, 其编码的M期诱导因子磷酸酶3(M-phase inducer phosphatase 3), 与G2/M期检测点关键调控分子Cdc2/cyclin B结合、互相活化, 控制着细胞进入有丝分裂的最后关卡[1]. 初步的研究发现细胞周期蛋白Cdc25C是一个肿瘤相关抗原候选基因(GenBank登录号为NM001790)[2]. 该候选基因属于CT抗原, 在正常组织局限表达而在肿瘤组织高水平表达. 我们前期的RT-PCR检测结果显示, Cdc25C高表达于肝细胞癌(16/30)、膀胱癌(11/15)、肺癌(6/12)、乳腺癌(7/14)和结肠癌(22/31); 在肾癌(2/12)和胃癌(4/15)中低表达; 在非白血性白血病(0/13)中无表达. 表明一些肿瘤患者的Cdc25C蛋白质具有了免疫原性, 有望成为新的肿瘤标志物[3]. 为了进一步了解Cdc25C在不同组织中的表达谱及其引起机体免疫反应的情况, 我们克隆了人Cdc25C基因(NM_001790.4)的全长, 将其构建在pET-32a(+)原核表达载体上, 成功诱导了Cdc25C的融合蛋白并进行了蛋白质谱鉴定, 为深入研究Cdc25C在肿瘤的发病、诊断和临床免疫治疗奠定基础.
人肝癌细胞株Bel-7404(广西医科大学组织学与胚胎学教研室保存), DMEM培养基、胎牛血清(加拿大WISENT生物技术有限公司), RNA提取试剂盒(北京天根生化科技有限公司), 逆转录试剂盒、PCR试剂盒、限制性内切酶BamH Ⅰ和Xho Ⅰ(加拿大MBI Fermentas公司), 胶回收试剂盒、质粒DNA提取试剂盒(杭州博日科技有限公司), pMD18-T vector(大连宝生物工程有限公司), 感受态大肠杆菌DH5α、BL21(DE3)、BL21(DE3)pLysS和Transetta(DE3), 及ArtMediaTM Protein Expression(AM3)自动诱导表达培养基(北京全式金生物), 引物合成、基因测序(上海英骏生物技术有限公司).
1.2.1 人肝癌细胞Bel-7404总RNA提取: 冻存的肝癌细胞株Bel-7404复苏后, 于含10%胎牛血清的DMEM培养基, 37 ℃、5%CO2及饱和湿度的条件下培养48 h, 收集细胞. 计数后按照试剂盒说明书进行总RNA的提取. 以紫外分光光度法确定RNA的含量和纯度.
1.2.2 RT-PCR扩增并回收Cdc25C的cDNA片段: 采用MBI Fermentas逆转录试剂盒及其方法, 对抽提的肝癌细胞总RNA进行逆转录. 以所得cDNA为模板, 用特异性引物Forward-5'CGGGATCCATGTCTACGGAACTCTTCTCATC-3'(含BamH Ⅰ酶切位点)、Reverse-5'CCGCTCGAGTTATCATGGGCTCATGTCCTTCACC-3'(含XhoⅠ酶切位点), 对Cdc25C基因进行扩增. PCR扩增条件: 94 ℃ 3 min预变性, 94 ℃ 30 s、 55 ℃ 30 s、72 ℃ 2 min, 35个循环, 最后72 ℃延伸5 min. PCR产物经1%琼脂糖凝胶电泳鉴定后用胶回收试剂盒回收DNA片段.
1.2.3 克隆载体pMD18-T-Cdc25C的构建和序列测定: 将PCR扩增产物和pMD18-T载体分别用BamHⅠ、XhoⅠ双酶切2 h后, 电泳切胶回收, 经T4连接酶16 ℃连接12 h后转化至感受态大肠杆菌DH5α, 筛选阳性克隆, 送往上海英骏生物技术有限公司, 测序验证重组克隆中插入序列是否与要求相一致.
1.2.4 表达载体pET-32a(+)-Cdc25C的构建和序列测定: 将测序正确的pMD18-T-Cdc25C重组表达质粒和pET-32a(+)载体分别用BamH Ⅰ、XhoⅠ双酶切2 h后, 电泳切胶回收Cdc25C DNA和pET-32a(+)载体大片段, 经T4连接酶16 ℃连接12 h后转化至感受态大肠杆菌DH5α, 筛选阳性克隆, 送往上海英骏生物技术有限公司, 测序验证重组克隆插入片段的序列信息.
1.2.5 Cdc25C蛋白的诱导表达及鉴定: 取测序正确的pET-32a(+)-Cdc25C重组表达质粒, 分别转化至BL21(DE3)、BL21(DE3)pLysS和Transetta(DE3)感受态细胞, 接种于3 mL Amp+的LB培养液中, 37 ℃恒温摇床振荡培养至A600约为0.8; 分别采用0.25 mmol/L IPTG和ArtMediaTM Protein Expression(AM3)自动诱导表达培养基两种方法进行诱导. 其中IPTG方法采用1.5 mL菌液加0.7 μL 0.5 mol/L IPTG, 培养5 h; AM3方法则加入ArtMediaTM Protein Expression自动诱导表达培养基50 μL-1 mL, 培养12 h. 诱导的蛋白经纯化后, 以10%SDS-PAGE胶电泳, 考马斯亮蓝染色观察, 并用ABI4700质谱仪进行蛋白质谱分析.
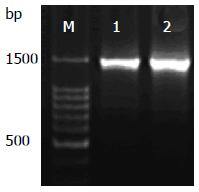
以人肝癌细胞Bel-7404总RNA为模板对Cdc25C基因编码区进行RT-PCR扩增, 琼脂糖凝胶电泳显示的扩增条带与预期PCR产物片段大小1442 bp接近(图1).
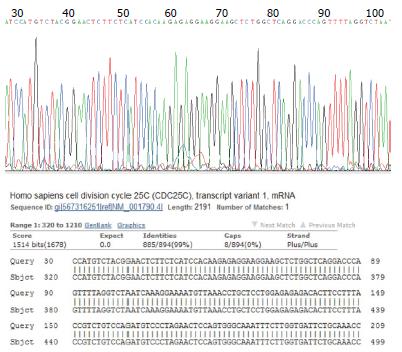
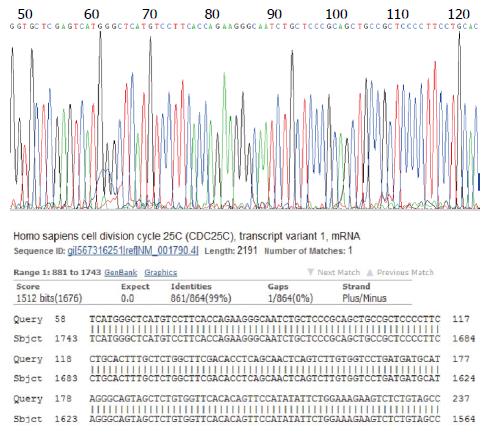
pMD18-T-Cdc25C阳性重组质粒经测序及BLAST比对, 发现重组克隆中插入序列与要求完全一致(部分测序与比对结果如图2, 图中BLAST比对显示序列一致度为99%是由所测序列800 bp以后的区段造成的, 为技术原因, 专门对后面区段进行测序即显示与原序列一致性, 下同), 表明Cdc25C cDNA在PCR扩增过程中并未发性变异. 而pET-32a(+)-Cdc25C重组质粒经测序验证后, 克隆插入片段的序列信息也与目的基因相一致, 说明重组表达质粒构建成功(部分测序与比对结果如图3).
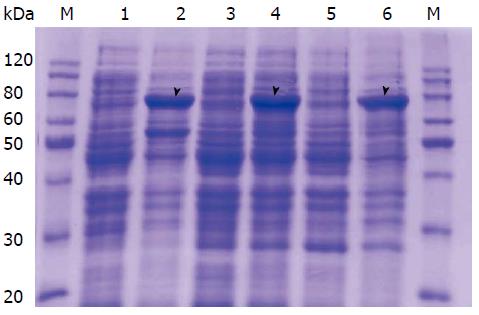
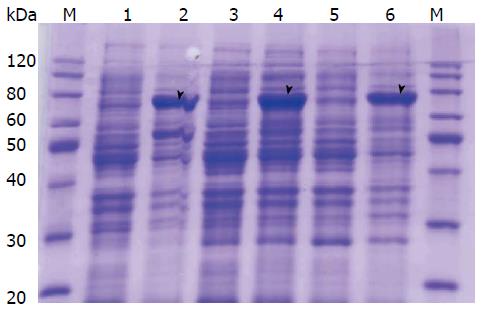
大肠杆菌BL21(DE3)、Transetta(DE3)和BL21(DE3)pLysS经原核表达载体pET-32a(+)-Cdc25C转化, 在37 ℃, 0.25 mmol/L IPTG诱导5 h条件下均有TRx-His-Cdc25C融合蛋白(TRx-His相对分子质量约20 kDa, Cdc25C相对分子质量约53 kDa)明显表达(图4). 与此同时, 利用50 μL-1 mL ArtMediaTM Protein Expression自动诱导表达培养基培养12 h, 也均能诱导pET-32a(+)-Cdc25C转化菌株表达TRx-His-Cdc25C融合蛋白(图5). 将蛋白从SDS-PAGE胶切下后进行MALDI-TOF-TOF MS/MS分析, 通过肽段同源性分析证实为Cdc25C. 图6为Cdc25C蛋白全长氨基酸序列, 红色的肽段是质谱分析与Cdc25C完全匹配的部分.
Cdc25基因是被Wickramasinghe等鉴别出来的[4], 可分为A、B 、C 3种亚型. Cdc25A表达增加可促进G1/S及G2/M检测点之间的转变; Cdc25B和Cdc25C在控制进入M期和G2/M检测点具有重要的作用[5]. 有研究资料表明3种Cdc25亚型在G1/S、G2/M转变和M期中都有作用, 他们协同启动细胞进入S期和调控G2/M的转变[6]. Cdc25C基因存在5种剪切体, 定位于染色体5q31, 由14个外显子和14个内含子组成, 全长约2115 bp, 其cDNA的开放阅读框架由1419个核苷酸组成, 编码473个氨基酸, 分子量约为53.23 kDa[3,7]. 在对Cdc25的研究过程中, 许多研究者逐渐认为细胞周期调节物可能是一种潜在的癌症治疗靶物质.
肿瘤最重要的特征是细胞的恶性增殖. 细胞周期调控机制的失活, 特别是G1/S和G2/M检测点的失活, 在细胞癌变过程中起着至关重要的作用[8,9]. 越来越多的证据表明Cdc25C的过度表达会导致细胞周期G2/M检测点失活, 进而引发细胞的恶性增殖[3]. 通过抑制Cdc25C的表达或上调Cdc25C蛋白的降解途径可以有效抗肿瘤细胞增殖, 甚至诱发细胞凋亡[10-12]. 作为参与G2/M检测点调控的关键分子之一, Cdc25C或其剪接体已被发现在前列腺癌、结肠癌、乳腺癌和女阴鳞状细胞癌等多种恶性肿瘤组织或细胞株中过度表达[13-16]. 因肿瘤发生与G2/M检测点应答相关, 故推测Cdc25C磷酸酶也可以作为肿瘤治疗的有效靶点. 在以后的研究中可以合成Cdc25C磷酸酶小分子抑制剂, 通过抑制Cdc25C磷酸酶寻找新奇的细胞周期抗癌靶点[17].
目前国内外对Cdc25C的研究, 主要侧重于研究其作为细胞周期调控因子的分子结构, 生物特性和作用机制. 而将Cdc25C作为肿瘤相关抗原的研究非常有限. 为进一步了解Cdc25C在不同组织中的表达谱, 能否有效地引起机体免疫应答, 以及其与肿瘤发生、发展和预后的关系, 非常有必要利用基因工程的方法重组表达Cdc25C. 本研究在成功构建人Cdc25C基因(NM_001790.4)全长的克隆载体和原核表达载体基础上, 分别采用小剂量IPTG和ArtMediaTM Protein Expression(AM3)自动诱导表达培养基两种方法, 在3种大肠杆菌BL21(DE3)、BL21(DE3)pLysS和Transetta(DE3)中均成功诱导表达出Cdc25C的融合蛋白. 这为今后研究Cdc25C在细胞中的功能及其与肿瘤细胞恶性增殖的关系, 进一步开展抗体血清学检测、抗体制备及其相关的研究, 以及开发Cdc25C全蛋白抗原疫苗和肽表位疫苗等奠定了实验基础.
细胞周期蛋白Cdc25C是一个新的肿瘤相关抗原候选基因. 前期初步研究表明Cdc25C有望成为新的肿瘤标志物. 为进一步了解其与肿瘤发生、发展和预后的关系, 非常有必要利用基因工程的方法重组表达肿瘤相关抗原Cdc25C.
李家平, 教授, 主任医师, 中山大学附属第一医院肿瘤介入科
肿瘤免疫治疗的靶点和毒性作用与传统治疗措施没有重叠, 免疫效应细胞一旦被激活, 能通过特异识别肿瘤相关抗原杀死和破坏肿瘤细胞, 有效清除微转移灶, 预防肿瘤复发. 要进行肿瘤的免疫治疗, 首先需要确定免疫治疗的有效靶点.
范忠义等从乳腺文库中扩增Cdc25C基因, 原核表达出人GST-Cdc25C融合蛋白用于细胞周期蛋白调控机制的研究; 张鹏等克隆了MCF-7细胞的Cdc25C全长基因, 得到了有磷酸酶活性的GST-Cdc25C融合蛋白.
具有地方特色, 针对广西高发癌进行, 从肝癌细胞株提取总RNA逆转录为cDNA后重组表达Cdc25C. 首次将其作为肝癌相关抗原, 为下一步研究做准备.
本文具有一定的实验意义.
编辑: 田滢 电编:鲁亚静
| 1. | Perdiguero E, Nebreda AR. Regulation of Cdc25C activity during the meiotic G2/M transition. Cell Cycle. 2004;3:733-737. [PubMed] [DOI] |
| 2. | Wang X, Zhao H, Xu Q, Jin W, Liu C, Zhang H, Huang Z, Zhang X, Zhang Y, Xin D. HPtaa database-potential target genes for clinical diagnosis and immunotherapy of human carcinoma. Nucleic Acids Res. 2006;34:D607-D612. [PubMed] [DOI] |
| 4. | Wickramasinghe D, Becker S, Ernst MK, Resnick JL, Centanni JM, Tessarollo L, Grabel LB, Donovan PJ. Two CDC25 homologues are differentially expressed during mouse development. Development. 1995;121:2047-2056. [PubMed] |
| 5. | Nilsson I, Hoffmann I. Cell cycle regulation by the Cdc25 phosphatase family. Prog Cell Cycle Res. 2000;4:107-114. [PubMed] [DOI] |
| 6. | Boutros R, Dozier C, Ducommun B. The when and wheres of CDC25 phosphatases. Curr Opin Cell Biol. 2006;18:185-191. [PubMed] [DOI] |
| 8. | Kawabe T. G2 checkpoint abrogators as anticancer drugs. Mol Cancer Ther. 2004;3:513-519. [PubMed] |
| 9. | Chen T, Stephens PA, Middleton FK, Curtin NJ. Targeting the S and G2 checkpoint to treat cancer. Drug Discov Today. 2012;17:194-202. [PubMed] [DOI] |
| 10. | 凌 晖, 苏 琦, 廖 前进, 唐 海林, 曾 希. Cdc25C cyclin B1在二烯丙基二硫化物诱导人胃癌BGC823细胞G2/M期阻滞中的作用. 中国肿瘤临床. 2008;35:1299-1302. |
| 11. | Chou YW, Zhang L, Muniyan S, Ahmad H, Kumar S, Alam SM, Lin MF. Androgens upregulate Cdc25C protein by inhibiting its proteasomal and lysosomal degradation pathways. PLoS One. 2013;8:e61934. [PubMed] [DOI] |
| 12. | Lo YH, Lin IL, Lin CF, Hsu CC, Yang SH, Lin SR, Wu MJ. Novel acyclic enediynes inhibit Cyclin A and Cdc25C expression and induce apoptosis phenomenon to show potent antitumor proliferation. Bioorg Med Chem. 2007;15:4528-4536. [PubMed] [DOI] |
| 13. | Ozen M, Ittmann M. Increased expression and activity of CDC25C phosphatase and an alternatively spliced variant in prostate cancer. Clin Cancer Res. 2005;11:4701-4706. [PubMed] [DOI] |
| 14. | Hernández S, Bessa X, Beà S, Hernández L, Nadal A, Mallofré C, Muntane J, Castells A, Fernández PL, Cardesa A. Differential expression of cdc25 cell-cycle-activating phosphatases in human colorectal carcinoma. Lab Invest. 2001;81:465-473. [PubMed] [DOI] |
| 15. | Albert H, Santos S, Battaglia E, Brito M, Monteiro C, Bagrel D. Differential expression of CDC25 phosphatases splice variants in human breast cancer cells. Clin Chem Lab Med. 2011;49:1707-1714. [PubMed] [DOI] |
| 16. | Wang Z, Trope CG, Flørenes VA, Suo Z, Nesland JM, Holm R. Overexpression of CDC25B, CDC25C and phospho-CDC25C (Ser216) in vulvar squamous cell carcinomas are associated with malignant features and aggressive cancer phenotypes. BMC Cancer. 2010;10:233. [PubMed] [DOI] |
| 17. | Garuti L, Roberti M, Pizzirani D. Synthetic small molecule Cdc25 phosphatases inhibitors. Curr Med Chem. 2008;15:573-580. [PubMed] [DOI] |