修回日期: 2014-04-15
接受日期: 2014-04-28
在线出版日期: 2014-05-28
目的: 探讨染料木黄酮(Genistein, Gen)与5-氟尿嘧啶(5-fluorouracil, 5-FU)诱导人肝癌MHCC97-L细胞周期阻滞与细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)1/2信号通路的关系.
方法: MTS法检测细胞增殖; 流式细胞术检测细胞周期; Western blot检测总ERK1/2和磷酸化ERK1/2蛋白表达.
结果: Gen与5-FU单用及联用均能抑制肝癌MHCC97-L细胞增殖; Gen诱导细胞S期阻滞, 少量抑制ERK1/2磷酸化, ERK1/2抑制剂可促进Gen对MHCC97-L细胞的生长抑制作用, 而对S期阻滞无明显影响; 5-FU单用和二者联用组均阻滞S期细胞, 并显著激活ERK1/2磷酸化, ERK1/2抑制剂可促进两组药物对MHCC97-L细胞的生长抑制和诱导S期阻滞作用.
结论: Gen与5-FU单用及联用均可通过阻滞细胞周期来发挥抗肝癌细胞增殖的作用; 抑制ERK1/2通路可抵抗Gen诱导的肝癌细胞S期阻滞, 而促进5-FU单用和二者联用组诱导肝癌细胞S期阻滞.
核心提示: 在本研究结果中, 同时看到不同药物可以通过激活或抑制细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)1/2磷酸化发挥抗肝癌细胞生长的生物学效应, 不同的刺激因素及ERK1/2与其他信号途径的相互作用等都可能成为ERK1/2调控细胞周期的复杂因素.
引文著录: 刘丹, 赵忠新, 迟大鹏, 梅庆步, 于海涛, 岳丽玲, 王玉, 陈萍, 郑立红, 王秀华, 王钰粟. ERK1/2通路对Genistein与5-FU诱导的人肝癌细胞周期阻滞的影响. 世界华人消化杂志 2014; 22(15): 2134-2139
Revised: April 15, 2014
Accepted: April 28, 2014
Published online: May 28, 2014
AIM: To investigate the role of the extracellular regulated protein kinases (ERK)1/2 pathway in genistein and 5-fluorouracil (5-FU)-induced cell cycle arrest in human hepatoma cells.
METHODS: The MTS method was used to assay cell proliferation. Cell cycle was detected by flow cytometry. The protein expression of total ERK1/2 and phospho-ERK1/2 was detected by Western blot.
RESULTS: Genistein and 5-FU, alone or in combination, inhibited proliferation of MHCC97-L cells. Genistein induced an S-phase arrest and slightly inhibited the expression of phospho-ERK1/2. ERK1/2 inhibitor could promote the inhibition of MHCC97-L cells by genistein, but had no significant effect on S-phase arrest. 5-FU alone or in combination with genistein arrested the cells in S phase and significantly activated ERK1/2. ERK1/2 inhibitor increased genistein and 5-FU-induced growth inhibition of MHCC97-L cells and S-phase arrest.
CONCLUSION: Genistein and 5-FU inhibit the proliferation of liver cancer cells by arresting the cell cycle. Inhibition of the ERK1/2 pathway can resist genistein-induced S phase arrest in liver cancer cells, but promote S phase arrest induced by 5-FU alone or in combination with genistein.
- Citation: Liu D, Zhao ZX, Chi DP, Mei QB, Yu HT, Yue LL, Wang Y, Chen P, Zheng LH, Wang XH, Wang YS. Handan Ganle inhibits PI3K/Akt signaling pathway in liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(15): 2134-2139
- URL: https://www.wjgnet.com/1009-3079/full/v22/i15/2134.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i15.2134
细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)1/2是丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路的一个重要亚族, 是调节细胞生长、发育及增殖的信号网络核心, 遵循MAPKs的三级酶促级联反应, 即刺激因素→MAPKKK→MAPKK→MAPK, 在ERKs传递途径中, MEK1/2作为MAPKK. PD98059是MEK1/2特异性抑制剂, 他可通过抑制MEK1/2的活性来抑制ERK1/2的磷酸化和激活, 从而发挥阻断ERK1/2信号通路的作用. 染料木黄酮(Genistein, Gen)为天然异黄酮物质, 具有多种生物学活性, 5-氟尿嘧啶(5-fluorouracil, 5-FU)为消化系肿瘤常用的化疗药物, 两者联合有可能成为临床预防和治疗肿瘤的可行性方法, 但其机制尚未明确. 本研究在前期结果[1]的基础之上, 以人肝癌细胞MHCC97-L为模型, 探讨Gen与5-FU诱导肝癌细胞周期阻滞与ERK1/2信号通路的关系.
肝癌MHCC97-L细胞购自复旦大学肝癌研究所. Gen(Sigma); 5-FU(天津金耀氨基酸有限公司); PD98059、MTS(Promega); 优级胎牛血清(Hyclone); 胰蛋白酶、DMSO(Amresco); DMEM高糖培养基(Gibco); 细胞周期检测试剂盒(上海碧云天生物技术有限公司); ERK1/2 polyclonal antibody、Phospho-ERK1/2 polyclonal antibody(Immunoway); β-actin(武汉博士德生物工程有限公司); 哺乳动物蛋白抽提试剂盒、BCA蛋白定量试剂盒、一步法快速WB(HRP)试剂盒(北京康为世纪生物科技有限公司); 蛋白Marker(MBI); ECL超敏发光液(北京普利莱基因技术有限公司); NC膜(Pall); 胶片(富士); 余为进口分装或国产分析纯.
1.2.1 细胞培养: MHCC97-L细胞用含10%FBS的DMEM高糖培养液置于37 ℃、5%CO2培养箱中培养, 隔1 d换液, 细胞贴壁生长, 待满瓶底时, 用胰酶消化, 吹打成单细胞, 分瓶传代.
1.2.2 实验分组: 实验分为对照组、Gen组(80 μmol/L)、5-FU组(40 μmol/L)、PD98059组(50 μmol/L)、Gen+5-FU组(80 μmol/L+40 μmol/L)、PD98059+Gen组(50 μmol/L+80 μmol/L)、PD98059+5-FU组(50 μmol/L+40 μmol/L)、PD98059+Gen+5-FU组(50 μmol/L+80 μmol/L +40 μmol/L), 后三组为阻断ERK1/2的药物组(PD98059预处理1 h后, 再加入联合的其他药物).
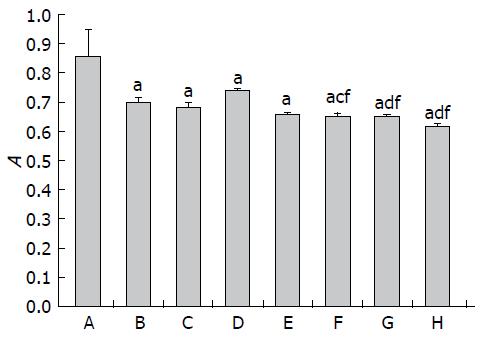
1.2.3 MTS: 取对数生长期的MHCC97-L细胞, 以6×103个/孔细胞浓度接种于96孔板, 每孔100 μL细胞悬液, 每组设4个复孔, 培养24 h后换液, 分别加入不同处理因素的培养液200 μL, 培养48 h后, 加入MTS, 每孔10 μL, 继续孵育2 h, 于自动酶标仪490 nm处测定每孔的吸光度(A)值, 实验重复3次, 计算抑制率(inhibition ratio, IR), IR(%) = (1-药物组A值/对照组A值)×100%.
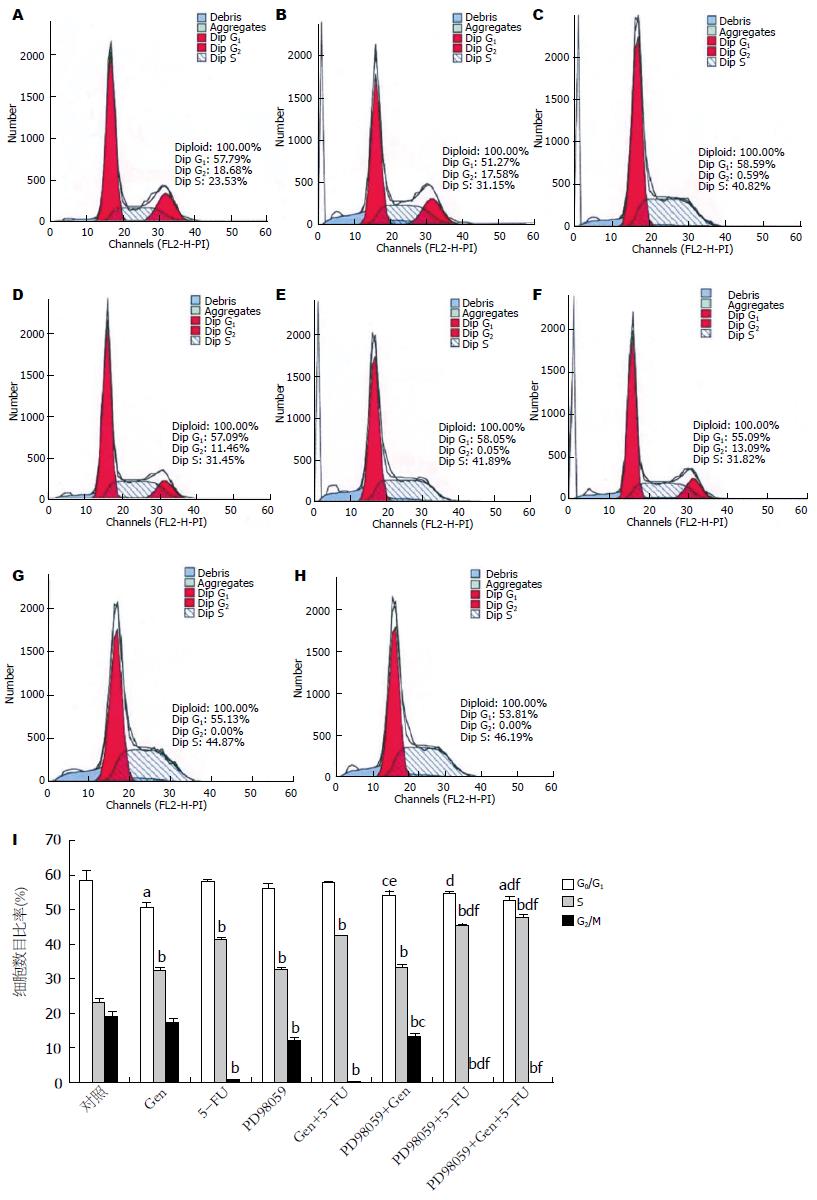
1.2.4 流式细胞术检测细胞周期: 将处于对数生长期的MHCC97-L细胞以1×105个/孔细胞浓度接种于12孔板中, 每孔1 mL细胞悬液, 每组设2个复孔, 培养24 h后换液, 加入不同处理因素的培养液, 培养48 h后, 胰酶消化, 收集细胞, PBS(预冷)洗涤细胞1次, 加入1mL 70 mL/L乙醇(预冷), 4 ℃固定12-24 h, 收集细胞, PBS(预冷)重悬细胞1次, 加入PI工作液500 μL, 37 ℃避光温浴30 min, 流式细胞仪在激发波长488 nm波长处检测红色荧光, 以MODIFIT软件分析细胞DNA含量及光散射分析, 实验重复3次.
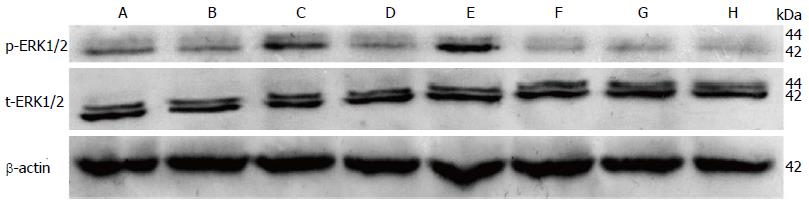
1.2.5 Western blot检测总ERK1/2(t-ERK1/2)及磷酸化ERK1/2(p-ERK1/2)的蛋白表达: 抽提细胞蛋白, 取对数生长期的MHCC97-L细胞, 以3×105个/孔细胞浓度接种于6孔板中, 每孔2 mL细胞悬液, 每组设2个复孔, 培养24 h后换液, 加入不同处理因素的培养液, 培养48 h后, PBS(预冷)洗涤细胞2次, 冰上加入400 μL的蛋白抽提试剂(裂解液与蛋白酶抑制剂的混合物), 冰上用枪头小心吹打贴壁细胞, 将裂解液转移至EP管中, 冰上孵育30 min, 4 ℃ 14000 g离心10 min, 小心转移上清液至新EP管中, 并记录各组转移体积. BCA蛋白定量, 采用微孔检测法, 将稀释好的A-G组BSA标准品和待测蛋白样品(稀释10倍)各25 μL分别加入96孔板, 每组设3个复孔, 加入200 μL BCA工作液, 混匀后, 37 ℃孵育30 min, 冷却至室温后, 于自动酶标仪检测570 nm的吸光度值, 绘制标准曲线, 计算待测样品的蛋白浓度, 用5×上样缓冲液和细胞裂解液稀释, 调整待测样品蛋白浓度为2 μg/μL, 100 ℃加热5min, 冷却后混匀, -20 ℃保存. 取各组样品15 mL(30 μg)上样, 经SDS-PAGE电泳分离蛋白样品后, 转移至NC膜上, 封闭液封闭10 min, 再用抗体反应液处理后的一抗4 ℃孵育过夜, 经洗涤3次(每次5 min)后, 进行ECL发光, 显影, 定影, 用Photoshop13.0软件分析胶片泳带, 靶蛋白表达量用相对比率来表示.
统计学处理 数据用mean±SD表示, 采用SPSS16.0软件进行统计学分析, 两组间均数比较采用t检验. P<0.05为差异有统计学意义.
检测48 h各药物组抑制肝癌细胞增殖情况 各药物组均能明显抑制细胞生长(P<0.05)(图1). 同时, PD98059、Gen、PD98059+Gen、5-FU、PD98059+5-FU、Gen+5-FU、PD98059+Gen+5-FU各组对肝癌细胞的抑制率分别为13.68%、18.01%、23.86%、20.58%、24.44%、22.92%、27.95%, PD98059预处理1 h的药物组抑制率均明显高于对应单药抑制率, 明显低于对应单药抑制率的叠加, 说明Gen、5-FU、Gen+5-FU发挥抗MHCC97-L细胞增殖作用需要ERK通路介导, 但不是唯一机制, 抑制ERK通路可促进三者对MHCC97-L细胞的抗增殖作用.
Gen组G0/G1期细胞减少, S期细胞增多, 阻滞S期; 5-FU组S期细胞明显增多, G2/M期细胞明显减少, 阻滞S期; PD98059组S期细胞增多, G2/M期细胞减少, 阻滞S期; Gen+5-FU组5-FU拮抗Gen对G0/G1期的减少, 二者对S期阻滞的协同作用不明显, 阻滞S期(图2).
阻断ERK的Gen组与PD98059和Gen单用比较, 其G0/G1期细胞较PD98059组减少、较Gen组增多, 阻断ERK后的Gen仍可推动G1期向S期转化, 但未达到本身单药水平, 说明抑制ERK通路可拮抗Gen对MHCC97-L细胞G0/G1期的减少作用, 而三者对S期阻滞无明显变化(P>0.05), 又说明Gen诱导MHCC97-L细胞S期阻滞与ERK通路密切相关; 阻断ERK的5-FU组与PD98059和5-FU单用比较, 其对S期细胞阻滞完全, G2/M期为0, 表明5-FU诱导MHCC97-L细胞S期阻滞与ERK通路相关, 但存在其他机制, 且抑制ERK通路可促进5-FU对MHCC97-L细胞S期阻滞的增加和G2/M期的减少; 阻断ERK的Gen+5-FU组, PD98059能增加Gen+5-FU对G0/G1期细胞的减少作用, 也致S期细胞完全阻滞, G2/M期为0, 既推动G1期向S期转化, 又完全阻滞S期, 提示Gen+5-FU组诱导MHCC97-L细胞S期阻滞与ERK通路有关, 仍存在其他机制, 且抑制ERK通路可促进Gen+5-FU对MHCC97-L细胞G0/G1期和G2/M期的减少作用(图2).
2.3 Western blot 各组t-ERK1/2的相对表达量差异不明显, p-ERK1/2的相对表达量由高到低依次为Gen+5-FU、5-FU、对照组、Gen、PD98059、PD98059+5-FU、PD98059+Gen、PD98059+Gen+5-FU, 提示5-FU和Gen+5-FU作用48 h后, 仍可显著激活MHCC97-L细胞ERK1/2活性, 而Gen作用48 h后, p-ERK1/2仅小幅度减少, 应用阻断剂的药物组ERK1/2活性进一步被抑制(图3).
ERK1/2信号通路被视为肿瘤治疗的新靶点[2-5], 他是调控细胞增殖的重要途径, 细胞增殖由细胞周期实现, 很多药物通过影响肿瘤细胞周期分布而致肿瘤细胞凋亡、坏死和自噬. Ma等[6]证明在体内外, Gen能明显抑制肝癌细胞生长和血管生成, 抑制Akt的活化和NF-κB的活性, 进而抑制cyclin D1等与NF-κB相关基因产物的表达, 而cyclin D是细胞G1/S期转化所必需的细胞周期蛋白[7], 抑制cyclin D可导致细胞G0/G1期阻滞. Gu等[8]通过体外实验提出, Gen可抑制肝癌MHCC97-H细胞的增殖、粘附与侵袭, 诱导细胞凋亡, 并呈浓度依赖, G0/G1期细胞阻滞, S期细胞减少. 肝癌MHCC97-H和MHCC97-L细胞属于同源不同转移潜能的两个细胞系, 前者转移率高, 后者转移率低. 本实验结果显示, Gen通过增加G1/S期转化来诱导S期阻滞, S期阻滞可能由Gen少量降低ERK1/2活性来实现, 抑制ERK1/2通路可抵抗Genistein诱导的肝癌细胞S期阻滞.
一般认为, 激活ERK途径可以促进细胞生长, 但有时也可以抑制细胞增殖, 因细胞种类、类型及其在不同环境中激活的机制而异[9-11]. Shen等[12]证明化疗药物(阿霉素)可以激活ERK通路. Lee等[13]在研究佛波酯诱导人红白血病K562细胞分化时, 发现cyclin D1表达增加和cyclin B1表达降低是ERK活性持续上升的结果. Chen等[14]报道, 硒代胱氨酸可通过激活ERK1/2来诱导S期阻滞, 促进人乳腺癌MCF-7细胞凋亡. Tsukada等[15]发现, ERK通路对肝癌HepG2细胞增殖效应取决于ERK活化的水平, ERK活性在一定范围内可刺激肝癌细胞增殖, 低于此范围不能刺激细胞增殖, 高于此范围, 可致细胞周期停滞而抑制细胞增殖. 本实验结果显示, 5-FU通过阻止S/G2转化来实现S期阻滞, S期阻滞部分由5-FU显著激活ERK1/2活性来实现; Gen与5-FU联用(同时加药)抑制肝癌MHCC97-L细胞增殖主要以5-FU的作用为主, 在抗增殖作用中Gen和5-FU有协同作用, 但5-FU能拮抗Gen的S期阻滞; 联用后所致的p-ERK1/2相对表达量最高与S期阻滞有关; 抑制ERK1/2通路可促进5-FU单用和二者联用组诱导肝癌细胞S期阻滞. 在Gen+5-FU、5-FU与Gen组中, 存在着一种趋势, 即p-ERK1/2相对表达量与抗MHCC97-L细胞生长抑制率、S期细胞阻滞和G2/M期细胞减少依次由高到低(或由多到少)呈正相关.
总之, 本研究结果中, 同时看到不同药物可以通过激活或抑制ERK1/2磷酸化发挥抗肝癌细胞生长的生物学效应, Gen与5-FU单用及联用均可通过阻滞细胞周期来发挥抗肝癌细胞增殖的作用. 不同的刺激因素及ERK1/2与其他信号途径的相互作用等都可能成为ERK1/2调控细胞周期的复杂因素, 这些因素也在不断的变化以达到某种平衡, 仍有待于深入探索与研究.
ERK1/2通路是调控细胞增殖的重要途径, 细胞增殖由细胞周期实现, 在药物抑制肿瘤细胞生长的研究中, 明确ERK1/2通路与细胞周期的关系有利于发现药物的作用机制及指导临床的用药.
傅晓辉, 副教授, 副主任医师, 东方肝胆外科医院
Genistein与化疗药物联合阻滞肿瘤细胞周期与ERK1/2通路相关性的大小有可能成为评价药物联用的可行性和有效性的指标.
激活ERK途径可以促进细胞生长, 但有时也可以抑制细胞增殖, 因细胞种类、类型及其在不同环境中激活的机制而异. 某些化疗药物可以通过激活ERK通路, 阻滞肿瘤细胞周期. ERK通路对肝癌细胞增殖效应取决于ERK活化的水平, ERK活性在一定范围内可刺激肝癌细胞增殖, 低于此范围不能刺激细胞增殖, 高于此范围, 可致细胞周期停滞而抑制细胞增殖.
本实验结果显示, Genistein与5-FU单用及联用均可通过阻滞细胞周期来发挥抗肝癌细胞增殖的作用; 抑制ERK1/2通路可抵抗Genistein诱导的肝癌细胞S期阻滞, 而促进5-FU单用和二者联用组诱导肝癌细胞S期阻滞.
Genistein是天然异黄酮物质, 5-FU是消化系肿瘤常用的化疗药物, 二者联合有可能增强肿瘤细胞对化疗药物的敏感性, 降低肿瘤细胞耐药性的产生, 减少化疗药物的剂量, 从而减轻患者的不良反应.
本文选题新颖, 实验方法科学, 结论可信. 为肝癌治疗提供了新的思路.
编辑: 田滢 电编:鲁亚静
| 2. | Roberts PJ, Der CJ. Targeting the Raf-MEK-ERK mitogen-activated protein kinase cascade for the treatment of cancer. Oncogene. 2007;26:3291-3310. [PubMed] |
| 3. | Wong KK. Recent developments in anti-cancer agents targeting the Ras/Raf/ MEK/ERK pathway. Recent Pat Anticancer Drug Discov. 2009;4:28-35. [PubMed] |
| 4. | Deng LF, Wang YH, Jia QA, Ren ZG, Shen HJ, Sun XJ, Li JH. [Anti-proliferation effect of sorafenib in combination with 5-FU for hepatocellular carcinoma in vitro: antagonistic performance and mechanism]. Zhonghua Gan Zang Bing Za Zhi. 2013;21:845-849. [PubMed] [DOI] |
| 5. | Guégan JP, Frémin C, Baffet G. The MAPK MEK1/2-ERK1/2 Pathway and Its Implication in Hepatocyte Cell Cycle Control. Int J Hepatol. 2012;2012:328372. [PubMed] [DOI] |
| 6. | Ma Y, Wang J, Liu L, Zhu H, Chen X, Pan S, Sun X, Jiang H. Genistein potentiates the effect of arsenic trioxide against human hepatocellular carcinoma: role of Akt and nuclear factor-κB. Cancer Lett. 2011;301:75-84. [PubMed] [DOI] |
| 8. | Gu Y, Zhu CF, Dai YL, Zhong Q, Sun B. Inhibitory effects of genistein on metastasis of human hepatocellular carcinoma. World J Gastroenterol. 2009;15:4952-4957. [PubMed] |
| 9. | Chang F, Steelman LS, Shelton JG, Lee JT, Navolanic PM, Blalock WL, Franklin R, McCubrey JA. Regulation of cell cycle progression and apoptosis by the Ras/Raf/MEK/ERK pathway (Review). Int J Oncol. 2003;22:469-480. [PubMed] |
| 10. | Hu H, Jiang C, Li G, Lü J. PKB/AKT and ERK regulation of caspase-mediated apoptosis by methylseleninic acid in LNCaP prostate cancer cells. Carcinogenesis. 2005;26:1374-1381. [PubMed] |
| 11. | Cagnol S, Chambard JC. ERK and cell death: mechanisms of ERK-induced cell death--apoptosis, autophagy and senescence. FEBS J. 2010;277:2-21. [PubMed] [DOI] |
| 12. | Shen H, Xu W, Luo W, Zhou L, Yong W, Chen F, Wu C, Chen Q, Han X. Upregulation of mdr1 gene is related to activation of the MAPK/ERK signal transduction pathway and YB-1 nuclear translocation in B-cell lymphoma. Exp Hematol. 2011;39:558-569. [PubMed] [DOI] |
| 13. | Lee CH, Yun HJ, Kang HS, Kim HD. ERK/MAPK pathway is required for changes of cyclin D1 and B1 during phorbol 12-myristate 13-acetate-induced differentiation of K562 cells. IUBMB Life. 1999;48:585-591. [PubMed] |
| 14. | Chen T, Wong YS. Selenocystine induces S-phase arrest and apoptosis in human breast adenocarcinoma MCF-7 cells by modulating ERK and Akt phosphorylation. J Agric Food Chem. 2008;56:10574-10581. [PubMed] [DOI] |
| 15. | Tsukada Y, Miyazawa K, Kitamura N. High intensity ERK signal mediates hepatocyte growth factor-induced proliferation inhibition of the human hepatocellular carcinoma cell line HepG2. J Biol Chem. 2001;276:40968-40976. [PubMed] |