修回日期: 2014-03-25
接受日期: 2014-04-03
在线出版日期: 2014-05-28
目的: 观察Smurf1、Smurf2、Smad3和Smad7蛋白在人肝纤维化组织中的表达, 探讨四者的相互关系及介导的信号传导在肝纤维化发生中的作用机制.
方法: 采用免疫组织化学法测定9例正常肝组织和38例慢性乙型肝炎病毒(hepatitis B virus, HBV)感染者肝组织中Smurf1、Smurf2、Smad3和Smad7的表达情况.
结果: Smurf1、Smurf2、Smad3和Smad7在肝内实质细胞及非实质细胞均可见广泛表达. 与正常肝相比, 肝纤维化组Smad3、Smurf2的阳性表达率显著增加(66.7% vs 100%、66.7% vs 92.1%, P<0.01、P<0.01), Smad7阳性表达率显著降低(77.8% vs 39.5%, P<0.01); 而Smurf1阳性表达率无显著变化(77.8% vs 63.2%, P>0.05), 差异无统计学意义. Smad3、Smurf2与纤维化程度呈显著正相关(P<0.01、P<0.01); Smad7与纤维化程度呈显著负相关(P<0.01); Smurf1与肝纤维化无显著相关性(P>0.05). Smurf2与Smad3呈显著正相关(P<0.01), 与Smad7呈显著负相关(P<0.01); Smurf1与Smurf2、Smad3、Smad7均无相关性(均P>0.05); Smad3与Smad7呈负相关(P<0.01).
结论: Smad3信号增强及Smad7信号缺失可能导致肝纤维化发展, Smurf2在肝纤维化进展中可能发挥双向调节作用.
核心提示: Smad泛素化调节因子(smad ubiquitination regulatory factor, Smurf)参与了转化生长因子β1(transforming growth factor-β1)/Smad信号通路的调节, Smurf2在肝纤维化进展中发挥双向调节作用, 但其对信号通路的促进作用可能远大于抑制作用, 最终促进肝纤维化的进展.
引文著录: 王标钰, 张法灿, 张国. 泛素调节因子在人肝纤维化过程中的表达及意义. 世界华人消化杂志 2014; 22(15): 2100-2107
Revised: March 25, 2014
Accepted: April 3, 2014
Published online: May 28, 2014
AIM: To observe the expression of Smad ubiquitination regulatory factor (Smurf)1, Smurf2, Smad3 and Smad7 proteins in liver fibrosis and to evaluate their interactions.
METHODS: Immunohistochemistry was applied to detect the expression of Smurf1, Smurf2, Smad3 and Smad7 in 9 normal liver tissue samples and 38 chronic HBV infection tissue samples.
RESULTS: Smurf1, Smurf2, Smad3 and Smad7 showed widespread expression in the liver parenchymal cells and nonparenchymal cells. Compared with normal liver tissue, the positive rates of Smad3 and Smurf2 expression increased significantly (66.7% vs 100%, 66.7% vs 92.1%, P < 0.01 for both) and the positive rate of Smad7 expression decreased significantly in liver fibrosis (77.8% vs 39.5%, P < 0.01), although the positive rate of Smurf1 expression had no significant change (77.8% vs 63.2%, P > 0.05). There were significant positive correlations between Smad3 and Smurf2 expression and the degree of fibrosis (P < 0.01 for both). Smad7 expression was negatively correlated with the degree of fibrosis (P < 0.01). There was no significant correlation between Smurf1 expression and liver fibrosis (P > 0.05). Smurf2 expression was positively correlated with Smad3 expression (P < 0.01) and negatively with Smad7 expression (P < 0.01). There was no significant relationship between Smurf1 and Smurf2, Smad3, Smad7 expression (P > 0.05 for all). There was a negative correlation between expression of Smad3 and that of Smad7 (P < 0.01).
CONCLUSION: The increase of Smad3 signal and decrease of Smad7 signal may lead to the development of liver fibrosis, and Smurf2 may play a bidirectionally regulatory role in the progression of liver fibrosis.
- Citation: Wang BY, Zhang FC, Zhang G. Significance of expression of Smad ubiquitination regulatory factors in liver fibrosis. Shijie Huaren Xiaohua Zazhi 2014; 22(15): 2100-2107
- URL: https://www.wjgnet.com/1009-3079/full/v22/i15/2100.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i15.2100
目前认为肝纤维化发生时细胞外基质(extracellular matrix, ECM)主要来源于活化的肝星状细胞(hepatic stellate cell, HSC), 而转化生长因子β1(transforming growth factor-β1, TGF-β1)则是导致肝纤维化最重要的细胞因子之一[1]. 转化生长因子β超家族信号传导因子(drosophila mothers against decapentaplegic protein, Smad)蛋白做为TGF-β1下游信号因子, 在TGF-β1/Smad信号通路中发挥着重要作用. Smad泛素化调节因子-2(smad ubiquitination regulatory factor2, Smurf2) 是E3泛素链接酶中的一种, 在TGF-β1/Smad信号通路起着重要的调控作用[2-4]. 我们对慢性乙型肝炎病毒(hepatitis B virus, HBV)感染者进行肝纤维化分级, 然后用免疫组织化学法检测Smurf1、Smurf2、Smad3和Smad7在人正常肝组织及肝纤维化组织中的表达, 探讨四者的相互关系及介导的信号在纤维化发生中的作用.
收集2006-01/2012-12广西壮族自治区人民医院38例诊断明确的慢性HBV感染者病理存档肝穿标本(肝纤维化分级为S1-4期), 男性32例, 女性6例, 年龄39.18岁±9.60岁. 另9例因外伤及良性肿瘤手术切除而收集的正常肝组织来自广西医科大学一附院. 本研究经过广西壮族自治区人民医院伦理委员会同意. 所有标本均经过40 g/L甲醛固定, 石蜡包埋, 3 µm连续切片, 主要试剂Smad3、Smad7、Smurf1、Smurf2购自美国圣克鲁斯(Santa Cruz)公司, 辣根过氧化物酶标记二抗购自美国赛信通(Cell Signaling Technology)公司及中衫金桥公司.
1.2.1 肝标本病理学检查: 肝组织石蜡切片, 常规作HE染色及Masson染色观察组织学情况, 并由两名资深病理科专家做出组织学诊断.
1.2.2 采用免疫组织化学染色二步法: 石腊切片常规脱腊至水, 用0.01 mol/L的柠檬酸缓冲液煮沸后高压修复抗原10 min, 3%H2O2修复内原性过氧化物酶10 min, 自然然冷却室温后分别滴加Smad3、Smad7、Smurf1及Smurf2一抗4 ℃孵育过夜; PBS冲洗3 min×5次, 再依次滴加辣根过氧化物酶标记二抗, 37 ℃水浴箱孵育30 min; PBS冲洗3 min×5次, 最后DAB显色约3 min, 苏木素复染1 min, 1%盐酸乙醇分化2 s, 氨水反蓝. 常规乙醇脱水、中性树胶封片, 光镜下观察并分析Smurf1、Smurf2、Smad3和Smad7蛋白表达情况. Smurf1、Smurf2、Smad3和Smad7抗体稀释度均为1:100. 用PBS代替一抗作阴性对照. 免疫组织化学结果判定: 采用双盲法观察结果, 每例肝组织标本在高倍镜下选取5个视野, 评分标准参照文献[5], 根据组织切片中阳性细胞百分比和着色强度进行半定量分级评分. 阳性细胞百分比≤10%为0分, 11%-25%为1分, 26%-50%为2分, 51%-75%为3分, ≥76%为4分; 不着色为0分, 浅黄色为1分, 黄色为2分, 棕黄色为3分. 取上述两项分值乘积作为总积分: 0分为阴性, 1-4为弱阳性(+), 6-8分为阳性(++), 9-12分为强阳性(+++).
统计学处理 应用SPSS17.0软件对数据进行处理, 纤维化组与正常对照组Smurf1、Smurf2、Smad3和Smad7蛋白两两比较用秩和检验, Smurf1、Smurf2、Smad3和Smad7与肝纤维化等级相关性用Spearman相关性分析, Smurf1、Smurf2、Smad3和Smad7相互关系进行Spearman相关性分析, P<0.05为差异有统计学意义.
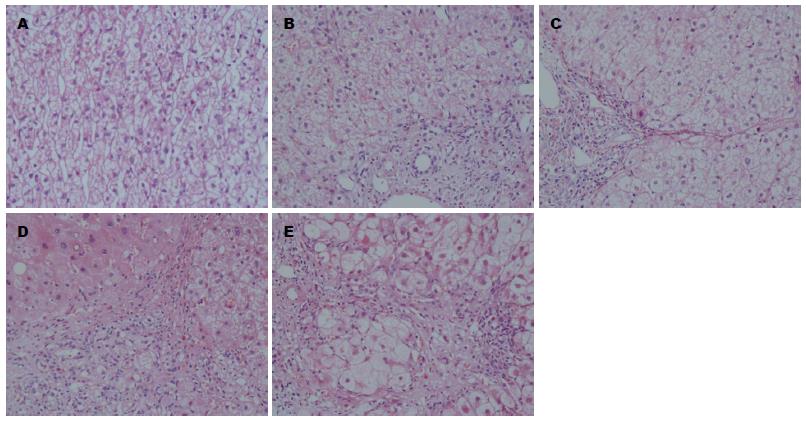
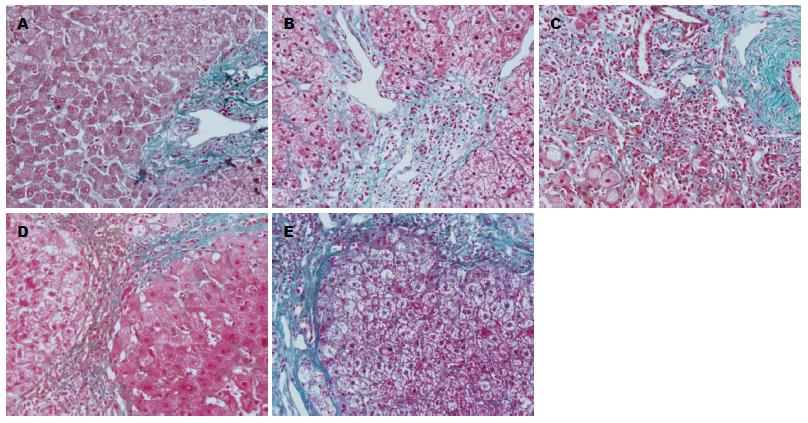
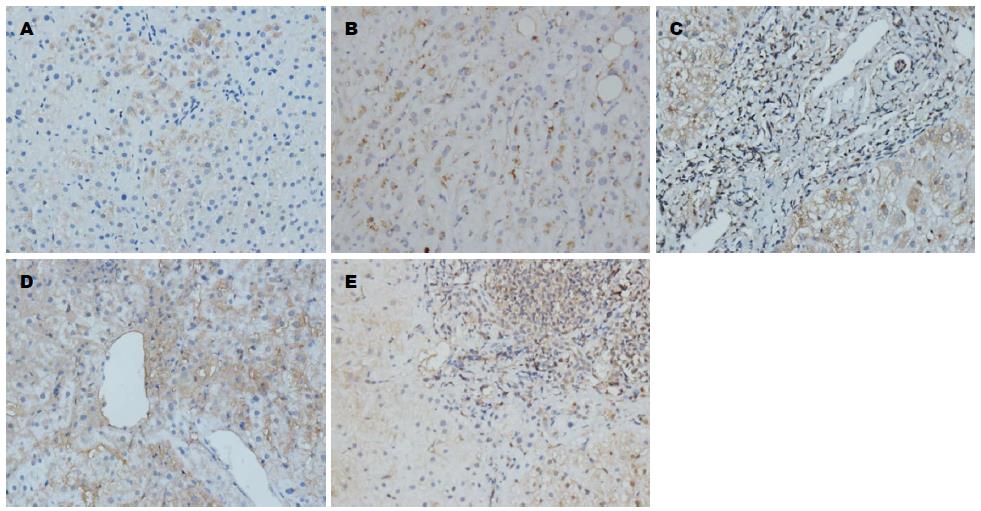
正常肝组织HE染色显示, 肝小叶结构正常, 肝细胞索以肝小叶中央静脉为中心呈放射状有序排列, 无明显炎性细胞浸润和细胞变性、坏死; 肝纤维化组织HE可见不同程度的变性、坏死及淋巴细胞浸润(图1). 正常肝Masson染色仅见汇管区有少量的纤维组织; 肝纤维化组织S1级可见汇管区纤维化扩大, 局限窦周及小叶内纤维化, S2级可见有纤维间隔形成, S3级纤维间隔伴小叶结构紊乱, S4级呈早期肝硬化表现(图2).
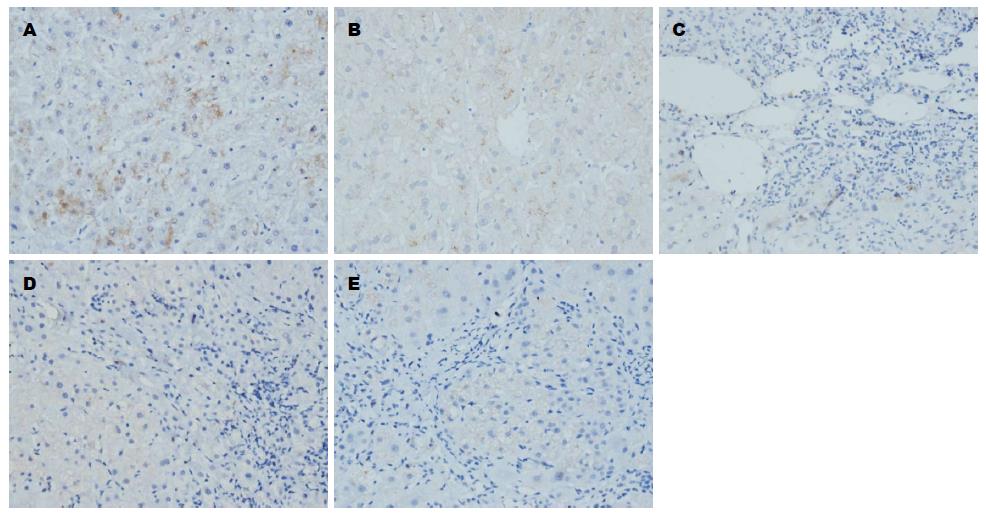
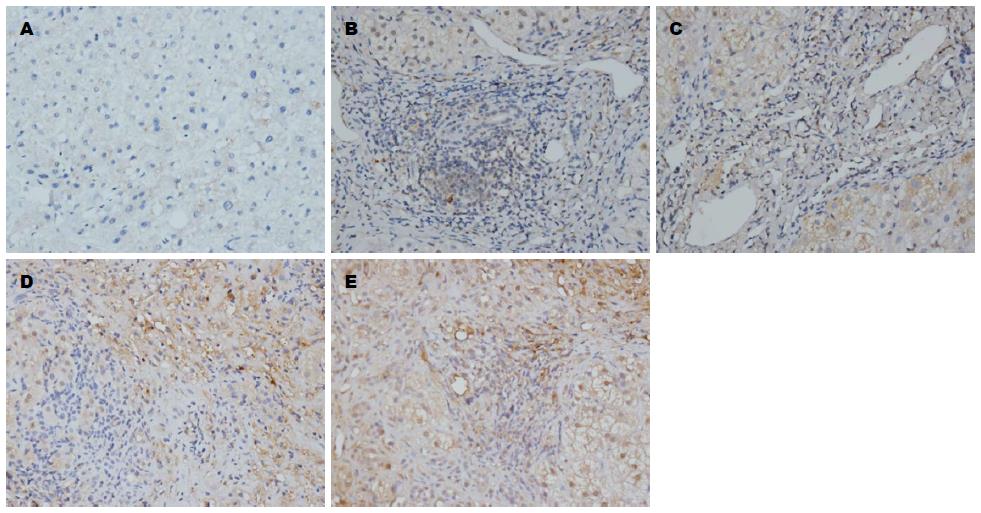
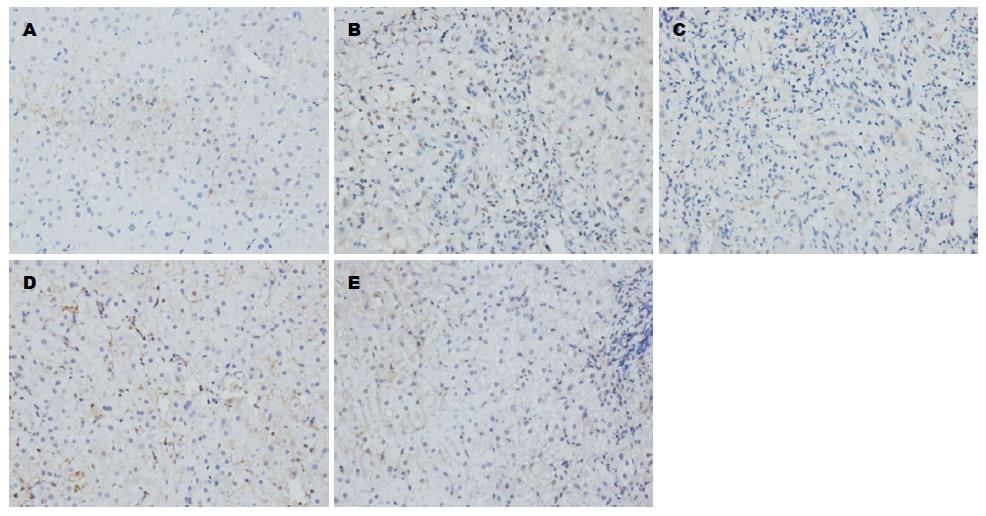
表达呈黄色及棕黄色, 在正常肝组织中主要分布在肝实质细胞胞质及肝星状细胞中, 汇管区及肝窦diss间隙亦可见少量弱阳性表达, 也可出现阴性表达. 与正常肝组织相比, Smad7表达明显减少, 主要分布在少数肝实质细胞胞质中, 较多表达为阴性(图3); Smad3、Smurf2表达明显增多, 主要分布在汇管区、纤维间隔及中央静脉周围的成纤维细胞、肝星状细胞及淋巴细胞, 肝实质细胞细胞质内亦可见弥漫性弱阳性表达(图4, 5). Smurf1表达与正常肝组织比较, 变化不显著, 主要在纤维间隔成纤维细胞、肝星状细胞及淋巴细胞及肝实质细胞细胞质内表达(图6). 与正常肝相比, 肝纤维化组Smad3、Smurf2表达显著增加(Z = -3.110、 Z = -2.716, P<0.01、 P<0.01), (表1, 2), Smad7表达显著降低(Z = -2.899, P<0.01), (表3); 而Smurf1表达无显著变化(Z = -1.399, P>0.05), (表4), 差异无统计学意义.
| 分组 | n | 表达强度 | |||
| - | + | ++ | +++ | ||
| 正常肝 | 9 | 3 | 3 | 3 | 0 |
| S1 | 13 | 0 | 6 | 5 | 2 |
| S2 | 9 | 0 | 2 | 5 | 2 |
| S3 | 9 | 0 | 0 | 7 | 2 |
| S4 | 7 | 0 | 0 | 2 | 5 |
| 分组 | n | 表达强度 | |||
| - | + | ++ | +++ | ||
| 正常肝 | 9 | 3 | 5 | 1 | 0 |
| S1 | 13 | 3 | 7 | 3 | 0 |
| S2 | 9 | 0 | 4 | 4 | 1 |
| S3 | 9 | 0 | 1 | 7 | 1 |
| S4 | 7 | 0 | 1 | 3 | 3 |
| 分组 | n | 表达强度 | |||
| - | + | ++ | +++ | ||
| 正常肝 | 9 | 2 | 3 | 4 | 0 |
| S1 | 13 | 5 | 8 | 0 | 0 |
| S2 | 9 | 6 | 3 | 0 | 0 |
| S3 | 9 | 6 | 3 | 0 | 0 |
| S4 | 7 | 6 | 1 | 0 | 0 |
| 分组 | n | 表达强度 | |||
| - | + | ++ | +++ | ||
| 正常肝 | 9 | 2 | 4 | 3 | 0 |
| S1 | 13 | 5 | 7 | 1 | 0 |
| S2 | 9 | 4 | 5 | 0 | 0 |
| S3 | 9 | 4 | 2 | 3 | 0 |
| S4 | 7 | 1 | 6 | 0 | 0 |
Smad3、Smurf2与纤维化程度呈显著正相关(r = 0.627、r = 0.652, P<0.01、 P<0.01), (表1, 2, 图4, 5); Smad7与纤维化程度呈显著负相关(r = -0.488, P<0.01), (表3, 图3); Smurf1与肝纤维化无显著相关性(r = -0.064, P>0.05), (表4, 图6).
Smurf2与Smad3呈显著正相关(r = 0.523, P<0.01), 与Smad7呈显著负相关(r = -0.447, P<0.01); Smurf1与Smurf2、Smad3、Smad7无相关性(r = -0.008、r = -0.053、 r = 0.219, P>0.05); Smad3与Smad7呈负直线相关(r = -0.389, P<0.01).
TGF-β1是引起肝纤维化最有效的细胞因子, 通过促进ECM的产生和沉积引起肝纤维化的发生, 其中TGF-β1/Smad信号传导通路是促进ECM生成的重要途径[6]. ECM主要来源于活化的肝星状细胞, 而肝星状细胞(hepatic stellate cell, HSC)的活化和增殖是肝纤维化发展的中心环节[7], TGF-β1可通过与其唯一的底物Smads结合发挥生物效应, 从而刺激HSC的活化和增殖[8]. 现在许多研究都集中在TGF-β信号传导通路, 特别是其底物及受体的调节[9-12]. 我们的研究显示, 在肝纤维化组织中Smad3大量表达在肝汇管区、纤维间隔的肝星状细胞及成纤维细胞中, 说明TGF-β1信号传导活跃导致了HSC大量活化. 根据其Smads在TGF-β信号传导中功能不同分为3类: (1)受体调节性Smads(R-Smads): 其中Smad2、3直接参与TGF-β信号传导; (2)通用性Smads(Co-Smad), 主要是Smad4; (3)抑制性Smads(I-Smads), 包括Smad6、7, 其中Smad7对TGF-β1/Smad信号传导进行负调控. 目前认为TGF-β1主要通过受体及其下游信号分子Smads完成信号通路的传导. TGF-β首先与受体复合物中的Ⅱ型受体结合, 然后磷酸化并激活Ⅰ型受体中的丝氨酸/苏氨酸激酶, 活化的Ⅰ型受体可磷酸化R-Smads, R-Smads可与Smad4形成复合物, 穿梭入细胞胞核内调节基因表达[13].
Smurf是E3泛素连接酶HECT家族中的成员之一, 其中Smurf2在调节TGF-β1/Smad过程中扮演着重要角色. 研究发现Smurf2可以通过降解TGF-βⅠ型及Ⅱ受体抑制TGF-β信号通路的转导[2]. Smurf2除了对TGF-β受体的降解外, 还选择性地与Smad2和Smad3直接结合, 泛素化降解Smad2及Smad3[14], 从而减弱TGF-β信号. 此外, 其可与Smad7形成Smad7-Smurf2复合物再与TGF-β受体结合, 最终共同降解Smad7和TGF-β受体[15-17]. Smurf1则可以通过Smad7与TGF-β受体结合, 最终导致Smad7和TGF-β受体的共同降解[18]. Tahashi等[19]研究发现, 在肝纤维化大鼠模型中, 急性肝损时TGF-β可快速诱导Smad7表达, Smad7可使HSC内TGF-β/Smad信号转导通路呈现平衡状态, 不致于产生过多的胶原蛋白; 但在HSC转化为肌成纤维细胞(myofibroblast, MFB)后便失去了TGF-β诱导Smad7表达上调的敏感性, 结果导致R-Smad持续磷酸化且无法被Smad7抑制, R-Smad信号下转, 又介导HSC向MFB转化并分泌大量TGF-β, 继续激活ECM的转录, 引起ECM大量堆积, 最终造成恶性循环. 我们的研究显示在肝纤维化组织中, Smad7表达随着肝纤维化程度加重逐减少, Smad3表达逐渐增多, 由此可见, Smad7表达的缺失导致其对TGF-β1/Smad信号负调控失灵, 而Smad3持续表达则导致了信号传导增强, 最终促进了肝纤维化的发生及发展. Latella等[20]发现Smad3缺陷转基因小鼠较野生型小鼠而言, 因为缺失Smad3信号分子而不易出现肝纤维化.
本研究表明在正常肝组织中Smurf1、Smurf2、Smad3和Smad7均有表达, 但在肝纤维化组中Smurf2、Smad3表达显著升高, 而Smad7表达显著下降. Smad3随着肝纤维化程度加重, 表达进行性增加, 与肝纤维化程度呈显著正相关(P<0.01), 而做为下游信号分子的Smad3表达越多, 说明TGF-β1信号通路传导越激烈, 从而刺激肝星状细胞的活化和增殖, 转化为肌成纤维细胞, 进而导致肝纤维化的进展. Smurf2与肝纤维化程度呈显著正相关(P<0.01), Tan等[21]研究发现在小鼠肾纤维化中Smurf2的表达增高, 上调Smurf2的表达能够显著增强Smad核转录共抑制因子SnoN(ski-related novel protein n, SnoN)的降解, 而SnoN的降解又会进一步刺激TGF-β信号[22], 这可能是Smurf2与纤维化程度呈显著正相关的原因之一. Zhang等[23]研究也有类似发现, Smurf2在儿童增生性瘢痕的成纤维细胞中表达逐渐增加, 参与了增生性瘢痕的进展. Smurf2与Smad3呈显著正相关(P<0.01), 研究表明调高Smurf2的表达能使细胞对TGF-β更加敏感, 产生更为有效的信号[24]. 根据Smurf2对TGF-β1/Smad信号通路的促进作用, 因此可以解释Smurf2与Smad3的正相关关系. Smurf2与Smad7呈显著负相关(P<0.01), 是因为Smurf2对Smad7也具有降解作用, Fukasawa等[25]在单侧输尿管闭塞的模型实验中证实了Smurf2降解Smad7的作用, Smurf2表达越多对Smad7的降解越大, 故二者呈现负相关. 然而Smurf2选择性的降解Smad7必然会导致信号通路的增强[26]. 这对于抑制信号通路的传导, 延缓肝纤维化的进展是不利的. 可见, Smurf2在TGF-β1/Smad信号传导中发挥双向调节的作用, 但对信号通路的促进作用可能远大其抑制作用, 最终导致肝纤维化的发展. Smad7与肝纤维化程度呈显著负相关(P<0.01), 与Smad3呈负直线相关(P<0.01), 说明Smad7表达缺失导致了其对信号通路抑制作用的减弱, 而通路信号的持续下传又必然导致Smad3表达的大量增加. Smurf1与肝纤维化无显著相关性(P>0.05), Smurf1与Smurf2、Smad3、Smad7亦无相关性(P>0.05), Smurf1虽可通过对Smad7和TGF-β受体进行降解调节信号传导, 但有研究表明[27-30]Smurf1主要通过对Smad1、Smad5泛素化降解参与BMP信号通路的调节. 因此, 其在肝纤维化发展中究竟发挥多大作用仍需进一步研究. 我们认为TGF-β1/Smad信号通路可能是慢性HBV感染导致肝纤维化的重要机制, 如果对通路中的信号分子施加干预或许能延缓肝纤维化的进展. 张国等[31]发现活血软坚方可能通过非特异性作用干扰转化生长因子和Smad的功能来发挥抗纤维化的作用. 这为慢性HBV感染后肝纤维化的防治提供一新途径.
肝纤维化是肝脏对各种原因所导致的肝损害时细胞外基质合成、降解与沉积不平衡而引起的病理过程, 涉及复杂的细胞及分子机制. 其中, 转化生长因子β1(transforming growth factor-β1, TGF-β1)/Smad信号通路可能是慢性乙型肝炎病毒(hepatitis B virus, HBV)感染导致肝纤维化重要机制.
庄林, 主任医师, 昆明市第三人民医院肝病科
目前研究多集中在对TGF-β信号传导通路底物及受体的调节上, Smad3和Smad7受泛素化调节因子(Smurf)的调节, 但Smurf对Samd的调节是否影响到肝纤维化的过程目前仍未解决.
2012年Zhang等研究发现, Smurf2在儿童增生性瘢痕的成纤维细胞中表达逐渐增加, 参与了增生性瘢痕的进展. 研究表明调高Smurf2的表达能使细胞对TGF-β更加敏感, 产生更为有效的信号.
目前Smurf1在人肝纤维化组织中表达情况尚未见相关报道, 本研究通过检测Smurf1、Smurf2、Smad3和Smad7的表达情况, 利于更全面的探讨泛素化调节因子对Samd的调节及对肝纤维化的影响.
TGF-β1/Smad信号通路可能是慢性HBV感染导致肝纤维化的重要机制, Smurf2对信号通路传导发挥促进作用, 如果对通路中的信号分子施加干预或许能延缓肝纤维化的进展.
本文有科学性、创新性和可读性, 可以在一定程度上地反映我国胃肠病学临床和基础研究先进水平.
编辑: 郭鹏 电编:鲁亚静
| 1. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] |
| 2. | Fukasawa H, Yamamoto T, Fujigaki Y, Misaki T, Ohashi N, Takayama T, Suzuki S, Mugiya S, Oda T, Uchida C. Reduction of transforming growth factor-beta type II receptor is caused by the enhanced ubiquitin-dependent degradation in human renal cell carcinoma. Int J Cancer. 2010;127:1517-1525. [PubMed] [DOI] |
| 3. | Dabydeen SA, Meneses PI. Smurf2 alters BPV1 trafficking and decreases infection. Arch Virol. 2011;156:827-838. [PubMed] [DOI] |
| 4. | Lönn P, Morén A, Raja E, Dahl M, Moustakas A. Regulating the stability of TGFbeta receptors and Smads. Cell Res. 2009;19:21-35. [PubMed] [DOI] |
| 5. | Hietbrink F, Koenderman L, Rijkers G, Leenen L. Trauma: the role of the innate immune system. World J Emerg Surg. 2006;1:15. [PubMed] [DOI] |
| 6. | Cutroneo KR. TGF-beta-induced fibrosis and SMAD signaling: oligo decoys as natural therapeutics for inhibition of tissue fibrosis and scarring. Wound Repair Regen. 2007;15 Suppl 1:S54-S60. [PubMed] [DOI] |
| 7. | Popov Y, Schuppan D. Targeting liver fibrosis: strategies for development and validation of antifibrotic therapies. Hepatology. 2009;50:1294-1306. [PubMed] [DOI] |
| 8. | Kisseleva T, Brenner DA. Role of hepatic stellate cells in fibrogenesis and the reversal of fibrosis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S73-S78. [PubMed] [DOI] |
| 9. | Kim EY, Kim BC. Lipopolysaccharide inhibits transforming growth factor-beta1-stimulated Smad6 expression by inducing phosphorylation of the linker region of Smad3 through a TLR4-IRAK1-ERK1/2 pathway. FEBS Lett. 2011;585:779-785. [PubMed] [DOI] |
| 10. | Meyer C, Godoy P, Bachmann A, Liu Y, Barzan D, Ilkavets I, Maier P, Herskind C, Hengstler JG, Dooley S. Distinct role of endocytosis for Smad and non-Smad TGF-β signaling regulation in hepatocytes. J Hepatol. 2011;55:369-378. [PubMed] [DOI] |
| 11. | Malapeira J, Esselens C, Bech-Serra JJ, Canals F, Arribas J. ADAM17 (TACE) regulates TGFβ signaling through the cleavage of vasorin. Oncogene. 2011;30:1912-1922. [PubMed] [DOI] |
| 12. | Cai Y, Zhou CH, Fu D, Shen XZ. Overexpression of Smad ubiquitin regulatory factor 2 suppresses transforming growth factor-β mediated liver fibrosis. J Dig Dis. 2012;13:327-334. [PubMed] [DOI] |
| 14. | Ito I, Hanyu A, Wayama M, Goto N, Katsuno Y, Kawasaki S, Nakajima Y, Kajiro M, Komatsu Y, Fujimura A. Estrogen inhibits transforming growth factor beta signaling by promoting Smad2/3 degradation. J Biol Chem. 2010;285:14747-14755. [PubMed] [DOI] |
| 15. | Inoue Y, Imamura T. Regulation of TGF-beta family signaling by E3 ubiquitin ligases. Cancer Sci. 2008;99:2107-2112. [PubMed] [DOI] |
| 16. | Bizet AA, Tran-Khanh N, Saksena A, Liu K, Buschmann MD, Philip A. CD109-mediated degradation of TGF-β receptors and inhibition of TGF-β responses involve regulation of SMAD7 and Smurf2 localization and function. J Cell Biochem. 2012;113:238-246. [PubMed] [DOI] |
| 17. | Dooley S, ten Dijke P. TGF-β in progression of liver disease. Cell Tissue Res. 2012;347:245-256. [PubMed] [DOI] |
| 18. | Ebisawa T, Fukuchi M, Murakami G, Chiba T, Tanaka K, Imamura T, Miyazono K. Smurf1 interacts with transforming growth factor-beta type I receptor through Smad7 and induces receptor degradation. J Biol Chem. 2001;276:12477-12480. [PubMed] [DOI] |
| 19. | Tahashi Y, Matsuzaki K, Date M, Yoshida K, Furukawa F, Sugano Y, Matsushita M, Himeno Y, Inagaki Y, Inoue K. Differential regulation of TGF-beta signal in hepatic stellate cells between acute and chronic rat liver injury. Hepatology. 2002;35:49-61. [PubMed] |
| 20. | Latella G, Vetuschi A, Sferra R, Catitti V, D'Angelo A, Zanninelli G, Flanders KC, Gaudio E. Targeted disruption of Smad3 confers resistance to the development of dimethylnitrosamine-induced hepatic fibrosis in mice. Liver Int. 2009;29:997-1009. [PubMed] [DOI] |
| 21. | Tan R, Zhang J, Tan X, Zhang X, Yang J, Liu Y. Downregulation of SnoN expression in obstructive nephropathy is mediated by an enhanced ubiquitin-dependent degradation. J Am Soc Nephrol. 2006;17:2781-2791. [PubMed] [DOI] |
| 22. | De Boeck M, ten Dijke P. Key role for ubiquitin protein modification in TGFβ signal transduction. Ups J Med Sci. 2012;117:153-165. [PubMed] [DOI] |
| 23. | Zhang Z, Finnerty CC, He J, Herndon DN. Smad ubiquitination regulatory factor 2 expression is enhanced in hypertrophic scar fibroblasts from burned children. Burns. 2012;38:236-246. [PubMed] [DOI] |
| 24. | Tan R, He W, Lin X, Kiss LP, Liu Y. Smad ubiquitination regulatory factor-2 in the fibrotic kidney: regulation, target specificity, and functional implication. Am J Physiol Renal Physiol. 2008;294:F1076-F1083. [PubMed] [DOI] |
| 25. | Fukasawa H, Yamamoto T, Togawa A, Ohashi N, Fujigaki Y, Oda T, Uchida C, Kitagawa K, Hattori T, Suzuki S. Down-regulation of Smad7 expression by ubiquitin-dependent degradation contributes to renal fibrosis in obstructive nephropathy in mice. Proc Natl Acad Sci U S A. 2004;101:8687-8692. [PubMed] [DOI] |
| 26. | Al-Salihi MA, Herhaus L, Sapkota GP. Regulation of the transforming growth factor β pathway by reversible ubiquitylation. Open Biol. 2012;2:120082. [PubMed] [DOI] |
| 27. | Murakami G, Watabe T, Takaoka K, Miyazono K, Imamura T. Cooperative inhibition of bone morphogenetic protein signaling by Smurf1 and inhibitory Smads. Mol Biol Cell. 2003;14:2809-2817. [PubMed] [DOI] |
| 28. | Ying SX, Hussain ZJ, Zhang YE. Smurf1 facilitates myogenic differentiation and antagonizes the bone morphogenetic protein-2-induced osteoblast conversion by targeting Smad5 for degradation. J Biol Chem. 2003;278:39029-39036. [PubMed] [DOI] |
| 29. | Das S, Chang C. Regulation of early xenopus embryogenesis by Smad ubiquitination regulatory factor 2. Dev Dyn. 2012;241:1260-1273. [PubMed] [DOI] |
| 30. | Zhao L, Huang J, Guo R, Wang Y, Chen D, Xing L. Smurf1 inhibits mesenchymal stem cell proliferation and differentiation into osteoblasts through JunB degradation. J Bone Miner Res. 2010;25:1246-1256. [PubMed] [DOI] |