修回日期: 2014-04-02
接受日期: 2014-04-09
在线出版日期: 2014-05-28
目的: 观察大鼠新生期经历直结肠扩张所致功能性慢性内脏痛对成年后大鼠抑郁样行为及下丘脑室旁核(corticotropin releasing hormone, PVN)内促肾上腺皮质激素释放激素(corticotropin releasing hormone, CRH)表达的影响, 探讨早期生活应激所致的功能性慢性内脏痛大鼠伴发抑郁样行为的可能作用机制.
方法: 将新生期♂SD大鼠20只, 随机分成2组(n = 10): 假手术(Sham)组, 新生期结直肠扩张(colorectal distension, CRD)组. CRD组大鼠出生后第8、10、12天, 每天给予两次结直肠扩张, 成年后即出生后第8-10周, 检测腹壁撤退反射(abdominal withdrawal reflex, AWR)评分、痛阈以及腹外斜肌放电幅度, 出生后第10-12周检测旷场实验、糖水偏好及强迫游泳等抑郁样行为变化, 行为学检测后取结肠进行HE染色观察组织病理变化, 取血浆检测皮质酮(cortisol, CORT)水平, 取脑PVN进行荧光检测CRH表达水平.
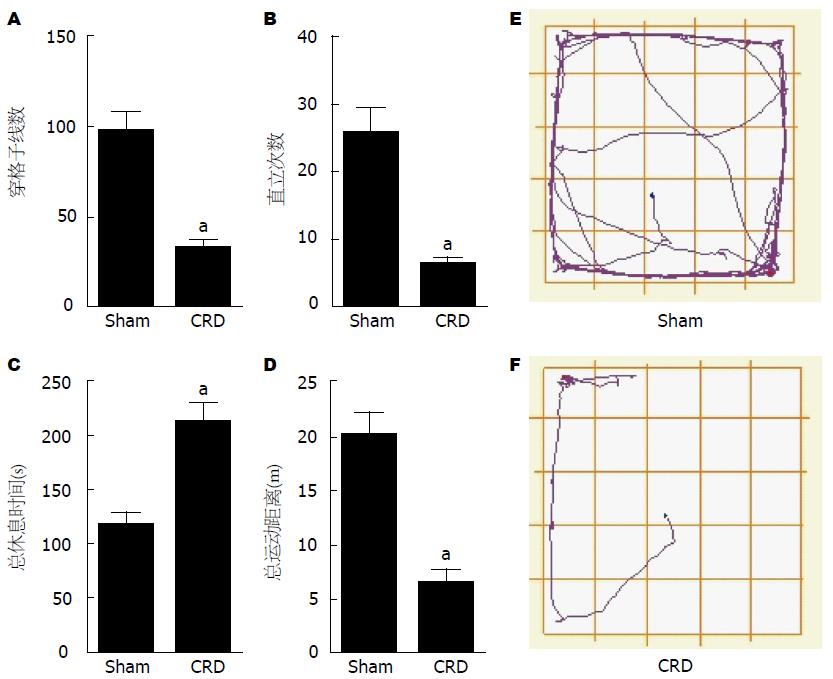
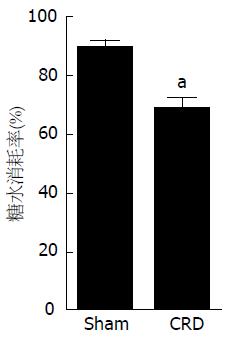
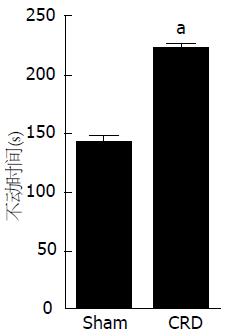
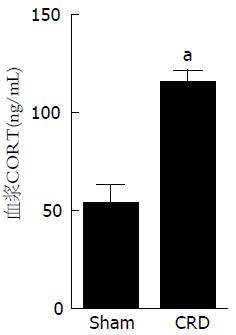
结果: (1)大鼠新生期经历直结肠扩张, 成年后痛阈值下降, AWR评分、腹外斜肌放电幅度增高(P<0.05, P<0.05), 结直肠组织均未见明显病理改变; (2)与Sham组相比, CRD组大鼠在5 min旷场实验中的穿格子线数、直立次数和总运动距离明显减少(均P<0.05), 总休息时间明显增多(P<0.05), 糖水消耗率下降(P<0.05), 强迫游泳过程中不动时间增加(P<0.05); (3)与Sham组相比较, CRD组大鼠血浆中CORT的水平增高(P<0.05), PVN内CRH表达也增加(P<0.05).
结论: 早期生活应激致功能性慢性内脏痛大鼠有抑郁样行为改变, 其机制可能与PVN内CRH表达增加, HPA轴功能失调有关.
核心提示: 下丘脑室旁核内促肾上腺皮质激素释放激素(corticotropin releasing hormone)表达增加, 下丘脑-腺垂体-肾上腺轴(hypothalamic-pituitary-adrenal)轴功能失调可能是早期生活应激致功能性慢性内脏痛大鼠内脏痛觉过敏和伴抑郁样行为改变的共同的病理生理机制.
引文著录: 喻乐, 花璐, 陈自洋, 花嵘, 张咏梅. 早期生活应激所致功能性慢性内脏痛对成年后大鼠抑郁样行为和下丘脑室旁核促肾上腺皮质激素释放激素表达的影响. 世界华人消化杂志 2014; 22(15): 2091-2099
Revised: April 2, 2014
Accepted: April 9, 2014
Published online: May 28, 2014
AIM: To investigate the effect of functional chronic visceral pain caused by neonatal colorectal distension (CRD) on depression-like behavior and expression of corticotropin releasing hormone (CRH) in the paraventricular nucleus (PVN) of adult male rats, and to explore the underlying mechanism.
METHODS: Neonatal male rats were randomly divided into two groups (n = 10 for each), a sham operation group and a CRD group. The CRD group was given colorectal distension twice daily on postnatal days 8, 10, and 12. Abdominal withdrawal reflex (AWR) scores, pain threshold, and external oblique discharge amplitude were used to test visceral hypersensitivity during postnatal weeks 8-10. Open field test, sucrose preference test and forced swim test were used to test depression-like behavior during postnatal weeks 10-12. After behavior tests, HE staining was used to detect pathological changes of the colorectal tissue. Immunofluorescence was used to detect the expression of CRH in the PVN. Radioimmunoassay was used to detect the level of cortisol in blood.
RESULTS: Colorectal distension resulted in chronic visceral hypersensitivity without pathological changes in the colorectal tissue. Rats with functional chronic visceral pain caused by early-life stress exhibited depression-like behavior. The expression of CRH in the PVN and the level of CORT in blood of CRD rats increased compared with control rats.
CONCLUSION: Rats with functional chronic visceral pain caused by early-life stress show depression-like behavior, and the underlying mechanism may be related to increased expression of CRH in the PVN and dysfunction of the HPA axis.
- Citation: Yu L, Hua L, Chen ZY, Hua R, Zhang YM. Effect of functional chronic visceral pain caused by neonatal colorectal distension on depression-like behavior and expression of CRH in the paraventricular nucleus of adult male rats. Shijie Huaren Xiaohua Zazhi 2014; 22(15): 2091-2099
- URL: https://www.wjgnet.com/1009-3079/full/v22/i15/2091.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i15.2091
功能性慢性内脏痛是一种以腹痛或腹部不适, 伴或不伴排便习惯改变为特征的胃肠功能性疾病, 症状至少持续3 mo, 但结肠组织未见明显病理学变化, 其发病机制复杂, 可能与包括心理因素、胃肠道异常运动与分泌、内脏高敏感性在内的中枢和外周因素有关[1-3]. 目前新生期直结肠扩张模型是国内外公认的比较理想的功能性慢性内脏痛模型之一. 大量的研究和分析[4-6]已证实, 早期生活应激包括童年虐待、忽视、母婴分离等是成年后抑郁发生的高危因素. 而抑郁等精神障碍是慢性疼痛常见的伴随症状, 导致严重的疾病负担, 严重影响患者的生活质量[7,8]. 早期生活应激所致的功能性慢性内脏痛大鼠是否伴发抑郁样行为及其作用机制尚不确切. 本研究通过观察大鼠新生期经历直结肠扩张所致功能性慢性内脏痛对成年后大鼠抑郁样行为及下丘脑室旁核(corticotropin releasing hormone, PVN)内促肾上腺皮质激素释放激素(corticotropin releasing hormone, CRH)表达的影响, 探讨早期生活应激所致的功能性慢性内脏痛大鼠伴发抑郁样行为的可能作用机制.
新生第8天♂SD大鼠, 由徐州医学院实验动物中心提供. 新生大鼠与母鼠同笼直到28 d, 鼠乳喂养. 母婴分离后, 每5只子鼠1笼, 保持室温23 ℃±1 ℃及12 h/12 h明/暗光照, 能够自由取食和进水. 随后大鼠正常饲养到第8周进行下述各项实验. 采用随机数字表法, 将大鼠随机分为2组(n = 10): 假手术组(Sham组)、新生期结直肠扩张组(colorectal distension, CRD组). 兔抗大鼠CRH(abcam公司, 美国); Alexa 594驴抗兔IgG(Life Technologies公司, 美国); 血浆皮质酮放射免疫试剂盒(北京华英生物技术研究所, 中国); 人血管成形气囊20.0 mm×3.0 mm(美国); BL-420E+多道生理记录仪(成都泰盟公司, 中国); 荧光显微镜(Olympus IX-81, 日本); 旷场箱及强迫游泳圆筒(上海软隆公司, 中国).
1.2.1 功能性慢性内脏痛模型的建立: 参照文献[9]通过新生期反复CRD的方法制备功能性慢性内脏痛模型: 新生大鼠于出生后第8、10、12天, 每天上午固定时间给予两次结直肠扩张, 将直径3 mm, 长20 mm的血管成形气囊从肛门插入至清醒新生大鼠的降结肠, 用0.3 mL水扩张产生60 mmHg的压力在结肠内留置1 min后, 将其减压退出, 间隔30 min后重复扩张1次. Sham组大鼠除未进行结直肠扩张外, 其他操作均与CRD组一致.
1.2.2 行为学测定: (1)AWR评分: 按Al-Chaer等[9]报道的方法, 大鼠在实验前18 h禁食不禁水, 用乙醚或氟烷麻醉后, 将未充气的球囊涂石蜡油后插入结直肠内, 用胶布将肛门外导管固定于大鼠尾根部, 导管经三通连接注射器和血压计, 大鼠放置在20 cm×6 cm×8 cm的有机玻璃箱内观察, 约30 min大鼠完全适应后开始实验. 分别采用20、40、60、80 mmHg 4个压力, 每次扩张持续20 s, 刺激间隔4 min, 采用单盲法, 取3次评分之均值. AWR的评分标准[10]为: 0分: 无明显行为变化; 1分: 大鼠身体不动或仅有简单的头部运动; 2分: 腹部肌肉开始收缩; 3分: 下腹壁抬离箱底或明显收缩变平; 4分: 腹壁拱起或伴身体、骨盆躬起; (2)AWR方法测定痛阈: 球囊放置过程同前, 通过注射器持续、缓慢加压, 每10 mmHg为一压力梯度, 每个压力停留10 s, 间隔4 min, 以肉眼观察出现明显的下腹壁抬离箱底或明显收缩变平(AWR 3分)时的最小压力值为痛阈.扩张压力范围在10-80 mmHg之间; 每只大鼠重复3次, 取平均值; (3)腹外斜肌放电的测量: 参照文献[9,11], 前述方法置入球囊后, 将大鼠固定于手术台上, 用1%左右的氟烷维持麻醉, 并随时通过测量疼痛反应调整气体麻醉机内氟烷的流量, 使大鼠不发生自主活动, 却有疼痛反应存在. 将银丝双极电极插入腹股沟韧带上方、距中线1.5 cm的一侧腹外斜肌上, 待适应15 min后, 对清醒大鼠予以结直肠扩张, 压力梯度分别为20、40、60、80 mmHg, 每次加压10 s, 刺激间隔4 min. 用BL-420E+生物机能实验系统记录在不同压力的结直肠扩张刺激下大鼠腹外斜肌的放电活动变化. 记录参数设置: 高频滤过2 kHz, 时间常数0.001 s, 采样频率为40 Hz, 灵敏度500 μV, 扫描速度250 ms/div; (4)旷场实验: 参照文献[12], 旷场为100 cm×100 cm×50 cm黑色聚碳酸酯板围成方箱, 计算机Anymaze软件将其底部平分为25个方格, 实验时手提大鼠尾巴将其轻轻放在箱底中心方格内, 记录大鼠5 min的旷场行为, 如穿格子线数, 直立次数, 总运动距离和总休息时间. 每次观察结束后清洗方箱内壁及底面, 以免上次余留的信息(如动物的大、小便、气味)影响下次测试结果; (5)糖水偏好实验: 参照文献[12,13], 将大鼠单笼饲养, 分别给予一瓶1%蔗糖溶液, 一瓶自来水后适应48 h, 禁水禁食24 h后进行糖水偏好实验. 每只大鼠同时给予事先称重的两瓶水, 1瓶为1%蔗糖溶液, 1瓶为自来水, 为避免大鼠喜好饮一侧水, 应定期倒换两水瓶位置, 1 h后取走进行称量, 每只大鼠糖水消耗率 = 糖水消耗量/(糖水消耗量+普通自来水消耗量)×100%; (6)强迫游泳实验: 参照文献[12,14], 将大鼠放入直径18 cm, 水深(30-40 cm)的圆筒中, 水温23℃±1℃, 记录大鼠5 min不动的时间(动物四肢不动漂浮于水面, 仅头部露出水面呼吸). 每次测试完毕后, 缸中的水需要倒掉并清洗干净后再开始下1次测试.
1.2.3 结直肠组织病理学检查: 第12周, 经组织灌注固定后, 取大鼠距肛门10 cm处降结肠作标本. 切片由徐州医学院附属医院病理科专家诊断, 观察指标为结直肠局部组织有无损伤及炎症等异常改变.
1.2.4 血浆糖皮质激素水平的测定: 静脉取血, 枸橼酸钠抗凝, 分离血浆, 以二氯甲烷提取, 放射免疫法测定血浆皮质酮含量(ng/mL).
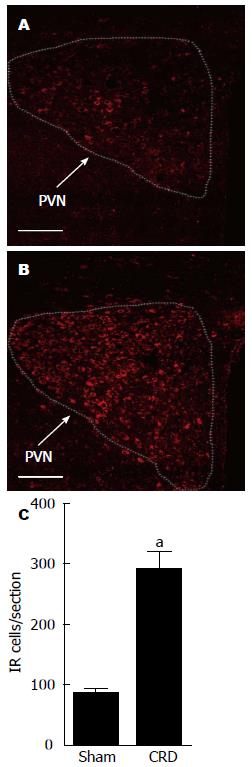
1.2.5 免疫荧光染色法检测PVN内CRH: 第12周大鼠经心脏组织灌注固定取脑固定, 沉糖脱水后脑组织冠状冰冻连续切片(厚度30 μm), PBS漂洗, 用含有0.3%Triton X-100的10%驴血清室温封闭2 h, 加入兔抗大鼠CRH抗体(1:200), 4 ℃孵育24 h, PBS漂洗, 暗室内加入Alexa 594驴抗兔IgG(1:200), 室温孵育2 h, PBS漂洗, 贴片、封片, 共聚焦显微镜下观察拍片、计数.
统计学处理 实验数据以mean±SD表示, 采用SPSS13.0统计学软件进行数据分析, 两组间比较采用成组t检验, P<0.05为差异有统计学意义.
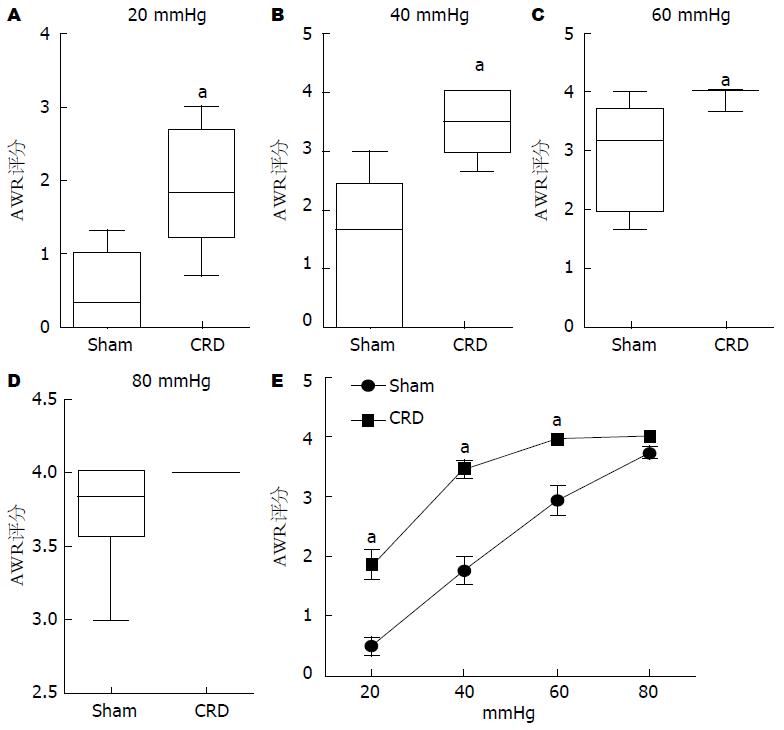
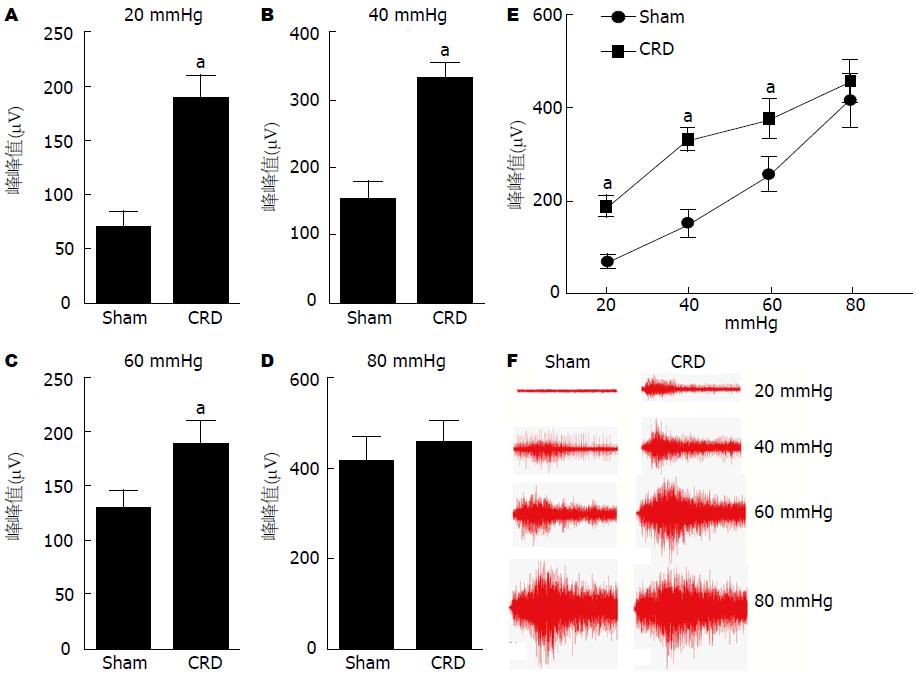
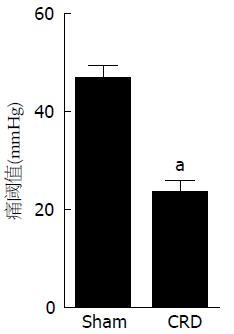
与Sham组相比较, 在20、40和60 mmHg扩张压力刺激下, CRD组大鼠的AWR评分和腹外斜肌放电幅度增加(P<0.05, P<0.05), 在80 mmHg压力刺激下两组大鼠的AWR评分和腹外斜肌放电幅度无显著差异(P>0.05, P>0.05), 而且随着扩张压力刺激的不断增加, 从20-80 mmHg, 两组大鼠的AWR评分和腹外斜肌放电幅度均越来越高(图1, 2). 与Sham组相比较, CRD组大鼠的痛阈明显降低(P<0.05)(图3).
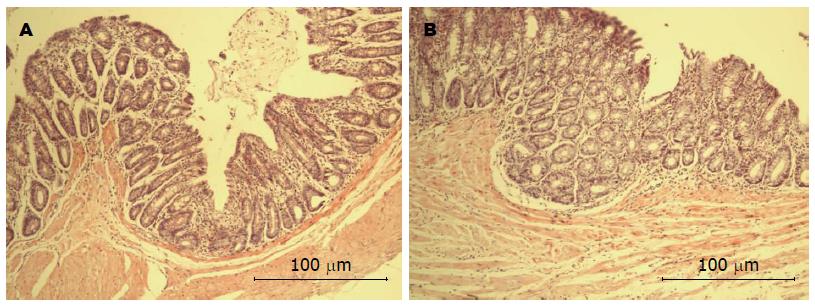
常规病理切片光镜下: 两组大鼠结直肠组织结构完整, 排列整齐, 黏膜表面光滑, 固有层内肠腺规则; 胞质呈嗜酸性红染, 胞核为圆形或椭圆形, 染成均匀的蓝黑色, 形态规则, 大小较为一致, 核仁清晰可见; 周围间质无明显水肿, 未见中性粒细胞、单核细胞、巨噬细胞浸润(图4).
与Sham组相比, CRD组大鼠在5 min旷场实验中的穿格子线数、直立次数和总运动距离明显减少(均P<0.05), 总休息时间明显增多(P<0.05)(图5), 糖水消耗率下降(P<0.05)(图6), 强迫游泳过程中不动时间增加(P<0.05)(图7).
与Sham组相比较, CRD组大鼠血浆中CORT的水平增高(P<0.05)(图8), 免疫荧光结果显示, 下丘脑PVN内CRH表达也增加(P<0.05)(图9).
人的大脑在6-19岁期间处于快速发育和优化阶段, 这种神经发育的可塑性最终决定成年后的脑高级功能[15,16]. 因此, 基因与环境(应激)相互作用有可能影响幼年神经发育, 最终导致成年后抑郁的发生. 早期生活应激事件, 如童年受虐待、失去父母、被忽视等不良事件可影响结直肠动力并引起内脏痛觉过敏, 增加成年后腹痛相关功能性肠病发生的危险性[17]. 而抑郁精神障碍是慢性疼痛常见的伴随症状, 导致严重的疾病负担, 影响患者的生活质量. 本研究通过对大鼠新生期进行反复的结直肠扩张建立功能性慢性内脏痛模型, 观察大鼠成年后抑郁样行为变化及下丘脑PVN内CRH表达的情况, 探讨早期生活应激所致的功能性慢性内脏痛大鼠伴发抑郁的可能作用机制, 为临床上多途径预防和治疗功能性慢性内脏痛提供可靠的依据, 改善患者的生活质量.
本研究观察到新生期经历直结肠扩张的CRD组大鼠与Sham组大鼠相比较, 成年后的痛阈值降低, AWR评分和腹外斜肌放电幅度增加, 结直肠组织无明显病理学改变, 说明我们的功能性慢性内脏痛模型的建立是比较稳定的. 旷场实验, 糖水偏好实验及强迫游泳实验是衡量啮齿类动物抑郁样行为的良好指标[12,18]. 本研究中CRD组大鼠较Sham组大鼠在旷场实验中的穿格子线数和直立次数均减少, 总休息时间增加, 总运动距离减少, 提示CRD组大鼠的自主行动和对外界的空间探索行为明显减少, 兴趣淡漠. 糖水消耗率是目前动物实验中快感缺失的评价指标, 快感缺失指的是体验快乐的能力下降, 被认为是抑郁症的核心症状. 糖水偏好实验中CRD组大鼠的糖水消耗率减少, 提示CRD组大鼠抑郁症状明显. 强迫游泳是模拟行为绝望而设计的, 动物经历一段时间的挣扎后就会由试图逃脱不断游泳的积极状态变为仅保持头部浮出水面停止游泳的消极状态, 抑郁的动物出现消极状态早, 不动时间就会增加. 本研究中CRD组大鼠较Sham组大鼠游泳不动时间增加, 提示CRD大鼠的消极沮丧情绪. 以上研究结果均说明, 早期生活应激所致的功能性慢性内脏痛大鼠伴有抑郁样行为表现.
目前, 功能性慢性内脏痛的发病机制尚不清楚. 有研究显示功能性慢性内脏痛患者在肠动力、内脏敏感性和HPA轴的功能等方面呈现出典型改变[19,20], 这些改变同时也是慢性应激相关精神疾病的共同特征[21,22]. CRH是HPA轴的重要调节肽, 下丘脑接受刺激后释放CRH, 刺激垂体ACTH的释放, 使血浆中糖皮质激素CORT水平增高. 慢性疼痛状态下, 长时间持续应激会破坏HPA轴的反馈机制, 通过HPA轴, 大脑和外周的糖皮质激素受体下调可能诱导更高水平的糖皮质激素产生, 最终导致HPA轴功能失调. 本研究证实了大鼠新生期经历反复的结直肠扩张, 成年后血浆中的CORT水平增高, PVN内CRH表达增加, 这些都有可能最终导致HPA轴功能失调, 内脏痛觉高敏. 本研究的实验结果提示下丘脑PVN内CRH神经元敏化可能参与早期生活应激所致的功能性慢性内脏痛大鼠内脏痛觉高敏的形成与维持.
早期生活应激能够增加成年后各种精神疾病障碍和行为问题的发生, 有研究显示早期发育阶段的应激能够引起成年后HPA轴功能对应激反应的持续改变, 最终引起抑郁易感性增加[23-26]. 在神经内分泌系统中, 一方面, HPA轴的激活为交感神经反应提供了能量基础; 另一方面, HPA轴和交感肾上腺系统与脑的周边、皮质系统相互作用, 提高了觉醒、处境评估和认知性能[27]. 在应激反应下, HPA轴会调节神经递质的释放、交感肾上腺的活动、体循环中糖皮质激素的含量, 从而控制交感神经反应和躯体症状. 而在慢性应激反应下, 多重信息会作用于神经中枢系统, 可能会扰乱HPA轴的负反馈, 从而出现焦虑、抑郁和慢性疼痛等情况[28,29]. 调查[26]显示抑郁患者的边缘区域包括下丘脑和海马有功能改变, 表现为CRH分泌过多, HPA轴功能活跃. 以地塞米松评价下丘脑反馈抑制CRH的研究[30]显示, 约1/2的重度抑郁患者其正常皮质激素抑制反应丧失. 长期高水平糖皮质激素对中枢神经系统级心脏均有负面影响. 就本研究来分析, 可能是早期生活应激所致的功能性慢性内脏痛诱导了抑郁精神障碍的发生, 而抑郁又促进了功能性慢性内脏痛的发生发展及维持, 而HPA轴功能紊乱可能是早期生活应激所致的功能性慢性内脏痛大鼠伴发抑郁精神障碍的原因, 也有可能是慢性疼痛和抑郁共同的神经生理机制[31].
总之, 本研究的实验结果对早期生活应激所致的功能性慢性内脏痛大鼠成年后伴发抑郁等精神障碍的病理生理机制有了进一步的认识, 为临床上采取积极有效的防治措施, 减少早期不良生活经历所造成的危害提供有力的依据.
早期生活负性事件包括童年虐待等是成年后抑郁发生的高危因素. 而抑郁是慢性疼痛常见的伴随症状, 导致严重的疾病负担. 慢性功能性内脏痛大鼠是否伴有抑郁样行为及其机制尚不确切. 早期生活应激所致功能性慢性内脏痛模型的建立, 为进一步研究人类功能性慢性内脏痛伴发抑郁的发展机制以及治疗提供契机.
王小众, 教授, 福建医科大学附属协和医院消化内科
近年来, 早期生活应激能够增加成年后各种精神疾病障碍和行为问题的发生, 引起人们的广泛关注. 有调查显示抑郁患者的边缘区域包括下丘脑和海马有功能改变, 表现为促肾上腺皮质激素释放激素(corticotropin releasing hormone, CRH)分泌过多, HPA轴功能活跃.对于早期生活应激所致的功能性慢性内脏痛大鼠是否伴发抑郁及是否影响室旁核内促肾上腺皮质激素释放激素(corticotropin releasing hormone, CRH)表达, 未见报道.
有研究显示功能性慢性内脏痛患者在肠动力、内脏敏感性和HPA轴的功能等方面呈现出典型改变, 这些改变同时也是慢性应激相关精神疾病的共同特征. 以地塞米松评价下丘脑反馈抑制CRH的研究显示, 约1/2的重度抑郁患者其正常皮质激素抑制反应丧失.
哺乳动物在神经发育的可塑阶段, 基因与环境(应激)相互作用有可能影响幼年神经发育. 利用新生期经历直结肠扩张模拟早期生活应激建立功能性慢性内脏痛模型, 有助于我们从脑-肠轴的角度探讨早期生活应激所致的功能性慢性内脏痛大鼠伴发抑郁可能作用机制.
本研究的实验结果对早期生活应激所致的功能性慢性内脏痛大鼠成年后伴发抑郁等精神障碍的病理生理机制有了进一步的认识, 为临床上采取积极有效的防治措施, 减少早期不良生活经历所造成的危害提供有力的依据.
本研究通过动物实验证实早期生活应激致功能性慢性内脏痛可引发成年后大鼠抑郁行为, 可能通过下丘脑室旁核CRH起作用, 对IBS的认识有一定意义.
编辑: 田滢 电编:鲁亚静
| 1. | Austin PD, Henderson SE. Biopsychosocial assessment criteria for functional chronic visceral pain: a pilot review of concept and practice. Pain Med. 2011;12:552-564. [PubMed] [DOI] |
| 2. | Anand P, Aziz Q, Willert R, van Oudenhove L. Peripheral and central mechanisms of visceral sensitization in man. Neurogastroenterol Motil. 2007;19:29-46. [PubMed] |
| 3. | Feng B, La JH, Schwartz ES, Gebhart GF. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Neural and neuro-immune mechanisms of visceral hypersensitivity in irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 2012;302:G1085-G1098. [PubMed] [DOI] |
| 4. | Jumper SA. A meta-analysis of the relationship of child sexual abuse to adult psychological adjustment. Child Abuse Negl. 1995;19:715-728. [PubMed] |
| 5. | Paolucci EO, Genuis ML, Violato C. A meta-analysis of the published research on the effects of child sexual abuse. J Psychol. 2001;135:17-36. [PubMed] |
| 6. | Schmidt MV, Wang XD, Meijer OC. Early life stress paradigms in rodents: potential animal models of depression? Psychopharmacology (Berl). 2011;214:131-140. [PubMed] [DOI] |
| 7. | Ataoğlu E, Tiftik T, Kara M, Tunç H, Ersöz M, Akkuş S. Effects of chronic pain on quality of life and depression in patients with spinal cord injury. Spinal Cord. 2013;51:23-26. [PubMed] [DOI] |
| 8. | Greenberg EN. The consequences of chronic pain. J Pain Palliat Care Pharmacother. 2012;26:64-67. [PubMed] [DOI] |
| 9. | Al-Chaer ED, Kawasaki M, Pasricha PJ. A new model of chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development. Gastroenterology. 2000;119:1276-1285. [PubMed] |
| 10. | Ren TH, Wu J, Yew D, Ziea E, Lao L, Leung WK, Berman B, Hu PJ, Sung JJ. Effects of neonatal maternal separation on neurochemical and sensory response to colonic distension in a rat model of irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 2007;292:G849-G856. [PubMed] |
| 12. | Beaugé LA, DiPolo R. Sidedness of the ATP-Na+-K+ interactions with the Na+ pump in squid axons. Biochim Biophys Acta. 1979;553:495-500. [PubMed] [DOI] |
| 13. | Sarkisova KY, Kuznetsova GD, Kulikov MA, van Luijtelaar G. Spike-wave discharges are necessary for the expression of behavioral depression-like symptoms. Epilepsia. 2010;51:146-160. [PubMed] [DOI] |
| 14. | Yazir Y, Utkan T, Aricioglu F. Inhibition of neuronal nitric oxide synthase and soluble guanylate cyclase prevents depression-like behaviour in rats exposed to chronic unpredictable mild stress. Basic Clin Pharmacol Toxicol. 2012;111:154-160. [PubMed] [DOI] |
| 15. | Shaw P, Greenstein D, Lerch J, Clasen L, Lenroot R, Gogtay N, Evans A, Rapoport J, Giedd J. Intellectual ability and cortical development in children and adolescents. Nature. 2006;440:676-679. [PubMed] |
| 16. | Bilbo SD, Schwarz JM. The immune system and developmental programming of brain and behavior. Front Neuroendocrinol. 2012;33:267-286. [PubMed] [DOI] |
| 18. | 王 丹. 抑郁症动物模型及行为学评价. 西安文理学院学报(自然科学版). 2012;2:51-53. |
| 19. | Cervero F, Jänig W. Visceral nociceptors: a new world order? Trends Neurosci. 1992;15:374-378. [PubMed] |
| 20. | Mayer EA, Collins SM. Evolving pathophysiologic models of functional gastrointestinal disorders. Gastroenterology. 2002;122:2032-2048. [PubMed] |
| 21. | Clarke G, Quigley EM, Cryan JF, Dinan TG. Irritable bowel syndrome: towards biomarker identification. Trends Mol Med. 2009;15:478-489. [PubMed] [DOI] |
| 22. | Gros DF, Antony MM, McCabe RE, Swinson RP. Frequency and severity of the symptoms of irritable bowel syndrome across the anxiety disorders and depression. J Anxiety Disord. 2009;23:290-296. [PubMed] [DOI] |
| 23. | Tofoli SMC, Baes CVW, Martins CMS, Juruena M. Early life stress, HPA axis, and depression. Psychol Neurosci. 2011;4:229-234. [DOI] |
| 24. | Juruena MF. Early-life stress and HPA axis trigger recurrent adulthood depression. Epilepsy Behav. 2014;38:148-159. [PubMed] [DOI] |
| 25. | Heim C, Newport DJ, Mletzko T, Miller AH, Nemeroff CB. The link between childhood trauma and depression: insights from HPA axis studies in humans. Psychoneuroendocrinology. 2008;33:693-710. [PubMed] [DOI] |
| 26. | Baes CV, Tofoli SMD, Martins CMS, Juruena MF. Assessment of the hypothalamic-pituitary-adrenal axis activity: glucocorticoid receptor and mineralocorticoid receptor function in depression with early life stress - a systematic review. Acta Neuropsychiatr. 2012;24:4-15. [DOI] |
| 27. | Lilly MP, Gann DS. The hypothalamic-pituitary-adrenal-immune axis. A critical assessment. Arch Surg. 1992;127:1463-1474. [PubMed] |
| 28. | Pariante CM, Lightman SL. The HPA axis in major depression: classical theories and new developments. Trends Neurosci. 2008;31:464-468. [PubMed] [DOI] |
| 29. | Blackburn-Munro G. Hypothalamo-pituitary-adrenal axis dysfunction as a contributory factor to chronic pain and depression. Curr Pain Headache Rep. 2004;8:116-124. [PubMed] |
| 30. | Carroll BJ, Cassidy F, Naftolowitz D, Tatham NE, Wilson WH, Iranmanesh A, Liu PY, Veldhuis JD. Pathophysiology of hypercortisolism in depression. Acta Psychiatr Scand Suppl. 2007;433:90-103. [PubMed] |