修回日期: 2014-04-03
接受日期: 2014-04-09
在线出版日期: 2014-05-18
目的: 观察紫草素作用前后对人共刺激细胞的增殖及对胃癌细胞NCI-N87、BGC-823、HGC-27杀伤活性的影响, 并探讨其作用机制.
方法: 分离健康者外周血单个核细胞, 在体外经CD3单克隆抗体(CD3 monoclon antibody, CD3 mAb)、白介素2(interleukin-2, IL-2)、干扰素γ(interferon-γ, IFN-γ)、白介素1α(interleukin-1α, IL-1α)、CD28 mAb、IL-15和IL-21共同诱导为人共刺激细胞, 予不同浓度紫草素诱导人共刺激细胞和3株胃癌细胞24、48、72 h后, 水溶性四唑盐(cell counting kit-8, CCK8)法检测人共刺激细胞增殖率, 四甲基偶氮唑蓝(colorimetric methyl thiazolyl tetrazolium, MTT)法检测胃癌细胞的抑制率, 流式细胞术(flow cytometry, FCM)检测人共刺激细胞颗粒酶B(granzyme B, GraB)、穿孔素(perforin, PFP)、CD107a、IFN-g的表达, Western blot检测人共刺激细胞b-catenin、P-ERK1/2、P-AKT和Bcl-2的表达, 乳酸脱氢酶释放法(lactate dehydrogenase, LDH)检测紫草素对人共刺激细胞杀伤3株胃癌细胞的活性影响.
结果: 经紫草素诱导48 h后, 人共刺激细胞0.2-50 mg/L浓度组增殖明显(P<0.05), 6-25 mg/L浓度组GraB、PFP、CD107a、IFN-g和β-catenin、p-ERK1/2、Bcl-2、P-AKT的表达显著高于对照组(P<0.05), 且对NCI-N87、BGC-823、HGC-27的杀伤活性较对照组增强(P<0.05).
结论: 紫草素在一定浓度范围内能够促进人共刺激细胞增殖, 并增强其对胃癌细胞NCI-N87、BGC-823、HGC-27的杀伤活性, 其机制可能与活化β-catenin、P-ERK1/2、Bcl-2、P-AKT和PFP、GraB、CD107a、IFN-g的表达有关.
核心提示: 紫草素在一定浓度范围内能促进人共刺激细胞增殖并提高其杀伤活性, 其可能机制为紫草素能激活β-catenin、磷酸化细胞外信号调节激酶l/2、Bcl-2和P-AKT信号通路促进人共刺激细胞增殖, 提高人共刺激细胞颗粒酶B(granzyme B)、穿孔素(perforin)、CD107a和干扰素γ(interferon-γ)表达促进人共刺激细胞对胃癌细胞的杀伤活性.
引文著录: 郭雪兴, 刘军权, 陈复兴, 吕小婷, 陈永强, 陈剑群. 紫草素对人共刺激细胞杀伤胃癌细胞的影响及其机制. 世界华人消化杂志 2014; 22(14): 1984-1991
Revised: April 3, 2014
Accepted: April 9, 2014
Published online: May 18, 2014
AIM: To observe the effect of shikonin on the growth of co-stimulated human cells and the cytotoxicity of co-stimulated cells to gastric cancer cell lines NCI-N87, BGC-823 and HGC-27, and to explore the underlying mechanisms.
METHODS: Peripheral blood mononuclear cells were separated form healthy volunteers and induced with various cytokines (CD3 mAb, IL-2, IFN-γ, IL-1α, CD28 mAb, IL-15 and IL-21) to result in co-stimulated human cells in vitro. After co-stimulated cells were incubated with shikonin of different concentrations for 24, 48 and 72 h and co-cultured with the three gastric cancer cell lines, CCK8 assay was used to assess the proliferation of co-stimulated cells, and MTT assay was used to measure the reduced rate of growth of gastric cancer cells. FCM was used to detect the expression of GraB, PFP, CD107a and IFN-γ on co-stimulated cells before and after shikonin treatment. LDH release assay was used to measure the influence of shikonin on cytotoxic activity of co-stimulated cells to gastric cancer cells. Western blot assay was used to measure β-catenin, P-ERK1/2, Bcl-2 and P-AKT expression in co-stimulated cells before and after shikonin induction.
RESULTS: After incubation with shikonin at concentrations ranging from 0.2 to 50 μg/L for 48 h, the proliferation rate of co-stimulated cells increased significantly (P < 0.05). The expression of GraB, PFP, CD107a, IFN-γ, β-catenin, P-ERK1/2, Bcl-2 and P-AKT on co-stimulated cells treated with shikonin at concentrations from 6 to 25 μg/L were significantly higher than that in the control group (P < 005). In addition, the cytotoxic activity of co-stimulated cells treated with shikonin against the three gastric cancer cell lines were significantly higher than that in the control group (P < 0.05).
CONCLUSION: These results suggest that shikonin can promote the growth of co-stimulated cells and increase the cytotoxic activity of co-stimulated cells against gastric cancer cells via mechanisms possibly associated with enhancing the activity of β-catenin, P-ERK1/2, Bcl-2 and P-AKT expression and increasing the expression of PFP, GraB, CD107a and IFN-γ.
- Citation: Guo XX, Liu JQ, Chen FX, Lv XT, Chen YQ, Chen JQ. Shikonin induces cytotoxicity of co-stimulated human cells to gastric cancer cell lines. Shijie Huaren Xiaohua Zazhi 2014; 22(14): 1984-1991
- URL: https://www.wjgnet.com/1009-3079/full/v22/i14/1984.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i14.1984
胃癌是消化系最常见恶性肿瘤之一, 其发病率居世界第4位, 在全球肿瘤致死原因中排名第2位[1]. 胃癌的常规治疗方法有手术、化疗、放疗等, 但其均会对机体造成不同程度的组织损伤和免疫功能减退[2]. 肿瘤过继细胞免疫治疗被认为是对肿瘤具有确切效果的又一治疗方法, 其主要是利用肿瘤患者的自身免疫细胞来治疗肿瘤[3]. 人共刺激细胞是肿瘤过继细胞免疫治疗中的一种效应细胞, 其是在常规细胞因子诱导的杀伤细胞(cytokine-induced killer cells, CIK)培养体系中增加刺激因子CD28单克隆抗体(CD28 monoclon antibody, CD28 mAb)、白介素15(interleukin-15, IL-15)和IL-21后获得的以CD3+CD56+为功能特征的异质群T淋巴细胞, 其增殖能力、细胞因子分泌和杀伤活性明显提高[4]. 如何获得足够数量并具有高细胞毒活性的效应细胞已成为人共刺激细胞治疗成功的关键[5]. 紫草素(shikonin)是一种从中药紫草中的提取的萘醌类化合物, 具有抗炎、抗氧化、抗肿瘤等多种药理活性[6]. 紫草素能明显抑制人胃癌细胞增殖[7]. 同时其也能调控机体的免疫功能, 例如提高免疫细胞活性, 促进淋巴细胞转化, 保护免疫器官和免疫功能免受肿瘤损伤[8]. 本研究主要探讨紫草素作用前后人共刺激细胞增殖和功能的变化, 为进一步提高人共刺激细胞的治疗效果提供参考.
紫草素(Sigma公司); 人胃癌HGC-27、BGC-823细胞株(上海细胞研究所), NCI-N87细胞株(昆明细胞研究所); IL-15和IL-21(R&D公司); CD3(上海免疫研究所); CD28 mAb(苏州大学生物技术研究所); FITC和PerCP标记的抗人CD3、PE标记的穿孔素(perforin, PFP)、颗粒酶B(granzyme B, GraB)和APC标记的CD107a抗体购自杭州联科生物公司; 干扰素γ(interferon-γ, IFN-γ)试剂盒(Abender公司); 乳酸脱氢酶释放法(lactate dehydrogenase, LDH)试剂盒(日本世诺临床诊断制品株式会社); 鼠抗人b-catenin、磷酸化细胞外信号调节激酶(phosphorylated extracellular signal regulated kinase, p-ERK1/2), 兔抗人Bcl-2和P-AKT抗体(CST公司); Encore生化分析仪(北京希亚克技术有限公司); FACS Caliber流式细胞仪(BD公司); ST-360酶标仪(上海科华实验系统有限公司).
1.2.1 人共刺激细胞的培养: 取健康者外周血100 mL, 淋巴细胞分离液分离得到单个核细胞, RPMI 1640培养液(含IFN-γ 2×106 U/L、10%小牛血清、5%人AB血清)调整细胞数为5×108/L, 接种于6孔板, 置37 ℃、5%CO2培养箱中培养24 h后收集细胞, 用RPMI 1640完全培养液(含10%小牛血清、5%人AB血清、IL-1a 10 mg/L、IL-2 5×104 U/L、CD3 mAb 1 mg/L、IL-15 20 mg/L、IL-21 10 mg/L和CD28 mAb 10 mg/L)调整细胞数为5×108/L, 接种于6孔板, 于37 ℃、5%CO2培养箱中培养, 每2天换培养基(含IL-15、IL-21、CD28)1次.
1.2.2 CCK8法检测紫草素对人共刺激细胞生长的影响: 收集培养10 d的人共刺激细胞, 1×108/L细胞数接种于96孔板, 200 mL/孔, 加入紫草素(终浓度为0、0.1、0.2、0.4、0.8、1.6、3、6、12.5、25、50、100、200、400 mg/L), 孵育24、48、72 h后, 每孔加入CCK8 10 mL, 37 ℃孵育4 h后, 于酶标仪450 nm处检测各孔吸光度(A)值. 重复3次. 增殖率 = (实验A值-对照A值)/(对照A值)×100%.
1.2.3 MTT法检测紫草素对3株胃癌细胞生长的影响: HGC-27、BGC-823、NCI-N87分别以1×107、2×108、5×107/L细胞数分别接种于96孔板, 200 mL/孔, 加入紫草素(浓度分别为为0、0.1、0.2、0.4、0.8、1.6、3、6、12.5、25、50、100、200、400 mg/L), 孵育24、48、72 h后, 每孔加MTT 20 mL, 37 ℃孵育4 h后弃上清, 每孔加入DMSO 150 mL, 沉淀产物溶解后于酶标仪450 nm处检测各孔A值. 抑制率(%) = (对照A值-实验A值)/(对照A)×100%.
1.2.4 FCM检测紫草素对人共刺激细胞中CD107a、GraB、PFP和IFN-γ表达的影响: 取经紫草素(终浓度分别为0、0.4、1.6、6、25、100 mg/L)诱导48 h后的人共刺激细胞, 调整细胞数至1×107/L, 取100 mL细胞悬液, 加入PerCP-Cy5.5标记的CD3抗体和FITC标记的CD56抗体各20 mL, 室温避光孵育30 min; (1)用于检测CD107a的管加入APC标记的鼠抗人anti-CD107a 5 mL; (2)用于检测GraB、PFP和IFN-g的管, 加入100 mL破膜剂A, 室温避光孵育15 min, 加入100 mL破膜剂B, 同时分别在试管中加入anti-GraB-PE、anti-PFP-PE 和anti-IFN-g-APC各5 mL; 均设置同型对照抗体管, 共同孵育15 min, 流式细胞术(flow cytometry, FCM)检测CD107a、GraB、PFP和IFN-g的含量.
1.2.5 LDH释放法检测人共刺激细胞杀伤活性: 收集培养10 d的人共刺激细胞, 2×109/L细胞数加入6孔板, 3 mL/孔, 加人紫草素(终浓度分别为0、0.4、1.6、6、25、100 mg/L), 培养48 h, 收集人共刺激细胞作为效应细胞. 取HGC-27、BGC-823和NCI-N87细胞配成2×108/L细胞悬液为靶细胞, 将效靶细胞等量混合, 置37 ℃、5%CO2培养箱中孵育6 h后混合, 取上清, 按LDH试剂盒说明书要求操作, 在生化分析仪340 nm处测定A值. 杀伤活性(%) = (A实验组-A效应细胞自然释放组)/(A靶细胞最大释放组-A靶细胞自然释组)×100%.
1.2.6 Western-blot检测紫草素作用前后人共刺激细胞β-catenin、P-ERK1/2、P-AKT和Bcl-2的表达: 取培养10 d的人共刺激细胞, 5×108/L细胞数接种于6孔板, 3 mL/孔, 加入紫草素(终浓度分别为0、0.4、1.6、6、25、100 μg/L), 培养48 h后, 收集人共刺激细胞, 提取蛋白, BCA法测蛋白浓度, 每管加入蛋白处理液30 mL, 煮沸5 min, 按每泳道蛋白样品40 μg加入SDS-PAGE样品孔内, 电泳后半干电转移至硝酸纤维膜上, 一抗、二抗孵育及显色、扫描条带, Imagel软件分析灰度值.
统计学处理 采用软件SPSS13.0进行统计学处理, 计量资料采用mean±SD表示, 多组间采用单因素方差分析(One-way ANOVA). P<0.05为差异有统计学意义.
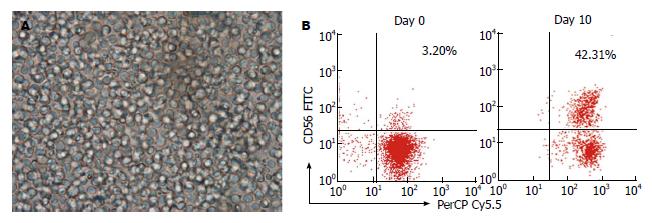
培养前, PBMC中CD3+CD56+T细胞比例<4%, 培养10 d后CD3+CD56+T细胞比例增至42.31%, 倒置显微镜观察培养第10天的人共刺激细胞形态如图1A, FCM检测人共刺激细胞表型CD3+CD56+表达如图1B.
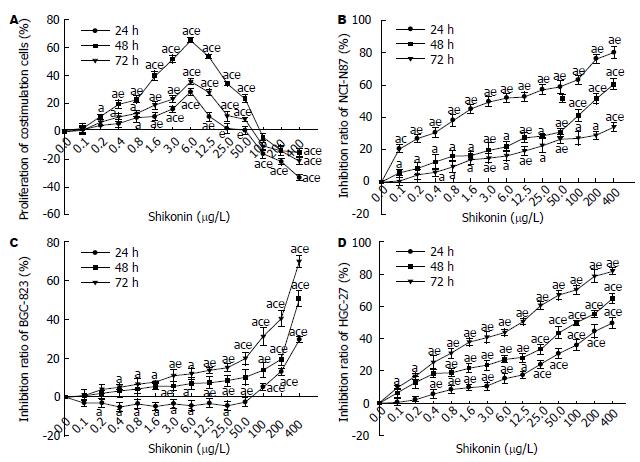
与对照组比较, 浓度为0.4-50 μg/L的紫草素诱导人共刺激细胞24、48、72 h后, 人共刺激细胞增殖明显(P<0.05); 相同浓度的紫草素作用后, 48 h时人共刺激细胞增殖达最高峰, 与24、72 h组比较有统计学意义(P<0.05); 紫草素浓度为100-400 μg/L时, 人共刺激细胞增殖率为负值(P<0.05), 提示高浓度紫草素对人共刺激细胞具有杀伤作用, 可能为高浓度的紫草素产生的细胞毒作用所致(图2A).
与对照组比较, 0.4-400 μg/L的紫草素对NCI-N87抑制明显(P<0.05), 且NCI-N87细胞的生长抑制率均随紫草素浓度增加而上升, 呈剂量依赖性; 紫草素浓度相同时, NCI-N87细胞生长抑制率24 h组达最高峰, 与48、72 h组比较, 均有显著差异(P<0.05), 结果如图2B. 紫草素浓度为100-400 μg/L时, 紫草素对BGC-823细胞抑制明显(P<0.05), 紫草素浓度相同时, BGC-823细胞生长抑制率72 h组达最高峰, 与24、48 h组比较, 均有显著差异(P<0.05)(图2C). 与对照组比较, 0.8-400 μg/L的紫草素对HGC-27抑制明显(P<0.05), 且HGC-27细胞的生长抑制率均随紫草素浓度增加而上升; 紫草素浓度相同时, HGC-27细胞生长抑制率72 h组达最高峰, 与24、48 h组比较, 均有显著差异(P<0.05)(图2D).
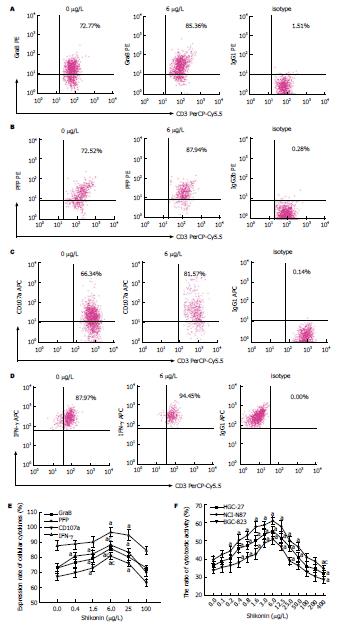
紫草素与人共刺激细胞共培养48 h后, 人共刺激细胞GraB、PFP、CD107a和IFN-γ的表达不同程度升高, 且6和25 μg/L浓度组与对照组比较均有统计学意义(P<0.05); 各实验组中, 6 μg/L组GraB、PFP和CD107a的表达最高, 与其他浓度组相比有统计学差别(P<0.05)(图3E).
经不同浓度紫草素作用48 h后, 人共刺激细胞对胃癌细胞NCI-N87、BGC-823和HGC-27的杀伤活性随着药物浓度的增加逐渐增强, 浓度在6 μg/L时杀伤活性达最高峰, 分别为55.30%、50.82%、60.86%, 0.4-25 μg/L, 与对照组比较, 差异显著(P<0.05)(图3F).
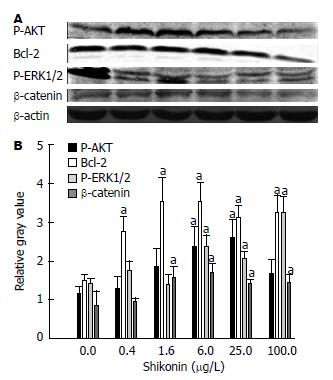
不同浓度紫草素作用48 h后, 人共刺激细胞中β-catenin、P-ERK1/2、Bcl-2和P-AKT蛋白的表达不同程度增高, 紫草素1.6-100 μg/L时β-catenin的表达高于对照组(P<0.05); 紫草素6-100 μg/L时P-ERK1/2的表达高于对照组(P<0.05), 且100 μg/L时P-ERK1/2表达最高; 紫草素0.4-100 μg/L时Bcl-2的表达高于对照组(P<0.05); 6-25 μg/L时P-AKT的表达高于对照组(P<0.05)(图4).
人共刺激细胞是PBMC在体外经多种细胞因子CD3 mAb、IL-2、IFN-γ、IL-1α、CD28 mAb、IL-15和IL-21诱导10 d后而获得的免疫效应细胞. 因CD3 mAb、IL-2、IFN-γ、IL-1a、CD28 mAb、IL-15和IL-21可以介导T细胞的增殖, 促进T细胞的活化及增强细胞毒活性, 并促其分泌IFN-γ及TNF-a等细胞因子, 所以人共刺激细胞的增殖率和细胞毒活性较CIK细胞明显提高[9]. Liu等[10]体外研究发现人共刺激细胞对能明显抑制SGC-7901、SW-1990和SW-1116细胞的增殖, 此细胞毒活性主要来源于CD3+CD56+T细胞比例较CIK细胞明显增高[11]. 本实验发现0.2-50 μg/L紫草素作用人共刺激细胞48 h后能明显促进其增殖, 增强人共刺激细胞对胃癌细胞的杀伤活性.
PFP和GraB是活化的T细胞和自然杀伤(natural killer, NK)细胞发挥细胞毒性作用的主要效应分子, 并协同发挥杀伤靶细胞的细胞毒性作用[12]. PFP在靶细胞膜上聚合形成活性孔道, 在靶细胞膜内外形成明显的渗透压反差, 导致靶细胞胀裂而死; GraB也可通过此PFP形成的孔道进入靶细胞, 导致靶细胞凋亡[13]. T细胞表面的CD107a分子, 与T细胞活化以后脱颗粒过程相关, 其比值可以直接反应该效应细胞具有的特异性杀伤活性[14]. IFN-γ可增强NK细胞、巨噬细胞和T淋巴细胞的活力, 促进其分泌各种细胞因子从而起到免疫调节作用, 并增强抗肿瘤能力[15]. 本研究发现紫草素促进人共刺激细胞GraB、PFP、CD107a和IFN-γ的表达并提高其对胃癌细胞的杀伤活性, 此印证了既往研究紫草素能通过免疫调节途径抗肿瘤理论[16]. 紫草素6-25 mg/L时人共刺激细胞的GraB、PFP、CD107a和IFN-γ表达均有不同程度的增加, 其杀伤活性在此范围内明显增强, 紫草素浓度为6 mg/L时达最大值, 与人共刺激细胞对胃癌细胞的杀伤结果相一致.
研究发现ERK1/2信号通路的激活能促进T淋巴细胞的活化、增殖并抑制其凋亡, 并促进IL-2生成[17]. 本研究发现, 紫草素促进人共刺激细胞P-ERK1/2的表达, 且100 μg/L时P-ERK1/2表达最高, 而此浓度紫草素抑制人共刺激细胞增殖, 这与ERK瞬态活化促进细胞增殖、持续活化促进细胞凋亡的理论一致[18]. 近来研究发现, Wnt/β-catenin信号通路在T细胞的增殖、分化、成熟等方面起着重要作用[19]. PI3K/Akt信号传递途径是T细胞最为重要的信号转导途径之一, 其功能主要表现为与CD28协同刺激信号一道促进T细胞活化; 调节周期蛋白和促T细胞增殖因子等表达使T细胞周期正常进行; 通过调控凋亡信号转导相关激酶活性和凋亡调控因子表达以拮抗P53、Fas等诱导的T细胞凋亡以等[20]. 在细胞凋亡过程中, Bcl-2是细胞死亡的负调因子, 其高表达能促进T细胞的增殖及活化. β-catenin的活化激活ERK分子, 进而上调抗凋亡分子Bcl-2的表达, 促进免疫细胞的存活, 从而控制自身免疫应答反应[21]. 鉴于β-catenin、P-ERK1/2、Bcl-2、P-AKT表达与免疫细胞增殖及活化的重要作用, 本研究发现紫草素能不同程度提高人共刺激细胞β-catenin、P-ERK1/2、Bcl-2、P-AKT的表达, 并且相同浓度范围下对人共刺激细胞的增殖及杀伤活性有明显的促进作用, 因此可以推断紫草素对人共刺激细胞的增殖和活化作用可能与激活β-catenin、P-ERK1/2、Bcl-2、P-AKT信号通路有关.
总之, 紫草素能促进人共刺激细胞增殖并提高其杀伤活性, 其可能机制为紫草素能激活β-catenin、P-ERK1/2、Bcl-2和P-AKT信号通路促进人共刺激细胞增殖, 提高GraB、PFP、CD107a和IFN-g表达促进人共刺激细胞对胃癌细胞的杀伤活性, 此为培养细胞毒性更强和安全性更高的免疫活性细胞提供了新的思路.
人共刺激细胞是一种由外周血淋巴细胞经7种细胞因子在体外诱导获得的异质群T淋巴细胞, 其为胃癌的新兴治疗方案. 紫草素是一种能抑制胃癌细胞增殖及调控机体免疫功能的中药. 本研究主要探讨紫草素对人共刺激细胞增殖和功能的影响.
徐灿霞, 教授, 主任医师, 中南大学湘雅三医院消化内科; 郑鹏远, 教授, 主任医师, 河南省郑州市, 郑州大学第二附属医院消化科
如何获得足够数量并具有高细胞毒活性的效应细胞已成为人共刺激细胞治疗成功的关键. 紫草素具有抗炎、抗氧化、抗肿瘤等多种药理活性. 同时紫草素能提高淋巴细胞活性. 本研究主要为进一步提高人共刺激细胞的治疗效果提供参考.
既往研究发现紫草素对胃癌细胞SGC-7901的抑制率呈剂量和浓度依赖性. 刘军权等体外研究发现人共刺激细胞对能明显抑制SGC-7901、SW-1990和SW-1116细胞的增殖. 本研究主要应用紫草素对人共刺激细胞杀伤3株不同分化胃癌细胞影响机制.
本文首先研究紫草素对人共刺激细胞增值率的影响, 后探讨紫草素促进人共刺激细胞增殖及增强人共刺激细胞对高分化胃癌细胞NCI-N87, 低分化胃癌细胞BGC-823和未分化胃癌细胞HGC-27杀伤活性的影响, 此研究国内外尚未见报道.
此研究为培养细胞毒性更强和安全性更高的人共刺激细胞提供了新的思路. 但此研究局限于体外实验, 如何使人共刺激细胞在体内持续发挥作用和引起体内的肿瘤免疫记忆并激发新一轮抗肿瘤免疫反应, 仍需进一步研究.
本文具有一定指导意义.
编辑 田滢 电编 鲁亚静
| 1. | Yang Q, Jie Z, Cao H, Greenlee AR, Yang C, Zou F, Jiang Y. Low-level expression of let-7a in gastric cancer and its involvement in tumorigenesis by targeting RAB40C. Carcinogenesis. 2011;32:713-722. [PubMed] [DOI] |
| 2. | Li XD, Xu B, Wu J, Ji M, Xu BH, Jiang JT, Wu CP. Review of Chinese clinical trials on CIK cell treatment for malignancies. Clin Transl Oncol. 2012;14:102-108. [PubMed] [DOI] |
| 3. | Ma Y, Xu YC, Tang L, Zhang Z, Wang J, Wang HX. Cytokine-induced killer (CIK) cell therapy for patients with hepatocellular carcinoma: efficacy and safety. Exp Hematol Oncol. 2012;1:11. [PubMed] [DOI] |
| 4. | Tumeh PC, Koya RC, Chodon T, Graham NA, Graeber TG, Comin-Anduix B, Ribas A. The impact of ex vivo clinical grade activation protocols on human T-cell phenotype and function for the generation of genetically modified cells for adoptive cell transfer therapy. J Immunother. 2010;33:759-768. [PubMed] [DOI] |
| 5. | Shi L, Zhou Q, Wu J, Ji M, Li G, Jiang J, Wu C. Efficacy of adjuvant immunotherapy with cytokine-induced killer cells in patients with locally advanced gastric cancer. Cancer Immunol Immunother. 2012;61:2251-2259. [PubMed] [DOI] |
| 6. | Wang R, Yin R, Zhou W, Xu D, Li S. Shikonin and its derivatives: a patent review. Expert Opin Ther Pat. 2012;22:977-997. [PubMed] [DOI] |
| 7. | Wang HB, Ma XQ. [Mechanisms of (2-methyl-n-butyl) shikonin induced apoptosis of gastric cancer SGC-7901 cells]. Yaoxue Xuebao. 2012;47:816-821. [PubMed] |
| 8. | Long S, Guang ZY, Bao JG, Wei X, Yan YH, YingLi W, Yang Z, Li HL. Shikonin derivatives protect immune organs from damage and promote immune responses in vivo in tumour-bearing mice. Phytother Res. 2012;26:26-33. [PubMed] [DOI] |
| 9. | Ramanathan S, Dubois S, Chen XL, Leblanc C, Ohashi PS, Ilangumaran S. Exposure to IL-15 and IL-21 enables autoreactive CD8 T cells to respond to weak antigens and cause disease in a mouse model of autoimmune diabetes. J Immunol. 2011;186:5131-5141. [PubMed] [DOI] |
| 10. | Liu JQ, Zhu Y, Chen FX, Zhang NZ, Lv XT, Zhou ZH, Zhang J, Zhang S, Tao ZZ, Li Y. [Co-stimulation of multiple activating factors on proliferation and phenotype of T lymphocytes in peripheral blood in vitro]. Xibao Yu Fenzinianyixue Zazhi. 2012;28:367-370. [PubMed] |
| 11. | Pievani A, Borleri G, Pende D, Moretta L, Rambaldi A, Golay J, Introna M. Dual-functional capability of CD3+CD56+ CIK cells, a T-cell subset that acquires NK function and retains TCR-mediated specific cytotoxicity. Blood. 2011;118:3301-3310. [PubMed] [DOI] |
| 12. | Saito S, Murakoshi K, Kotake S, Kamatani N, Tomatsu T. Granzyme B induces apoptosis of chondrocytes with natural killer cell-like cytotoxicity in rheumatoid arthritis. J Rheumatol. 2008;35:1932-1943. [PubMed] |
| 13. | Brown DM, Lee S, Garcia-Hernandez Mde L, Swain SL. Multifunctional CD4 cells expressing gamma interferon and perforin mediate protection against lethal influenza virus infection. J Virol. 2012;86:6792-6803. [PubMed] [DOI] |
| 14. | Parkinson-Lawrence EJ, Dean CJ, Chang M, Hopwood JJ, Meikle PJ, Brooks DA. Immunochemical analysis of CD107a (LAMP-1). Cell Immunol. 2005;236:161-166. [PubMed] |
| 15. | Becker C, Lienenklaus S, Jablonska J, Bauer H, Weiss S. CD8(+) T cells armed with retrovirally transduced IFN-gamma. J Mol Med (Berl). 2007;85:63-73. [PubMed] |
| 16. | Chen HM, Wang PH, Chen SS, Wen CC, Chen YH, Yang WC, Yang NS. Shikonin induces immunogenic cell death in tumor cells and enhances dendritic cell-based cancer vaccine. Cancer Immunol Immunother. 2012;61:1989-2002. [PubMed] [DOI] |
| 17. | Raman M, Chen W, Cobb MH. Differential regulation and properties of MAPKs. Oncogene. 2007;26:3100-3112. [PubMed] |
| 18. | Norambuena A, Metz C, Vicuña L, Silva A, Pardo E, Oyanadel C, Massardo L, González A, Soza A. Galectin-8 induces apoptosis in Jurkat T cells by phosphatidic acid-mediated ERK1/2 activation supported by protein kinase A down-regulation. J Biol Chem. 2009;284:12670-12679. [PubMed] [DOI] |
| 19. | Gattinoni L, Ji Y, Restifo NP. Wnt/beta-catenin signaling in T-cell immunity and cancer immunotherapy. Clin Cancer Res. 2010;16:4695-4701. [PubMed] [DOI] |
| 20. | Wang X, Hao J, Metzger DL, Ao Z, Chen L, Ou D, Verchere CB, Mui A, Warnock GL. B7-H4 Treatment of T Cells Inhibits ERK, JNK, p38, and AKT Activation. PLoS One. 2012;7:e28232. [PubMed] [DOI] |
| 21. | Charo J, Finkelstein SE, Grewal N, Restifo NP, Robbins PF, Rosenberg SA. Bcl-2 overexpression enhances tumor-specific T-cell survival. Cancer Res. 2005;65:2001-2008. [PubMed] |