修回日期: 2014-04-10
接受日期: 2014-04-28
在线出版日期: 2014-05-18
目的: 研究CD133+CXCR4+胃癌细胞侵袭能力.
方法: Transwell检测CD133-CXCR4-、CD133-CXCR4+、CD133+CXCR4-、CD133+CXCR4+四组细胞迁移和侵袭能力. 半定量酶链聚合反应检测CD133+CXCR4+组与CD133+CXCR4-组细胞上皮间质转化(epithelial mesenchymal transition, EMT)相关因子表达. 分别用基质细胞衍生因子-1α(stromalcellderivedfactor-1α, SDF-1α)、AMD3100作用KATO-Ⅲ细胞后, Transwell检测CD133+CXCR4+组与CD133+CXCR4-组细胞侵袭能力. 半定量酶链聚合反应检测KATO-Ⅲ细胞中EMT相关因子表达.
结果: CD133+CXCR4+组平均迁移细胞数(136.67±14.36)高于CD133+CXCR4-组(55.33±7.37, P = 0.01). CD133+CXCR4+组E-cadherin mRNA相对灰度值(0.3068±0.0399)低于CD133+CXCR4-组(0.7665±0.0899, P = 0.005). CD133+CXCR4+组N-cadherin mRNA表达(0.5852±0.0453)、Snail mRNA表达(0.9178±0.0788)均高于CD133+CXCR4-组(0.2980±0.0626, P = 0.006; 0.6468±0.1506, P = 0.03). CD133+CXCR4+组中, 与对照组相比, SDF-1α组侵袭细胞数明显上升(P = 0.033). SDF-1α组E-cadherin mRNA表达下降(P = 0.018), 而AMD3100组E-cadherin mRNA表达上升(P = 0.008). SDF-1α组Snail mRNA表达上升(P = 0.028), 而AMD3100组Snail mRNA表达下降(P = 0.006). 然而CD133+CXCR4-组中, SDF-1α组侵袭细胞数无明显变化. SDF-1α与AMD3100组E-cadherin mRNA与Snail mRNA表达均无明显变化.
结论: CD133+CXCR4+胃癌细胞可能通过EMT和SDF-1α/CXCR4获得高侵袭能力.
核心提示: 本研究初步明确CXCR4与CD133双阳性胃癌细胞的迁移与侵袭能力, 并深入地揭示了基质细胞衍生因子-1α(stromalcellderivedfactor-1α)/CXCR4轴与上皮间质转化(epithelial mesenchymal transition)现象在CXCR4与CD133双阳性胃癌细胞的迁移与侵袭能力扮演的重要作用.
引文著录: 俞远林, 姜波健, 俞继卫. CD133+CXCR4+胃癌KATO-Ⅲ细胞的侵袭能力. 世界华人消化杂志 2014; 22(14): 1977-1983
Revised: April 10, 2014
Accepted: April 28, 2014
Published online: May 18, 2014
AIM: To assess the invasive capacity of CD133+ CXCR4+ gastric cancer cells.
METHODS: The invasive and migration capacities of CD133-CXCR4-, CD133-CXCR4+, CD133+CXCR4-, and CD133+CXCR4+ gastric cancer cells were assessed by Transwell assays. The mRNA expression of EMT related factors in CD133+CXCR4- and CD133+CXCR4+ cells was detected by semi-quantitative RT-PCR. After SDF-1α and AMD3100 were used to stimulate and inhibit KATO-Ⅲ cells, respectively, the invasive ability of CD133+CXCR4+ and CD133+CXCR4- cells was assessed, and the mRNA expression of EMT related factors was detected by semi-quantitative RT-PCR.
RESULTS: The mean number of migrated cells in the CD133+CXCR4+ group was significantly more than that in the CD133+CXCR4- group (136.67 ± 14.36 vs 55.33 ± 7.37, P = 0.01). The expressive level of E-cadherin mRNA in the CD133+CXCR4+ group was significantly lower than that in the CD133+CXCR4- (0.3068 ± 0.0399 vs 0.7665 ± 0.0899, P = 0.005). The expressive levels of N-cadherin and Snail mRNAs in CD133+CXCR4+ cells were significantly stronger than those in CD133+CXCR4- cells (0.5852 ± 0.0453 vs 0.2980 ± 0.0626, P = 0.006; 0.9178 ± 0.0788 vs 0.6468 ± 0.1506, P = 0.03). In CD133+CXCR4+ cells, SDF-1α treatment significantly increased the number of invasive cells (P = 0.033), decreased the expressive level of E-cadherin mRNA (P = 0.018), and increased the expressive level of Snail mRNA (P = 0.028). AMD3100 treatment significantly increased E-cadherin mRNA expression (P = 0.008) and decreased Snail mRNA expression (P = 0.006). In CD133+CXCR4- cells, SDF-1α or AMD3100 treatment did not significantly alter the invasion and expressive levels of E-cadherin and Snail mRNAs.
CONCLUSION: The high invasion ability of CD133+CXCR4+ gastric cancer cells may be mediated by EMT and SDF-1α/CXCR4.
- Citation: Yu YL, Jiang BJ, Yu JW. High invasive capacity of CD133+CXCR4+ gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2014; 22(14): 1977-1983
- URL: https://www.wjgnet.com/1009-3079/full/v22/i14/1977.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i14.1977
胃癌的发病率在恶性肿瘤中位居前列, 其高死亡率主要由胃癌易侵袭和转移所致[1]. 肿瘤起始细胞(tumor initiating cells, TICs)又称肿瘤干细胞(cancer stem cells, CSCs), 是一类与正常干细胞相似的具有多能特性的祖细胞, 能够自我更新、无限增殖及多向分化[2]. CD133作为TICs的重要标志物近年来引起广泛关注[3-6]. 近来发现, 基质细胞衍生因子-1α(stromalcellderivedfactor-1α, SDF-1α)/CXCR4轴在乳腺癌、前列腺癌、肺癌、胰腺癌迁移、侵袭和转移过程中发挥关键作用[7]. 在结肠癌中, CXCR4和CD133联合表达提示高转移特性[8]. 此外, 在胃癌KATO-III细胞中SDF-1α/CXCR4轴参与调控CD133的表达[9]. 本研究旨在探索CXCR4和CD133联合表达对胃癌KATO-Ⅲ细胞侵袭能力的影响.
人胃癌KATO-Ⅲ细胞细胞株(ATCC公司, 美国); 胎牛血清(Hyclone公司, 美国); ATCC培养基(ATCC公司, 美国); CXCR4兔抗人多克隆抗体(Abcam公司, 英国); CD133鼠抗人单克隆抗体(Miltenyi公司, 德国); 辣根过氧化物酶(HRP)标记的二抗(Jackson公司, 美国); CD133分选试剂盒、CXCR4分选试剂盒(Miltenyi公司, 德国); HRP标记的二抗(Jackson公司, 美国); 人重组SDF-1α(PeproTech公司, 美国); CXCR4特异性受体抑制剂AMD3100(Sigma公司, 美国); TRIzol试剂和PCR试剂盒(Takara公司, 日本); 目的引物(上海生工生物工程公司, 中国);
1.2.1 细胞培养及免疫磁珠分选: 细胞培养: KATO-Ⅲ细胞用含20%胎牛血清, 100 U/mL青霉素、100 U/mL链霉素的ATCC培养基, 置37 ℃、5%CO2饱和湿度培养箱中, 每2-3 d传代1次. 收集KATO-Ⅲ细胞, 调整密度至1×107个/mL, 用300 μL缓冲液重悬, 按操作步骤经MiniMACS分离柱分选, 用无血清含20 ng/mL EGF及10 ng/mL bFGF的ATCC培养基重悬, 并设定为CD133+CXCR4+组、CD133+CXCR4-组、CD133-CXCR4+组、CD133-CXCR4-组. 实验分为3组: (1)空白对照组: 即不加任何药物的细胞组; (2)SDF-1α组: 100 ng/mL SDF-1α刺激2 h; (3)AMD3100组: CXCR4特异性的抑制剂AMD3100(40 μmol/L)预处理细胞30 min[10].
1.2.2 免疫蛋白印迹法(Western blot)检测: 用100 μL裂解液作用于1×105个胰酶消化后的KATO-III细胞, 冰上裂解30 min, 4 ℃12000 r/min, 5 min离心, 取上清液60 μL+15 μL蛋白上样缓冲液, 即得该组细胞的蛋白, 每次均取15 μL上样量在10%分离胶、5%浓缩胶上面进行SDS-PAGE凝胶电泳分离, 经电转膜仪转至PVDF膜. 然后用5%脱脂奶粉室温封闭2 h, 用5%脱脂奶稀释的兔抗人CXCR4抗体(1:1000)、鼠抗人抗体CD133(1:200), 4 ℃轻摇过夜, 用吐温-20三羟甲基氨基甲烷缓冲盐溶液(TBST)振洗, 洗3次, 每次10 min, 分别加HRP标记的山羊抗兔和抗鼠IgG二抗(1:2000), 室温下孵育2 h, 再用TBST振洗2次, 每次10 min; TBS振洗1次, 每次10 min. 加增强化学发光(ECL)底物显色, 曝光洗片. 取胶片于扫描仪上获取图像, 图像分析软件进行半定量分析, 实验重复3次取平均值[11].
1.2.3 半定量聚合酶链式反应(RT-PCR)检测: TRIzol法提取总RNA, 逆转录成cDNA后行PCR反应(表1). 反应条件为94 ℃ 3 min, 94 ℃ 30 s、50 ℃-57 ℃ 30 s、72 ℃ 30 s 35个循环, 4 ℃ 10 min, 应用凝胶成像系统及凝胶图像分析软件行半定量分析目的产物与对应GAPDH产物的灰度值, 目的mRNA表达水平以目的mRNA扩增条带灰度值与GAPDH mRNA扩增条带灰度值比值表示, 图像分析软件进行半定量分析, 实验重复3次取平均值[11].
| 因子 | 引物序列 | 产物长度(bp) | 功能 |
| Snail | 上游: 5'-CCTCCCTGTCAGATGAGGAC-3' | 234 | EMT调节因子 |
| 下游: 5'-CCAGGCTGAGGTATTCCTTG-3' | |||
| E-cadherin | 上游: 5'-TGCCCAGAAAATGAAAAAGG-3' | 200 | 上皮细胞表面标志物 |
| 下游: 5'-GTGTATGTGGCAATGCGTTC-3' | |||
| N-cadherin | 上游: 5'-ACAGTGGCCACCTACAAAGG-3' | 201 | 间质细胞表面标志物 |
| 下游: 5'-CCGAGATGGGGTTGATAATG-3' | |||
| CD133 | 上游: 5'-TTACGGCACTCTTCACCT-3' | 172 | TICs表面标志物 |
| 下游: 5'-TATTCCACAAGCAGCAAA-3' | |||
| GAPDH | 上游: 5'-ACGGATTTGGTCGTATTGGGCG-3' | 197 | 内参 |
| 下游: 5'-CTCCTGGAAGATGGTGATGG-3' |
1.2.4 Transwell法检测KATO-Ⅲ细胞侵袭能力: 将基质胶以1:1比例用无血清ATCC培养基稀释后, 取50 μL铺于Transwell上室中, 置于37 ℃培养箱中, 待上室的基质胶凝结, 收集对数生长期KATO-Ⅲ细胞, 以无血清ATCC培养基重悬, 取100 μL加入Transwell上室中, 调整细胞浓度为1×105-5×105个/孔, 下室中加入含有20%胎牛血清的ATCC完全培养基, 37 ℃培养箱培养24 h后, 取出Transwell小室, 用棉签擦去上室中的基质胶及细胞, 4%多聚甲醛固定, 结晶紫染色, 在高倍镜下平移非重叠观察9个视野, 计数其中的穿膜细胞数, 并计算平均数, 实验结果最终以平均穿膜细胞数表示.
1.2.5 Transwell法检测KATO-Ⅲ细胞迁移能力: 收集对数生长期KATO-Ⅲ细胞, 以无血清ATCC培养基重悬, 取100 μL加入Transwell上室中, 调整细胞浓度为1×105-5×105个/孔, 下室中加入含有20%胎牛血清的ATCC完全培养基, 37 ℃培养箱培养24 h后, 取出Transwell小室, 用棉签擦去上室的细胞, 4%多聚甲醛固定, 结晶紫染色, 在高倍镜下平移非重叠观察9个视野, 计数其中的穿膜细胞数, 并计算平均数, 实验结果最终以平均穿膜细胞数表示.
统计学处理 采用SPSS17.0软件进行统计学分析, 计量数据以mean±SD表示, 组间比较采用单因素方差分析. P<0.05为差异有统计学意义. CXCR4及CD133联合表达和胃癌临床病理的关系采用卡方检验分析.
Transwell法迁移能力检测发现, CD133+CXCR4+组平均迁移细胞数(136.67±14.36), 显著高于CD133+CXCR4-组(55.33±7.37, P = 0.01), CD133-CXCR4+组(31.33±5.51, P = 0.01), CD133-CXCR4-组(33.33±5.69, P = 0.002) (图1).
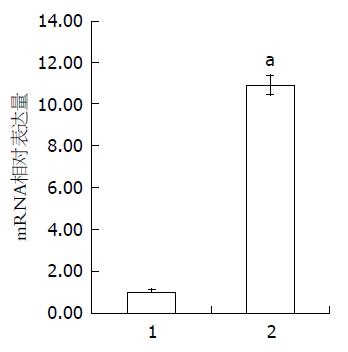
RT-PCR检测发现, CD133+CXCR4+组E-cadherin mRNA相对灰度值(0.3068±0.0399)显著低于CD133+CXCR4-组(0.7665±0.0899, P = 0.005). CD133+CXCR4+组N-cadherin mRNA相对灰度值(0.5852±0.0453)显著高于CD133+CXCR4-组(0.2980±0.0626, P = 0.006). CD133+CXCR4+组Snail mRNA相对灰度值(0.9178±0.0788)显著高于CD133+CXCR4-组(0.6468±0.1506, P = 0.03)(图2).
Transwell法侵袭能力检测发现, CD133+CXCR4+组中, 与对照组(42.33±6.51)相比, SDF-1α组侵袭细胞数(81.67±12.10, P = 0.033)明显上升. 然而在CD133+CXCR4-组中, 与对照组(17.67±3.51)相比, SDF-1α组侵袭细胞数(17.33±4.93, P = 0.475)无明显变化(图3).
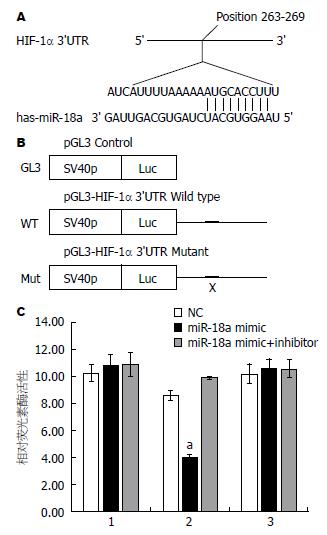
RT-PCR检测发现, CD133+CXCR4+组中, 与对照组(0.4102±0.0675)相比, SDF-1α组E-cadherin mRNA相对灰度值(0.2170±0.0220, P = 0.018)下降, 而AMD3100组E-cadherin mRNA相对灰度值(0.8415±0.0934, P = 0.008)上升. 与对照组(0.3034±0.0501)相比, SDF-1α组Snail mRNA相对灰度值(0.5660±0.0715, P = 0.028)上升, 而AMD3100组Snail mRNA相对灰度值(0.1280±0.0274, P = 0.006)下降. CD133+CXCR4-组中, 与对照组(0.3281±0.0657)相比, SDF-1α组E-cadherin mRNA相对灰度值(0.3014±0.0282, P = 0.335)无明显变化, AMD3100组E-cadherin mRNA相对灰度值(0.3300±0.0312, P = 0.480)无明显变化. 与对照组(0.1908±0.0471)相比, SDF-1α组Snail mRNA相对灰度值(0.1759±0.0361, P = 0.391)无明显变化, AMD3100组Snail mRNA相对灰度值(0.1715±0.0598, P = 0.187)无明显变化(图4),
半定量 RT-PCR示, CXCR4 mRNA及CD133 mRNA相对灰度值在淋巴结转移组高于无淋巴结转移组, 差异均有统计学意义(P = 0.011, P = 0.038). CXCR4蛋白相对灰度值在N1组明显高于无淋巴结转移的N0组, 差异有统计学意义(P = 0.023), 而明显低于N2+N3组(P = 0.008); 在淋巴管浸润组明显高于无淋巴管浸润组(P = 0.020). CD133蛋白灰度值在N1组、N2+N3组与N0组之间差异有统计学意义(P = 0.04, P = 0.01), N1组与N2+N3组之间无明显差异; 在淋巴管浸润组高于无淋巴管浸润组(P = 0.047).
Bonnte等[12]最早研究发现在白血病中, 存在一特定亚群细胞与正常干细胞相似的具有多能特性的祖细胞, 能够自我更新、无限增殖及多向分化, 并由此提出了TICs理论. 近年来, TICs理论已在多种实体肿瘤相继得到验证[13]. 人AC133抗原也称为CD133, 是PROM1基因编码的5次跨膜糖蛋白, 被认为是包括脑肿瘤、胰腺癌、结肠癌、前列腺癌中陆续得到实验论证[3-6]等多种TICs的标志. 在对KATO-Ⅲ胃印戒细胞癌的研究中发现, CD133+亚群KATO-Ⅲ细胞相对于CD133-亚群具有更强的克隆形成能力、分化能力、裸鼠移植成瘤能力及耐药的潜能, 同时, 后续实验[14]已成功转染并抑制KATO-Ⅲ CD133+胃癌细胞CD133基因的表达, CD133基因表达被抑制以后, 细胞的增殖活性、侵袭和克隆球形成能力显著降低, 由此推测CD133或可作为胃癌TICs的表面标志物之一[11].
SDF-1α/CXCR4轴是由趋化因子SDF-1α与其特异性受体CXCR4相互作用而构成的一个与细胞间信息传递、细胞迁移有密切关系的偶联分子对[15]. 体外实验中, 本研究利用免疫磁珠分选成功分离出以CD133和CXCR4为标志物的不同亚群细胞. 随后, 通过Transwell法检测发现, CD133+CXCR4+亚群细胞迁移能力显著高于其它亚群, 由此推测CD133+CXCR4+亚群细胞可能具备高侵袭潜能. 深入地, 通过SDF-1α激活SDF-1α/CXCR4轴后, CD133+CXCR4+亚群细胞侵袭能力明显上升, 而CD133+CXCR4-亚群细胞侵袭能力无明显变化.
EMT是指上皮细胞发生形态转变, 变为间质细胞的一个过程[16]. 本课题组前期研究表明CD133可以通过诱导EMT的发生而促进胃癌的侵袭与转移. 通过RT-PCR检测CD133+CXCR4+与CD133+CXCR4-两个亚群细胞EMT相关因子mRNA表达发现, 对应于CD133+CXCR4-亚群, CD133+CXCR4+亚群细胞上皮标志物E-cadherin表达降低, 而间质标志物N-cadherin和Snail表达升高. 由此推断, CD133+CXCR4+亚群更倾向于发生EMT现象, 其机制可能是CD133通过CXCR4诱导EMT发生促进胃癌的侵袭和转移.
为了进一步验证CD133+胃癌KATO-Ⅲ细胞中SDF-1α/CXCR4轴与EMT现象之间的关系. 本研究利用SDF-1α或CXCR4特异性抑制剂AMD3100激活或抑制SDF-1α/CXCR4轴, 观察CD133+CXCR4+与CD133+CXCR4-两个亚群细胞EMT相关因子的表达变化. 结果发现, 在CD133+CXCR4+亚群中, 激活或抑制SDF-1α/CXCR4轴能够调控EMT相关因子的表达. 然而, CD133+CXCR4-亚群中, 激活或抑制SDF-1α/CXCR4轴, EMT相关因子表达无明显变化. TICs理论认为, 因侵袭能力不同, TICs可分为运动型TICs与静止型TICs. 由此, 我们可认为在CD133+胃癌KATO-Ⅲ细胞中, CD133+CXCR4+亚群细胞属于运动型TICs, 负责侵袭和转移的启动与发生.
总之, CD133+CXCR4+胃癌细胞可能通过EMT和SDF-1α/CXCR4获得高侵袭能力的一群运动型TICs, 同时, CD133与CXCR4蛋白双阳性与胃癌淋巴结转移正相关.
胃癌是消化系常见恶性肿瘤之一, 其死亡原因主要是胃癌高侵袭能力和高转移能力. 肿瘤起始细胞(tumor initiating cells, TICs)是近年来的研究热点, 多种证据表明TICs与肿瘤复发转移密切相关. 研究不同亚群的胃癌TICs侵袭能力差异, 有利于进一步阐明胃癌发生转移的机制.
刘丽江, 教授, 江汉大学医学院病理学
明确CD133+CXCR4+亚群胃癌细胞可能通过EMT和SDF-1α/CXCR4轴获得高侵袭能力, 属于运动型TICs. 然而, 具体机制尚待深入探究.
近来发现, SDF-1α/CXCR4轴在多种恶性肿瘤的迁移、侵袭和转移过程中发挥关键作用. 在结肠癌中, CXCR4和CD133联合表达提示高转移可能性. 本课题组前期发现CXCR4和CD133在胃癌原发灶中高表达, 两者呈正相关, 其联合表达与转移淋巴结比率和转移淋巴结数呈正相关, 推测胃癌CD133阳性细胞亚群可能在CXCR4介导下更易导致淋巴管浸润和淋巴结转移.
本研究在体外实验的层面上, 首次利用免疫磁珠法从胃癌细胞株中分选出CD133+CXCR4+亚群细胞, 并对其迁移和侵袭能力进行检测, 随即对其机制进行深入的探索, 从而为胃癌的转移和复发寻找更加充分的理论依据.
由于胃癌侵袭转移的机制尚未明确, 基于本课题组前期研究成果及国内外文献报道, 本研究通过免疫磁珠分选的方法分离CD133+CXCR4+亚群胃癌细胞, 通过检测侵袭能力及EMT相关因子的表达情况, 初步阐明CD133+CXCR4+亚群胃癌细胞侵袭能力机制, 从而为进一步探寻胃癌的转移和复发提供理论依据.
本文选题具有重要的基础研究及临床应用的意义.
编辑 田滢 电编 鲁亚静
| 1. | Jemal A, Tiwari RC, Murray T, Ghafoor A, Samuels A, Ward E, Feuer EJ, Thun MJ. Cancer statistics, 2004. CA Cancer J Clin. 2004;54:8-29. [PubMed] |
| 2. | Scatena R, Bottoni P, Pontoglio A, Giardina B. Cancer stem cells: the development of new cancer therapeutics. Expert Opin Biol Ther. 2011;11:875-892. [PubMed] [DOI] |
| 3. | O'Brien CA, Pollett A, Gallinger S, Dick JE. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature. 2007;445:106-110. [PubMed] |
| 4. | Rappa G, Fodstad O, Lorico A. The stem cell-associated antigen CD133 (Prominin-1) is a molecular therapeutic target for metastatic melanoma. Stem Cells. 2008;26:3008-3017. [PubMed] [DOI] |
| 5. | Hermann PC, Huber SL, Herrler T, Aicher A, Ellwart JW, Guba M, Bruns CJ, Heeschen C. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell. 2007;1:313-323. [PubMed] [DOI] |
| 6. | Smith LM, Nesterova A, Ryan MC, Duniho S, Jonas M, Anderson M, Zabinski RF, Sutherland MK, Gerber HP, Van Orden KL. CD133/prominin-1 is a potential therapeutic target for antibody-drug conjugates in hepatocellular and gastric cancers. Br J Cancer. 2008;99:100-109. [PubMed] [DOI] |
| 7. | Sun X, Cheng G, Hao M, Zheng J, Zhou X, Zhang J, Taichman RS, Pienta KJ, Wang J. CXCL12 / CXCR4 / CXCR7 chemokine axis and cancer progression. Cancer Metastasis Rev. 2010;29:709-722. [PubMed] [DOI] |
| 8. | Zhang SS, Han ZP, Jing YY, Tao SF, Li TJ, Wang H, Wang Y, Li R, Yang Y, Zhao X. CD133(+)CXCR4(+) colon cancer cells exhibit metastatic potential and predict poor prognosis of patients. BMC Med. 2012;10:85. [PubMed] [DOI] |
| 9. | 姜 海广, 陆 瑞祺, 吴 巨钢, 周 国才, 俞 继卫, 姜 波健. 基质细胞源性因子-1α/CXC趋化因子受体-4轴经PI3K/Akt通路对胃癌细胞CD133表达的调控作用. 中华实验外科杂志. 2012;29:378-380. |
| 10. | Domanska UM, Timmer-Bosscha H, Nagengast WB, Oude Munnink TH, Kruizinga RC, Ananias HJ, Kliphuis NM, Huls G, De Vries EG, de Jong IJ. CXCR4 inhibition with AMD3100 sensitizes prostate cancer to docetaxel chemotherapy. Neoplasia. 2012;14:709-718. [PubMed] |
| 12. | Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997;3:730-737. [PubMed] |
| 13. | Magee JA, Piskounova E, Morrison SJ. Cancer stem cells: impact, heterogeneity, and uncertainty. Cancer Cell. 2012;21:283-296. [PubMed] [DOI] |