修回日期: 2014-03-22
接受日期: 2014-03-28
在线出版日期: 2014-05-18
目的: 探讨白藜芦醇在酒精诱导的HepG2细胞氧化应激中的抗氧化作用, 揭示白藜芦醇抗酒精性肝损伤的作用机制.
方法: 白藜芦醇预处理HepG2细胞24 h后, 用酒精诱导氧化应激的产生. MTT方法检测白藜芦醇处理组与对照组HepG2细胞活力; 用ELISA试剂盒检测不同实验组的超氧化物歧化酶(superoxide dismutase, SOD)和细胞内总活性氧(reactive oxygen species, ROS)含量; 采用RT-PCR方法检测抗氧化通路中关键基因SOD1、SOD2和过氧化氢酶的mRNA表达水平.
结果: MTT结果显示, 与对照组比较, 白藜芦醇(12.5、25、50、100 μmol/L)对HepG2细胞的细胞毒性均在20%以下, 300 mmol/L酒精可致近50%HepG2细胞死亡; 25-100 μmol/L白藜芦醇可有效对抗300 mmol/L酒精对HepG2引起的细胞毒性作用; SOD活性显示100 μmol/L白藜芦醇预处理组SOD含量(0.391±0.011)明显高于非处理组(0.286±0.019), 而ROS结果显示酒精诱导组(29234.79±2288)明显高于白藜芦醇25、50、100 μmol/L预处理组(18023.26±1359.66; 13528.44±1078.99; 8219.87±635.99); RT-PCR结果显示, 与300 mmol/L酒精比较, 25、50和100 μmol/L白藜芦醇可上调SOD1 mRNA表达量(0.5535±0.0035; 0.586±0.0113; 0.623±0.0127); 12.5、25、50、100 μmol/L白藜芦醇均可上调SOD2 mRNA表达量(1.249±0.011; 1.369 ±0.028; 1.377±0.021; 1.401±0.0578); 50和100 μmol/L白藜芦醇均可上调过氧化氢酶(0.1955±0.004; 0.2275±0.00707)mRNA的表达量.
结论: 本研究提示酒精可诱导氧化应激的产生, 而白藜芦醇通过调节抗氧化通路中基因的表达发挥抗氧化功能, 从而削弱酒精的细胞损伤作用.
核心提示: 本研究发现经白藜芦醇处理后, 酒精诱导的细胞内总活性氧(reactive oxygen species)含量明显下降, 氧化应激(oxidative stress)较未处理组减轻. 随后应用Real-time PCR技术对超氧化物歧化酶(superoxide dismutase)和过氧化氢酶mRNA表达水平的检测证明白藜芦醇可以通过增加抗氧化酶的表达提高抗氧化酶活性, 加快活性氧自由基代谢, 从而起到细胞保护作用.
引文著录: 何培元, 高淑梅, 侯志平, 马立新, 李炳庆. 白藜芦醇对酒精诱导的HepG2细胞氧化损伤的保护作用及相关基因表达的变化. 世界华人消化杂志 2014; 22(14): 1928-1935
Revised: March 22, 2014
Accepted: March 28, 2014
Published online: May 18, 2014
AIM: To assess the effect of resveratrol as an antioxidant on alcohol-induced oxidative stress in HepG2 cells and to explore the possible mechanisms involved.
METHODS: HepG2 cells were pretreated with resveratrol for 24 h before treatment with alcohol to induce oxidative stress. MTT assay was performed to detect the viability of resveratrol-treated HepG2 cells and control cells. ELISA was used to detect the activity of superoxide dismutase (SOD) and the level of total intracellular reactive oxygen species (ROS). Finally, RT-PCR was performed to detect the expression levels of SOD1, SOD2 and catalase, which are key genes involved in anti-oxidation pathway.
RESULTS: In comparison with control cells (not treated with resveratrol), the toxicity of resveratrol (12.5, 25, 50, 100 μmol/L) towards HepG2 cells during pre-treatment was below 20%. Treatment with 300 mmol/L alcohol without pre-treatment with resveratrol resulted in the death of around 50% of cells. Resveratrol at concentrations ranging from 25 to 100 μmol/L had an antagonistic effect against cytotoxicity of 300 mmol/L alcohol to HepG2 cells. SOD activity was significantly higher in cells pre-treated with 100 mmol/L resveratrol (0.391 ± 0.011) compared to non-treated controls (0.391 ± 0.011 vs 0.286 ± 0.019, P < 0.05). After alcohol induction, non-treated cells showed a higher ROS level compared to cells treated with 25, 50, and 100 μmol/L resveratrol (29234.79 ± 2288.00 vs 18023.26 ± 1359.66, 13528.44 ± 1078.99, 8219.87 ± 635.99). Compared to cells induced with 300 mM alcohol, resveratrol increased the expression levels of SOD1 (0.5535 ± 0.0035, 0.586 ± 0.0113, 0.623 ± 0.0127), SOD2 (1.249 ± 0.011, 1.369 ± 0.028, 1.377 ± 0.021, 1.401 ± 0.0578) and catalase (0.1955 ± 0.004, 0.2275 ± 0.00707).
CONCLUSION: Resveratrol as an antioxidant protects against alcohol-induced oxidative stress by regulating the expression of genes involved in anti-oxidant pathways.
- Citation: He PY, Gao SM, Hou ZP, Ma LX, Li BQ. Resveratrol protects against alcohol-induced oxidative stress in human HepG2 cells. Shijie Huaren Xiaohua Zazhi 2014; 22(14): 1928-1935
- URL: https://www.wjgnet.com/1009-3079/full/v22/i14/1928.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i14.1928
白藜芦醇属于非黄酮类多酚化合物, 主要存在于各种红葡萄果实和红葡萄酒中[1], 是一种天然的植物抗毒素, 研究证据表明白藜芦醇具有抗衰老、抗氧化、抗肿瘤、抗炎和免疫调节作用[2-5]. 目前其在肝脏疾病的治疗方面有一些研究, 其作用机制主要为消除自由基和抗氧化[6].
过量饮酒成为当今世界范围内一个重要的公共卫生问题. 嗜酒者的肝脏、神经系统疾患的发病率比一般人群高20%[7]. 酒精性肝病(alcoholic liver disease, ALD)为长期大量饮酒所致肝脏损伤性疾病. 虽然很多学者致力于酒精性肝病的研究, 但依然缺乏有效的治疗方法[8]. 之前的相关研究表明氧化应激在发病过程中发挥了重要作用[8-10]. 肝细胞癌细胞(HepG2)被广泛用于肝细胞毒性、肝脂质代谢和体外代谢研究[11], 是在细胞水平研究肝病的一种良好模型. 目前, 还没有关于白藜芦醇对抗酒精诱导的细胞毒性作用及其机制的研究. 本实验旨在研究白藜芦醇对酒精所诱导的氧化应激的抗氧化作用及其分子机制.
人肝细胞癌HepG2细胞株购于美国ATCC公司; 酒精、二甲基亚砜(DMSO)购自天津化工厂; DMEM培养基、胎牛血清、MTT购自Sigma公司; 总RNA提取试剂盒、RT-PCR扩增试剂盒购自上海生工公司; 细胞培养箱(美国Thermo)、倒置显微镜为日本Olympus公司产品, 由承德医学院基础研究所提供.
1.2.1 细胞培养人肝细胞癌HepG2细胞: 于DMEM(Dulbecco's modified Eagle's medium)培养液, 包含10%(V/V)小牛血清和50 μg/mL庆大霉素, 37℃、5%CO2培养箱中培养. 细胞密度达到80%以上后种在96孔细胞培养板上, 密度为每孔1×105个.
1.2.2 毒性检测: 使用MTT[3-(4,5-di-methylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide]方法检测细胞活性, 方法同参考文献[14]. HepG2细胞(1×105)种于96孔细胞培养板中, 培养24 h后以不同浓度的白藜芦醇(0-100 μmol/L)处理24 h后测细胞活性以观察白藜芦醇的细胞毒性; 同样以不同浓度的酒精[12](0-400 mmol/L)处理细胞24 h后检测细胞活性以观察酒精的细胞毒性.
1.2.3 白藜芦醇对抗酒精毒性细胞活力检测: 以不同浓度的白藜芦醇(0-100 μmol/L)预处理HepG2细胞24 h后, 用300 mmol/L浓度的酒精诱导24 h, 之后在每孔中加入20 μL MTT, 孵育4 h, 弃去培养液, 加入100 μL DMSO, 摇床震荡15 min, 待紫色结晶完全溶解后, 酶标仪570 nm处读取吸光值.
1.2.4 SOD、ROS检测: 使用武汉华美生物工程有限公司的ELISA试剂盒检测SOD、ROS表达, 分别按照说明书严格进行操作, 用荧光酶标仪在490 nm处读取SOD吸光度值; 以激发波长480 nm, 发射波长530 nm读取ROS吸光度值.
1.2.5 RT-PCR 检测细胞内SOD1, SOD2及过氧化氢酶mRNA的表达: 使用上海生工总RNA提取试剂盒严格按照说明书提取HepG2细胞总RNA; 使用紫外分光光度计检测A260/230和A260/280以检测RNA纯度及计算RNA浓度. 引物设计参考文献[13,14]并在GenBank中比对, 由上海生工合成, 表1为相关基因上下游引物基本信息. 根据上海生工一步法反转录试剂盒说明书配制 RT-PCR混合物. 反转录体系为: RNA样本(50 ng/μL)1 μL, 5×RT Buffer 4 μL, 反转录引物2 μL, 反转录酶1 μL, 双蒸水12 μL, 总共20 μL. 使用PCR仪48 ℃ 1 min, 42 ℃ 60 min, 95 ℃ 5 min进行反转录. PCR复合扩增体系为: 各基因cDNA 9.3 μL, 10.7 μL PCR反应混合物, 包含5×PCR Buffer、 25 μmol/L MgCl2和上下游引物. 扩增条件: 95 ℃ 10 min, 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃延长1 min, 34个循环, 4 ℃保存. 内参基因为β-actin. 应用GeXP基因分析仪分析抗氧化酶基因(SOD1、SOD2和过氧化氢酶)mRNA水平的变化.
| 基因名称 | GeneBank 号 | 加标记(斜体部分)的引物序列 | |
| 上游引物 | 下游引物 | ||
| ACTBa | NM_001101 | AGGTGACACTATAGAATAGATCATTGCTCCTCCTGAGC | GTACGACTCACTATAGGGAAAAGCCATGCCAATCTCATC |
| KanRb | AGGTGACACTATAGAATA | AGGTGACACTATAGAATA | |
| SOD1 | NM_000454 | AGGTGACACTATAGAATATCATCAATTTCGAGCAGAAGG | GTACGACTCACTATAGGGA TGCTTTTTCATGGACCACC |
| SOD2 | NM_ | AGGTGACACTATAGAATA | GTACGACTCACTATAGGGA |
| Catalase | NM_ | AGGTGACACTATAGAATA | GTACGACTCACTATAGGGA |
统计学处理 采用SPSS20.1软件进行分析, 统计结果以mean±SD表示, 计量资料采用方差分析. P<0.05为差异有统计学意义.
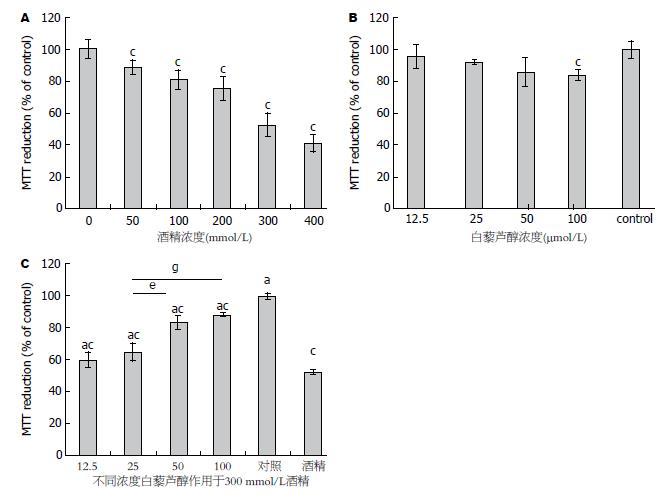
白藜芦醇与酒精的细胞毒性结果如图1A, B. 图1A为不同浓度酒精(0-400 mmol/L)作用于HepG2细胞24 h后的细胞活力. 各不同酒精浓度组细胞活性较对照组均有所下降, 差异均有统计学意义(P>0.05). 图1B为不同浓度的白藜芦醇(0-100 μmol/L)作用于HepG2细胞24 h后的细胞毒性. 100 μmol/L组细胞活性较对照组有所下降, 两组间差异有统计学意义(P<0.05), 其余各组与对照组相比均无明显变化(P<0.05).
白藜芦醇对抗酒精毒性的细胞活力检测图1C显示了不同浓度的白藜芦醇减弱300 mmol/L酒精诱导的细胞毒性作用, 12.5 μmol/L白藜芦醇组细胞活性与酒精组相比无统计学差异(P>0.05). 25、50和100 μmol/L的白藜芦醇与酒精组比较具有统计学意义(P<0.05). 对上述3个处理组进行组间比较, 25 μmol/L组细胞活性较50及100 μmol/L组低, 差异有统计学意义(P<0.05), 50 μmol/L组与100 μmol/L比较无统计学差异(P>0.05).
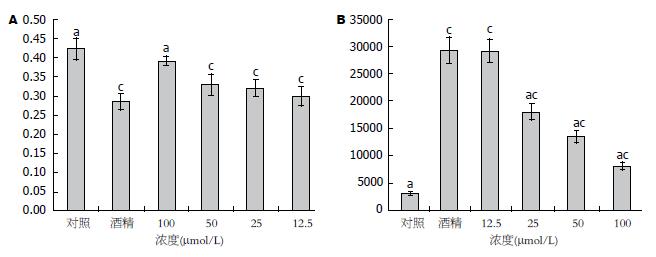
与对照组比较, 酒精组细胞内SOD活性明显下降, 具有统计学差异(P<0.05); 与酒精组比较100 μmol/L白藜芦醇组细胞内SOD活性明显升高, 有统计学差异(P<0.05), 而其他三组较低浓度白藜芦醇预处理组SOD活性略有升高与酒精组比较无统计学差异(P>0.05). 图2B所示为ROS水平: 与对照组比较, 酒精组细胞内ROS水平明显升高. 与酒精组比较, 25、50及100 μmol/L组白藜芦醇组细胞内ROS水平明显下降, 有统计学差异(P<0.05), 而最低浓度的12.5 μmol/L组ROS水平与酒精组比较无统计学差异(P>0.05).
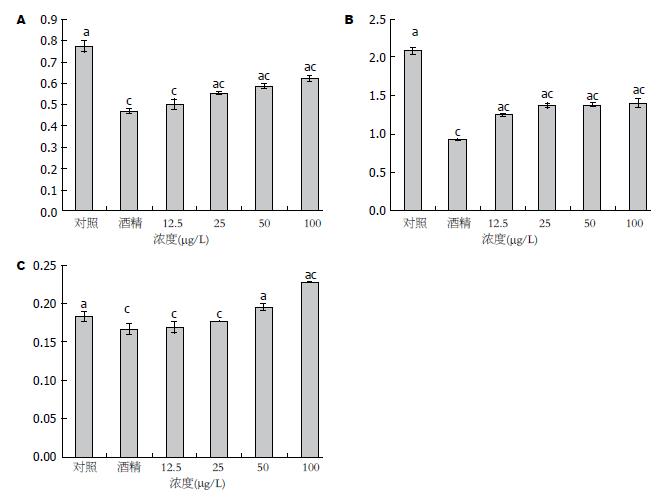
图3显示经不同浓度白藜芦醇预处理再以300 mmol/L酒精诱导后HepG2细胞内SOD1、SOD2和过氧化氢酶3种基因mRNA水平. 图3A示SOD1 mRNA水平: 与未施加任何处理的对照组比较, 酒精组SOD1 mRNA水平明显下降, 差异有统计学意义(P<0.05); 不同浓度的白藜芦醇预处理组SOD1 mRNA水平均有所升高, 其中12.5 μmol/L组升高幅度较小与酒精组比较无统计学差异(P>0.05), 其他3个浓度组均有统计学差异(P<0.05). 图3B示SOD2 mRNA水平: 与对照组比较酒精组SOD2 mRNA水平明显下降; 与酒精组比较各不同浓度的白藜芦醇预处理组SOD2 mRNA水平均有所升高, 且有统计学差异(P<0.05). 图3C示过氧化氢酶mRNA水平变化: 与对照组比较酒精组过氧化氢酶mRNA水平有所下降, 有统计学意义(P<0.05); 与酒精组相比50和100 μmol/L两个高浓度预处理组过氧化氢酶mRNA水平明显升高有统计学差异(P<0.05), 而两个低浓度预处理组与酒精组比较无统计学差异(P>0.05).
在酒精性肝病中氧化应激已成为公认的致病机制, 应用抗氧化剂减轻氧化应激程度以改善酒精引起的肝脏损伤已成为一种治疗手段. 抗氧化药物在动物水平体内实验和细胞水平体外实验都显现出了明显的治疗效果. 以往研究表明水飞蓟素通过上调还原型谷胱甘肽等抗氧化物质对抗酒精的氧化应激, 从而起到保护肝细胞的作用[15]. 同样, 以桷皮素预处理肝细胞也可以减弱酒精诱导的肝细胞内氧化应激水平[16,17]. 利用原代培养的大鼠肝脏细胞进行的体外实验研究证实, 抗氧化剂β-胡萝卜素可以减轻酒精诱导的氧化应激[18]. 用大鼠进行的动物实验也表明口服抗氧化剂维生素C及硫胺素等抗氧化剂可以有效减轻酒精诱导的血清肝脏酶学异常[19]. 周俊英等[20]检测到酒精性肝病大鼠存在氧化应激指标的改变, 并且已有人验证酒精性肝病大鼠发病机制与氧化应激密切相关[21]. 这些研究表明, 氧化应激引起肝细胞损伤, 而抗氧化剂是阻止酒精性肝损害的有效策略.
绝大多数药物都是在一定浓度范围内发挥其治疗作用, 浓度过低对疾病起不到治疗效果, 浓度过高必将对机体产生不良反应. 为了确保本研究所采用的药物浓度处于安全并且有效的浓度范围, 实验操作中首先进行了白藜芦醇及酒精细胞毒性的检测. 实验数据显示: 从12.5-50 μmol/L浓度的白藜芦醇对细胞活性无影响, 100 μmol/L浓度白藜芦醇组细胞活性虽有所下降, 但细胞活性可达80%以上, 仍处于药物毒理实验可接受的范围内. 酒精对细胞的毒性作用非常明显, 从100-400 mmol/L不同酒精处理组细胞活性均有所下降, 最高酒精浓度组细胞活性仅约40%. 为便于后续实验中白藜芦醇效果的观察, 采用了细胞活性接近50%的300 mmol/L组作为后续实验的酒精处理浓度.
20世纪40年代发现的白藜芦醇是一种天然多酚类化合物, 以往研究表明其对多种疾病有治疗作用, 并且证实其作用与抗氧化功能相关[7]. 白藜芦醇可通过清除ROS、减弱ROS生成酶活性和增强SOD等ROS代谢酶活性[22,23]等不同途径发挥抗氧化作用. Kitada等[24]研究发现白藜芦醇可以通过恢复SOD2的正常功能减轻氧化应激以减少糖尿病肾病的发病. 郑毅等[25]研究表明白藜芦醇可以增加过氧化氢酶、血红素加氧酶及SOD1的表达对抗过氧化氢诱导的氧化应激从而起到保护晶状体上皮细胞的作用. 为明确白藜芦醇对酒精所致的肝细胞损伤有无保护作用, 对经白藜芦醇预处理及未经预处理的细胞活性分别进行了检测. 结果证实从25、50和100 μmol/L浓度白藜芦醇处理组均有细胞保护作用, 且50 μmol/L组较25 μmol/L组效果好, 50和100 μmol/L两组效果无明显差异. 该结果为今后实际应用中药物剂量的选择提供了参考数据及理论依据.
ROS是一类含氧的具有较强氧化性的自由基氧和非自由基氧的总称, 包括超氧阴离子、过氧化氢和一氧化氮等. SOD和过氧化氢酶是两个氧自由基代谢的关键酶, 细胞内不同的亚细胞结构存在不同的SOD亚型, SOD1也叫铜/锌SOD, SOD2也称锰SOD, 分别存在于细胞浆和细胞线粒体内. SOD可以催化氧化能力强的超氧化物生成H2O2, 过氧化氢酶可进一步催化H2O2生成H2O和氧化能力更低的O2. 为了研究白藜芦醇抗氧化损伤的作用靶点, 本课题检测了细胞内ROS水平和SOD活性, 结果表明: 酒精可致使细胞内ROS水平升高而SOD活性降低, 以白藜芦醇预处理细胞可使细胞内ROS明显减少, 同时还能提高SOD活性.
为进一步研究白藜芦醇作用的机制, 对SOD1、SOD2和过氧化氢酶3种酶的mRNA水平进行了检测, 结果表明酒精诱导后SOD1、SOD2和过氧化氢化氢酶mRNA水平均有所下降, 其中SOD1和SOD2下降幅度明显高于过氧化氢酶. 说明酒精主要是通过降低SOD活性减缓活性氧的代谢速度. 经白藜芦醇预处理后SOD1、SOD2和过氧化氢化氢酶mRNA水平均有所升高, 说明白藜芦醇通过增加上述三种基因的转录水平达到加速活性氧代谢的效果而最终起到对细胞的保护作用.
肝炎病毒一直是我国肝病的最主要病因, 酒精性肝病的发病率仅次于病毒性肝炎, 是我国肝病的第2大病因. 我国医疗条件不断改善, 1992年乙型肝炎疫苗在全国范围内列入计划免疫管理, 这必将使肝炎病毒感染人数逐渐减少. 与此同时, 人们生活水平明显提高, 各种酒精类饮料的消费量也逐年攀升, 酒精性肝病的患病率不断升高, 不难预测酒精性肝病在不久的将来会成为我国肝病的首要病因. 酒精性肝病的发病机制及治疗方案的研究意义重大. 本试验结果显示酒精可通过降低SOD和过氧化氢酶活性致使细胞内ROS升高, 从而使细胞内出现氧化应激, 细胞活性明显下降. 白藜芦醇的抗氧化应激作用已被多项在体内及体外模型上进行的研究所证实, 但其作用机制仍需进一步研究. 本试验结果表明白藜芦醇可通过增加SOD和过氧化氢酶mRNA水平提高活性氧代谢通路中关键酶的活性, 从而降低细胞内ROS含量, 减轻细胞损伤. 本研究从氧化应激的角度研究酒精导致细胞损伤的机制, 并且观察到白藜芦醇对酒精诱导的细胞氧化损伤有保护作用, 为其今后的实际应用提供了理论基础.
人体内的抗氧化系统除了上述以SOD及过氧化氢酶为代表的抗氧化酶还包括一类非酶类抗氧化物质, 如:还原型谷胱甘肽(glutathione, GSH)、维生素E、维生素C、辅酶Q等, 其中还原型谷胱甘肽是最具代表性的内源性非酶类抗氧化物, 是巯基的主要供体[26]. Gupta等[27]和Singh等[28]进行的临床研究证实酒精性肝病患者血液中还原型谷胱甘肽的浓度较正常对照组明显下降. Checa等[29]的进一步研究表明消除自由基过程中的过度消耗及酒精对还原型谷胱甘肽合成的抑制共同导致其含量明显下降. 高健等[30]曾研究还原型谷胱甘肽对酒精性肝病的治疗作用, 结果表明还原型谷胱甘肽可以有效降低酒精性肝病患者ALT、AST、γ-GT, 同时对肝纤维化的发展有抑制作用. 本试验中对白藜芦醇处理前后细胞内ROS含量、SOD和过氧化氢酶活性及酶的基因表达水平进行了检测, 由实验数据可知白藜芦醇可以通过提高抗氧化酶活性来减少ROS含量. 但ROS含量的减少是抗氧化酶及还原型谷胱甘肽等非酶类抗氧化物共同起作用的结果[31]. 白藜芦醇是否也能通过提高还原型谷胱甘肽等非酶类抗氧化物水平而起到抗氧化作用呢?这个课题值得设计相关的研究项目去进一步探索.
我国酒精性肝病发病率逐年升高, 不久的将来可能超越病毒性肝炎成为我国肝病的第1大病因. 严重的酒精性肝病会发展成酒精性肝硬化甚至出现肝功能衰竭. 目前对酒精性肝病发病机制认识有限, 临床上缺乏特效的治疗方案及药物.
张进祥, 副教授, 华中科技大学同济医学院附属协和医院
氧化应激是酒精性肝病中导致肝细胞损伤的重要发病机制. 多种自由基、抗氧化酶及非酶性抗氧化物参与其中构成了一个较为复杂的网络式反应体系. 各种不同的组分在整个氧化应激体系中的地位及其相互关系成为研究的热点. 如何应用各种人工合成药物及中草药对抗氧化应激保护肝细胞是研究的重点.
从酒精在体内的生物化学代谢过程可以确定, 酒精的代谢过程中生成了大量的活性氧, 氧化应激所致的脂质过氧化是肝细胞受损的主要机制, 同时酒精代谢的中间产物也会降低抗氧化物质的活性. 国内外已有研究证实酒精性肝病患者血清SOD、过氧化氢酶及还原型谷胱甘肽等抗氧化物质活性低于健康人群. 但其活性降低的机制尚需更深入的研究.
本文测定了肝细胞内超氧化物歧化酶(superoxide dismutase, SOD)活性及总活性氧(reactive oxygen species, ROS)含量, 并应用Real-time PCR 技术检测了SOD及过氧化氢酶mRNA水平, 从而对酒精性肝病中氧化应激发生的机制有了新的认识. 并通过毒性检测获得了用酒精和白藜芦醇处理肝细胞的浓度, 为后续的科研工作提供了有价值的参数.
本研究检测了经白藜芦醇处理前后细胞内ROS含量和SOD活性以及SOD和过氧化氢酶的mRNA表达水平, 证实白藜芦醇可以通过增加抗氧化酶的基因表达提高抗氧化应激能力, 对酒精诱导的氧化应激所致细胞损伤有保护作用, 提供了一种有潜在研发价值的酒精性肝病治疗药物, 并为其可能的临床应用提供理论基础.
本文结果较明确, 具有一定创新性, 可读性和科学性.
编辑 田滢 电编 鲁亚静
| 1. | Renaud S, de Lorgeril M. Wine, alcohol, platelets, and the French paradox for coronary heart disease. Lancet. 1992;339:1523-1526. [PubMed] [DOI] |
| 2. | Singh CK, Kumar A, Lavoie HA, Dipette DJ, Singh US. Diabetic complications in pregnancy: is resveratrol a solution? Exp Biol Med (Maywood). 2013;238:482-490. [PubMed] [DOI] |
| 3. | Sinha K, Chaudhary G, Gupta YK. Protective effect of resveratrol against oxidative stress in middle cerebral artery occlusion model of stroke in rats. Life Sci. 2002;71:655-665. [PubMed] [DOI] |
| 4. | Polycarpou E, Meira LB, Carrington S, Tyrrell E, Modjtahedi H, Carew MA. Resveratrol 3-O-D-glucuronide and resveratrol 4'-O-D-glucuronide inhibit colon cancer cell growth: evidence for a role of A3 adenosine receptors, cyclin D1 depletion, and G1 cell cycle arrest. Mol Nutr Food Res. 2013;57:1708-1717. [PubMed] [DOI] |
| 5. | Puca AA, Carrizzo A, Ferrario A, Villa F, Vecchione C. Endothelial nitric oxide synthase, vascular integrity and human exceptional longevity. Immun Ageing. 2012;9:26. [PubMed] [DOI] |
| 6. | Rivière C, Richard T, Quentin L, Krisa S, Mérillon JM, Monti JP. Inhibitory activity of stilbenes on Alzheimer's beta-amyloid fibrils in vitro. Bioorg Med Chem. 2007;15:1160-1167. [PubMed] [DOI] |
| 7. | Carrizzo A, Forte M, Damato A, Trimarco V, Salzano F, Bartolo M, Maciag A, Puca AA, Vecchione C. Antioxidant effects of resveratrol in cardiovascular, cerebral and metabolic diseases. Food Chem Toxicol. 2013;61:215-226. [PubMed] [DOI] |
| 8. | Majano PL, Medina J, Zubía I, Sunyer L, Lara-Pezzi E, Maldonado-Rodríguez A, López-Cabrera M, Moreno-Otero R. N-Acetyl-cysteine modulates inducible nitric oxide synthase gene expression in human hepatocytes. J Hepatol. 2004;40:632-637. [PubMed] [DOI] |
| 9. | Gutiérrez-Ruiz MC, Quiroz SC, Souza V, Bucio L, Hernández E, Olivares IP, Llorente L, Vargas-Vorácková F, Kershenobich D. Cytokines, growth factors, and oxidative stress in HepG2 cells treated with ethanol, acetaldehyde, and LPS. Toxicology. 1999;134:197-207. [PubMed] |
| 10. | Nah HY, Lee WS, Joo YE, Kim HS, Choi SK, Rew JS, Kim SJ, Jung YD, Ahn BW, Park JS. Resveratrol protects HepG2 and Chang liver cells from oxidative stress. Chonnam Med J. 2005;41:243-252. |
| 11. | Knasmüller S, Mersch-Sundermann V, Kevekordes S, Darroudi F, Huber WW, Hoelzl C, Bichler J, Majer BJ. Use of human-derived liver cell lines for the detection of environmental and dietary genotoxicants; current state of knowledge. Toxicology. 2004;198:315-328. [PubMed] [DOI] |
| 12. | Senthil Kumar KJ, Liao JW, Xiao JH, Gokila Vani M, Wang SY. Hepatoprotective effect of lucidone against alcohol-induced oxidative stress in human hepatic HepG2 cells through the up-regulation of HO-1/Nrf-2 antioxidant genes. Toxicol In Vitro. 2012;26:700-708. [PubMed] [DOI] |
| 13. | Azmi NH, Ismail N, Imam MU, Ismail M. Ethyl acetate extract of germinated brown rice attenuates hydrogen peroxide-induced oxidative stress in human SH-SY5Y neuroblastoma cells: role of anti-apoptotic, pro-survival and antioxidant genes. BMC Complement Altern Med. 2013;13:177. [PubMed] [DOI] |
| 14. | Ismail N, Ismail M, Fathy SF, Musa SN, Imam MU, Foo JB, Iqbal S. Neuroprotective effects of germinated brown rice against hydrogen peroxide induced cell death in human SH-SY5Y cells. Int J Mol Sci. 2012;13:9692-9708. [PubMed] [DOI] |
| 15. | Song Z, Deaciuc I, Song M, Lee DY, Liu Y, Ji X, McClain C. Silymarin protects against acute ethanol-induced hepatotoxicity in mice. Alcohol Clin Exp Res. 2006;30:407-413. [PubMed] [DOI] |
| 16. | Liu S, Hou W, Yao P, Zhang B, Sun S, Nüssler AK, Liu L. Quercetin protects against ethanol-induced oxidative damage in rat primary hepatocytes. Toxicol In Vitro. 2010;24:516-522. [PubMed] [DOI] |
| 17. | Oliva J, Bardag-Gorce F, Tillman B, French SW. Protective effect of quercetin, EGCG, catechin and betaine against oxidative stress induced by ethanol in vitro. Exp Mol Pathol. 2011;90:295-299. [PubMed] [DOI] |
| 18. | Peng HC, Chen JR, Chen YL, Yang SC, Yang SS. beta-Carotene exhibits antioxidant and anti-apoptotic properties to prevent ethanol-induced cytotoxicity in isolated rat hepatocytes. Phytother Res. 2010;24 Suppl 2:S183-S189. [PubMed] [DOI] |
| 19. | Ambadath V, Venu RG, Madambath I. Comparative study of the efficacy of ascorbic acid, quercetin, and thiamine for reversing ethanol-induced toxicity. J Med Food. 2010;13:1485-1489. [PubMed] [DOI] |
| 20. | 周 俊英, 赵 彩彦, 甄 真. 酒精性肝病发病过程中氧化应激指标的变化. 中国组织化学与细胞化学杂志. 2006;644-648. |
| 22. | Rocha KK, Souza GA, Ebaid GX, Seiva FR, Cataneo AC, Novelli EL. Resveratrol toxicity: effects on risk factors for atherosclerosis and hepatic oxidative stress in standard and high-fat diets. Food Chem Toxicol. 2009;47:1362-1367. [PubMed] [DOI] |
| 23. | Kohnen S, Franck T, Van Antwerpen P, Boudjeltia KZ, Mouithys-Mickalad A, Deby C, Moguilevsky N, Deby-Dupont G, Lamy M, Serteyn D. Resveratrol inhibits the activity of equine neutrophil myeloperoxidase by a direct interaction with the enzyme. J Agric Food Chem. 2007;55:8080-8087. [PubMed] [DOI] |
| 24. | Kitada M, Kume S, Imaizumi N, Koya D. Resveratrol improves oxidative stress and protects against diabetic nephropathy through normalization of Mn-SOD dysfunction in AMPK/SIRT1-independent pathway. Diabetes. 2011;60:634-643. [PubMed] [DOI] |
| 25. | Zheng Y, Liu Y, Ge J, Wang X, Liu L, Bu Z, Liu P. Resveratrol protects human lens epithelial cells against H2O2-induced oxidative stress by increasing catalase, SOD-1, and HO-1 expression. Mol Vis. 2010;16:1467-1474. [PubMed] |
| 26. | Halliwell B. Antioxidant defense mechanisms: from the beginning to the end. Free Radic Res. 1999;31:261-272. |
| 27. | Gupta S, Pandey R, Katyal R, Aggarwal HK, Aggarwal RP, Aggarwal SK. Lipid peroxide levels and antioxidant status in alcoholic liver disease. Indian J Clin Biochem. 2005;20:67-71. [PubMed] [DOI] |
| 28. | Singh M, Gupta S, Singhal U, Pandey R, Aggarwal SK. Evaluation of the oxidative stress in chronic alcoholics. J Clin Diagn Res. 2013;7:1568-1571. [PubMed] [DOI] |
| 29. | Fernández-Checa JC, Hirano T, Tsukamoto H, Kaplowitz N. Mitochondrial glutathione depletion in alcoholic liver disease. Alcohol. 1993;10:469-475. [PubMed] |
| 31. | Cederbaum AI, Lu Y, Wu D. Role of oxidative stress in alcohol-induced liver injury. Arch Toxicol. 2009;83:519-548. [PubMed] [DOI] |