修回日期: 2013-12-24
接受日期: 2014-02-18
在线出版日期: 2014-04-08
目的: 构建A20和增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)共表达的腺病毒载体, 观察其对人单核-巨噬细胞系THP-1的影响.
方法: PCR扩增目的基因片段A20, 将目的基因与载体GV314连接获得重组穿梭质粒pGV314-A20, 在DH5a感受态细胞中扩增, 同源重组得到含有目的基因的腺病毒载体, 转染293T细胞, 包装成具有感染能力的共表达A20和EGFP的腺病毒颗粒, 转染目的细胞THP-1, 通过Western blot检测A20蛋白在THP-1细胞的表达, EILSA检测脂多糖(lipopolysaccharide, LPS)刺激THP-1后其上清肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)和白介素-6(interleukin-6, IL-6)的表达.
结果: 限制性内切酶酶切鉴定与DNA测序证实重组载体构建成功, 包装的腺病毒滴度达到1×1011 pfu/mL, 感染了腺病毒后的293细胞出现了明显的气球样变, Western blot证实转染THP-1后A20蛋白表达显著增加, 与空白组比较, THP-1上清中TNF-α和IL-6的表达下降, 两者相比, 有统计学差异(P<0.05).
结论: 成功构建A20与EGFP共表达腺病毒载体, 能够在THP-1细胞表达, 降低其炎性因子表达, 为进一步研究其抗炎功能奠定基础.
核心提示: 构建A20和增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)双基因表达载体, 通过A20与EGFP使用不同的启动子共表达, 通过EGFP的表达观察绿色荧光有利于观察转染率, 同时EGFP不会影响A20蛋白的表达, 转染单核-巨噬细胞系THP-1细胞上调A20表达, 观察其对炎症因子释放的影响.
引文著录: 郭永红, 陈琳, 何瑜, 周云, 范超, 张颖, 纪光晰, 秦源, 张凌云, 贾战生. A20与EGFP共表达腺病毒载体的构建及转染THP-1细胞. 世界华人消化杂志 2014; 22(10): 1436-1441
Revised: December 24, 2013
Accepted: February 18, 2014
Published online: April 8, 2014
AIM: To construct an adenoviral vector expressing A20 and enhanced green fluorescent protein (EGFP) and evaluate its effects in human mononuclear cell line THP-1.
METHODS: A20 gene fragment was amplified by PCR and inserted to GV314 vector to obtain a recombinant shuttle plasmid pGV314-A20. The recombinant vector was amplified in competent cells DH5α. A recombinant adenovirus co-expressing A20 and EGFP was generated by homologous recombination and packaged via 293T cells. The adenovirus was transfected into THP-1 cells, and then the expression of protein A20 was detected by Western blot. The levels of tumor necrosis factor alpha (TNF-α) and interleukin-6 (IL-6) in the culture supernatants of lipopolysaccharides (LPS)-stimulated THP-1 cells were assessed by ELISA.
RESULTS: The recombinant vector was identified and confirmed by restriction enzyme digestion and DNA sequencing. The titer of packaged adenoviruses was 1 × 1011 pfu/L, and 293 cells infected with the adenovirus showed obvious ballooning. Western blot analysis indicated that A20 protein expression was increased in THP-1 cells transfected by the adenovirus. The levels of TNF-α and IL-6 in the supernatants declined significantly in the A20 group compared with the control group (P < 0.05).
CONCLUSION: A recombinant adenoviral vector which expresses A20 and EGFP has been successfully constructed, which lays a foundation for further study of anti-inflammatory function of A20.
- Citation: Guo YH, Chen L, He Y, Zhou Y, Fan C, Zhang Y, Ji GX, Qin Y, Zhang LY, Jia ZS. Construction and identification of a recombinant adenoviral vector expressing A2 and EGFP. Shijie Huaren Xiaohua Zazhi 2014; 22(10): 1436-1441
- URL: https://www.wjgnet.com/1009-3079/full/v22/i10/1436.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i10.1436
锌指蛋白A20又称为肿瘤坏死因子α诱导蛋白3(tumor necrosis factor alpha induced protein 3, TNFAIP3), 是1990年美国密西根州大学病理系Dixit教授在内皮细胞对肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)应答反应的研究中发现[1]. 作为负调控因子, A20能在多种组织细胞内诱导表达, A20的调节作用表现为抑制TNF-α、白介素-1(interleukin-1, IL-1)、IL-6、IL-8、细胞间黏附分子等多种促炎因子的过度释放, 以及抑制细胞凋亡和坏死. A20在发挥调控功能时主要利用其双重泛素化酶功能, 使胞浆中相关信号通路的多种关键蛋白分子泛素化, 进而被蛋白酶体识别, 加速降解, 达到抑制信号通路的作用, 抑制促炎因子的表达, 增加抗炎因子的表达[2,3]. 研究表明, A20在TNF-α、IL-1和Toll样受体(Toll-like receptor, TLR)等刺激之下, 通过其结构中的双重泛素化功能负向调节TNF-α和TLR-信号通路, 从而抑制核转录因子-κB(nuclear factor-κB, NF-κB)信号通路的活性[4]. 目前, 关于A20在单核及巨噬细胞中的作用机制知之甚少, 因此, 在本项研究中, 通过构建A20及增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)双基因表达载体, 转染单核-巨噬细胞系THP-1细胞上调A20表达, 观察其对炎症因子释放的影响, 为进一步探索A20对单核-巨噬细胞系统作用机制打下基础.
各种限制性内切酶均购自NEB公司; T4 DNA聚合酶、Taq DNA聚合酶购自SinoBio公司; 小量质粒提取试剂盒及质粒pGEM T-Easy购自Promega; 琼脂糖凝胶回收试剂盒购自天根生化公司; DNA Marker购自Fermentas公司; DMEM培养基、胎牛血清购自Hyclone公司; 大肠杆菌DH5α、腺病毒载体GV314及包装系统购自上海吉凯基因化学技术公司; HEK293购自ATCC(cat# CRL-1573); 辅助包装质粒购自Microbix公司(Microbix, Canada); 腺病毒纯化系统Adeno-X™ Virus Purification Kit购自BD Biosciences(Clontech); TNF-α和IL-6 EILSA检测试剂盒购自RD公司; 兔源A20单克隆抗体购自Abcam公司.
1.2.1 PCR扩增目的基因片段: 参照已在GenBank中登录的A20基因的序列设计引物, 根据克隆所需在上下游引物分别引入BamHⅠ和AgeⅠ限制性酶切位点, 引物均由捷瑞生物公司合成. A20引物的序列: 上游5'-AGGTCGACTCTAGAGGATCCCGCCACCATGGCTGAACAAGTCCTTCCTC-3'; 下游5'-TCCTTGTAGTCCATACCGCCATACATCTGCTTGAACTG-3'.
1.2.2 重组穿梭质粒构建: 利用PCR产物交换入线性化表达载体构建重组穿梭质粒, 将目的载体GV314进行BamHⅠ/AgeⅠ酶切线性化, 酶切产物电泳回收后与纯化后的PCR产物片段进行交换, 其产物转化细菌感受态细胞DH5α, 阳性对照为纯化的GAPDH基因的PCR产物, 克隆进行菌落PCR鉴定, 接种阳性转化子, 37 ℃培养16 h后保存为甘油菌, 分装200 µL进行测序和比对分析, 比对正确的即为构建成功的重组目的质粒.
1.2.3 腺病毒质粒同源重组和鉴定: 利用AdMax腺病毒包装系统, 将携带外源基因的腺病毒穿梭质粒GV314与辅助包装质粒共转染HEK293细胞, 利用Cre/loxP重组酶系统的作用产生重组腺病毒. 具体过程为: 将处于对数生长期的293T细胞进行胰酶消化, 制成细胞悬液(细胞数约为4×105)接种于24孔培养板中37 ℃、5%CO2培养箱, 培养至细胞融合度达到约50%-60%, 转染前2 h将细胞培养基更换为无血清DMEM培养基, 根据Invitrogen Lipofectamine 2000转染试剂使用说明书进行转染操作, 转染24 h后荧光显微镜下观察细胞内荧光标记基因(EGFP)的表达情况, 转染36 h后收集细胞进行Western blot检测.
1.2.4 重组腺病毒GV314/A20中目的基因A20的鉴定: 取病毒液100 µL, 99 ℃加热10 min, 12000 g离心15 min, 进行PCR反应, 扩增产物在1.2%琼脂糖凝胶上电泳, 观察有无目的片段.
1.2.5 重组腺病毒的包装、扩增、纯化: pAdGV314/A20质粒经PacⅠ酶切线性化、酚/氯仿抽提, 乙醇沉淀回收并测定其含量与纯度, 转染HEK293大约10-15 d时, 细胞部分出现病变(cytopathic effect, CPE), 待大部分细胞出现典型的CPE(局部细胞变圆、脱落, 成网状), 且有50%的细胞脱壁, 收集病毒上清于-80 ℃保存, 重复感染、收集步骤, 于液氮和37 ℃水浴中反复冻融4次, 取病毒上清液再次感染293细胞进行扩增, 进行数轮扩增, 将最终收集的PBS重悬病毒上清液按Adeno-X™ Virus Purification Kit (BD Biosciences, Clontech)的步骤纯化重组腺病毒.
1.2.6 腺病毒滴度测定-终点稀释法: 收集的病毒利用终点稀释法进行滴度测定, 以下式计算所测样本病毒颗粒滴度(Spearman-Karber Method): 病毒滴度 = 10(x+0.8)(pfu/mL), x = 10-1到10-13依次稀释度下CPE阳性率总和.
1.2.7 重组腺病毒转染THP-1: 将THP-1细胞以1×106/mL的密度接种于培养瓶中, 按100感染复数(multiplicity of infection, MOI)加入重组腺病毒感染THP-1细胞, 观察荧光表达同时Western blot鉴定A20蛋白表达. 重组腺病毒转染THP-1后48 h, 每孔细胞加入100 µL RIPA裂解液, 含终浓度1 mg/mL PMSF, 冰上裂解10 min, 12000 g高速低温离心10 min, 取5 µL裂解上清BCA蛋白定量, 取相同质量的总蛋白50 µg, 加入5×电泳上样缓冲液, 100 ℃煮沸10 min, 进行常规SDS-PAGE电泳, 电转移至PVDF膜上, 以兔源A20单克隆抗体为一抗, 羊抗兔IgG-HRP为二抗, ECL化学发光试剂盒检测A20蛋白的表达.
1.2.8 细胞培养上清中TNF-α和IL-6浓度的测定: 将THP-1细胞以1×106/mL的密度接种于6孔培养板中加入100 ng/L的LPS刺激, 加入10%胎牛血清, 5%CO2 37 ℃继续培养12 h后, 离心收集细胞培养上清, 按照RD公司ELISA试剂盒说明书操作检测上清中TNF-α和IL-6浓度.
统计学处理 本实验数据采用GrapPad Prism5软件处理, 正态分布计量资料采用mean±SD表示, 组间比较采用ANOVA方差分析, P<0.05为差异有统计学意义.
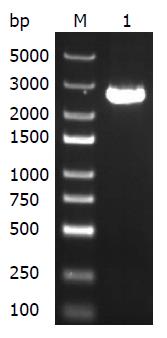
质粒中A20基因CDS全长约为2.4 kb,PCR法扩增该片段, 琼脂糖凝胶电泳显示在2.4 kb处有明显的目的条带, 电泳结果显示条带符合理论结果(图1).
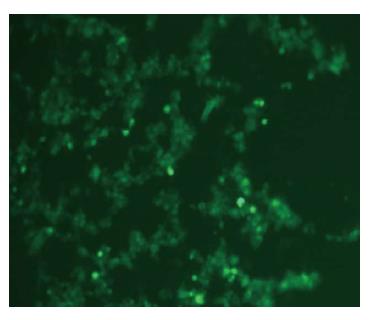
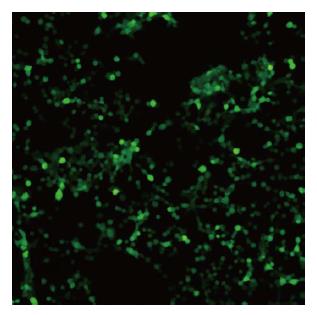
pAd-GV314/A20经脂质体转染293T细胞后24 h出现绿色荧光蛋白表达(图2), 荧光表达随时间增强, 测得腺病毒滴度为1×1011 pfu/mL.
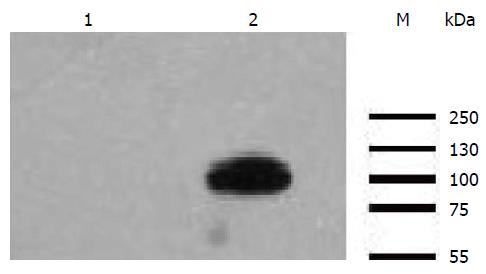
重组腺病毒pAdGV314/A20转染THP-1细胞后Western blot鉴定A20蛋白表达, 目的蛋白分子量为89 kDa(图4).
LPS以100 ng/mL诱导刺激THP-1, 12 h后用ELISA法检测培养上清中细胞因子IL-6、TNF-α的水平. 在LPS刺激后, 对照组细胞因子IL-6、TNF-α表达上调, 而pAdGV314/A20转染组与对照组比较, 表达较低, 两者比较差异有统计学意义(P<0.05, 表1).
A20基因在人类其定位于6q23, 其cDNA全长4426 bp, 转录产物mRNA全长约4 kb, 可读框为2370 bp. 人A20蛋白大小为90 kDa, 氨基酸序列高度保守, 与小鼠的A20蛋白有高达98%的同源性, 其氨基端的卵巢肿瘤基序(ovarian tumor motif, OTU)结构域, 能够与泛素结合, 发挥去泛素化酶作用, 其羧基端结构域的锌指结构具有泛素化酶功能, 由于其双重的泛素化功能, 通过使NF-κB信号通路中的关键分子肿瘤坏死因子受体相关因子6(TNF receptor-associated factor 6, TRAF6)去泛素化及RIP1泛素化降解, 可抑制NF-κB信号通路的活化[5,6]. A20最早被认为是一种TNF诱导基因和NF-κB靶向基因, 多种刺激因素可以诱导其在不同类型细胞中的表达[7]. NF-κB信号转导研究中, A20可以直接下调NF-κB活性、下调NF-κB依赖性炎性细胞因子的表达以及重要膜受体TLR4的表达, 在预防体内炎症反应过度、保护组织细胞免于发生炎症损伤中发挥重要作用[8], 因此A20能抑制多种炎症因子的产生和分泌, A20缺陷的巨噬细胞中NF-κB活性增强, A20缺陷的小鼠对LPS和TNF的敏感性也大大提高, 可发生多器官的重度炎症反应, 使小鼠出生后不久即死亡[9,10].
单核巨噬细胞是人体重要的免疫细胞, 具有多种功能, 包括炎症时通过趋化作用募集炎症细胞. 单核巨噬细胞在炎症反应中发挥抗原提呈、吞噬消化和杀伤作用, 可以合成、分泌多种生物活性介质, 参与成纤维细胞、血管内皮细胞的迁移、增生, 促进血管和肉芽组织的形成, 是感染发生发展过程中的核心介导细胞[11,12], 因此研究单核巨噬细胞对了解炎症信号转导通路和作用机制具有重要意义. THP-1细胞来源于人急性单核细胞白血病细胞, 其细胞表型和分化更能完整的代表人单核巨噬细胞系统的功能, 因此是目前运用较多的用以研究单核巨噬细胞分化及功能的细胞模型[13].
本实验成功构建了pAdGV314/A20的表达载体, GV314载体中含有HIV的基本元件5'长末端重复序列(long terminal repeat, LTR)和3'LTR以及其他辅助元件, GV314载体含有EGFP, 其启动子为猿猴空泡病毒(simian vacuolating virus 40, SV40), 而A20的启动子为巨细胞病毒(cytomegalovirus, CMV), 两个目的基因分别使用不同的启动子, 不会相互影响, 而EGFP的表达有利于直接观察转染效率. 构建成功的表达载体有荧光表达, 是转染成功的直接证据, 转染效率可达到80%以上, 可用于后续转染THP-1细胞及功能实验. LPS对单核巨噬细胞THP-1具有显著的诱导激活作用, 在LPS诱导THP-1细胞产生炎症反应后, IL-6、TNF-α表达显著增加, 说明LPS诱导了核转录因子NF-κB的表达炎症细胞因子的上调[13,14]. 通过转染THP-1上调A20蛋白的表达, 结果表明, A20对LPS激活THP-1细胞细胞分泌TNF-α和IL-6存在干预作用, 加入A20时能够明显降低TNF-α和IL-6的表达, 因此, A20具有抑制LPS对单核细胞NF-κB的激活作用, 降低细胞TNF-α和IL-6的分泌水平, 对单核细胞LPS炎症应答具有负向调节作用, 具有抗炎活性, pAdGV314/A20转染组较空载体组及空白组IL-6、TNF-α表达降低, 但是IL-6、TNF-α并没有完全降到LPS刺激前的水平, 说明还存在其他的通路诱导炎症反应, 例如细胞膜受体TLR4等[15].
本研究以LPS攻击THP1细胞作为炎症细胞模型, 观察过表达A20对THP-1细胞分泌到培养液中的TNF-α和IL-6水平的影响, 了解A20对细胞炎症反应的调节能力, 为进一步研究A20对单核巨噬细胞系统作用奠定了基础.
A20是炎症信号传导的中心调节因子-核转录因子-κB(nuclear factor-κB, NF-κB)抑制因子, 在天然免疫和过继性免疫调节中发挥了重要作用. A20与多种炎症疾病及自身免疫性疾病相关, 具有抑制炎症、抑制凋亡等作用, 了解该蛋白的作用机制有利于研究相关疾病.
郭永红, 副主任医师, 西安交通大学医学院第二附属医院感染科
A20的主要作用是抑制炎症及凋亡, A20可能成为一种减缓炎症反应的理想候选靶分子, 目前关于A20在单核及巨噬细胞中的作用机制了解较少, 增加其表达是否能抑制炎症及相应的不良反应均需要深入研究.
研究证实, 在A20缺陷小鼠中, 容易发生慢性炎症及多器官的炎性损伤, 而在小鼠过敏性哮喘及类风湿关节炎等自身免疫的炎症性病理模型中, 过表达A20能减缓小鼠的炎症反应并有一定保护作用, A20在病毒感染引起的固有免疫信号通路中发挥着调控作用.
既往过表达A20及增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP), 大都采用融合表达, 这种表达会影响A20蛋白的表达及活性, 本方法可克服此类缺点, 利用不同启动子表达不同蛋白质, 起到同时表达又不相互干扰, 可推广使用.
建立A20过表达载体, 利用同时表达的EGFP观察其在不同细胞的表达, 了解其抑制炎症及凋亡的效果, 进行完善及改进后有可能应用于临床治疗.
该研究为进一步探索A20对单核-巨噬细胞系统作用机制打下基础, 研究方法和技术有创新性, 得到有价值的科学结论.
编辑 郭鹏 电编 鲁亚静
| 1. | Opipari AW, Boguski MS, Dixit VM. The A20 cDNA induced by tumor necrosis factor alpha encodes a novel type of zinc finger protein. J Biol Chem. 1990;265:14705-14708. [PubMed] |
| 2. | Wertz IE, O'Rourke KM, Zhou H, Eby M, Aravind L, Seshagiri S, Wu P, Wiesmann C, Baker R, Boone DL. De-ubiquitination and ubiquitin ligase domains of A20 downregulate NF-kappaB signalling. Nature. 2004;430:694-699. [PubMed] [DOI] |
| 3. | Shembade N, Ma A, Harhaj EW. Inhibition of NF-kappaB signaling by A20 through disruption of ubiquitin enzyme complexes. Science. 2010;327:1135-1139. [PubMed] [DOI] |
| 4. | Lu TT, Onizawa M, Hammer GE, Turer EE, Yin Q, Damko E, Agelidis A, Shifrin N, Advincula R, Barrera J. Dimerization and ubiquitin mediated recruitment of A20, a complex deubiquitinating enzyme. Immunity. 2013;38:896-905. [PubMed] [DOI] |
| 5. | Verstrepen L, Verhelst K, van Loo G, Carpentier I, Ley SC, Beyaert R. Expression, biological activities and mechanisms of action of A20 (TNFAIP3). Biochem Pharmacol. 2010;80:2009-2020. [PubMed] [DOI] |
| 6. | Evans PC, Ovaa H, Hamon M, Kilshaw PJ, Hamm S, Bauer S, Ploegh HL, Smith TS. Zinc-finger protein A20, a regulator of inflammation and cell survival, has de-ubiquitinating activity. Biochem J. 2004;378:727-734. [PubMed] |
| 7. | Vereecke L, Beyaert R, van Loo G. The ubiquitin-editing enzyme A20 (TNFAIP3) is a central regulator of immunopathology. Trends Immunol. 2009;30:383-391. [PubMed] [DOI] |
| 8. | Das S, Pandey K, Kumar A, Sardar AH, Purkait B, Kumar M, Kumar S, Ravidas VN, Roy S, Singh D. TGF-β1 re-programs TLR4 signaling in L. donovani infection: enhancement of SHP-1 and ubiquitin-editing enzyme A20. Immunol Cell Biol. 2012;90:640-654. [PubMed] [DOI] |
| 9. | Coornaert B, Carpentier I, Beyaert R. A20: central gatekeeper in inflammation and immunity. J Biol Chem. 2009;284:8217-8221. [PubMed] [DOI] |
| 10. | Lee EG, Boone DL, Chai S, Libby SL, Chien M, Lodolce JP, Ma A. Failure to regulate TNF-induced NF-kappaB and cell death responses in A20-deficient mice. Science. 2000;289:2350-2354. [PubMed] |
| 11. | Turer EE, Tavares RM, Mortier E, Hitotsumatsu O, Advincula R, Lee B, Shifrin N, Malynn BA, Ma A. Homeostatic MyD88-dependent signals cause lethal inflamMation in the absence of A20. J Exp Med. 2008;205:451-464. [PubMed] |
| 12. | Zhang FX, Kirschning CJ, Mancinelli R, Xu XP, Jin Y, Faure E, Mantovani A, Rothe M, Muzio M, Arditi M. Bacterial lipopolysaccharide activates nuclear factor-kappaB through interleukin-1 signaling mediators in cultured human dermal endothelial cells and mononuclear phagocytes. J Biol Chem. 1999;274:7611-7614. [PubMed] |
| 13. | Auwerx J. The human leukemia cell line, THP-1: a multifacetted model for the study of monocyte-macrophage differentiation. Experientia. 1991;47:22-31. [PubMed] |
| 14. | Diya Zhang, Lili Chen, Shenglai Li, Zhiyuan Gu, Jie Yan. Lipopolysaccharide (LPS) of Porphyromonas gingivalis induces IL-1beta, TNF-alpha and IL-6 production by THP-1 cells in a way different from that of Escherichia coli LPS. Innate Immun. 2008;14:99-107. [PubMed] [DOI] |
| 15. | Peng X, Li W, Zhang W. Poly(ADP-ribose) polymerase 1 inhibition protects human aortic endothelial cells against LPS-induced inflammation response. Acta Biochim Biophys Sin (Shanghai). 2012;44:911-917. [PubMed] [DOI] |