修回日期: 2014-01-28
接受日期: 2014-02-18
在线出版日期: 2014-04-08
目的: 探讨苦参素(oxymatrine, OM)体外逆转人肝癌耐药细胞株多药耐药的作用及其机制.
方法: MTT法检测耐药细胞株HepG2/阿霉素(adriamycin, ADM)多药耐药性及苦参素干预前后耐药细胞药敏性的变化; 流式细胞术检测苦参素对耐药细胞细胞凋亡及细胞膜表面P糖蛋白(P-glycoprotein, P-gp)表达的影响; 实时荧光定量PCR法检测苦参素作用前后耐药细胞内三磷酸腺苷结合运转蛋白B1(ATP-binding cassette, sub-family B member 1, ABCB1)基因的表达的变化.
结果: 当苦参素浓度为0.5 mg/mL时对HepG2及HepG2/ADM 2种细胞株的生长抑制率均<10%, 无明显毒性作用. HepG2/ADM细胞株对ADM、顺铂(cisplatin, CDDP)、5-氟尿嘧啶(5-fluorouracil, 5-FU)3种化疗药物表现出不同程度的耐药性, 其耐药指数分别为27.52、5.50、4.39. 无细胞毒性的0.5 mg/mL浓度的苦参素能够部分逆转HepG2/ADM对上述3种化疗药物的耐药性, 其逆转倍数分别为3.68、2.82、2.03倍. 苦参素作用HepG2/ADM细胞24、48、72 h后, 各组细胞早期细胞凋亡率较各阴性对照组均有所提高且随OM作用时间的延长而逐渐增加(1.77%±0.25% vs 0.50%±0.10%, 2.53%±0.15% vs 0.63%±0.06%, 3.83%±0.42% vs 0.66%±0.06%, P<0.05). 苦参素作用48 h后与阴性对照组比较HepG2/ADM耐药细胞株ABCB1基因表达下调, 其比率为0.49倍; 耐药细胞株细胞膜表面P-gp的表达下调(21.50%±1.08% vs 40.83%±0.35%, P<0.01).
结论: 苦参素能够在体外逆转人肝癌耐药细胞株HepG2/ADM的多药耐药性, 其作用机制可能与其提高耐药细胞早期细胞凋亡率, 下调耐药相关基因ABCB1及其蛋白表达产物P-gp的表达有关.
核心提示: 苦参素能够在体外部分逆转人肝癌耐药细胞株HepG2/阿霉素(adriamycin)的多药耐药, 相关分子机制可能与其抑制三磷酸腺苷结合运转蛋白B1(ATP-binding cassette, sub-family B member 1)基因的表达, 降低了细胞膜表面P糖蛋白(P-glycoprotein, P-gp)的表达含量, 导致P-gp的转运功能下降, 减少肿瘤细胞对化疗药物的外排和促进肝癌耐药细胞的早期凋亡相关.
引文著录: 王炜, 黄赞松, 周喜汉, 覃月秋. 苦参素逆转人肝癌细胞株HepG2/ADM多药耐药的作用. 世界华人消化杂志 2014; 22(10): 1409-1416
Revised: January 28, 2014
Accepted: February 18, 2014
Published online: April 8, 2014
AIM: To investigate whether oxymatrine (OM) reverses the multidrug resistance of hepatocellular carcinoma cell line HepG2/adriamycin (ADM) in vitro and to explore the potential mechanisms involved.
METHODS: MTT assay was used to test the sensitivity of HepG2 cells, HepG2/ADM cells and oxymatrine-treated HepG2/ADM cells to chemotherapeutics and oxymatrine. Flow cytometry was used to detect the apoptosis and the protein levels of p-glycoprotein (P-gp) in HepG2 cells, HepG2/ADM cells and oxymatrine-treated HepG2/ADM cells. Real-time fluorescence quantitative PCR was used to determine the expression of multidrug resistance related gene ATP-binding cassette, sub-family B member 1 (ABCB1) in HepG2/ADM cells and oxymatrine-treated HepG2/ADM cells.
RESULTS: Oxymatrine at concentrations lower than 0.5 mg/mL had no apparent cytotoxic effects on HepG2/ADM cells. HepG2/ADM cells showed cross-resistance to ADM, cisplatin (CDDP), and 5-fluorouracil (5-FU), and the resistance indexes were 27.52, 5.50 and 4.39, respectively. Oxymatrine could partly reverse the resistance of HepG2/ADM cells to ADM, CDDP and 5-FU by 3.68, 2.82 and 2.03 times, respectively. After addition of oxymatrine for 24, 48 and 72 h, the rates of early apoptosis of HepG2/ADM cells were increased gradually compared with the control group (1.77% ± 0.25% vs 0.50% ± 0.10%, 2.53% ± 0.15% vs 0.63% ± 0.06%, 3.83% ± 0.42% vs 0.66% ± 0.06%, P < 0.05 for all). Oxymatrine down-regulated the expression levels of multidrug resistance-related genes ABCB1 and P-gp compared with the control group (21.50% ± 1.08% vs 40.83% ± 0.35%, P < 0.01).
CONCLUSION: Oxymatrine can reverse multidrug resistance of HepG2/ADM cells in vitro possibly via mechanisms related to down-regulation of ABCB1 and P-gp and promotion of cell apoptosis.
- Citation: Wang W, Huang ZS, Zhou XH, Qin YQ. Oxymatrine reverses multidrug resistance of human hepatocellular carcinoma HepG2/ADM cells. Shijie Huaren Xiaohua Zazhi 2014; 22(10): 1409-1416
- URL: https://www.wjgnet.com/1009-3079/full/v22/i10/1409.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i10.1409
原发性肝癌是我国最常见的恶性肿瘤之一, 其年发病率及死亡率在我国所有恶性肿瘤中仅次于肺癌居第2位[1]. 全球每年平均约有69万例死于肝癌, 而我国约占其中的50%[2]. 原发性肝癌起病隐匿, 早期缺乏典型症状和特有体征, 致使其诊断困难. 尽管肝癌肿瘤标志物甲胎蛋白的检测及影像学的发展使许多亚临床肝癌或小肝癌得以检出, 但仍有约80%的患者在肝癌检出时已属于中晚期且合并肝硬化, 而丧失手术机会[3]. 对这些患者常需采用包括手术在内的综合治疗, 其中化疗特别是局部灌注占有重要地位, 然而由于肿瘤多药耐药(multidrug resistance, MDR)的存在, 导致目前肝癌临床化疗效果普遍不佳. 中药因其低毒高效和多阶段性作用的优势已在肿瘤MDR逆转方法的研究中逐步受到重视. 苦参素即氧化苦参碱, 是一种从我国传统中药材苦参、广豆根中提取的生物碱. 近年来有研究表明苦参素具有抗肝癌作用, 且对正常肝细胞无明显破坏. 本研究以人肝癌耐药细胞株HepG2/阿霉素(adriamycin, ADM)为研究对象, 选用苦参素体外逆转其耐药性, 观察药物作用效果并初步探讨其细胞及分子生物学机制.
人肝癌耐药细胞株HepG2/ADM(广州吉妮欧生物科技有限公司)、人肝癌细胞株HepG2细胞株(中科院上海细胞库)、苦参素(oxymatrine, OM)(江苏正大天晴药业股份有限公司)、ADM(深圳万乐药业有限公司)、MTT(Amresco公司)、5-氟尿嘧啶(5-fluorouracil, 5-FU)(旭东海普药业有限公司)、顺铂(cisplatin, CDDP)(山东罗欣药业股份有限公司)、Annexin V-FITC细胞凋亡检测试剂盒(南京凯基生物科技有限公司)、逆转录试剂盒(Thermo公司)、荧光定量PCR试剂盒(天根生化科技有限公司)、鼠抗人P-gp抗体(Abcam公司).
1.2.1 MTT法检测OM对HepG2及HepG2/ADM细胞株的抑制作用: 分别取处于对数生长期的HepG2及HepG2/ADM细胞, 按细胞传代方法制备细胞悬液, 同时予细胞计数, 通过调整细胞浓度, 使其浓度为5×104个/mL. 将混匀的细胞悬液接种于96孔细胞培养板, 100 μL/孔. 设OM组、阴性对照组和空白对照组. OM组设5个药物梯度, 每组设5个复孔. 于饱和湿度、37 ℃、5%CO2的细胞培养箱中培养. 待细胞贴壁后(培养4 h后), 小心吸取旧培养基, 然后分别向OM组加入预先配制好的含OM培养液(浓度分别为0.5、1.0、2.0、4.0、8.0 mg/mL), 200 μL/孔; 向阴性对照组和空白对照组加入新培养液200 μL/孔. 继续于培养箱中培养44 h后, 分别向3组细胞中各加入5 mg/mL MTT 20 μL/孔, 继续孵育4 h. 取出培养板, 吸取上清液, 加入DMSO, 150 μL/孔, 后置于恒温振荡箱中震荡, 37 ℃、100 r/min, 振荡10 min. 通过全自动酶标仪于490 nm波长处测定吸光度(A)值, 用复孔平均A值进行比较, 计算OM对HepG2及HepG2/ADM细胞株分别作用48 h后的抑制率(inhibition rate, IR). 计算公式: IR(%) = [1-(实验组A值-空白组A值)/(阴性对照组A值-空白组A值)]×100%. 利用SPSS16.0软件计算OM的50%抑制浓度(50% inhibiting concentration, IC50). 实验不同日重复3次. 以对细胞生长抑制率≤10%的药物浓度为非细胞毒性浓度.
1.2.2 MTT法检测耐药细胞株HepG2/ADM的多药耐药性及OM干预后HepG2/ADM药敏性的变化: 根据上述实验结果, 选取无细胞毒性作用的0.5 mg/mL OM作用于HepG2/ADM细胞48 h, 制备HepG2/ADM+OM组细胞. 将实验细胞分为HepG2、HepG2/ADM及HepG2/ADM+OM 3组, 每组均设有阴性对照组和空白对照组. 分别取处于对数生长期的3组细胞, 按细胞传代方法制备细胞悬液, 同时予细胞计数, 通过调整细胞浓度, 使其浓度为5×104/mL. 将各组混匀的细胞悬液接种于96孔细胞培养板, 100 μL/孔. 待细胞贴壁后(培养4 h后), 加入试验药物: ADM、CDDP、5-FU. 参照各药临床用量的血峰浓度, 设置5个试验浓度, 每个浓度均设5个复孔. 继续培养44 h后, 分别向3组细胞中加入5 mg/mL MTT 20 μL/孔, 继续孵育4 h. 吸取上清液, 然后加入DMSO, 150 μL/孔, 后置于恒温振荡箱中震荡, 37 ℃、100 r/min, 振荡10 min. 在全自动酶标仪上于490 nm波长处测定A值. 利用SPSS16.0软件计算3种化疗药物的IC50、耐药指数(resistance index, RI) = 耐药细胞IC50/亲本细胞IC50及逆转倍数 = 耐药细胞IC50/OM作用后耐药细胞IC50. MTT试验在不同日重复3次.
1.2.3 通过流式细胞仪检测OM对耐药细胞细胞凋亡的影响: 取HepG2/ADM细胞及0.5 mg/mL OM分别作用24、48、72 h的HepG2/ADM细胞, 使用不含EDTA的胰酶消化细胞, 制成单细胞悬液, 用PBS液洗涤细胞2次(800 r/min离心5 min), 计数后调整细胞悬液浓度, 收集1×105-5×105个细胞. 实验分为24、48、72 h组, 每组均设有阴性对照. 各组分别加入500 μL的Binding Buffer悬浮细胞, 之后依次加入5 μL Annexin V-FITC、5 μL Propidium Iodide充分混匀. 在室温下避光、反应5-15 min, 1 h内通过流式细胞仪的检测各组细胞不同时期的细胞凋亡率, 记录其早期细胞凋亡率. 激发波长Ex = 488 nm; 发射波长Em = 525 nm, 用BD FACSDiva Software进行参数获取和数据分析. 实验在不同日, 重复3次.
1.2.4 实时荧光定量PCR检测OM作用前后耐药细胞内耐药相关基因三磷酸腺苷结合运转蛋白B1(ATP-binding cassette, sub-family B member 1, ABCB1)的表达: 取处于对数生长期的HepG2/ADM细胞及0.5 mg/mL的OM作用48 h的HepG2/ADM细胞, 倒掉培养液, 用PBS液清洗3次. 用1000 μL TRIzol提取总RNA, 紫外分光光度计测定RNA纯度(A260/280 = 1.8-2.0)并定量, 取1 μg总RNA, 1 μL oligo(dT)18 primer按RT-PCR试剂盒说明书构建20 μL反应体系进行逆转录, 反应合成第一链cDNA. 接下来通过Real-time PCR检测相关目的基因ABCB1及内参基因B2M的表达. 目的基因ABCB1上游引物: 5'-TCTGGAGCACTGAAAGATAAG-3', 下游引物: 5'-ACCTGCAAACTCTGAGCATACATA-3'; 内参基因B2M上游引物: 5'-AGTATGCCTGCCGTGTGAAC-3', 下游引物: 5'-TTCATCCAATCCAAATGCGGC-3'. 按荧光定量PCR试剂盒说明书构建25 μL反应体系, 用荧光定量PCR仪检测相关目的基因的表达情况. 阴性对照组与OM实验组分管同机进行PCR反应, 实验不同日重复3次. 最后用琼脂糖凝胶电泳实验验证PCR扩增产物.
1.2.5 流式细胞仪检测OM作用前后耐药细胞内耐药相关蛋白P-gp的表达: 取HepG2、HepG2/ADM及0.5 mg/mL的OM作用48 h的HepG2/ADM细胞, 将实验细胞分为HepG2、HepG2/ADM及HepG2/ADM+OM 3组. 用含10%胎牛血清的冰冷PBS液洗涤细胞3次(800 r/min离心5 min), 用上述冰PBS把细胞悬液调整至1×105-5×105个/mL浓度. 取90 μL细胞悬液, 加入10 μL鼠抗人P-gp抗体, 轻柔吹打混匀, 在4 ℃环境中孵育至少30 min. 用上述冰PBS液洗涤细胞3次, 以除去未与蛋白结合的游离抗体. 之后用500 μL冰PBS液重悬细胞, 实验过程中细胞一直避光放于冰上. 在1 h内通过流式细胞仪进行检测, 激发波长Ex = 488 nm; 发射波长Em = 525 nm. 以检测到的P-gp荧光强度反应细胞内P-gp含量, 用BD FACSDiva Software进行参数获取和数据分析. 实验在不同日, 重复3次.
统计学处理 采用SPSS16.0软件进行统计分析, 数据以mean±SD表示, 两样本均数比较采用独立样本t检验, 多组均数间比较采用单因素方差分析(One-way ANOVA)、两两比较采用SNK法, P<0.05为差异有统计学意义.
不同浓度的OM(0.5、1、2、4、8 mg/mL)作用HepG2及HepG2/ADM细胞株48 h后, 对HepG2及HepG2/ADM细胞株的具体抑制率如表1. 当OM浓度为0.5 mg/mL时对HepG2及HepG2/ADM细胞株的生长抑制率均<10%, 无明显毒性作用, 因而选用0.5 mg/mL作为OM逆转肝癌细胞耐药的安全实验剂量. 使用SPSS16.0软件对数据进行统计分析, OM对HepG2及HepG2/ADM细胞株的IC50分别为3.96 mg/mL±0.33 mg/mL、5.86 mg/mL±0.27 mg/mL, P<0.05.
| 苦参素(mg/mL) | 抑制率(%) | |
| HepG2 | HepG2/ADM | |
| 0.5 | 7.38±0.79 | 6.92±0.46 |
| 1.0 | 17.75±3.10 | 13.69±1.77 |
| 2.0 | 33.37±1.88 | 24.20±3.01 |
| 4.0 | 52.00±2.80 | 39.02±2.94 |
| 8.0 | 66.55±2.36 | 62.20±3.62 |
与HepG2细胞相比较, HepG2/ADM对ADM、CDDP、5-FU 3种化疗药物表现出不同程度的耐药性, 其耐药指数分别为27.52、5.50、4.39. 0.5 mg/mL OM作用HepG2/ADM细胞48 h后, 3种化疗药物对HepG2/ADM的IC50均有一定程度的降低, 其耐药性的逆转倍数分别为3.68、2.82、2.03倍(表2).
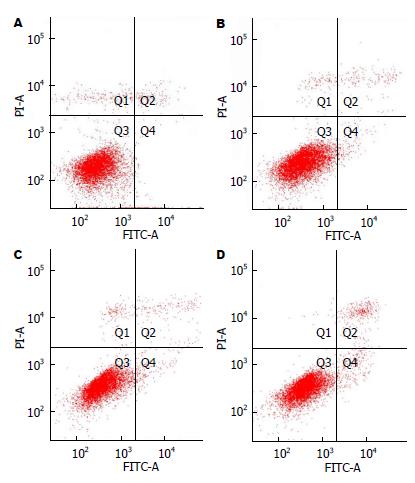
以二维散点图记录HepG2/ADM细胞凋亡, 以阴性对照设定正常界限, FITC为横坐标, PI为纵坐标, 早期凋亡细胞位于右下象限(Q4, FITC+、PI-). 0.5 mg/mL OM作用HepG2/ADM细胞24、48、72 h后, 各组细胞早期细胞凋亡率较各阴性对照组均有所提高且随OM作用时间的延长而逐渐增加. 各组早期细胞凋亡率分别为1.77%±0.25%、2.53%±0.15%、3.83%±0.42%, 各实验组与各阴性对照组相比较, 实验组各组间相比, 差异较均有统计学差异(P<0.05, 表3, 图1).
以阴性对照组作为校准, 因目的序列与内参序列扩增效率相近, 可采用2-∆∆Ct法分析阴性对照组与OM实验组耐药相关基因ABCB1的表达. ∆Ct(校准样品) = Ct(目的基因)-Ct(内参基因); ∆Ct(实验样品)= Ct(目的基因)- Ct(内参基因), 2-∆∆Ct = 2-[∆Ct(实验样品)-∆Ct(校准样品)]. 将检测到的各组Ct值
代入上述公式, 与阴性对照组相比OM实验组ABCB1的表达为阴性对照组的0.49倍, 经OM作用后耐药相关基因ABCB1的表达明显降低. 目的基因ABCB1及内参基因B2M熔解曲线峰图仅见单一峰, 无杂峰. 琼脂糖凝胶电泳验证目的基因ABCB1及内参基因B2M PCR扩增产物均见单一清晰条带, 无杂带和拖尾现象. 均表明产物特异性好, 无非特异性扩增和引物二聚体(表4).
| 样品 | CtABCB1(目的基因) | CtB2M(内参基因) |
| 阴性对照组 | 26.07±0.048 | 15.80±0.138 |
| OM实验组 | 28.11±0.314 | 16.81±0.960 |
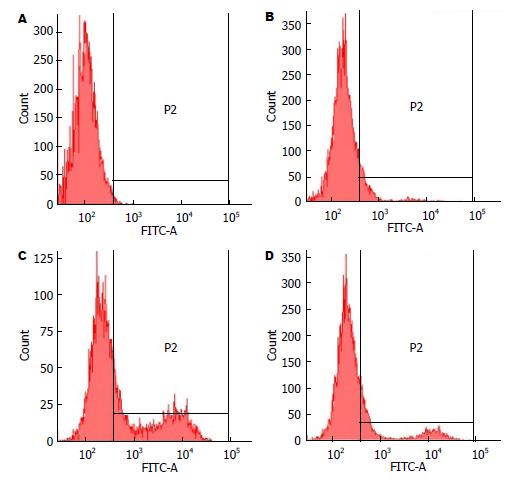
以流式细胞仪检测到的P-gp荧光强度反应细胞膜表面的P-gp含量, 横坐标为荧光强度, 纵坐标为细胞出现频率, 阴性对照设定正常荧光边界, P2区代表P-gp阳性表达. 结果显示HepG2组细胞P-gp含量明显低于HepG2/ADM组细胞, HepG2/ADM+OM组细胞(0.5 mg/mL OM作用48 h后), 细胞膜表面P-gp的表达率与HepG2/ADM组相比, 有一定程度的降低, 但仍高于HepG2组(21.50%±1.08% vs 40.83%±0.35%, 21.50%±1.08% vs 10.36%±0.60%, P<0.01, 表5, 图2).
肿瘤耐药性是目前影响肿瘤临床化疗效果的主要原因, 肿瘤细胞耐药类型较多, 可分为先天性耐药和获得性耐药2类, 根据耐药谱的不同, 又可分为原药耐药和多药耐药. 肿瘤MDR是指肿瘤细胞对一种抗肿瘤药物产生耐药性, 同时又对其他结构和作用机制完全不同的抗肿瘤药物也产生交叉耐药性的现象[4-6]. 肿瘤多药耐药形成机制异常复杂, 与膜转运蛋白、酶、细胞凋亡、器官微环境等多种因素密切相关, 是多基因、多步骤综合作用的结果[7]. 肿瘤MDR已涉及临床多种常用的抗癌药物, 是目前肿瘤临床化疗失败的主要原因之一. 肿瘤细胞的MDR现象是肿瘤治疗中最常见和最棘手的问题, 因而应用MDR逆转剂是克服肿瘤临床耐药、提高肿瘤化疗有效性的一种潜在的重要手段. 针对天然耐药和获得性耐药2种不同耐药类型以及临床复杂的耐药机制, 寻找结构独特、活性强、选择性好而不良反应小的多药耐药逆转剂, 是临床逆转MDR的重要途径之一, 也一直是国内外众多肿瘤学者的研究目标[8]. 中药具有低毒、多靶点、多阶段性作用特点, 可以针对肿瘤多药耐药的多种机制进行有效的逆转[9]. 因而在具有抗癌作用的中草药成分中,筛选低毒高效的MDR逆转剂具有重要的研究价值和开发前景.
肝癌是我国最常见的恶性肿瘤之一. 临床资料显示, 约60%以上的肝癌(含早期肝癌)确诊时已发生临床或显微镜下转移, 约90%的患者被诊断为肝癌时已为中晚期, 而丧失手术机会[10]. 药物化疗在临床肝癌的非手术治疗中占有重要的地位, 然而由于肿瘤MDR的存在, 导致目前肝癌临床化疗效果普遍不佳.
苦参素即氧化苦参碱, 是一种从豆科槐属植物苦参、广豆根中提取的四环喹嗪啶类生物碱. 据《本草纲目》中记载: 苦参, 苦、寒、无毒, 具有养肝胆气、除伏热肠、补中明目、祛风燥湿等功效. 目前, 国内对其研究多集中在抗乙型肝炎病毒、抗肝纤维化及提高肿瘤放化疗引发的白细胞低下等方面[11]. 近年来有研究表明OM具有抗肝癌作用, 且对正常肝细胞无明显破坏[12,13]. 韦星等[14,15]研究发现OM可以通过上调bax、wtp53基因和下调c-myc、bcl-2、hTERT基因的表达, 促进人肝癌SMMC-7721细胞凋亡, 降低端粒酶活性, 从而抑制肝癌细胞的增殖. 亦有相关实验证实, 苦参碱具有一定的逆转肿瘤MDR的功效[16]. 吴迪炯等[17]将苦参碱作用于急性早幼粒细胞白血病全反式维甲酸耐药细胞株NB4-R1, 研究最终发现苦参碱能够显著逆转NB4-R1细胞株的耐药性, 逆转机制可能与其增强耐药细胞的分化能力及提高细胞凋亡率相关. 孙付军等[18]建立小鼠S180肿瘤细胞多药耐药模型, 用苦参碱口服给药4 wk后, 通过流式细胞术检测小鼠瘤体中多药耐药基因表达产物P170、肺耐药蛋白LRP的含量及拓扑异构酶Ⅱ的活性, 结果发现P170、LRP的表达率和TopoⅡ的活性较给药前均有一定程度的降低, 提示苦参碱逆转肿瘤MDR的作用.
本研究使用OM体外逆转人肝癌细胞株HepG2/ADM的多药耐药性, 观察药物作用效果并初步探讨其细胞及分子生物学机制. 通过MTT系列实验, 我们的实验发现HepG2/ADM细胞株对ADM、CDDP、5-FU 3种化疗药物表现出交叉耐药性, 无细胞毒性作用的OM作用耐药细胞株48 h后, 耐药细胞株对上述3种化疗药物的敏感性均有一定程度的增加. 之后通过相关细胞及分子生物学实验研究, 一方面发现OM作用后HepG2/ADM细胞内耐药相关蛋白P-gp及其相关基因ABCB1的表达量均有下调; 另一方面发现HepG2/ADM的早期细胞凋亡率有一定程度的提高且随OM作用时间的延长而逐渐增加. 相关研究表明P-gp是由多药耐药基因ABCB1编码的一种跨膜糖蛋白[19]. P-gp分子上含有2个跨膜结构域, 每个跨膜结构域上均有有一个ATP结合位点, 他可以和抗肿瘤药物及疏水亲脂性化合物结合, 通过ATP水解供能, 逆浓度梯度将药物泵出细胞外, 导致细胞内药物浓度降低[20]. 我们由此推测OM的使用抑制了ABCB1基因的表达, 降低了细胞膜表面P-gp的表达含量, 导致P-gp的转运功能下降, 减少肿瘤细胞对相关化疗药物的外排作用, 增加细胞内化疗药物浓度, 从而部分逆转了HepG2/ADM的多药耐药性. 我们的实验亦发现OM能部分增加HepG2/ADM细胞株早期细胞凋亡率, 大量相关实验研究发现通过诱导细胞凋亡杀伤肿瘤细胞是众多化疗药物发挥抗癌作用的共同机制, 肿瘤多药耐药的产生多与相应的凋亡调控基因及因子表达失控而引发的凋亡受抑相关[21]. 由此推测OM的使用, 提高了耐药细胞的细胞凋亡率, 从而协助了的相关化疗药物对肿瘤细胞凋亡的诱导作用, 最终降低了HepG2/ADM的多药耐药性. 有研究表明bcl-2、突变p53、ras﹑c-fos、c-fun、TNF等细胞凋亡途径上的有关基因和因子都参与了肿瘤MDR的形成[22]. 对于OM与细胞凋亡及肿瘤MDR的关系, 仍需做进一步深入研究. 本实验表明无细胞毒浓度(0.5 mg/mL)的OM能够在体外能部分逆转HepG2/ADM细胞株的多药耐药, 相关分子机制可能与其抑制ABCB1基因的表达, 降低了细胞膜表面P-gp的表达含量, 导致P-gp的转运功能下降, 减少肿瘤细胞对化疗药物的外排和增加肝癌耐药细胞的早期凋亡相关. 为提高临床肝癌化疗效果及中药MDR逆转剂的开发和应用提供新思路.
化疗在肝癌的非手术治疗中占有重要的地位, 然而由于肿瘤多药耐药(multidrug resistance, MDR)的存在, 导致目前肝癌临床化疗效果普遍不佳. 中药因其低毒高效和多阶段性作用的优势已在肿瘤多药耐药逆转方法的研究中逐步受到重视.
徐泱, 副主任医师, 上海复旦大学附属中山医院
苦参素(oxymatrine, OM)即氧化苦参碱, 是一种从豆科槐属植物苦参、广豆根中提取的生物碱. 近年来有研究表明苦参素具有抗肝癌作用, 且对正常肝细胞无明显破坏作用, 但关于其否具有逆转肝癌MDR的研究少见.
有研究报道苦参碱在一定程度上可以逆转人膀胱癌多药耐药细胞株T24/阿霉素(adriamycin, ADM)、人乳腺癌多药耐药细胞株MCF-7/ADM、鼻咽癌耐药细胞HONE1/DDP的MDR.
本研究探讨OM体外逆转人肝癌细胞HepG2/ADM多药耐药性的作用效果及其与细胞凋亡、细胞耐药相关基因及蛋白的关系.
本研究探讨OM体外逆转人肝细胞癌MDR的作用及其分子生物学机制, 为提高临床肝癌化疗效果及中药MDR逆转剂的开发和应用提供新思路.
该研究证明了OM能够在体外逆转人肝癌细胞株HepG2/ADM的多药耐药性, 并初步探讨了其作用机制可能与其提高耐药细胞凋亡率, 下调耐药相关基因及蛋白表达有关. 有一定理论价值, 对临床应用也有一定的指导作用.
编辑 郭鹏 电编 鲁亚静
| 2. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 4. | Takara K, Sakaeda T, Okumura K. An update on overcoming MDR1-mediated multidrug resistance in cancer chemotherapy. Curr Pharm Des. 2006;12:273-286. [PubMed] [DOI] |
| 5. | Beck WT. The cell biology of multiple drug resistance. Biochem Pharmacol. 1987;36:2879-2887. [PubMed] [DOI] |
| 6. | Krishna R, Mayer LD. Multidrug resistance (MDR) in cancer. Mechanisms, reversal using modulators of MDR and the role of MDR modulators in influencing the pharmacokinetics of anticancer drugs. Eur J Pharm Sci. 2000;11:265-283. [PubMed] [DOI] |
| 10. | Chen JG, Zhang SW. Liver cancer epidemic in China: past, present and future. Semin Cancer Biol. 2011;21:59-69. [PubMed] [DOI] |
| 14. | 韦 星, 黄 赞松, 黄 岑汉, 周 喜汉, 黄 衍强, 邓 志华. 苦参素注射液联合顺铂对人肝癌SMMC-7721细胞凋亡相关基因c-myc、bcl-2和bax表达的影响. 山东医药. 2012;52:12-14. |
| 15. | 韦 星, 黄 赞松, 黄 岑汉, 周 喜汉, 黄 衍强, 邓 志华. 苦参素注射液与顺铂联合对人肝癌细胞SMMC-7721端粒酶活性及wtp53、hTERT mRNA表达的影响. 实用医学杂志. 2012;28:1759-1761. |
| 17. | 吴 迪炯, 周 郁鸿, 朱 俊, 赵 苇, 钟 维君, 王 珍, 钱 欢, 李 睿, 付 珊, 孙 洁. 苦参碱对急性早幼粒细胞白血病细胞维甲酸耐药的逆转作用研究. 中华血液学杂志. 2011;32:313-316. |
| 18. | 孙 付军, 王 宁, 李 贵海, 王 学荣, 李 晓晶, 尹 格平. 苦参碱对获得性多药耐药小鼠S180肿瘤细胞基因表达产物P170、LRP及TOPOⅡ表达的影响. 中药材. 2004;27:838-840. |
| 19. | Haus-Cohen M, Assaraf YG, Binyamin L, Benhar I, Reiter Y. Disruption of P-glycoprotein anticancer drug efflux activity by a small recombinant single-chain Fv antibody fragment targeted to an extracellular epitope. Int J Cancer. 2004;109:750-758. [PubMed] [DOI] |
| 20. | Goldstein LJ. Clinical reversal of drug resistance. Curr Probl Cancer. 2005;19:65-124. [PubMed] [DOI] |