修回日期: 2013-02-16
接受日期: 2013-03-05
在线出版日期: 2013-03-28
目的: 观察以重组腺相关病毒(recombinant adeno-associated virus, rAAV)介导的RNA干扰(RNA interference, RNAi)对HepG2.2.15细胞中乙型肝炎病毒(hepatitis B virus, HBV)复制和表达的影响.
方法: 将hu6驱动的shRNA表达框置于腺相关病毒(adeno-associated virus, AAV)的2个ITR(inverted terminal repeat, ITR)之间, 之后接有HBV的基本核心启动子(bacic core promoter, BCP)及其驱动的AAV的Rep基因, 构成rAAV, 作为抗HBV的shRNA表达框的质粒载体, 转染HepG2.2.15细胞(肝细胞性肝癌细胞插入乙型肝炎病毒基因), 测定上清液中第1天、第2天、第3天及第10天HBsAg、HBeAg表达及HBV DNA拷贝数, 并对细胞基因组AAVS1区域进行测序.
结果: 成功构建了含目的序列的rAAV质粒载体PLRBR322-324、PLRBR522-324、PLRBR322-2424、PLRBR522-2424. 体外质粒转染细胞实验显示4个载体对HBsAg、HBeAg表达及HBV DNA复制均有抑制效应, 且前两者对HBsAg高一些、后两者对HBeAg高一些, 第3个对HBV DNA拷贝数高一些. 转染后第3天后抑制效应最明显, 第10天抑制率仍较高. 针对细胞基因组AAVS1区域测序结果显示, 目的序列定点整合于该区域.
结论: 利用AAV和HBV各种元件构建的rAAV,作为抗HBV的shRNA表达框的载体, 借助Rep蛋白介导的定点整合作用, 为解决RNAi抗HBV作用时间短暂的问题做了一些技术上的探索.
引文著录: 付冰峰, 李绍祥, 宁守斌. 重组腺相关病毒介导的RNA干扰对乙型肝炎病毒复制和表达的影响. 世界华人消化杂志 2013; 21(9): 814-819
Revised: February 16, 2013
Accepted: March 5, 2013
Published online: March 28, 2013
AIM: To observe the effect of recombinant adenovirus-associated virus (rAAV)-mediated RNA interference on HBV replication and expression in HepG2.2.15 cells.
METHODS: The expression box of hu6-shRNA was placed between two ITRs of AAV and then ligated to the basic core promoter (BCP) of HBV and BCP-driven Rep gene of AAV, which resulted in rAAV. The rAAV was transfected into HepG2.2.15 cells (HCC cells in which the HBV gene was inserted). The expression of HBsAg and HBeAg and replication of HBV-DNA in cultured supernatant were determined on days 1, 2, 3 and 10 after transfection, and the AAVS1 region was sequenced on day 3 after transfection.
RESULTS: The target sequence-containing vectors PLRBR322-324, PLRBR522-324, PLRBR322-2424 and PLRBR522-2424 were successfully constructed. All the four vectors had inhibitory effects on the expression of HBsAg and HBeAg and on HBV-DNA replication, with the former two (PLRBR322-324 and PLRBR522-324) having more significant inhibitory effect on HBsAg expression, the latter two on HBeAg expression and the third on HBV-DNA replication. The inhibitory effects on HBsAg and HBeAg expression and HBV-DNA replication were most obvious on day 3 after transfection, and the inhibition rate remained high on day 10. Site-directed integration of the target sequence was located in the AAVS1 region.
CONCLUSION: The rAAV constructed by several elements of AAV and HBV, together with the help of site-directed integration mediated by Rep protein, is a good exploration to solve the problem of short-term effect of RNAi against HBV.
- Citation: Fu BF, Li SX, Ning SB. Effect of recombinant adenovirus-associated virus-mediated RNA interference on HBV replication and expression. Shijie Huaren Xiaohua Zazhi 2013; 21(9): 814-819
- URL: https://www.wjgnet.com/1009-3079/full/v21/i9/814.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i9.814
慢性乙型肝炎病毒(hepatitis B virus, HBV)感染与肝硬化、肝细胞癌密切相关[1], 目前全球每年因HBV感染相关的终末期肝病而死亡的人数多达100万[2], 是一个严重的公共卫生问题. 慢性乙型肝炎的治疗主要包括抗病毒、免疫调节、抗炎和抗氧化、抗纤维化及对症治疗, 其中抗病毒治疗是关键, 持续有效的抑制病毒能延缓甚至阻滞肝病进程, 改善慢性HBV感染者生活质量[3]. 但是抗HBV治疗, 阻断肝细胞内HBV的复制和表达, 仍是目前难题之一. 近年来备受关注的RNA干扰技术, 为HBV基因治疗提供了新的策略. RNA干扰通过RNaseⅢ家族的Drosha酶和/或Dicer酶将双链RNA(dsRNA)切割成小干扰RNA(small interfering RNA, siRNA), 降解与其同源的靶mRNA或抑制靶mRNA翻译, 从而下调靶基因表达[4]. 这种机制存在几乎所有真核生物中[5], 具有高效性、特异性等优点, 目前已有siRNA/shRNA抑制HBV复制与感染[6-9]报道, 但没有克服作用时间短暂等不足. 为探讨RNAi抗HBV的作用效果, 解决RNAi作用时间短暂的问题, 本实验针对HBV pre-C/C区和S区基因序列, 设计构建重组腺相关病毒(recombinant adeno-associated virus, rAAV), 利用腺相关病毒(adeno-associated virus, AAV)宿主范围广、不致病、免疫原性低等优点[10], 作为抗HBV的shRNA表达框的载体, 转染含HBV病毒基因组的HepG2.2.15细胞中, 观察对HBV复制和表达的抑制作用.
DMEM购自美国Gibco公司; 胎牛血清购自苏州四季青生物公司; 限制性内切酶BamHⅠ、XbaⅠ、XhoⅠ、T4连接酶、Real-time PCR试剂盒均购自Takara生物技术公司; 转染试剂lipofectamine 2000购自美国Invitrogen公司; 质粒小提试剂盒、胶回收试剂盒购自美国Promega公司; 质粒中提试剂盒购自北京全式金生物公司; 引物由北京市理化分析测试中心合成; DH5α感受态细胞购自Tigen公司; ELISA试剂盒购自上海科华公司; HepG2.2.15细胞由解放军302医院曲建慧副教授惠赠; 质粒pGe322、pGe522及PLRBR由北京军区总医院全军肝病治疗中心实验室前期合成并保存.
1.2.1 HepG2.2.15细胞的培养及准备: HepG2.2.15细胞复苏后生长于DMEM中(含10%胎牛血清、2 mmol/L谷氨酰胺、100 U/mL青霉素及100 µg/mL链霉素), 并在37 ℃、5%CO2孵箱中进行培养, 2-3 d更换培养液.
1.2.2 靶位的选择及shRNA的设计: 根据在GenBank中的HBV S基因及C基因作为靶序列, 同时根据shRNA设计原则, 靶位1(324-352)序列为: AACCTCCAATCACTCACCACCCTCTTGTC, 靶位2(2424-2452)序列为: GCTGGTGGCTCCAGTTCAGGAACAGTAAA.
1.2.3 重组载体的构建: (1)引物的合成: S1正义链5'-GATCCCGAACCTCCAATCACTCACCACCCTCTTGTCGAAGCTTGGACAAGAGGTTGGTGAGTGATTGGAGGTTTTTTTT-3', S1反义链: 5'-CTAGAAAAAA AACCTCCAATCACTCACCACCCTCTTGTCCAAGCTTC GACAAGAGGTTGGTGAGTGATTGGAGGTT CGG-3'; S2正义链: 5'-GATCCCGGCTGGTGGCTCCAGTTCAGGAACAGTAAA GAAGCTTGTTTACTGTTCCTGAACTGGAGCCACCAGCTTTTTT-3', S2反义链: 5'-CTAGAAAAAA GCTGGTGGCTCCAGTTCAGGAACAGTAAA CAAGCTTCTTTACTGTTCCTGAACTGGAGCCACCAGCCGG-3'. 以上引物均由北京理化分析测试中心合成; (2)引物退火, 琼脂糖电泳, 切胶, 行胶回收; (3)载体的构建及检测: 以限制性内切酶BamHⅠ、XbaⅠ分别线性化pGe322、pGe522载体, 酶切产物进行琼脂糖凝胶电泳检测并回收, 双链DNA分别与酶切回收产物连接, 应用T4连接酶、16 ℃连接过夜, 形成pGe322-324、pGe522-324、pGe322-2424、pGe522-2424 4个重组载体. 再将重组载体与PLRBR载体用限制性内切酶XbaⅠ、XhoⅠ进行酶切, 37 ℃水浴过夜. 对重组载体及PLRBR载体进行琼脂糖凝胶电泳检测并回收, 再将PLRBR载体回收产物分别与4个重组载体回收产物连接, 应用T4连接酶、16 ℃连接过夜, 形成PLRBR322-324、PLRBR522-324、PLRBR322-2424、PLRBR522-2424. 将连接产物转化感受态细胞DH5α后铺于LB平板, 挑单个菌落进行过夜摇菌扩增, 质粒小提试剂盒提取质粒进行双酶切鉴定, 其电泳结果与实验预计结果相符.
1.2.4 转染HepG2.2.15细胞: 转染前用含0.25%胰酶-0.02%乙二胺四乙酸(EDTA)消化后吹打成单细胞悬液, 细胞技术后接种于12孔培养板中, 放于孵箱中进行培养. 约24 h后观察细胞生长铺满孔底面积约70%时用于转染. 转染前更换无血清培养基, 质粒与Lipofectamine 2000脂质体按1:3共转染, 室温放置20 min后加入每孔中, 在孵箱中培养6 h候换DMEM中(含10%胎牛血清、2 mmol/L谷氨酰胺、100 U/mL青霉素及100 µg/mL链霉素), 并在37 ℃、5%CO2孵箱中进行培养. 设空白对照组及转入空质粒的阴性对照组, 每组设3个复孔.
1.2.5 HBsAG、HBeAG及HBV-DNA的检测: 取转染后第1天、第2天、第3天及第10天上清液根据ELISA试剂盒实验步骤检测HBsAG、HBeAG. 结果用S/N值(实验孔吸光度值/阴性对照孔吸光度值)表示. HBV-DNA检测: 将上清液吸出, 用磷酸盐缓冲液漂洗细胞, 制备细胞裂解液, 具体步骤按试剂盒说明书进行检测.
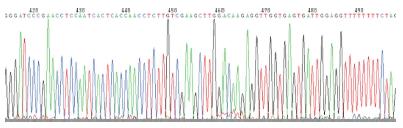
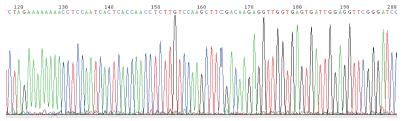
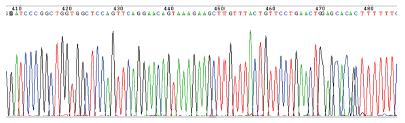
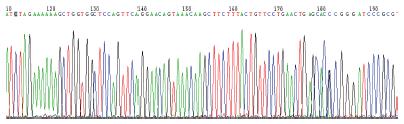
1.2.6 细胞核DNA的提取、纯化及测序: 取转染后3 d细胞, 留取上清液后, 按细胞DNA提取试剂盒步骤提取细胞DNA, 以细胞DNA为模板行PCR, 引物: 5'-AGGAACCCCTAGTGATGGAGT-3', 引物: 5'-TCAGAGGACATCACGTG-3', PCR产物送生物公司测序.
统计学处理 采用SPSS17.0数据包进行统计分析, 计量资料采用mean±SD表示, 所得数据经正态性检验符合正态分布, 组间比较采用单因素方差分析, 多个均数之间两两比较采用LSD法, 以P<0.05认为有统计学意义.
体外质粒转染细胞实验显示本实验合成的4个载体(图1-4)对HBsAg、HBeAg表达及HBV DNA复制均有抑制效应, PLRBR322-324、PLRBR522-324载体靶向于HBV S区, 其抑制HBsAG作用较明显, 其中PLRBR322-324第1天、第2天抑制效率分别为28.3%和49.9%, 第3天最高达68.6%, 到第10天仍然有56%的抑制率(表1). PLRBR322-2424、PLRBR522-2424靶向于HBV pre-C/C区, 其抑制HBeAg作用较明显, 其中PLRBR322-2424前两天抑制效率分别为24.9%、46.3%, 第3天达最大抑制效率为67.1%, 第10天抑制率仍较高, 达到了51.3%(表2); PLRBR322-2424对HBV-DNA抑制效作用最强, 第1天、第2天抑制率分别为26.4%、43.3%, 第3天最大, 达到57%, 第10天仍保持有41.4%的稳定抑制效果. 阴性对照组与空白对照组比较无统计学意义(表3).
| 分组 | 第1天 | 第2天 | 第3天 | 第10天 |
| PLRBR322-324 | 5.39±0.11a | 7.76±0.09a | 9.29±0.06a | 8.93±0.12a |
| PLRBR522-324 | 5.49±0.13a | 8.01±0.11a | 10.94±0.13a | 9.75±0.15a |
| PLRBR322-2424 | 6.32±0.08a | 10.74±0.14a | 18.72±0.17a | 13.71±0.1a |
| PLRBR522-2424 | 6.46±0.10a | 11.01±0.07a | 18.55±0.12a | 14.02±0.13a |
| 空白对照组 | 7.51±0.13 | 15.49±0.13 | 29.50±0.14 | 20.28±0.11 |
| 阴性对照组 | 7.26±0.11 | 15.25±0.18 | 29.26±0.13 | 19.98±0.12 |
| 分组 | 第1天 | 第2天 | 第3天 | 第10天 |
| PLRB322-324 | 6.51±0.04a | 12.01±0.11a | 20.32±0.06a | 12.80±0.13a |
| PLRBR522-324 | 6.36±0.11a | 11.89±0.06a | 21.09±0.08a | 12.68±0.14a |
| PLRBR322-2424 | 5.71±0.08a | 8.37±0.10a | 10.62±0.14a | 8.65±0.09a |
| PLRBR522-2424 | 5.75±0.12a | 8.56±0.08a | 11.96±0.13a | 8.96±0.11a |
| 空白对照组 | 7.60±0.07 | 15.56±0.15 | 32.25±0.28 | 17.75±0.07 |
| 阴性对照组 | 7.41±0.23 | 15.32±0.21 | 31.92±0.11 | 17.50±0.13 |
| 分组 | 第1天 | 第2天 | 第3天 | 第10天 |
| PLRB322-324 | 1.29±0.04a | 1.75±0.09a | 2.05±0.08a | 1.77±0.06a |
| PLRBR522-324 | 1.32±0.03a | 1.76±0.08a | 2.15±0.07a | 1.81±0.04a |
| PLRBR322-2424 | 1.26±0.04a | 1.64±0.08a | 2.03±0.08a | 1.74±0.08a |
| PLRBR522-2424 | 1.23±0.04a | 1.68±0.08a | 2.11±0.07a | 1.78±0.08a |
| 空白对照组 | 1.71±0.02 | 2.89±0.05 | 4.68±0.07 | 2.95±0.02 |
| 阴性对照组 | 1.63±0.04 | 2.71±0.09 | 4.51±0.05 | 2.79±0.06 |
据世界卫生组织报告, 全球约有20亿人曾感染过HBV, 其中3.5亿人为慢性感染者. 核苷(酸)类似物和干扰素α(interferon-α, IFN-α)是目前全球公认有效的抗HBV药物[11], 但临床研究发现, 二者在使用过程中存在着应答率有限、停药后易反复等诸多问题, 而且干扰素治疗容易产生干扰素样反应, 核苷类药物易引起病毒变异继而耐药[12], 为改善疗效, 许多学者进行了联合用药抗HBV的探索, 但在最终疗效的评定上出现了较多争议[13,14]. 由于HBV复制及逆转录过程中存在RNA阶段, 从而为RNAi提供了靶点[15]. 早期的实验将shRNA序列插入到质粒中, 已经证实能够明显地抑制HBV的复制和表达, 但只能产生短时间的基因沉默效果, 对细胞毒性也较大[16]. 为此很多学者进行了试验性的研究, 将AAV作为广泛应用的基因工程治疗载体, 基于以下优点[10,17-22]: (1)可以广泛感染人细胞, 包括分裂期细胞和非分裂期细胞; (2)AAV本身无致病性; (3)可以特异性整合于人类19号染色体长臂末端, 无致癌及致突变作用; (4)以辅助质粒P-Helper代替辅助病毒进行重组腺相关病毒的包装; (5)使插入的siRNA表达时间延长, 可稳定发挥干扰作用.
本实验将hu6-shRNA表达框置于AAV两个ITR之间, 之后接BCP和Rep基因, 构成rAAV, 作为抗HBV的shRNA表达框的载体. rAAV感染HepG2.2.15细胞后, BCP驱动Rep蛋白得以表达, 因Rep蛋白有促进复制、定点整合及拯救的作用, 因此LITR-hu6-shRNA-RITR可以复制, 使得rAAV的拷贝数大大增加. 但由于rAAV没有Cap基因, 因此复制的rAAV基因组不能被包装成子代病毒颗粒, 只是拷贝数增加而已, 因而不会引起靶细胞裂解. 其基因组所携带的hu6-shRNA表达框, 通过RNAi途径, 发挥抗HBV作用. 随着时间的延迟, BCP-Rep被清除, Rep基因随之降解、消失, rAAV失去产毒性感染的条件, 因为Rep定点整合作用, 其基因组整合入AAVS1, 进入潜伏感染, 所携带的hu6-shRNA表达框也随之定点整合到AAVS1, 并随着细胞的分裂而分裂、复制, 持续生成shRNA, 通过RNAi稳定发挥抗HBV的作用[23]. 体外质粒转染细胞实验显示本实验合成的4个载体对HBsAg、HBeAg表达及HBV DNA复制均有抑制效应, PLRBR322-324、PLRBR522-324载体靶向于HBV S区, 其抑制HBsAG作用较明显, PLRBR522-2424靶向于HBV pre-C/C区, 其抑制HBeAg作用较明显, PLRBR322-2424对HBV-DNA抑制效作用最强, 说明通过RNAi抑制靶基因表达的有效性很大程度上取决于靶向的mRNA部位及与靶序列的匹配程度. 在本实验中针对单一位点设计的shRNA表达质粒表现出对HBsAg、HBeAG以及HBV-DNA均有不同程度的抑制效应, 其原因可能在于针对某一位点的siRNA不仅能够使相应mRNA降解, 同时可以降解HBV的全长mRNA. 由于HBV的全长mRNA同时是逆转录模板, 其降解会导致HBV-DNA的复制明显减低, 从而减少转录产物mRNA的数量, 进而减少各位点的表达量. 针对细胞基因组AAVA1区域的测序结果可见目的序列, 证明shRNA定点整合于细胞基因组, 因此可以持续生成shRNA. 与王玥等[24]实验结果最大抑制率达87.49%相比本实验抑制相对较低, 可能与转染效率低相关, 下一步拟将rAAV经同源同组的方法置入腺病毒基因组中, 形成腺病毒/腺相关病毒杂合体病毒并进行病毒包装、扩增, 再转染HepG2.2.15细胞, 提高转染效率. 与胡斌等[25]合成的载体相比, 本载体中有Rep基因, shRNA能定点整合与细胞基因组, 可发挥长期稳定的干扰基因表达的作用.
本研究表明以AAV作为载体, 将shRNA置于其中后, 通过转染靶细胞使shRNA定点整合入细胞内, 从而可以长期稳定发挥抗HBV复制和表达的作用, 为解决RNAi作用短暂的问题打下了基础, 使之可能成为一种不同于传统乙肝治疗的新途径, 可以长期、有效的抑制病毒的复制和表达, 改善远期预后, 使大多数患者受益.
慢性乙型肝炎病毒感染可继发肝硬化、肝细胞癌, 目前全球每年因HBV感染相关的终末期肝病而死亡的人数多达100万, 是一个严重的公共卫生问题. 核苷(酸)类似物和干扰素α(IFN-α)是目前全球公认有效的抗HBV药物, 但临床研究发现, 二者在使用过程中存在着应答率有限、停药后易反复等诸多问题, 而且干扰素治疗容易产生干扰素样反应, 核苷类药物易引起病毒变异继而耐药. 因此, 寻找一种新的治疗HBV感染的方法势在必行.
杨江华, 副教授, 皖南医学院弋矶山医院感染科; 张占卿, 主任医师, 上海市(复旦大学)公共卫生中心(肝脏病学, 传染病学)
近年来将AAV作为广泛应用的基因工程治疗载体, 利用其能使插入的siRNA表达时间延长, 可稳定发挥干扰作用, 解决RNA干扰抗HBV作用时间短暂的问题.
RNAi作为一种全新的技术为防治乙型肝炎病毒感染提供了新的治疗思路, 但是同时也有作用时间短暂等问题有待解决. 直到最近几年因为AAV能使插入的siRNA表达时间延长, 可稳定发挥干扰作用等优点, 将AAV作为广泛应用的基因工程治疗载体, 为解决RNAi作用时间短暂提供新的思路.
本文可能为乙肝治疗提供一种新的途径, 可以长期、有效的抑制病毒的复制和表达, 改善远期预后, 使大多数患者受益.
RNA干扰(RNAi): 指在进化过程中高度保守的、由双链RNA(dsRNA)诱发的、同源mRNA高效特异性降解的现象. 由于使用RNAi技术可以特异性剔除或关闭特定基因的表达, 所以该技术已被广泛用于探索基因功能和传染性疾病及恶性肿瘤的基因治疗领域.
本文设计合理, 具有一定创新性, 可为乙型肝炎治疗提供新的思路.
编辑: 田滢 电编: 鲁亚静
| 1. | Chien RN, Liaw YF. Thymalfasin for the treatment of chronic hepatitis B. Expert Rev Anti Infect Ther. 2004;2:9-16. [PubMed] [DOI] |
| 2. | Ganem D, Prince AM. Hepatitis B virus infection-natural history and clinical consequences. N Engl J Med. 2004;350:1118-1129. [PubMed] [DOI] |
| 3. | Morgan M, Keeffe EB. Diagnosis and treatment of chronic hepatitis B: 2009 update. Minerva Gastroenterol Dietol. 2009;55:5-22. [PubMed] |
| 4. | Weinberg MS, Arbuthnot P. Progress in the use of RNA interference as a therapy for chronic hepatitis B virus infection. Genome Med. 2010;2:28. [PubMed] [DOI] |
| 7. | 边 中启, 孙 璐璐, 陈 维灶, 肖 安, 马 世武, 崔 志磊, 刘 霜, 刘 明秋, 严 维耀, 郑 兆鑫. 靶向C基因的shRNA抗乙型肝炎病毒在BHK-21细胞中的复制与表达. 中华医学杂志. 2010;90:2776-2781. |
| 8. | Starkey JL, Chiari EF, Isom HC. Hepatitis B virus (HBV)-specific short hairpin RNA is capable of reducing the formation of HBV covalently closed circular (CCC) DNA but has no effect on established CCC DNA in vitro. J Gen Virol. 2009;90:115-126. [PubMed] [DOI] |
| 9. | Ebert G, Poeck H, Lucifora J, Baschuk N, Esser K, Esposito I, Hartmann G, Protzer U. 5' Triphosphorylated small interfering RNAs control replication of hepatitis B virus and induce an interferon response in human liver cells and mice. Gastroenterology. 2011;141:696-706, 706. e1-e3. [PubMed] [DOI] |
| 10. | Flotte TR. Gene therapy progress and prospects: recombinant adeno-associated virus (rAAV) vectors. Gene Ther. 2004;11:805-810. [PubMed] [DOI] |
| 11. | European Association For The Study Of The Liver. EASL clinical practice guidelines: Management of chronic hepatitis B virus infection. J Hepatol. 2012;57:167-185. [PubMed] |
| 12. | 李 文滨, 吴 畏, 伍 衡, 肖 治宇, 林 青, 王 捷. RNA干扰沉默乙型肝炎病毒复制对肝癌细胞系HepG2.2.15生长的影响. 中华肝胆外科杂志. 2010;16:688-691. |
| 13. | Janssen HL, van Zonneveld M, Senturk H, Zeuzem S, Akarca US, Cakaloglu Y, Simon C, So TM, Gerken G, de Man RA. Pegylated interferon alfa-2b alone or in combination with lamivudine for HBeAg-positive chronic hepatitis B: a randomised trial. Lancet. 2005;365:123-129. [PubMed] [DOI] |
| 14. | Buster EH, Ter Borg MJ, Vingerling JR, Janssen HL. Low incidence of retinopathy during peginterferon alpha-2b and lamivudine therapy for chronic hepatitis B. J Hepatol. 2006;45:160-161; author reply 160-161. [PubMed] [DOI] |
| 15. | 杨 慧, 赵 龙凤, 赵 中夫, 张 国英, 刘 明社. 短发夹RNA介导的RNA干扰技术在HepG2.2.15细胞中的应用研究. 中国药物与临床. 2011;11:502-504, I0001. |
| 17. | McCarty DM, Young SM, Samulski RJ. Integration of adeno-associated virus (AAV) and recombinant AAV vectors. Annu Rev Genet. 2004;38:819-845. [PubMed] [DOI] |
| 18. | Shiau AL, Liu PS, Wu CL. Novel strategy for generation and titration of recombinant adeno-associated virus vectors. J Virol. 2005;79:193-201. [PubMed] [DOI] |
| 19. | Smith-Arica JR, Bartlett JS. Gene therapy: recombinant adeno-associated virus vectors. Curr Cardiol Rep. 2001;3:43-49. [PubMed] [DOI] |
| 20. | Daly TM. Overview of adeno-associated viral vectors. Methods Mol Biol. 2004;246:157-165. [PubMed] |
| 21. | Grieger JC, Samulski RJ. Adeno-associated virus as a gene therapy vector: vector development, production and clinical applications. Adv Biochem Eng Biotechnol. 2005;99:119-145. [PubMed] [DOI] |
| 22. | Małecki M, Woźniak A, Janik P. [Adeno-associated viruses (AAV)]. Postepy Biochem. 2008;54:57-63. [PubMed] |