修回日期: 2013-01-14
接受日期: 2013-01-18
在线出版日期: 2013-02-08
目的: 观察常氧与低氧下CagA+幽门螺杆菌(Helicobacter pylori, H. pylori)对人胃癌SGC7901细胞系低氧诱导因子-2α(hypoxia inducible factor-2alpha, HIF-2α)、ABCG2表达的影响, 初步探讨H. pylori在胃癌发生发展中的干细胞机制, 及其与肿瘤微环境低氧的协同作用.
方法: 内镜下采集胃黏膜标本, 行H. pylori培养并鉴定, PCR方法检测H. pylori CagA+基因. CagA+H. pylori与胃癌SGC7901细胞于常氧和低氧环境下共培养48 h(分常氧对照组、低氧对照组、常氧CagA+H. pylori组、低氧CagA+H. pylori组). 免疫细胞化学法检测HIF-2α和ABCG2蛋白的表达, RT-PCR法检测ABCG2 mRNA的表达.
结果: 免疫细胞化学结果显示: 常氧下胃癌SGC7901细胞HIF-2α、ABCG2蛋白呈低水平表达, 低氧和CagA+H. pylori均能显著诱导HIF-2α、ABCG2蛋白表达(与常氧对照组相比, 均P<0.01), 与低氧对照组和常氧CagA+H. pylori组相比, 低氧CagA+H. pylori组表达进一步升高(均P<0.01). 相关分析显示HIF-2α与ABCG2表达呈正相关(r = 0.976, P<0.05). RT-PCR检测ABCG2 mRNA表达结果与免疫细胞化学一致.
结论: CagA+H. pylori可刺激胃癌细胞HIF-2α、ABCG2表达, 低氧环境下其表达进一步增加, 表明CagA+H. pylori和低氧对HIF-2α、ABCG2的表达有协同作用. 提示CagA+H. pylori和低氧可能是诱导胃癌细胞干细胞化及化疗抵抗的重要原因.
引文著录: 张金花, 冯玉光, 高桂鹏, 陶元勇, 张小茜, 张红梅, 焦建新. 常氧与低氧下CagA+幽门螺杆菌对人胃癌SGC7901细胞系HIF-2α、ABCG2表达的影响. 世界华人消化杂志 2013; 21(4): 293-299
Revised: January 14, 2013
Accepted: January 18, 2013
Published online: February 8, 2013
AIM: To observe the effect of CagA+Helicobacter pylori (H. pylori) on the expression of HIF-2α and ABCG2 in human gastric cancer cell line SGC7901 under normoxia and hypoxia conditions to investigate whether H. pylori infection and the tumor microenvironment have a synergistic effect in the initiation and development of gastric cancer.
METHODS: Gastric mucosal biopsy specimens collected by endoscopy were cultured under microaerophilic conditions and H. pylori isolates were identified. CagA+H. pylori strains were confirmed by PCR. Gastric cancer cell line SGC7901 was co-cultured with a CagA+H. pylori strain for 48 h under either normoxia or hypoxia condition (cells were divided into a normoxia control group, a hypoxia control group, a normoxia plus CagA+H. pylori group, and a hypoxia plus CagA+H. pylori group). Immunocytochemistry was used to detect the expression of HIF-2α and ABCG2 proteins, and RT-PCR was used to detect the expression of ABCG2 mRNA.
RESULTS: Immunocytochemistry results showed that HIF-2α and ABCG2 proteins were expressed at low levels under normoxia, while both hypoxia and CagA+H. pylori could significantly induce the expression of HIF-2α and ABCG2 proteins compared to the normoxia control group (all P < 0.01). Compared to the hypoxia control group and normoxia plus CagA+H. pylori group, the expression of HIF-2α and ABCG2 proteins was further elevated in the hypoxia plus CagA+H. pylori group (all P < 0.01). There was a positive correlation between the expression of HIF-2α and that of ABCG2 (r = 0.976, P < 0.05). Similar results were obtained for ABCG2 mRNA expression by RT-PCR.
CONCLUSION: CagA+H. pylori can stimulate the expression of HIF-2α and ABCG2 in gastric cancer cells under normoxia condition, and their expression can be further up-regulated under hypoxia condition. CagA+H. pylori and hypoxia have a synergistic effect on the expression of HIF-2α and ABCG2, suggesting that CagA+H. pylori and hypoxia may play an important role in inducing gastric cancer cell de-differentiation and chemotherapy resistance.
- Citation: Zhang JH, Feng YG, Gao GP, Tao YY, Zhang XQ, Zhang HM, Jiao JX. Effects of CagA+Helicobacter pylori infection on expression of HIF-2α and ABCG2 in human gastric cancer cell line SGC7901 under normoxia and hypoxia conditions. Shijie Huaren Xiaohua Zazhi 2013; 21(4): 293-299
- URL: https://www.wjgnet.com/1009-3079/full/v21/i4/293.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i4.293
幽门螺杆菌(Helicobacter pylori, H. pylori)是定殖于胃黏膜的一种革兰氏阴性微需氧菌, 目前已确认为胃癌的Ⅰ类致癌因子, 其长期定殖于胃黏膜上皮, 并可进入细胞内生存, 引起胃黏膜的慢性炎症及胃黏膜上皮细胞的基因及表遗传学改变, 经过萎缩、肠化、不典型增生等阶段, 最终导致胃癌的发生, 是人类慢性炎症导致肿瘤的代表模型之一[1-4]. 细胞毒素相关蛋白A(cytotoxin-associated protein A , CagA)是H. pylori最主要毒力因子之一, CagA+H. pylori菌株与胃癌的关系更密切[2-5]. H. pylori致胃癌的分子机制取得了很大进展, 但确切机制仍需深入探索. 近年来, 随着肿瘤起源于肿瘤干细胞学说的提出, H. pylori致胃癌的干细胞机制研究成为热点[6-9]. 近年来, 肿瘤干细胞学说认为肿瘤起源于正常成体干细胞或成熟体细胞的干细胞化, 是肿瘤发生、发展、侵袭、转移、耐药及复发的根源[6]. 许多证据已显示肿瘤基因突变、环境因素及表遗传学改变可导致非干细胞的干细胞化[6]. 多项研究表明[10-13], 在胃癌的发生发展过程中, H. pylori可引起多条干细胞通路异常. 低氧微环境是多种实体肿瘤包括胃癌的特征之一, 是肿瘤发生发展、浸润转移、放化疗抵抗及复发的重要原因[14]. 肿瘤低氧与肿瘤干细胞的关系也是近年热点[15-19]. 研究表明, 低氧通过诱导低氧诱导因子-2α(hypoxia inducible factor-2alpha, HIF-2α)调控相关干细胞信号通路来维持干细胞的表型, 与肿瘤的干细胞化及化疗抵抗有关[20,21]. 作者推测, H. pylori和低氧作为胃癌的两种重要的环境因子, 可能对胃癌的发生发展起重要协同作用. ABCG2是新近发现的ABC半转运体超家族中的成员之一, 具有外排泵的作用, 是肿瘤干细胞的通用分子标志物, 其过表达是肿瘤复发、转移及产生耐药的重要原因[22-25]. 有研究表明[24,25], ABCG2是HIF-2α的靶基因之一, 可能是低氧下肿瘤干细胞化及化疗抵抗的重要原因. 本实验通过常氧与低氧下CagA+H. pylori与胃癌细胞共培养, 观察常氧与低氧下CagA+H. pylori对人胃癌SGC7901细胞系HIF-2α、ABCG2表达的影响, 初步探讨H. pylori在胃癌发生发展中的干细胞机制, 及其与肿瘤微环境低氧的协同作用.
人胃癌SGC7901细胞系购自山东省医学科学院; CagA+H. pylori菌株为本院一例慢性萎缩性胃炎患者胃黏膜标本培养所得; RPMI 1640培养基购自杭州四季青公司; 哥伦比亚琼脂购自英国Oxoid公司; 微需氧产气袋、厌氧培养罐购自日本三菱公司; 兔抗人ABCG2、HIF-2α多克隆抗体、SP-9000免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司; 细菌基因组DNA提取试剂盒购自北京艾德莱生物科技有限公司; PCR扩增试剂盒、M-MuLV第一链cDNA合成试剂盒购自上海生物技术有限公司等.
1.2.1 细菌培养及鉴定: 内镜下收集快速尿素酶试验阳性患者的胃黏膜组织, 研磨后接种于哥伦比亚血琼脂平板上, 置于厌氧培养罐微需氧条件(80 mL/L CO2, 70 mL/L O2, 850 mL/L N2)、37 ℃环境中培养3-5 d, 观察细菌菌落形态、进行革兰染色、并经尿素酶、过氧化氢酶、氧化酶等进行鉴定, PCR检测CagA基因.
1.2.2 细胞培养: 胃癌SGC7901细胞接种于RPMI 1640培养基(含10%小牛血清、青链霉素各100 U/mL), 置于37 ℃、50 mL/L CO2孵箱中常规培养及传代.
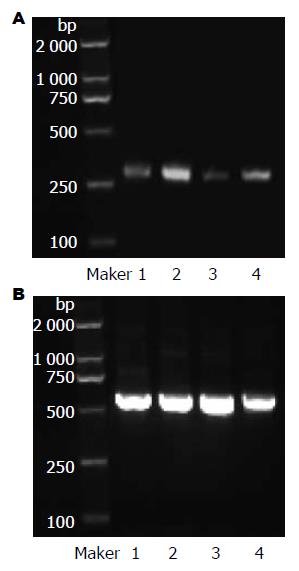
1.2.3 RT-PCR检测CagA+H. pylori对常氧与低氧下胃癌SGC7901细胞ABCG2 mRNA表达的影响: 胃癌SGC7901细胞置37 ℃、50 mL/L CO2培养箱内常规培养, 取对数生长期的细胞接种于6孔板中, 待细胞贴壁后换液, 按细菌和细胞100:1的比例将CagA+H. pylori加入到不含抗生素的培养基中. 设常氧对照组、常氧CagA+H. pylori组、低氧对照组、低氧CagA+H. pylori组. 分别于常氧下或厌氧培养罐(80 mL/L CO2, 70 mL/L O2, 850 mL/L N2)培养48 h收集细胞, TRIzol提取总RNA, 用M-MuLv逆转录酶试剂盒首先将mRNA逆转录成cDNA. 取反转录产物2 μL进行PCR扩增. 引物设计: 扩增ABCG2及β-actin mRNA部分片段的引物, 产物片段分别为311 bp与539 bp, 引物序列如下: ABCG2: 上游5'-GCGACCTGCCAATTTCAA AT-3', 下游5'-AGCCCAGTTGTAGGCTCATCCA-3'; β-actin: 上游5'-GTGGGGCGCCCCAGGCACCA-3', 下游 5'-CTCCTTAATGTCACGCACGATTTC-3'. 反应条件: 预变性94 ℃ 5 min; 变性94 ℃ 30 s, 退火β-actin 56.5 ℃、ABCG2 62 ℃ 30 s, 延伸72 ℃ 30 s, 扩增35个循环; 72 ℃总延伸10 min; 4 ℃保存. 1.5%琼脂糖凝胶电泳检测扩增结果. 应用Image J图像分析软件计算条带灰度值, 目的条带灰度值分别与相应β-actin灰度值相比, 即为其表达量.
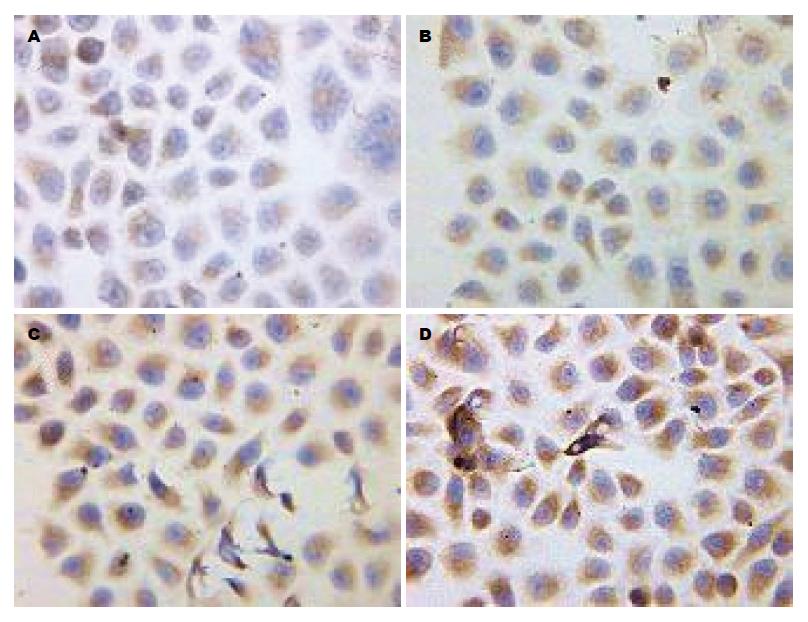
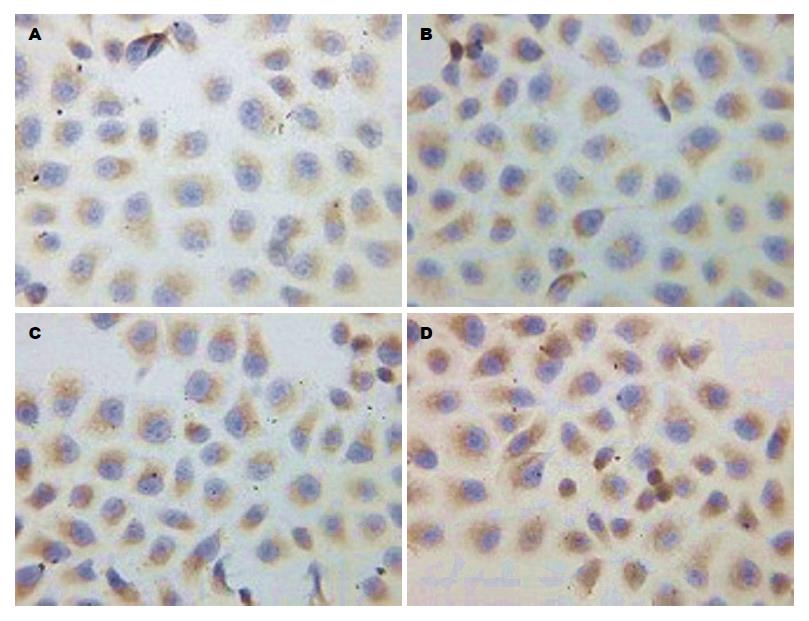
1.2.4 免疫细胞化学SP法检测CagA+H. pylori对常氧与低氧下胃癌SGC7901细胞HIF-2α及ABCG2蛋白表达的影响: 取对数生长期的SGC7901制成2×108/L的细胞悬液, 加入放有盖玻片的6孔板内, 待细胞贴壁后换液, 按细菌和细胞100:1的比例将CagA+H. pylori加入到不含抗生素的培养基中. 设常氧对照组、常氧CagA+H. pylori组、低氧对照组、低氧CagA+H. pylori组. 分别于常氧下或厌氧培养罐(80 mL/L CO2, 70 mL/L O2, 850 mL/L N2)培养48 h后取出细胞爬片, PBS冲洗, 冷丙酮固定15 min. 按SP-9000试剂盒步骤检测HIF-2α、ABCG2. 用已知阳性的乳腺癌切片作阳性对照, 以PBS代替一抗作阴性对照. 结果判定: HIF-2α的阳性结果为棕黄色颗粒, 主要位于细胞质, 细胞核中也有少量表达. ABCG2的阳性结果为细胞质内有棕黄色颗粒出现. 采用Image pro plus图像分析软件, 检测HIF-2α、ABCG2阳性细胞的平均吸光度(A)值, 以间接反映HIF-2α、ABCG2蛋白的表达量, 并取其均值.
统计学处理 定量资料的统计学描述采用mean±SD表示, 用统计学软件SPSS18.0进行数据处理. 组间比较用t检验, 两变量相关性用Pearson线性相关分析, P<0.05为差异具有统计学意义.
胃黏膜标本经培养、鉴定及CagA基因检测证实为CagA+H. pylori菌株.
常氧下胃癌SGC7901细胞ABCG2 mRNA呈低水平表达, 与单纯常氧对照组相比, 单纯低氧或CagA+H. pylori均能促进其表达, 差异具有统计学意义(t = 8.1914, 12.318, 均P<0.01); 与低氧对照组和常氧CagA+H. pylori组相比, 低氧CagA+H. pylori组表达进一步升高(t = 8.889, 10.518, 均P<0.01, 表1, 图1).
常氧下胃癌SGC7901细胞HIF-2α、ABCG2蛋白呈低水平表达, 与单纯常氧对照组相比, 低氧可显著促进HIF-2α、ABCG2表达(HIF-2α: t = 78.800; ABCG2: t = 16.319; 均P<0.01), CagA+H. pylori也能显著促进HIF-2α、ABCG2表达(HIF-2α: t = 85.909; ABCG2: t = 70.522; 均P<0.01); 与低氧对照组和常氧CagA+H. pylori组相比, 低氧CagA+H. pylori组表达进一步升高, 具有统计学差异(HIF-2α: t = 32.002、34.339; ABCG2: t = 14.113、17.900; 均P<0.01). HIF-2α与ABCG2表达呈正相关(r = 0.976,P<0.05, 表1, 图2, 3).
胃癌是消化系常见的恶性肿瘤之一, H. pylori长期感染引起胃黏膜慢性炎症, 是胃癌的重要病因之一[1-4]. H. pylori感染胃上皮细胞后, 激活核因子κB(nuclear factor κB, NF-κB)、AP-1、PI3K、STAT 3、Wnt/β-catenin和COX-2等肿瘤相关信号通路, H. pylori还诱导DNA甲基化和组蛋白乙酰化等表遗传学改变[2-4]. CagA蛋白是H. pylori最主要毒力因子之一, 其通过cag PAI编码的Ⅳ型分泌系统(T4SS)进入宿主细胞, 被Src蛋白家族酪氨酸激酶酪氨酸磷酸化后与酪氨酸磷酸酶SHP-2结合后, 刺激细胞分裂和增殖[2-4], CagA还可诱导胃癌细胞中钙调蛋白基因启动子区去甲基化修饰, 从而上调其表达, 与胃癌的发生密切相关[5]. H. pylori与胃癌干细胞关系的研究表明[6-9,10-13], 慢性H. pylori感染激活多条干细胞相关通路Wnt/β-catenin、Notch、FGF、Hedgehog和BMP表达增加.
肿瘤微环境低氧是多种实体瘤包括胃癌的特征之一, 低氧诱导因子家族(hypoxia inducible factors, HIFs)是低氧效应的关键分子. HIFs是一组由结构同源的α亚基和共同的β亚基组成的异源二聚体转录因子, 包括HIF-1、HIF-2和HIF-3. 其中α亚单位在蛋白水平受氧分压的密切调节, 低氧下稳定而常氧下迅速被泛素蛋白酶系统降解[14]. 已有研究证实, 低氧是正常干细胞壁龛(niche)的重要特征之一, 低氧通过诱导干细胞产生HIFs调控Notch、OCT-4、c-Myc、Nanog和Wnt/β-catenin等多条干细胞信号通路的表达, 维持干细胞未分化特征[15]. 近年研究发现[16-19], 低氧不但可以维持肿瘤干细胞的未分化状态, 还可以诱导非肿瘤干细胞的去分化, 可能是低氧下肿瘤放化疗抵抗和复发的根源. 既往对HIF-1α与肿瘤的关系研究较多, 最近研究发现[20,21], HIF-2α与肿瘤干细胞关系更密切. Pietras等[20]研究发现, HIF-2α能使神经嵴样人神经母细胞瘤起始细胞维持在未分化状态. Seidel等[21]发现, HIF-2α能调节胶质母细胞瘤干细胞表型. ABCG2是ABC转运蛋白超家族成员之一, 可外排多种化疗药物, 其高表达是肿瘤多药耐药的重要原因之一. 研究发现[22,23], 多种干细胞均高表达ABCG2, 其功能可能与保护干细胞免遭外源及内源毒素的侵害以维持干细胞的稳定性有关. 有研究发现[24,25], ABCG2是HIF-2α的直接靶基因, 可能是低氧诱导肿瘤细胞去分化的原因之一.
本实验通过常氧与低氧下CagA+H. pylori与胃癌细胞共培养, 观察常氧与低氧下CagA+H. pylori对人胃癌SGC7901细胞系HIF-2α、ABCG2表达的影响. 免疫细胞化学结果显示: 常氧下胃癌SGC7901细胞HIF-2α、ABCG2蛋白呈低水平表达, 低氧和CagA+H. pylori均能显著诱导HIF-2α、ABCG2蛋白表达, 与低氧对照组和常氧CagA+H. pylori组相比, 低氧CagA+H. pylori组表达进一步升高. 相关分析显示HIF-2α与ABCG2表达呈正相关. RT-PCR检测各组ABCG2 mRNA表达结果显示与免疫细胞化学结果一致. 说明CagA+H. pylori与低氧均可刺激胃癌细胞HIF-2α、ABCG2表达, 且二者有协同作用, 提示CagA+H. pylori和低氧可能通过激活HIF-2α-ABCG2通路诱导胃癌细胞干细胞化及化疗抵抗. 先前研究发现[26], H. pylori感染胃黏膜上皮可诱导氧自由基产生, 与胃癌的发生和发展有关. Park等[27]进一步研究发现常氧下H. pylori感染胃癌细胞后HIF-1α表达增加, 与氧自由基活性增加平行, 而氧自由基抑制剂则可在抑制氧自由基活性的同时抑制HIF-1α的表达. 本研究首次发现体外常氧下CagA+H. pylori可促进胃癌细胞HIF-2α蛋白表达, 可能也与氧自由基的作用有关, 有待进一步研究证实. 该结果与Griffiths等[28]的体内研究一致, 其在H. pylori致胃癌发生的动物模型中发现HIF-2α在H. pylori相关性胃炎、肠化、不典型增生、 肠型、弥漫型胃癌中均表达增高. 几项研究发现[29-31], 在H. pylori诱导胃癌过程中, 胃癌干细胞候选标志物Msi-1、CD44、Cytokeratin-7表达增加. 本研究首次发现常氧下CagA+H. pylori与胃癌细胞共培养后干细胞通用标志物ABCG2表达增加, 推测可能是通过HIF-2α-ABCG2通路促进其表达. 本研究结果提示: H. pylori通过HIF-2α-ABCG2途径促进胃癌干细胞化和多药耐药, 并与肿瘤低氧有协同作用, 是H. pylori促进胃癌发生发展的机制之一, 值得深入研究.
幽门螺杆菌(H. pylori)是胃癌的I类致癌因子, CagA是H. pylori的主要毒力因子之一, CagA+H. pylori菌株与胃癌的关系更密切. 低氧微环境是多种实体肿瘤包括胃癌的特征之一, 其通过诱导HIF-2α来维持干细胞的表型, 与肿瘤的干细胞化及化疗抵抗有关. H. pylori和低氧是胃癌的两种重要环境因子, 可能对胃癌的发生发展起重要的协同作用.
关玉盘, 教授, 首都医科大学附属北京朝阳医院消化科
随着肿瘤干细胞学说的提出, H. pylori致胃癌的干细胞机制研究成为热点. 低氧是多种实体肿瘤的特征之一, 但H. pylori在胃癌发生发展中的干细胞机制及其与肿瘤微环境低氧是否具有协同作用尚不清楚.
ABCG2是HIF-2α的直接靶基因之一. 低氧条件下通过诱导HIF-2α-ABCG2通路维持肿瘤的干细胞化及化疗抵抗. 近年来, H. pylori致胃癌的干细胞机制也成为研究的热点. 有研究表明, H. pylori在胃癌发生发展过程中可引起多条干细胞通路异常.
本研究通过探讨常氧与低氧下CagA+H. pylori对人胃癌SGC7901细胞系HIF-2α、ABCG2表达的影响, 证明CagA+H. pylori可诱导胃癌细胞HIF-2α、ABCG2表达, 并且CagA+H. pylori和低氧对HIF-2α、ABCG2的表达有协同作用, 提示CagA+H. pylori和低氧可能是诱导胃癌细胞干细胞化及化疗抵抗的重要原因.
本研究结果说明H. pylori和低氧可能是导致胃癌细胞干细胞化的重要原因, 提示根除H. pylori在防止胃癌的发生发展、侵袭转移、耐药及复发中具有重要作用, 值得进一步深入研究.
本文设计合理, 方法得当, 结果可信, 分析条理清晰, 结论具有基础研究和临床研究价值.
编辑: 李军亮 电编: 闫晋利
| 1. | Houghton J, Wang TC. Helicobacter pylori and gastric cancer: a new paradigm for inflammation-associated epithelial cancers. Gastroenterology. 2005;128:1567-1578. [PubMed] [DOI] |
| 2. | Ohnishi N, Yuasa H, Tanaka S, Sawa H, Miura M, Matsui A, Higashi H, Musashi M, Iwabuchi K, Suzuki M. Transgenic expression of Helicobacter pylori CagA induces gastrointestinal and hematopoietic neoplasms in mouse. Proc Natl Acad Sci USA. 2008;105:1003-1008. [PubMed] [DOI] |
| 3. | Correa P, Houghton J. Carcinogenesis of Helicobacter pylori. Gastroenterology. 2007;133:659-672. [PubMed] [DOI] |
| 4. | Ding SZ, Goldberg JB, Hatakeyama M. Helicobacter pylori infection, oncogenic pathways and epigenetic mechanisms in gastric carcinogenesis. Future Oncol. 2010;6:851-862. [PubMed] [DOI] |
| 6. | Wu XZ. Origin of cancer stem cells: the role of self-renewal and differentiation. Ann Surg Oncol. 2008;15:407-414. [PubMed] [DOI] |
| 7. | Pilpilidis I, Kountouras J, Zavos C, Katsinelos P. Upper gastrointestinal carcinogenesis: H. pylori and stem cell cross-talk. J Surg Res. 2011;166:255-264. [PubMed] [DOI] |
| 8. | Saikawa Y, Fukuda K, Takahashi T, Nakamura R, Takeuchi H, Kitagawa Y. Gastric carcinogenesis and the cancer stem cell hypothesis. Gastric Cancer. 2010;13:11-24. [PubMed] [DOI] |
| 9. | Sell S. Infection, stem cells and cancer signals. Curr Pharm Biotechnol. 2011;12:182-188. [PubMed] [DOI] |
| 10. | Katoh M. Dysregulation of stem cell signaling network due to germline mutation, SNP, Helicobacter pylori infection, epigenetic change and genetic alteration in gastric cancer. Cancer Biol Ther. 2007;6:832-839. [PubMed] [DOI] |
| 11. | Martin J, Donnelly JM, Houghton J, Zavros Y. The role of sonic hedgehog reemergence during gastric cancer. Dig Dis Sci. 2010;55:1516-1524. [PubMed] [DOI] |
| 12. | Gnad T, Feoktistova M, Leverkus M, Lendeckel U, Naumann M. Helicobacter pylori-induced activation of beta-catenin involves low density lipoprotein receptor-related protein 6 and Dishevelled. Mol Cancer. 2010;9:31. [PubMed] [DOI] |
| 13. | Hung KH, Wu JJ, Yang HB, Su LJ, Sheu BS. Host Wnt/beta-catenin pathway triggered by Helicobacter pylori correlates with regression of gastric intestinal metaplasia after H. pylori eradication. J Med Microbiol. 2009;58:567-576. [PubMed] [DOI] |
| 14. | Bertout JA, Patel SA, Simon MC. The impact of O2 availability on human cancer. Nat Rev Cancer. 2008;8:967-975. [PubMed] [DOI] |
| 15. | Zhang J, Li L. Stem cell niche: microenvironment and beyond. J Biol Chem. 2008;283:9499-9503. [PubMed] [DOI] |
| 16. | Heddleston JM, Li Z, Lathia JD, Bao S, Hjelmeland AB, Rich JN. Hypoxia inducible factors in cancer stem cells. Br J Cancer. 2010;102:789-795. [PubMed] [DOI] |
| 17. | Axelson H, Fredlund E, Ovenberger M, Landberg G, Påhlman S. Hypoxia-induced dedifferentiation of tumor cells--a mechanism behind heterogeneity and aggressiveness of solid tumors. Semin Cell Dev Biol. 2005;16:554-563. [PubMed] [DOI] |
| 18. | Das B, Tsuchida R, Malkin D, Koren G, Baruchel S, Yeger H. Hypoxia enhances tumor stemness by increasing the invasive and tumorigenic side population fraction. Stem Cells. 2008;26:1818-1830. [PubMed] [DOI] |
| 19. | Heddleston JM, Li Z, McLendon RE, Hjelmeland AB, Rich JN. The hypoxic microenvironment maintains glioblastoma stem cells and promotes reprogramming towards a cancer stem cell phenotype. Cell Cycle. 2009;8:3274-3284. [PubMed] [DOI] |
| 20. | Pietras A, Hansford LM, Johnsson AS, Bridges E, Sjölund J, Gisselsson D, Rehn M, Beckman S, Noguera R, Navarro S. HIF-2alpha maintains an undifferentiated state in neural crest-like human neuroblastoma tumor-initiating cells. Proc Natl Acad Sci USA. 2009;106:16805-16810. [PubMed] [DOI] |
| 21. | Seidel S, Garvalov BK, Wirta V, von Stechow L, Schänzer A, Meletis K, Wolter M, Sommerlad D, Henze AT, Nistér M. A hypoxic niche regulates glioblastoma stem cells through hypoxia inducible factor 2 alpha. Brain. 2010;133:983-995. [PubMed] [DOI] |
| 22. | Zhou S, Schuetz JD, Bunting KD, Colapietro AM, Sampath J, Morris JJ, Lagutina I, Grosveld GC, Osawa M, Nakauchi H. The ABC transporter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the side-population phenotype. Nat Med. 2001;7:1028-1034. [PubMed] [DOI] |
| 23. | Scharenberg CW, Harkey MA, Torok-Storb B. The ABCG2 transporter is an efficient Hoechst 33342 efflux pump and is preferentially expressed by immature human hematopoietic progenitors. Blood. 2002;99:507-512. [PubMed] [DOI] |
| 24. | Martin CM, Ferdous A, Gallardo T, Humphries C, Sadek H, Caprioli A, Garcia JA, Szweda LI, Garry MG, Garry DJ. Hypoxia-inducible factor-2alpha transactivates Abcg2 and promotes cytoprotection in cardiac side population cells. Circ Res. 2008;102:1075-1081. [PubMed] [DOI] |
| 25. | Krishnamurthy P, Ross DD, Nakanishi T, Bailey-Dell K, Zhou S, Mercer KE, Sarkadi B, Sorrentino BP, Schuetz JD. The stem cell marker Bcrp/ABCG2 enhances hypoxic cell survival through interactions with heme. J Biol Chem. 2004;279:24218-24225. [PubMed] [DOI] |
| 26. | Bagchi D, Bhattacharya G, Stohs SJ. Production of reactive oxygen species by gastric cells in association with Helicobacter pylori. Free Radic Res. 1996;24:439-450. [PubMed] [DOI] |
| 27. | Park JH, Kim TY, Jong HS, Kim TY, Chun YS, Park JW, Lee CT, Jung HC, Kim NK, Bang YJ. Gastric epithelial reactive oxygen species prevent normoxic degradation of hypoxia-inducible factor-1alpha in gastric cancer cells. Clin Cancer Res. 2003;9:433-440. [PubMed] |
| 28. | Griffiths EA, Pritchard SA, McGrath SM, Valentine HR, Price PM, Welch IM, West CM. Hypoxia-associated markers in gastric carcinogenesis and HIF-2alpha in gastric and gastro-oesophageal cancer prognosis. Br J Cancer. 2008;98:965-973. [PubMed] [DOI] |
| 29. | Murata H, Tsuji S, Tsujii M, Nakamura T, Fu HY, Eguchi H, Asahi K, Okano H, Kawano S, Hayashi N. Helicobacter pylori infection induces candidate stem cell marker Musashi-1 in the human gastric epithelium. Dig Dis Sci. 2008;53:363-369. [PubMed] [DOI] |
| 30. | Jang BI, Li Y, Graham DY, Cen P. The Role of CD44 in the Pathogenesis, Diagnosis, and Therapy of Gastric Cancer. Gut Liver. 2011;5:397-405. [PubMed] [DOI] |
| 31. | Kirchner T, Müller S, Hattori T, Mukaisyo K, Papadopoulos T, Brabletz T, Jung A. Metaplasia, intraepithelial neoplasia and early cancer of the stomach are related to dedifferentiated epithelial cells defined by cytokeratin-7 expression in gastritis. Virchows Arch. 2001;439:512-522. [PubMed] [DOI] |