修回日期: 2013-10-23
接受日期: 2013-11-06
在线出版日期: 2013-12-18
目的: 研究自身免疫性肝炎(autoimmune hepatitis, AIH)患者外周血淋巴细胞亚群的表达及与肝功能, 免疫球蛋白和肝脏炎性活动指数(hepatitis activity index, HAI)的相关性, 探讨在AIH诊断及治疗中的意义.
方法: 选择确诊且未经治疗的AIH患者36例, 为AIH组; 36例健康者为对照组. 分别检测肝功能、免疫球蛋白, AIH组行肝穿刺检查, 评价肝脏炎症活动性. 流式细胞术检测外周血淋巴细胞亚群的比率, 并与肝功能、免疫球蛋白及HAI评分进行相关性分析.
结果: AIH组外周血CD3+CD4+ T, CD3+CD8+ T, CD19+ B, CD5+CD19+ B比率及CD3+CD4+ T/CD3+CD8+ T, CD5+CD19+ B/CD19+ B比值明显高于对照组, 差异有统计学意义(P<0.05); CD4+CD25+CD127dim T比率较对照组, 差异无统计学意义. AIH组CD3+CD4+ T, CD3+CD8+ T, CD5+CD19+ B比率分别与丙氨酸氨基转移酶、天冬氨酸氨基转移酶及HAI评分呈正相关; CD5+CD19+ B比率与免疫球蛋白G呈正相关(r = 0.482, P<0.01).
结论: 淋巴细胞亚群的异常表达是导致肝脏炎症损伤加重的直接因素, 细胞免疫与肝脏炎性损伤的关系更为密切; 调节性T细胞在AIH中的免疫抑制作用或许不明显.
核心提示: 既往研究认为具有免疫负调节作用的调节性T细胞(regulatory T cells, Tregs)在自身免疫性肝炎(autoimmune hepatitis, AIH)患者体内的低表达进一步加重肝脏炎症损伤. 而本研究发现AIH患者外周血Tregs的表达并无明显下调, 这可能是由于免疫微环境的改变, 又或者是Tregs参与了机体的抗炎反应, 而非免疫抑制作用.
引文著录: 肖锐, 陈楠, 方维丽, 周璐, 张洁, 李姝, 郑忠青, 王邦茂, 刘文天. 自身免疫性肝炎患者外周血淋巴细胞亚群的异常表达. 世界华人消化杂志 2013; 21(35): 4006-4013
Revised: October 23, 2013
Accepted: November 6, 2013
Published online: December 18, 2013
AIM: To investigate the abnormal changes in peripheral blood lymphocyte subsets in patients with autoimmune hepatitis and to analyze their correlations with liver dysfunction, immunoglobulin (Ig) and hepatitis activity index (HAI) to explore the significance of abnormal lymphocyte subsets in the diagnosis and treatment of autoimmune hepatitis (AIH).
METHODS: Thirty-six patients who were diagnosed with AIH and did not accept prior immunosuppressive therapy were included. Thirty-six healthy subjects were used as controls. Patients in both groups received tests of liver function and immune function. Liver biopsy and histopathological examination were carried out to evaluate HAI score for AIH patients. The subsets of T lymphocytes, B lymphocytes and regulatory T cells (Tregs) were detected by flow cytometry (FCM). Correlations between the percentages of lymphocyte subgroups and liver function, Ig and HAI score were evaluated.
RESULTS: The percentages of CD3+CD4+ T, CD3+CD8+ T, CD19+ B,CD5+CD19+ B and the ratios of CD3+CD4+ T/CD3+CD8+ T and CD5+CD19+ B/CD19+ B cells were all significantly higher in AIH patients than in controls (all P < 0.05). However, there was no statistical significance in the percentage of CD4+CD25+CD127dim Tregs between the two groups. The percentages of CD3+CD4+ T, CD3+CD8+ T, and CD5+CD19+ B cells had a positive correlation with serum levels of alanine aminotransferase, aspartate aminotransferase and HAI score. The percentage of CD5+CD19+ B cells was positively related to IgG (r = 0.482, P < 0.01).
CONCLUSION: In AIH patients, abnormal peripheral blood T and B lymphocyte subsets may lead to the aggravation of liver injury. Cellular immunity mediated by T lymphocyte subsets may be more closely related to liver injury and hepatic inflammatory activity. Immuno-regulatory effect of regulatory T cells may not be obvious in AIH patients.
- Citation: Xiao R, Chen N, Fang WL, Zhou L, Zhang J, Li S, Zheng ZQ, Wang BM, Liu WT. Abnormal peripheral blood lymphocyte subsets in patients with autoimmune hepatitis. Shijie Huaren Xiaohua Zazhi 2013; 21(35): 4006-4013
- URL: https://www.wjgnet.com/1009-3079/full/v21/i35/4006.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i35.4006
自身免疫性肝炎(autoimmune hepatitis, AIH)是一种病因不明、病理机制复杂的慢性炎症性疾病, 主要表现为肝功能异常、免疫球蛋白升高、多种自身抗体阳性和特异性的肝组织病理学异常改变[1,2], 其主要发病机制与遗传易感性、环境促发因素、抗原交叉反应及免疫功能异常密切相关. 目前研究认为, 导致AIH肝损伤的免疫调节过程复杂, 可能由细胞免疫和体液免疫共同介导[3], 而淋巴细胞亚群的表达可能在其中发挥着重要的作用, 然而, 淋巴细胞亚群的异常表达如何参与AIH发病的机制尚无定论. 另外, 具有免疫抑制功能的调节性T细胞(regulatory T cells, Tregs)在肝损伤过程中如何发挥作用目前还不明确. 因此, 本研究就AIH患者外周血T、B淋巴细胞亚群的表达进行检测, 并与肝功能指标、免疫球蛋白以及肝脏炎症活动性指数(hepatitis activity index, HAI)进行相关性分析, 以探讨T、B淋巴细胞亚群及Tregs是如何参与肝细胞的自身免疫损伤, 为今后AIH的临床诊断及治疗提供新的依据.
选择2011-04/2012-12在本院就诊的AIH患者36例, 为AIH组, 女性31例, 男性5例, 平均年龄61岁±10.5岁, 其诊断参照2002年美国肝病学会修订发表的AIH诊断标准及评分标准(Czaja and Freese, 2002)[4]. 选择健康志愿者36例为正常对照组, 女性28例, 男性8例, 平均年龄44.3岁±13.6岁. 两组间年龄、性别比较无差异. 分别采集两组研究对象清晨空腹时的外周静脉血, 进行肝功能、免疫球蛋白和淋巴细胞亚群检测. AIH组肝穿刺活检以进行病理学检查, 参照Knodell评分系统[5]进行肝脏炎症活动性评价. 实验器材及试剂准备: 实验采用全自动生物化学分析仪(Olympus AU5400系统)检测肝功能指标: 丙氨酸氨基转移酶(alanine aminotransferase, ALT), 天冬氨酸氨基转移酶(aspartate aminotransferase, AST), γ-谷胺酰转移酶(γ-glutamyltransferase, γ-GT), 碱性磷酸酶(alkaline phosphatase, ALP), 总胆红素(total bilirubin, TBiL), 直接胆红素(direct bilirubin, DBiL); 罗氏(Roche)E170电化学发光法检测免疫球蛋白A(immunoglobulin A, IgA), IgG和IgM; FACSCA型流式细胞仪(Becton, Dickinson and Company, NewYork, USA)检测T、B淋巴细胞亚群; 所用试剂包括: PERCP-CD3/FITC-CD4/PE-CD8试剂盒、APC-CD19抗体、FITC-CD5抗体、PE-CD4抗体、FITC-CD25抗体、APC-CD127抗体和溶血素, 均购自美国BD公司(Becton, Dickinson and Company, NewYork, USA).
采用流式细胞术检测T、B淋巴细胞亚群, 应用Cell-Quest软件分析其表达情况. 分别采集AIH组与对照组的外周血约2 mL, 加入肝素抗凝, 备用. (1)T淋巴细胞亚群检测: 取外周血100 μL, 加入CD3、CD4、CD8抗体20 μL, 置室温避光孵育20 min, 加入溶血素400 μL, 混匀, 上机分析; (2)B淋巴细胞亚群检测: 取外周血100 μL, 分别加入CD19、 CD5抗体各20 μL, 置室温避光孵育15 min, 溶血素1 mL, 1500 r/min离心5 min, 弃上清液, 加入1 mL PBS混匀, 1500 r/min, 离心5 min, 弃上清液, 加入300 μL PBS, 混匀, 上机分析; (3) 调节性T细胞检测: 取外周血100 μL, 分别加入CD4、CD25、 CD127抗体各20 μL, 室温避光孵育15 min, 加入溶血素1 mL, 1500 r/min离心5 min, 弃上清液, 加入1 mL PBS混匀, 1500 r/min, 离心5 min, 弃上清液, 加入300 μL PBS, 混匀, 上机分析.
统计学处理 采用SPSS19.0统计学软件进行数据分析, 所获计量资料均经正态性及方差齐性检验, 采用两个独立样本均数的t检验, 相关性分析采用Bivariate Correlations分析; P<0.05为差异有统计学意义.
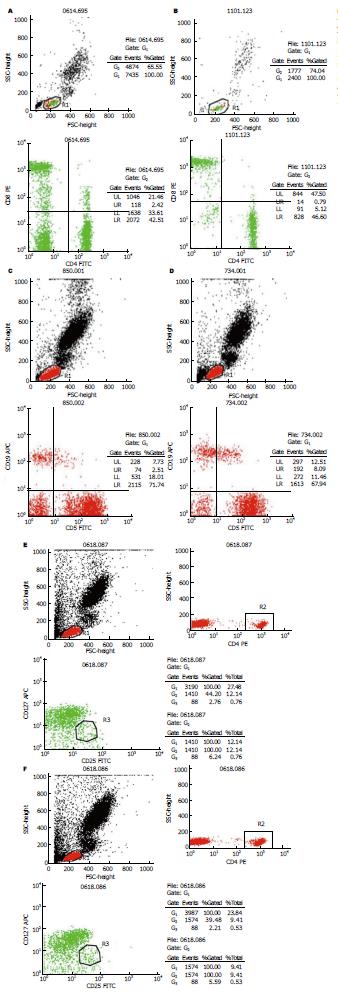
AIH组外周血CD3+CD4+ T, CD3+CD8+ T, CD19+ B, CD5+CD19+ B比率以及CD3+CD4+ T/CD3+CD8+ T, CD5+CD19+ B/CD19+ B比值均明显高于对照组, 差异有统计学意义(P<0.05); AIH组外周血CD3+ T, CD4+CD25+CD127dim T比率与对照组相比, 差异无统计学意义(表1, 图1A-F).
| AIH组 | 对照组 | t值 | P值 | |
| CD3+ T | 61.820±11.935 | 64.739±7.615 | -1.237 | 0.220 |
| CD3+CD4+ T | 46.952±21.107 | 35.322±3.408 | 3.264 | 0.002a |
| CD3+CD8+ T | 33.288±11.308 | 25.245±3.076 | 4.118 | 0.000a |
| CD3+CD4+ T/CD3+CD8+ T | 1.592±0.356 | 1.421±0.178 | 2.572 | 0.012a |
| CD19+ B | 13.510±5.536 | 9.940±1.207 | 3.780 | 0.000a |
| CD5+CD19+ B | 8.448±6.089 | 2.840±0.915 | 4.073 | 0.000a |
| CD5+CD19+ B/CD19+ B | 0.776±0.652 | 0.294±0.100 | 3.262 | 0.000a |
| CD4+CD25+CD127dim T | 5.586±2.170 | 6.094±1.363 | -0.886 | 0.382 |
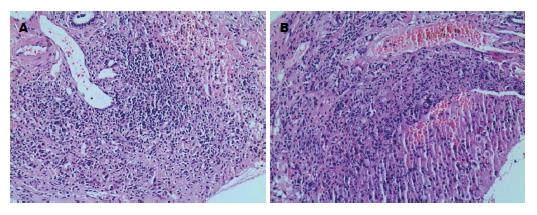
AIH组肝功能中ALT、AST、γ-GT、TBiL和DBiL与对照组相比明显升高, 差异有统计学意义(P<0.05), 免疫球蛋白检测结果示IgG明显高于对照组, 差异有统计学意义(P<0.05), 而ALP、IgM、IgA两组相比差异无统计学意义(表2); AIH患者行肝穿刺病理学检查, 分别从汇管区坏死、小叶内炎症、门静脉炎症以及肝纤维化四个方面评价肝组织炎症活动程度, 以HAI评分(0-22分)表示(图2).
| AIH组 | 对照组 | t值 | P值 | |
| 丙氨酸氨基转移酶(U/L) | 180.917±175.525 | 26.111±10.959 | 5.281 | 0.000a |
| 天冬氨酸氨基转移酶(U/L) | 169.861±171.128 | 22.889±8.905 | 5.146 | 0.000a |
| 碱性磷酸酶(U/L) | 189.300±38.097 | 90.850±35.513 | 8.454 | 0.754 |
| γ-谷胺酰转移酶(U/L) | 148.000±39.618 | 31.600±16.291 | 12.152 | 0.000a |
| 总胆红素(μmol/L) | 87.880±114.881 | 13.900±10.897 | 2.867 | 0.007a |
| 直接胆红素(μmol/L) | 59.965±83.909 | 5.585±4.157 | 2.895 | 0.006a |
| 免疫球蛋白G(mg/dl) | 1740.278±652.731 | 1154.639±309.144 | 4.865 | 0.000a |
| 免疫球蛋白M(mg/dl) | 141.125±63.042 | 165.200±90.233 | -0.978 | 0.334 |
| 免疫球蛋白A(mg/dl) | 284.100±176.027 | 229.000±119.162 | 1.158 | 0.254 |
| 炎性活动指数(F) | 5.222±2.030 |
2.3.1 T细胞亚群改变与肝功能、免疫球蛋白及HAI评分的相关性分析: AIH患者的T细胞亚群CD3+CD4+ T比率分别与肝功能指标ALT、AST呈正相关(r分别为0.860, 0.826, P<0.01), CD3+CD8+ T比率分别与ALT、AST呈正相关 (r分别为0.884, 0.863, P<0.01); 并且CD3+CD4+ T, CD3+CD8+ T比率与HAI评分呈正相关(r分别为0.738, 0.769, P<0.01). 而CD3+CD4+ T、CD3+CD8+ T比率与ALP、γ-GT、TBiL、DBiL则无相关性.
2.3.2 B细胞亚群改变与肝功能、免疫球蛋白及HAI评分的相关性分析: AIH患者的B细胞亚群CD5+CD19+ B比率分别与肝功能指标中的ALT、AST呈正相关(r分别为0.577, 0.642, P<0.05), 与ALP、γ-GT、TBiL、DBiL无相关性;与HAI评分也呈正相关(r = 0.334, P<0.05); 与血清IgG呈正相关(r = 0.482, P<0.01), 但与IgM、IgA则无相关性.
Liberal等[6]在综述了近年来有关AIH发病相关免疫机制的研究后发现, 肝脏受损伤的可能途径为: 肝细胞表达的人类白细胞抗原Ⅱ(human leukocyte antigen-Ⅱ, HLA-Ⅱ)类分子与自身抗原形成复合物, 由抗原递呈细胞递呈至辅助性T细胞(T-helper, Th)Th0, 经诱导分化为Th1、Th2. Th1分泌细胞因子增强HLA-Ⅰ类分子的表达, 刺激细胞毒性T细胞(cytotoxic T lymphocyte, CTL)增殖并分化, 发挥细胞毒作用杀伤肝细胞. Th2分泌细胞因子诱导B细胞增殖分化为浆细胞产生自身抗体, 加重肝细胞损伤. 本研究发现AIH患者外周血T、B淋巴细胞亚群CD3+CD4+ T、CD3+CD8+ T、CD19+ B、CD5+CD19+ B的表达较正常人明显增多, 他们分别反映了初始Th0、CTL、初始B细胞和浆细胞活化增殖水平的相应提高.活化后的CD3+CD4+ T经诱导分化为Th1和Th2, Th1刺激CD3+CD8+ T发挥细胞毒作用杀伤肝细胞, 主要参与细胞免疫和炎症反应; Th2诱导CD19+ B增殖分化为CD5+CD19+ B, 后者分泌自身抗体参与肝脏自身免疫反应. 这一研究结果与上述文献的观点一致, AIH患者外周血T、B淋巴细胞亚群的表达增多, 其介导的细胞免疫和体液免疫应答也相应增强, 因而淋巴细胞亚群的异常表达在AIH发病及肝损伤过程中可能发挥重要作用.
Tregs是一类具有独立功能的T细胞亚群, 主要通过抑制CD4+ T、CD8+ T的活化与增殖, 发挥免疫负调节作用. 有研究报道患者体内Tregs数量的减少和/或功能的减低可能导致免疫应答的紊乱, 与AIH发病有关[7,8]. 而本研究发现AIH患者外周血CD4+CD25+CD127dim Tregs比率较正常人无明显减低. 近年研究发现[9-12], 在某些自身免疫性疾病中, Tregs的数量及功能并未减少或缺失, 甚至随着组织器官炎性程度的增加呈增高趋势. 一方面可能由于特定的免疫微环境阻止了Tregs的免疫抑制功能[13], 另一方面可能由于Tregs随血液循环迁移到炎症部位后大量增殖, 以对抗炎症反应, 而非参与免疫负调节[11]. 而在AIH患者体内是否也存在类似的机制则有待进一步的证实.
临床评价肝功能的指标主要有ALT、AST、ALP、γ-GT、TBiL和DBiL, 他们能较敏感的提示肝细胞损伤的严重程度. AIH主要以血清ALT, AST升高为主, ALP、γ-GT、TBiL和DBiL可轻度升高, 诊断AIH时ALP/AST(或ALT)<1.5对确诊更有意义[4]. 本研究将AIH组淋巴细胞亚群分别与异常的肝功能指标进行相关性分析, CD3+CD4+ T、CD3+CD8+ T、CD5+CD19+ B比率分别与ALT、AST呈正相关, 其中CD3+CD4+ T、CD3+CD8+ T与ALT、AST的相关性更好, 进一步提示T淋巴细胞亚群的异常活化可能与肝细胞损伤及坏死有关, 因而导致血清肝功能指标ALT、AST升高明显. 相关性分析还发现, CD5+CD19+ B比率与IgG呈正相关, 与IgM和IgA无相关性, 这表明异常活化的CD5+CD19+ B能够分泌以IgG为主的单反应性、高亲和力的自身抗体[14], 从而介导体内持续的免疫应答. 另外, HAI评分作为衡量AIH肝组织病理学改变的指标, 从汇管区坏死、小叶内炎症、门静脉炎症以及肝纤维化4个方面针对肝组织炎症活动程度进行评价, 分数越高, 肝脏炎症反应程度越重. AIH患者淋巴细胞亚群CD3+CD4+ T、CD3+CD8+ T、CD5+CD19+ B比率与HAI评分呈正相关, 并且CD3+CD4+ T、CD3+CD8+ T与HAI评分相关性更好. 因此, 这一研究结果提示T淋巴细胞亚群介导的细胞免疫可能与AIH肝脏炎症活动性的关系更为密切.
总之, AIH的发病及肝损伤是由细胞免疫和体液免疫共同参与的. 目前针对AIH的诊断, 仍缺乏敏感性及特异性高的实验室指标, 本研究通过测定AIH患者外周血T、B淋巴细胞亚群的表达, 并结合异常的临床指标进行相关性研究后发现, 淋巴细胞亚群的异常活化是导致肝脏炎症损伤加重的直接因素, 其中T淋巴细胞亚群介导的细胞免疫与肝损伤及炎症活动性的关系更加密切, 但具有免疫抑制功能的调节性T细胞在AIH中的作用或许不明显. 因此, 对于诊断及治疗困难的AIH患者, 可以通过细胞免疫检测手段, 例如检测其淋巴细胞亚群的表达情况, 从而提高AIH的诊断效能, 并采用药物或细胞制剂诱导相关亚群表达下调[15,16], 从而抑制肝脏免疫炎症反应. 随着免疫学及分子生物学的发展, AIH的病因及发病机制将会得到深入了解, 相应的治疗学也会更加丰富与完善.
自身免疫性肝炎(autoimmune hepatitis, AIH)的病因及发病机制复杂. 细胞免疫和体液免疫共同参与了AIH的肝损伤, 迄今为止已经发现了多种T、B淋巴细胞亚群, 他们在AIH的发生, 发展及肝损伤过程中所起的作用各不相同.
陈积圣, 教授, 中山大学孙逸仙纪念医院肝胆外科
T、B淋巴细胞与AIH的免疫炎症反应具有密切关系. 目前研究发现T、B淋巴细胞具有多种不同功能的亚群, 各亚群对AIH发生和发展的影响越来越受到重视, 而调节性T细胞在AIH中的免疫调节作用还有待深入研究.
目前研究认为AIH的免疫炎症反应是由细胞免疫和体液免疫共同介导的, 细胞免疫与肝损伤的关系更为密切. 近年来, 调节性T细胞在AIH中的作用备受关注. 淋巴细胞亚群参与AIH免疫损伤的认识不断得到巩固和更新, 为AIH的临床诊疗也提供了新的依据.
通过本文可了解AIH患者外周血T、B淋巴细胞亚群的异常表达情况, 并结合异常的临床指标及肝组织病理学改变, 进一步明确肝损伤的机制, 为今后AIH的临床诊断及治疗提供新的思路.
本文选题较先进, 技术路线设计合理, 具有一定的学术价值.
编辑: 田滢 电编:鲁亚静
| 1. | Malekzadeh Z, Haghazali S, Sepanlou SG, Vahedi H, Merat S, Sotoudeh M, Nasseri-Moghaddam S, Malekzadeh R. Clinical features and long term outcome of 102 treated autoimmune hepatitis patients. Hepat Mon. 2012;12:92-99. [PubMed] [DOI] |
| 2. | Zachou K, Muratori P, Koukoulis GK, Granito A, Gatselis N, Fabbri A, Dalekos GN, Muratori L. Review article: autoimmune hepatitis -- current management and challenges. Aliment Pharmacol Ther. 2013;38:887-913. [PubMed] [DOI] |
| 3. | Manns MP, Vogel A. Autoimmune hepatitis, from mechanisms to therapy. Hepatology. 2006;43:S132-S144. [PubMed] [DOI] |
| 4. | Czaja AJ, Freese DK. Diagnosis and treatment of autoimmune hepatitis. Hepatology. 2002;36:479-497. [PubMed] [DOI] |
| 5. | Knodell RG, Ishak KG, Black WC, Chen TS, Craig R, Kaplowitz N, Kiernan TW, Wollman J. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis. Hepatology. 1981;1:431-435. [PubMed] [DOI] |
| 6. | Liberal R, Longhi MS, Mieli-Vergani G, Vergani D. Pathogenesis of autoimmune hepatitis. Best Pract Res Clin Gastroenterol. 2011;25:653-664. [PubMed] [DOI] |
| 7. | Longhi MS, Liberal R, Holder B, Robson SC, Ma Y, Mieli-Vergani G, Vergani D. Inhibition of interleukin-17 promotes differentiation of CD25 cells into stable T regulatory cells in patients with autoimmune hepatitis. Gastroenterology. 2012;142:1526-35.e6. [PubMed] [DOI] |
| 8. | Longhi MS, Mitry RR, Samyn M, Scalori A, Hussain MJ, Quaglia A, Mieli-Vergani G, Ma Y, Vergani D. Vigorous activation of monocytes in juvenile autoimmune liver disease escapes the control of regulatory T-cells. Hepatology. 2009;50:130-142. [PubMed] [DOI] |
| 9. | Buckner JH. Mechanisms of impaired regulation by CD4(+)CD25(+)FOXP3(+) regulatory T cells in human autoimmune diseases. Nat Rev Immunol. 2010;10:849-859. [PubMed] |
| 10. | Sasaki M, Ikeda H, Sawada S, Sato Y, Nakanuma Y. Naturally-occurring regulatory T cells are increased in inflamed portal tracts with cholangiopathy in primary biliary cirrhosis. J Clin Pathol. 2007;60:1102-1107. [PubMed] [DOI] |
| 11. | Peiseler M, Sebode M, Franke B, Wortmann F, Schwinge D, Quaas A, Baron U, Olek S, Wiegard C, Lohse AW. FOXP3+ regulatory T cells in autoimmune hepatitis are fully functional and not reduced in frequency. J Hepatol. 2012;57:125-132. [PubMed] [DOI] |
| 12. | Sakaki M, Hiroishi K, Baba T, Ito T, Hirayama Y, Saito K, Tonoike T, Kushima M, Imawari M. Intrahepatic status of regulatory T cells in autoimmune liver diseases and chronic viral hepatitis. Hepatol Res. 2008;38:354-361. [PubMed] [DOI] |
| 13. | Wiegard C, Frenzel C, Herkel J, Kallen KJ, Schmitt E, Lohse AW. Murine liver antigen presenting cells control suppressor activity of CD4+CD25+ regulatory T cells. Hepatology. 2005;42:193-199. [PubMed] [DOI] |
| 14. | Burastero SE, Casali P, Wilder RL, Notkins AL. Monoreactive high affinity and polyreactive low affinity rheumatoid factors are produced by CD5+ B cells from patients with rheumatoid arthritis. J Exp Med. 1988;168:1979-1992. [PubMed] [DOI] |
| 15. | Czaja AJ. Challenges in the diagnosis and management of autoimmune hepatitis. Can J Gastroenterol. 2013;27:531-539. [PubMed] |
| 16. | Czaja AJ. Promising pharmacological, molecular and cellular treatments of autoimmune hepatitis. Curr Pharm Des. 2011;17:3120-3140. [PubMed] [DOI] |