修回日期: 2013-10-22
接受日期: 2013-10-31
在线出版日期: 2013-12-18
目的: 探讨薯蓣皂苷元(diosgenin, Dio)对人食管癌Eca109细胞的增殖、凋亡、迁移和侵袭的影响以及其作用机制.
方法: MTT和Transwell实验检测薯蓣皂苷元对肿瘤细胞的增殖、凋亡、迁移和侵袭的影响. Western blot检测薯蓣皂苷元处理后的Eca109细胞丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路中c-jun氨基末端应激活化蛋白激酶(c-Jun N-terminal of stress-activated protein kinase, JNK), 细胞外信号调节激酶(extracellular signal-regulated kinase, Erk1/2)和p38丝裂原激活蛋白激酶(p38 mitogen-activated protein kinase, p38)的蛋白表达水平.
结果: 食管癌Eca109细胞经过50 μg/mL的薯蓣皂苷元处理48 h后, 与未经药物处理的对照组相比, 细胞的增殖、迁移(16.54 vs 34.12, P<0.05)和侵袭(9.42 vs 26.99, P<0.05)效应显著下降, 细胞的凋亡效应明显增加(0.24 vs 0.64, P<0.05). Eca109细胞中p-p38蛋白的表达水平明显降低(1.66 vs 0.23, P<0.05), 而JNK、Erk1/2、p38、p-JNK、p-Erk1/2蛋白表达水平的差异并不显著.
结论: 薯蓣皂苷元可能通过p-p38途径调控人食管癌细胞的增殖、凋亡、迁移和侵袭.
核心提示: 薯蓣皂苷元可显著抑制食管癌Eca109细胞的增殖、迁移并诱导其凋亡, 下调磷酸化的p38蛋白的表达可能是其诱导细胞凋亡的重要机制.
引文著录: 林杰, 谈永飞, 马铁梁, 葛志军, 吴媛媛, 丁伟良, 冯加可, 蒋国军, 史国振, 唐志安. 薯蓣皂苷元通过MAPK通路对食管癌细胞Eca109的调控. 世界华人消化杂志 2013; 21(35): 3977-3982
Revised: October 22, 2013
Accepted: October 31, 2013
Published online: December 18, 2013
AIM: To investigate the effects of diosgenin on the proliferation, apoptosis, migration and invasion of human esophageal Eca109 cells and to explore the underlying mechanisms.
METHODS: MTT and transwell experiments were executed to detect the effects of diosgenin on the proliferation, migration and invasion of Eca109 cells. Western blot was applied to detect the expression of c-Jun N-terminal of stress-activated protein kinase (JNK), extracellular signal-regulated kinase (Erk1/2) and the p38 kinase of the mitogen-activated protein kinase (MAPK) pathway.
RESULTS: Compared with the control group, Eca109 cells treated with 50 μg/mL of diosgenin for 48 h showed significantly decreased proliferation, migration (16.54 vs 34.12, P < 0.05) and invasion (9.42 vs 26.99, P < 0.05) but increased apoptosis (0.24 vs 0.64, P < 0.05). Moreover, diosgenin treatment significantly decreased the expression of p-p38 protein (1.66 vs 0.23, P < 0.05) but had no significant effect on the expression of JNK, Erk1/2, p38, p-JNK, or p-Erk1/2.
CONCLUSION: Diosgenin regulates the proliferation, apoptosis, migration and invasion of Eca109 cells possibly via the p-p38 pathway.
- Citation: Lin J, Tan YF, Ma TL, Ge ZJ, Wu YY, Ding WL, Feng JK, Jiang GJ, Shi GZ, Tang ZA. Diosgenin regulates proliferation, apoptosis, migration and invasion of human esophageal cancer Eca109 cells via the MAPK signaling pathway. Shijie Huaren Xiaohua Zazhi 2013; 21(35): 3977-3982
- URL: https://www.wjgnet.com/1009-3079/full/v21/i35/3977.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i35.3977
食管癌是我国高发肿瘤, 位居肿瘤死亡的第4位. 其发生发展和多种细胞信号转导通路密切相关[1]. 手术和化疗为其主要治疗手段, 临床使用的化疗药物主要通过诱导肿瘤细胞凋亡而发生抗癌效果, 但同时其非选择性杀伤正常细胞也给肿瘤患者带来很多不良反应. 虽然目前化疗药物为数不少, 但是大多其有效率低, 因此临床上急需找到高效, 低毒的食管癌治疗方法.
薯蓣皂苷元(diosgenin, Dio)是一种植物甾体化合物, 其抗肿瘤作用机制仍不明了. 薯蓣皂苷元能诱导多种肿瘤细胞的凋亡, 抑制其迁移和侵袭效应[2-5]. 但目前尚无文献报告薯蓣皂苷元对人食管癌细胞Eca109的效应以及其作用机制.
丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)调控细胞的增殖、侵袭、迁移和分化, 对研究肿瘤的发生、发展有重要的临床意义. 主要包括3条信号通路: c-jun氨基末端应激活化蛋白激酶(c-Jun N-terminal of stress-activated protein kinase, JNK), 细胞外信号调节激酶(extracellular signal-regulated kinase, Erk1/2)和p38丝裂原激活蛋白激酶(p38 mitogen-activated protein kinase, p38)[6]. MAPK通路可在多种不同的信号转导通路中充当一种共同的信号转导成份, 且在细胞周期调控中发挥重要的作用. 本文主要研究薯蓣皂苷元应用于Eca109细胞后, 探索其作用效果及相关机制, 为食管癌的治疗提供新策略.
人食管癌细胞Eca109株购自美国典型培养物保藏中心(American Type Culture Collection, ATCC)细胞库, 培养于体积10%胎牛血清、100 μg/mL的链霉素、100 U/mL的青霉素的RPMI 1640的培养液中, 置于37 ℃、体积分数为50 mL/L CO2、饱和湿度的二氧化碳培养箱中培养. JNK(兔抗人)、p-JNK(兔抗人)、Erk1/2(兔抗人)、p-Erk1/2(兔抗人)、p38(兔抗人)、p-p38(兔抗人)抗体购自美国Cell Signaling公司; Bcl-2相关X蛋白(Bcl2-associated X protein, BAX)(兔抗人)和B细胞白血病/淋巴瘤相关蛋白(B cell leukemia/lymphoma 2, Bcl-2)(兔抗人)抗体购自Abcam公司; 甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体购自碧云天公司; 薯蓣皂苷元购自Sigma-Aldrich公司(货号: S8534-25MG).
1.2.1 显微镜观察细胞形态: 显微镜观察取对数生长期Eca109细胞株4×104/mL接种到24孔板内, 1 mL/孔. 加入不含血清的RPMI 1640培养液, 培养24 h后, 加入含不同浓度薯蓣皂苷元的RPMI 1640培养液(6.25、12.5、25、50、100 μg/mL), 阴性对照组中加无薯蓣皂苷元的RPMI 1640培养液. 药物分别作用24、48、72 h后, 在倒置显微镜下观察细胞形态变化.
1.2.2 MTT实验: 取对数生长期的Eca109细胞, 用0.25%胰蛋白酶消化, 以1×105/孔的密度接种于96孔板, 每孔设5个复孔, 并设阴性对照组. 贴壁后, 加入含不同浓度薯蓣皂苷元的RPMI 1640培养液. 分别在培养24、48、72 h后, 用酶标仪测570 nm处的吸光度(A570)值.
1.2.3 Transwell实验: 用于检测不同浓度(6.25、12.5、25、50、100 μg/mL)的薯蓣皂苷元对Eca109细胞株迁移(无基底膜组)、侵袭(有基底膜组)效应, 实验采用孔径为8 μm的24孔Borden小室, 上室中加入2×105个细胞, 下室加入600 μL含体积分数为10%胎牛血清的RPMI 1640培养基. 分别在培养24、48、72 h后, Giemsa染色, 于200倍光镜下随机选择9个视野计数穿膜细胞数, 取其平均值, 作为穿过人工基底膜的细胞数量.
1.2.4 Western blot检测: 取对数生长期Eca109细胞, 胰酶消化后调整细胞数为5×105/mL, 以1 mL/孔接种于6孔板. 待细胞贴壁后, 加入最适浓度薯蓣皂苷元作用48 h, 同时设置未加药物的阴性对照组, 提取各组细胞总蛋白, 经PAGE电泳后转膜, 脱脂奶粉封闭, 使用一抗, 4 ℃孵育过夜, 加二抗, 室温孵育2 h后洗二抗, ECL显影, 观察及摄片. 用Gel-Pro Analyzer4.0软件比较条带的积分光密度.
统计学处理 应用SPSS16.0统计软件对数据进行统计学处理. 对计量资料, 所得数据用mean±SD表示, 样本均数比较采用t检验或单因素方差分析(one way ANOVA). P<0.05为差异有统计学意义.
未加薯蓣皂苷元的对照组Eca109细胞呈圆形贴壁生长. 不同浓度的薯蓣皂苷元处理后, 细胞形态发生明显变化: 大小不一, 轮廓不规则. 在50 μg/mL浓度组中细胞表现为整体萎缩, 变形, 细胞折光减弱等经典细胞凋亡性状. 在100 μg/mL浓度组中, 细胞的增殖活性最低, 细胞大量凋亡.
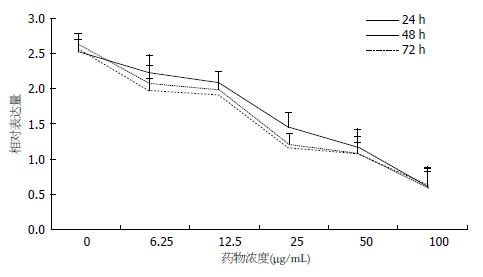
MTT比色法结果显示, 不同浓度的薯蓣皂苷元处理Eca109细胞后, 能明显抑制Eca109细胞的增殖, 呈浓度依赖性. 与阴性对照组相比, 差异皆有统计学意义(P<0.05). 其中, 我们发现薯蓣皂苷元作用48 h和72 h组的生长抑制率要明显高于24 h(图1).
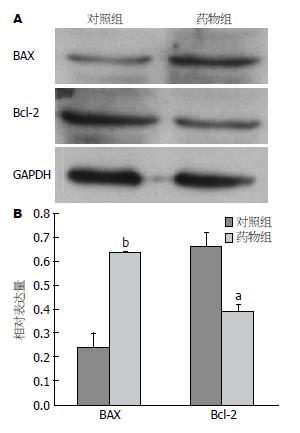
选取50 μg/mL浓度组中, 薯蓣皂苷元处理Eca109细胞48 h后, 用Western blot检测了凋亡相关的蛋白BAX和凋亡抑制蛋白Bcl-2. 结果表明Bcl-2的表达随之下调, 而BAX的表达显著升高, 与对照组相比, 具有统计学差异(P<0.05)(图2).
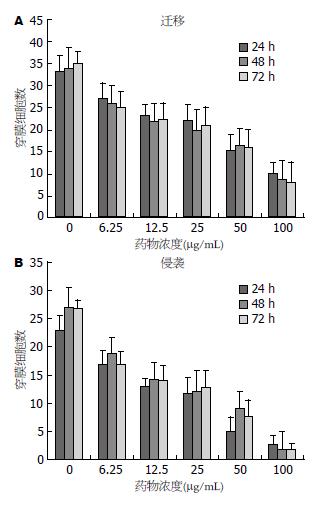
Transwell实验测定了薯蓣皂苷元对Eca109细胞的迁移和侵袭的影响. 在薯蓣皂苷元处理组中, Eca109细胞的迁移以及侵袭能力明显减弱, 穿膜细胞数明显减少, 呈浓度依赖性, 与阴性对照组比较, 差异均具有统计学意义(P<0.05, 图3).
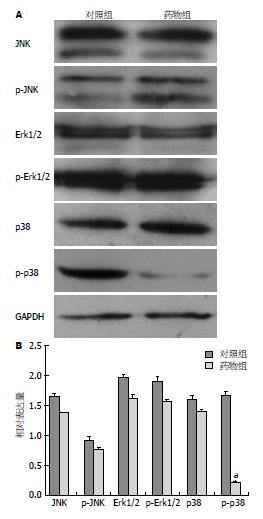
取薯蓣皂苷元的最适浓度50 μg/mL作用48 h后, Western blot检测MAPK信号通路下游蛋白, 实验结果表明, p-p38的蛋白含量显著降低, 而p-JNK、JNK、p- Erk1/2、Erk1/2及p38变化都不明显(图4).
近年来的研究表明, 中药抑制肿瘤生长的机理可能为以下几方面: 抑制肿瘤细胞的增殖, 促进肿瘤细胞的凋亡, 诱导肿瘤细胞的分化, 抑制肿瘤细胞信号转导, 逆转多药耐药, 通过细胞自噬机制等[7,8]. 由于缺乏对中药作用规律的科学研究, 其抗肿瘤疗效势必受到影响.
薯蓣皂苷元是从天热中草药薯蓣科植物中提取的有效成分, 具有抗肿瘤活性[3-6]. 据先前研究表明, 薯蓣皂苷元诱导人胃黏液腺癌MGC-823细胞的凋亡依赖Caspase3[9]; 诱导人黑色素瘤A375-S2细胞, 人白血病细胞HL-60细胞, 人胃癌细胞SGC-7901细胞的增殖、分化和凋亡[10-12]. 我们的结果显示不同浓度的薯蓣皂苷元处理Eca109细胞后, 能明显抑制Eca109细胞的增殖活性, 并且呈剂量依赖性, 与先前研究结论一致. 我们选取50 μg/mL组作为后续实验的研究对象.
BAX和Bcl-2蛋白与调控细胞凋亡相关. 过度表达的Bcl-2抑制细胞的凋亡, BAX过度表达可以促进细胞的凋亡, 以阻止正常细胞的恶性转化[13,14]. 而且, BAX的低表达和Bcl-2的过度表达对细胞的凋亡可以产生协调作用[15]. 我们发现食管癌细胞Eca109经过薯蓣皂苷元处理48 h后, 用Western blot检测发现凋亡相关的蛋白BAX表达与对照组相比显著升高, 凋亡抑制蛋白Bcl-2表达明显降低.
凌博凡等[16]研究发现薯蓣皂苷元明显抑制人结肠癌细胞LoVo的迁移和侵袭. 我们通过Transwell实验观察薯蓣皂苷元对Eca109细胞的迁移和侵袭效应的影响. 实验结果表明薯蓣皂苷元可以显著抑制Eca109细胞的迁移和侵袭, 并且呈浓度依赖性.
药物诱导细胞凋亡、增殖、分化和迁移等, 其分子机制十分复杂. 很多基因的变化都参与调控细胞的凋亡、增殖、迁移效应. 其中, MAPK信号通路最为经典. 据文献报告, 薯蓣皂苷元通过抑制核因子-B细胞轻链增强子(nuclear factor of kappa light polypeptide gene enhancer in B-cells, NF-B)信号通路和p38 MAPK 的激活, 可引起K562细胞的基因片段化[17,18]; 薯蓣皂苷元在HEL细胞中, 破坏钙离子平衡, 激活p53, 调节Caspsae3的活性, 诱导肿瘤细胞的凋亡[19]. 在Bcap37细胞和HT-29细胞中, 薯蓣皂苷元抑制环氧合酶-2(cyclooxygenase, COX-2)的表达, 促进其凋亡[20,21]. 相关研究表明, 在结肠癌细胞系HCT-116和HT-29中, 薯蓣皂苷元可以增加p38的激活, 但对JNK和Erk1/2的激活没有影响[22]. 在非小细胞肺癌A549细胞中, 薯蓣皂苷元和TRAIL两药合用导致MAPK信号途径中的JNK、Erk1/2、p38明显激活[23]. 为进一步探讨薯蓣皂苷元诱导Eca109细胞凋亡, 抑制其迁移和侵袭的作用机制. 我们检测了MAPK信号转导通路中的3条主要通路蛋白, 实验结果表明, 磷酸化的p-p38蛋白水平含量在薯蓣皂苷元药物组中较阴性对照组明显降低, 非磷酸化的JNK、Erk1/2、p38差异不明显. 另外, 磷酸化的p-JNK、p-Erk1/2在药物组和阴性对照组中差异亦不显著. 相关研究表明, p38信号通路是MAPK通路的一个重要分支, 在人肝细胞癌HepG2细胞中, p38可通过调节肿瘤抑制蛋白p53、BAX及凋亡相关蛋白Caspase9等因子启动抗增殖及凋亡作用[24]. 在肝癌细胞Hepa1-6及HepG2中, p38 MAPK可以通过调节p53、前凋亡分子CHOP-1和激活转录因子-2(activating transcription factor-2, ATF-2)介导肿瘤细胞的凋亡过程[25]. 总之, 我们认为, 在食管癌Eca109细胞中, 导致薯蓣皂苷元药物组中细胞的侵袭、迁移效应增强的原因是, 薯蓣皂苷元通过抑制p38蛋白的活性, 从而抑制了细胞的迁移和侵袭.
总之, 我们推测, 在食管癌细胞中, 薯蓣皂苷元可能通过p38通路对Eca109细胞的增殖、迁移、侵袭等起着调控作用, 而与JNK和Erk1/2通路关系并不密切. 在一定程度上揭示了薯蓣皂苷元对MAPK信号转导通路的影响的潜在可能, 为临床上食管癌的治疗提供一定的线索.
食管癌是常见的消化系恶性肿瘤, 常规的治疗方法有手术切除, 化疗及放疗, 这些方法有一定的不良反应和化疗耐药性. 因此, 寻找一种高效低毒的天热植物药物对食管癌治疗具有重要临床意义.
张志坚, 教授, 福州总医院消化内科
薯蓣皂苷元是从我国特有的穿龙薯蓣中分离等到的一种植物甾体化合物. 具有降血脂, 降血糖, 抗风湿, 抗心肌缺血, 抗肿瘤等重要作用. 研究表明, 薯蓣皂苷元对胃癌, 结肠癌, 非小细胞肺癌等多种癌症具有抑制作用.
MAPK属于一种蛋白激酶, 可在多种不同的信号转导途径中充当一种共同的信号转导成份, 且在细胞周期调控中发挥重要的作用. 其中Erk1/2信号转导通路调控细胞生长和分化, JNK和p38信号转导通路在炎症与细胞凋亡中发挥重要作用.
本文从MAPK信号通路中JNK, Erk1/2和p38磷酸化和非磷酸化蛋白含量的表达的变化, 观察薯蓣皂苷元抑制食管癌Eca109细胞增殖及诱导其凋亡的作用, 探讨其可能的分子机制.
下调p38的磷酸化水平, 可能是薯蓣皂苷元抑制食管癌Eca109细胞增殖、迁移并诱导其凋亡的机制之一, 本研究为进一步研究薯蓣皂苷元抗肿瘤的作用机制提供依据.
本文研究的有关食管癌与薯蓣皂苷元关系的研究目前国内外报道甚少, 研究具有重要的临床意义.有一定的创新性. 观察指标选择恰当, 技术路线清晰结果可靠, 结论客观. 讨论部分条理分明, 有系统的理论分析和有价值的结论.
编辑: 郭鹏 电编:鲁亚静
| 2. | Raju J, Mehta R. Cancer chemopreventive and therapeutic effects of diosgenin, a food saponin. Nutr Cancer. 2009;61:27-35. [PubMed] [DOI] |
| 3. | Das S, Dey KK, Dey G, Pal I, Majumder A, MaitiChoudhury S, kundu SC, Mandal M. Antineoplastic and apoptotic potential of traditional medicines thymoquinone and diosgenin in squamous cell carcinoma. PLoS One. 2012;7:e46641. [PubMed] [DOI] |
| 4. | He Z, Tian Y, Zhang X, Bing B, Zhang L, Wang H, Zhao W. Anti-tumour and immunomodulating activities of diosgenin, a naturally occurring steroidal saponin. Nat Prod Res. 2012;26:2243-2246. [PubMed] [DOI] |
| 5. | Wang Z, Cheng Y, Wang N, Wang DM, Li YW, Han F, Shen JG, Yang de P, Guan XY, Chen JP. Dioscin induces cancer cell apoptosis through elevated oxidative stress mediated by downregulation of peroxiredoxins. Cancer Biol Ther. 2012;13:138-147. [PubMed] [DOI] |
| 6. | Yang SH, Sharrocks AD, Whitmarsh AJ. MAP kinase signalling cascades and transcriptional regulation. Gene. 2013;513:1-13. [PubMed] [DOI] |
| 10. | 霍 锐, 周 秋丽, 王 本祥, 王 敏伟, 田 代真一, 小 野寺敏, 池 岛乔. 薯蓣苷元诱导人黑素瘤细胞A375-S2凋亡依赖半胱天冬酶和MAPK途径. 中国药理学与毒理学杂志. 2003;17:270-275. |
| 12. | Gao LL, Li FR, Jiao P, Yang MF, Zhou XJ, Si YH, Jiang WJ, Zheng TT. Paris chinensis dioscin induces G2/M cell cycle arrest and apoptosis in human gastric cancer SGC-7901 cells. World J Gastroenterol. 2011;17:4389-4395. [PubMed] [DOI] |
| 13. | Kang MH, Reynolds CP. Bcl-2 inhibitors: targeting mitochondrial apoptotic pathways in cancer therapy. Clin Cancer Res. 2009;15:1126-1132. [PubMed] [DOI] |
| 14. | Reed JC. Proapoptotic multidomain Bcl-2/Bax-family proteins: mechanisms, physiological roles, and therapeutic opportunities. Cell Death Differ. 2006;13:1378-1386. [PubMed] [DOI] |
| 15. | Adams JM, Cory S. Bcl-2-regulated apoptosis: mechanism and therapeutic potential. Curr Opin Immunol. 2007;19:488-496. [PubMed] [DOI] |
| 17. | Gao M, Chen L, Yu H, Sun Q, Kou J, Yu B. Diosgenin down-regulates NF-κB p65/p50 and p38MAPK pathways and attenuates acute lung injury induced by lipopolysaccharide in mice. Int Immunopharmacol. 2013;15:240-245. [PubMed] [DOI] |
| 18. | Wang L, Meng Q, Wang C, Liu Q, Peng J, Huo X, Sun H, Ma X, Liu K. Dioscin restores the activity of the anticancer agent adriamycin in multidrug-resistant human leukemia K562/adriamycin cells by down-regulating MDR1 via a mechanism involving NF-κB signaling inhibition. J Nat Prod. 2013;76:909-914. [PubMed] [DOI] |
| 19. | Cailleteau C, Micallef L, Lepage C, Cardot PJ, Beneytout JL, Liagre B, Battu S. Investigating the relationship between cell cycle stage and diosgenin-induced megakaryocytic differentiation of HEL cells using sedimentation field-flow fractionation. Anal Bioanal Chem. 2010;398:1273-1283. [PubMed] [DOI] |
| 20. | Ghezali L, Leger DY, Limami Y, Cook-Moreau J, Beneytout JL, Liagre B. Cyclopamine and jervine induce COX-2 overexpression in human erythroleukemia cells but only cyclopamine has a pro-apoptotic effect. Exp Cell Res. 2013;319:1043-1053. [PubMed] [DOI] |
| 21. | Lepage C, Liagre B, Cook-Moreau J, Pinon A, Beneytout JL. Cyclooxygenase-2 and 5-lipoxygenase pathways in diosgenin-induced apoptosis in HT-29 and HCT-116 colon cancer cells. Int J Oncol. 2010;36:1183-1191. [PubMed] [DOI] |
| 22. | Lepage C, Léger DY, Bertrand J, Martin F, Beneytout JL, Liagre B. Diosgenin induces death receptor-5 through activation of p38 pathway and promotes TRAIL-induced apoptosis in colon cancer cells. Cancer Lett. 2011;301:193-202. [PubMed] [DOI] |
| 24. | Kim BJ, Ryu SW, Song BJ. JNK- and p38 kinase-mediated phosphorylation of Bax leads to its activation and mitochondrial translocation and to apoptosis of human hepatoma HepG2 cells. J Biol Chem. 2006;281:21256-21265. [PubMed] [DOI] |