修回日期: 2013-08-21
接受日期: 2013-11-06
在线出版日期: 2013-11-28
目的: 本研究主要探讨基因重组人粒细胞集落刺激因子(recombinant human granulocyte colony-stimulating factor, rhG-CSF)治疗小鼠结肠炎的疗效并探讨其可能的作用机制.
方法: 应用5% 2,4,6-三硝基苯磺酸灌肠诱导Balb/c小鼠结肠炎症, 结肠炎小鼠随机分为2组, 在造模后3 h, 分别给予rhG-CSF或磷酸盐缓冲液(phosphate buffered saline, PBS)皮下注射进行治疗干预, 连续6 d, 每日观察小鼠体质量, 腹泻及便血情况. 造模后第6天处死小鼠, 获取结肠组织, 根据黏连、溃疡及炎症计大体损伤评分; 取降结肠组织, HE染色后计病理组织评分; 获取结肠组织匀浆, 应用ELISA方法检测炎症细胞因子白介素-17(interleukin-17, IL-17)及IL-23的表达水平; 获取肠系膜淋巴结淋巴细胞, 体外培养3 d后, 应用流式细胞术检测CD4+CD25+调节性T细胞的表达.
结果: rhG-CSF治疗组小鼠的DAI评分、大体损伤评分及病理组织评分明显低于PBS对照组; 与对照组相比rhG-CSF治疗组小鼠结肠组织中IL-17及IL-23的表达水平明显减低, 而肠系膜淋巴结中CD4+CD25+调节性T细胞的表达上调.
结论: 基因重组人粒细胞集落刺激因子改善了小鼠的结肠炎症, Th17细胞与调节性T细胞的平衡调节是其可能的作用机制.
核心提示: 本研究提示基因重组人粒细胞集落刺激因子改善了小鼠的结肠炎症, Th17细胞与调节性T细胞的分化平衡调节是其可能的作用机制. 基因重组人粒细胞集落刺激因子是炎症性肠病(inflammatory bowel disease)有效的辅助治疗方法.
引文著录: 林艳, 王思亮, 岳原亦, 郑长青. 应用基因重组人粒细胞集落刺激因子治疗小鼠炎症性肠病的作用机制. 世界华人消化杂志 2013; 21(33): 3700-3705
Revised: August 21, 2013
Accepted: November 6, 2013
Published online: November 28, 2013
AIM: To examine if recombinant human granulocyte colony-stimulating factor (rhG-CSF) could promote the recovery of 2,4,6-trinitrobenzene sulfuric acid (TNBS)-induced colitis in Balb/c mice and to analyze the potential mechanisms involved.
METHODS: Colitis was induced in Balb/c mice by rectal administration of 5%TNBS. Three hours later, the mice were given rhG-CSF (100 µg/kg) or phosphate-buffered saline (PBS) subcutaneously once a day from day 0 to day 5. The weight loss, stool, and fecal occult blood were then recorded daily. The mice were sacrificed on day 5, and the whole colons were obtained and scored for adhesion, ulcer and inflammation. Tissue specimens from the descending colon were obtained and stained with hematoxylin and eosin. Inflammation was scored for severity, extent, epithelial damage and crypt loss. The expression of pro-inflammatory cytokine proteins IL-17 and IL-23 in colon tissues was detected by ELISA. Mesenteric lymph node (MLN) cells were prepared and cultured in vitro for 3 d to examine the expression of CD4+ CD25+ Tregs by flow cytometry.
RESULTS: Treatment with rhG-CSF significantly ameliorated murine colitis in terms of improved clinical and pathological signs. The levels of IL-17 and IL-23 were significantly lower in the colon tissues of rhG-CSF-treated mice in comparison with controls. The expression of CD4+ CD25+ Tregs in MLN cells from rhG-CSF-treated mice increased.
CONCLUSION: Treatment with rhG-CSF ameliorates murine TNBS-induced colitis via mechanisms possibly associated with the suppression of IL-23/IL-17 and promotion of CD4+ CD25+ Tregs.
- Citation: Lin Y, Wang SL, Yue YY, Zheng CQ. Mechanisms underlying therapeutic effects of recombinant human granulocyte colony-stimulating factor against TNBS-induced experimental colitis in mice. Shijie Huaren Xiaohua Zazhi 2013; 21(33): 3700-3705
- URL: https://www.wjgnet.com/1009-3079/full/v21/i33/3700.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i33.3700
炎症性肠病(inflammatory bowel disease, IBD)是一组慢性肠道炎症性疾病, 主要包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD), 其病因及发病机制尚未完全阐明. 目前认为IBD是一种多因素疾病, 其发病机制[1]可能为环境及感染因素作用于遗传易感个体引起肠道异常免疫反应所致. 肠道黏膜免疫异常是IBD发病的中心环节, 贯穿其发生发展的始终. 研究显示调节肠道黏膜免疫, 恢复黏膜免疫耐受已成为IBD治疗的关键, 针对肠道黏膜免疫功能的调节为IBD的治疗提供了新的治疗靶点[2]. 粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)作为一种造血细胞生长因子, 已被证实可作用于肠道上皮细胞, 起到增殖、分化和修复等作用[3], G-CSF具有调节肠道黏膜先天免疫的功能, 目前已成为潜在的IBD辅助治疗方法. 为了进一步明确基因重组人粒细胞集落刺激因子(recombinant human granulocyte colony-stimulating factor, rhG-CSF)对IBD的治疗作用并探讨其可能的作用机制我们进行以下研究.
6-8周龄的Balb/c纯系♀小鼠30只由中国医科大学动物实验室提供, 体质量18-20 g, 饲养于清洁环境; 2,4,6-三硝基苯磺酸(TNBS)购自Sigma公司; 无水乙醇购自博尔美公司; rhG-CSF购自麒麟鲲鹏(中国)生物药业有限公司; 小鼠白介素-17(interleukin-17, IL-17)、IL-23 ELISA试剂盒购自晶美生物工程有限公司; FITC-CD4荧光抗体和PE-CD25荧光抗体均购自eBioscience公司.
1.2.1 动物模型的建立: 全部小鼠禁食24 h不禁水, 造模前先称质量, 让小鼠前爪自由抓住笼面, 抓取小鼠尾部, 使小鼠倒立. 经腹腔麻醉后, 从肛门插入直径为1.5 mm的灌胃针, 深度为3.0-4.0 cm, 缓缓注入TNBS+无水乙醇药液后拔管. 捏住肛门继续保持倒立姿势30 s后将小鼠放回鼠笼.
1.2.2 分组: 小鼠结肠炎建立后被随机分为2组即rhG-CSF及磷酸盐缓冲液(phosphate buffered saline, PBS)治疗组: 于造模后3 h经腹腔分别注射rhG-CSF(100 µg/kg)及PBS进行治疗干预, 并连续给药6 d.
1.2.3 小鼠一般状态观察: 每日观察记录小鼠生存情况, 小鼠一般状态、皮毛、食量、体质量、大便性状血便情况, 记录第1、3、5天DAI评分.
1.2.4 大体形态损伤评分: 取小鼠结肠, 沿肠系膜纵行剖开, 观察大体形态改变. 根据黏连、溃疡形成及炎症的程度进行大体形态损伤评分. 大体形态损伤评分标准如表1.
| 类型 | 得分 |
| 黏连 | |
| 无 | 0 |
| 轻度(结肠与其他组织剥离较易) | 1 |
| 重度 | 2 |
| 溃疡形成及炎症 | |
| 无 | 0 |
| 局部充血, 无溃疡 | 1 |
| 1处溃疡不伴充血和肠壁增厚 | 2 |
| 1处溃疡伴炎症 | 3 |
| >2处溃疡伴炎症 | 4 |
| >2处溃疡和或炎症>2cm | 5 |
| 溃疡和或炎症>2 cm病变范围每增加1 cm计分加1 | 6-8 |
1.2.5 病理组织学评价: 取距肛门2 cm处结肠组织应用40 g/L甲醛固定, 常规石蜡包埋, 切片, HE染色, 由经验丰富的病理科医生于电镜下评估结肠炎的严重程度. 病理组织学评分标准如表2.
| 上皮损伤和溃疡形成 | 溃疡深度 | 水肿 | 淋巴单核浆细胞浸润 | 浸润深度 | 中性粒细胞浸润 | 浸润深度 | 嗜酸性粒细胞浸润 | 浸润深度 | 计分 |
| 无 | 无 | 无 | 无 | 无 | 0 | ||||
| 糜烂 | 黏膜下层 | 轻 | 轻 | 黏膜下层 | 轻 | 黏膜下层 | 轻 | 黏膜下层 | 1 |
| 溃疡 | 肌层 | 中 | 中 | 肌层 | 中 | 肌层 | 中 | 肌层 | 2 |
| 浆膜层 | 重 | 重 | 浆膜层 | 重 | 浆膜层 | 重 | 浆膜层 | 3 |
1.2.6 ELISA方法检测结肠组织中IL-17、IL-23的表达水平: 取中段结肠组织, 冰上将结肠组织均浆后高速离心, 取上清液应用ELISA方法测定IL-17及IL-23的表达水平, 具体方法参照说明书.
1.2.7 流式细胞术检测肠系膜淋巴结调节性T细胞的表达: 收集小鼠肠系膜淋巴结制备细胞悬液, 应用淋巴细胞分离液分离淋巴细胞, 将获取的淋巴细胞以1×106/mL置于培养皿中, 于5%CO2, 37 ℃温箱中孵育72 h, 72 h后收集细胞, 应用流式细胞术检测CD4+CD25+调节性T细胞的表达.
研究显示给予rhG-CSF治疗的小鼠, 腹泻便血等临床症状较对照组减轻, 小鼠体质量在治疗后第3天开始恢复, 于治疗后第5天体质量接近于造模前水平, 已无明显腹泻及血便; 而对照组小鼠腹泻及便血症状较明显, 体质量恢复较慢, 于治疗后第5天体质量与造模前相较下降10%-15%. rhG-CSF治疗组小鼠第5天的DAI评分为7.3±0.1, 明显低于PBS对照组(9.5±0.15, P<0.05).
rhG-CSF治疗组小鼠结肠黏连、溃疡及炎症较对照组明显减轻, 其大体形态损伤评分为1.33±0.12, 明显低于PBS对照组(4.6±0.25, P<0.01).
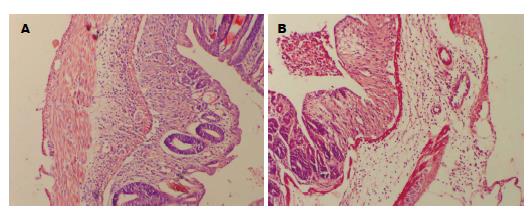
取距肛门2 cm处结肠组织, 经石蜡包埋, HE染色后于显微镜下观察可见结肠黏膜充血、出血、糜烂, 黏膜层、黏膜下层中性粒细胞及其他炎性细胞浸润, 病变严重小鼠从黏膜层至浆膜层弥漫性充血、出血, 全层非局限性透壁性坏死; 肠上皮细胞坏死脱落, 甚至出现黏膜层、黏膜下层及肌层坏死脱落. rhG-CSF治疗组小鼠结肠组织于显微镜下观察无溃疡形成, 炎症细胞浸润范围及深度浅, 而对照组镜下可见深溃疡形成, 大量炎症细胞浸润, rhG-CSF治疗组病理组织评分为11.2±2.1, 明显低于PBS对照组(15.2±2.4, P<0.05). 两组病理改变对比如图1.
rhG-CSF治疗组小鼠结肠组织中IL-17及IL-23的含量分别(21.66 ng/mL±2.12 ng/mL, 426.14 ng/mL±11.28 ng/mL), 明显低于PBS治疗组(226.03 ng/mL±7.25 ng/mL, 971.12 ng/mL±12.6 ng/mL, P<0.05)
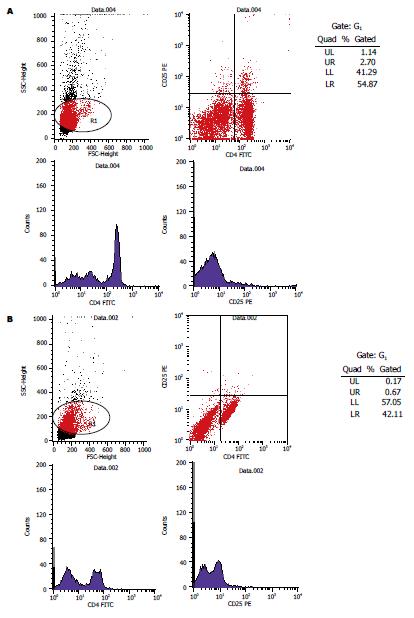
rhG-CSF治疗组调节性T细胞(regulatory t cells, Tregs)的表达率较高, 而PBS组调节性T细胞的表达很低几乎检测不到, rhG-CSF治疗组的Tregs表达率与PBS组比较差异明显(2.29±0.02 vs 0.26±0.01, P<0.05). 两组Tregs表达对比如图2.
IBD是肠道慢性非特异性炎症性疾病, 近年来在我国发病率呈逐年上升趋势. 尽管IBD病因仍不明确, 但大量证据表明IBD患者的免疫系统异常是造成炎症和组织损伤的内在因素. IBD患者的肠道黏膜存在异常的免疫应答, 有大量的促炎因子和抑炎因子: 前者促发疾病的产生, 加速疾病进展, 后者抗炎修复, 抑制疾病进展, 这些特征提供了临床上给予靶向生物治疗的理论依据[4]. 近年来生物制剂如英夫利昔[5][肿瘤坏死因子α(tumor necrosis factor α, TNF-α)特异性抗体]已应用于临床, 更多的生物制剂如IL-10、IL-6抗体等[6,7]已进入临床实验阶段. 粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)对于肠道黏膜免疫系统具有调节作用, 已作为IBD的辅助治疗试用于临床, 成为IBD辅助治疗的又一选择.
重组人粒细胞集落刺激因子(recombinant human granulocyte colony-stimulating factor, rhG-CSF)是一种造血生长因子, 他可以促进中性粒细胞的存活和蛋白合成, 抑制氧化代谢, 不仅在抗感染的非特异性细胞免疫中起到极其重要的作用, 而且与整个机体的免疫功能密切相关[8]. 研究表明rhG-CSF具有免疫调节作用, 参与肠道黏膜免疫反应: rhG-CSF可通过JAK酪氨酸激酶、核因子κB(nuclear factor kappa B, NF-κB)、STAT转录因子等途径, 作用在肠道上皮, 起到增殖、分化和修复等作用[9]. Kudo等[10]应用rhG-CSF治疗DSS结肠炎小鼠显示了较好的疗效, 而Sainathan等[11]发现GM-CSF也同样具有改善小鼠结肠炎症的作用, 因此提示造血生长因子在调节肠道免疫, 治疗炎症性肠病方面具备潜力. 目前国外已有相关的临床研究证实rhG-CSF对于IBD患者治疗的有效性[12], 在此研究中应用rhG-CSF有效治疗了一例UC患者, 并使其获得长期缓解.
本研究以TNBS灌肠的方法建立小鼠结肠炎模型, 经腹腔给予rhG-CSF进行治疗干预, 结果显示rhG-CSF治疗组小鼠腹泻、血便、体质量减轻等临床症状改善明显优于对照组: 其DAI评分、大体组织评分及病理组织评分均低于PBS组, 提示rhG-CSF改善了小鼠的结肠炎症, 此结果与国外相关研究一致[10]. 为了进一步探究rhG-CSF治疗结肠炎的可能作用机制, 探讨rhG-CSF的可能作用途径, 我们研究了rhG-CSF治疗后Th17细胞与调节性T细胞的平衡变化.
Th17细胞是近年来发现的一种新的细胞亚群, 以分泌IL-17而得名, Th17细胞除了分泌IL-17(也称IL-17A)外, 还主要分泌IL-17F、IL-21、IL-22、TNF-α、IL-6[13]等细胞因子. 多项研究表明Th17细胞参与自身免疫反应, 是自身免疫性疾病的重要效应细胞. 近年来Th17细胞在IBD中的作用受到越来越多的关注. 研究表明IBD患者结肠黏膜表达高水平IL-17, 在活动性CD及UC中尤其明显[14]; IL-17RA基因敲除小鼠建立的肠炎模型, 结肠炎症明显减轻[15]. 无论是临床研究还是动物实验均提示Th17细胞在IBD发病机制中扮演重要角色. IL-23是炎症性肠病相关的重要细胞因子, 大量研究已经证明炎症性肠病中IL-23对促进Th1、Th17相关因子的合成发挥着关键性作用[16]. IL-23不仅可促使肠道T细胞的增殖, 促进Th17细胞的聚集, 还可加强表达IL-17A+、干扰素-γ+(interferon-γ+, IFN-γ+)T细胞群的出现. 目前认为Th17细胞效应的IL-23/IL-17轴在IBD发生中起关键作用[17]. 本研究显示结肠炎小鼠结肠组织IL-23和IL-17均呈高表达, 而经rhG-CSF治疗后, IL-23和IL-17的表达明显下降. 此结果提示rhG-CSF调节肠道免疫, 下调炎症反应, 抑制Th17细胞分化, 阻断其效应细胞因子的表达从而达到控制炎症和损伤的作用.
调节性T细胞(regulatory T cells, Tregs)具有抑制自身免疫反应的功能, CD4+CD25+ Tregs是维持机体内环境稳定的主要Tregs, 其功能主要通过下调自身免疫应答来诱导自身免疫耐受和抑制自身免疫疾病的发生. 目前研究认为Th17/Tregs转化平衡是维持肠道免疫稳态的重要因素, 其平衡失常可能是导致IBD的重要原因之一[18]. 我们的研究显示rhG-CSF治疗小鼠不仅可以下调Th17细胞因子的表达而且小鼠结肠肠系膜淋巴结中CD4+CD25+ Tregs的表达明显上调.
总之, rhG-CSF改善了小鼠的结肠炎症, 小鼠结肠组织中Th17相关细胞因子表达下调而调节性T细胞表达上调, 提示rhG-CSF的作用机制可能通过调节Th17/Tregs的平衡而实现. 而rhG-CSF如何调节Th17/Tregs的平衡转化还有待于进一步的研究.
炎症性肠病(inflammatory bowel disease, IBD)是病因未明的肠道慢性非特异性炎症性疾病, 由于免疫异常是其主要的发病因素, 目前治疗以对症及免疫调节为主. 随着对IBD发病机制的深入研究, 许多新的治疗方法及新的药剂已应用于临床, 使IBD的治疗疗效得到改善.
陈其奎, 教授, 中山大学附属第二医院消化内科
肠道黏膜免疫系统异常是IBD发病的中心环节, 贯穿于疾病发生发展的始终. 近期研究发现Th17细胞/调节性T细胞的分化失衡是IBD发生的重要原因之一. 深入研究其分化平衡的调节机制必将为IBD治疗提供新的方法及靶点.
重组人粒细胞集落刺激因子(rhG-CSF)是一种造血生长因子, 具有免疫调节作用, 参与肠道黏膜免疫反应, 已有研究显示rhG-CSF主要通过调节先天免疫反应发挥免疫调节作用. 国外相关研究显示rhG-CSF在实验动物及临床研究均显示出对于IBD治疗的有效性.
目前rhG-CSF与IBD的研究主要集中于疗效研究, 作用机制研究较少, 本研究主要探究rhG-CSF是否通过Th17细胞/调节性T细胞的分化调节发挥作用.
探讨基因重组人粒细胞集落刺激因子治疗结肠炎的发病机制具有重要意义, 该研究结果不仅提示基因重组人粒细胞集落刺激因子可成为IBD辅助治疗方法, 而且对其机制的研究可为其临床应用提供理论依据及应用指导.
本文对于炎症性肠病的发病机制的研究和潜在的临床应用具有较好的科学意义.
编辑: 田滢 电编:鲁亚静
| 1. | Qin X. Etiology of inflammatory bowel disease: a unified hypothesis. World J Gastroenterol. 2012;18:1708-1722. [PubMed] |
| 2. | Cario E. Commensal-innate immune miscommunication in IBD pathogenesis. Dig Dis. 2012;30:334-340. [PubMed] [DOI] |
| 3. | Krishnan K, Arnone B, Buchman A. Intestinal growth factors: potential use in the treatment of inflammatory bowel disease and their role in mucosal healing. Inflamm Bowel Dis. 2011;17:410-422. [PubMed] [DOI] |
| 4. | Kellermayer R. Epigenetics and the developmental origins of inflammatory bowel diseases. Can J Gastroenterol. 2012;26:909-915. [PubMed] |
| 5. | Lopez A, Billioud V, Peyrin-Biroulet C, Peyrin-Biroulet L. Adherence to anti-TNF therapy in inflammatory bowel diseases: a systematic review. Inflamm Bowel Dis. 2013;19:1528-1533. [PubMed] [DOI] |
| 6. | Kotlarz D, Beier R, Murugan D, Diestelhorst J, Jensen O, Boztug K, Pfeifer D, Kreipe H, Pfister ED, Baumann U. Loss of interleukin-10 signaling and infantile inflammatory bowel disease: implications for diagnosis and therapy. Gastroenterology. 2012;143:347-355. [PubMed] [DOI] |
| 7. | Waldner MJ, Neurath MF. Novel cytokine-targeted therapies and intestinal inflammation. Curr Opin Pharmacol. 2009;9:702-707. [PubMed] |
| 8. | Waight JD, Hu Q, Miller A, Liu S, Abrams SI. Tumor-derived G-CSF facilitates neoplastic growth through a granulocytic myeloid-derived suppressor cell-dependent mechanism. PLoS One. 2011;6:e27690. [PubMed] |
| 9. | Mannon PJ, Leon F, Fuss IJ, Walter BA, Begnami M, Quezado M, Yang Z, Yi C, Groden C, Friend J. Successful granulocyte-colony stimulating factor treatment of Crohn's disease is associated with the appearance of circulating interleukin-10-producing T cells and increased lamina propria plasmacytoid dendritic cells. Clin Exp Immunol. 2009;155:447-456. [PubMed] |
| 10. | Kudo T, Matsumoto T, Nakamichi I, Yada S, Esaki M, Jo Y, Ohji Y, Yao T, Iida M. Recombinant human granulocyte colony-stimulating factor reduces colonic epithelial cell apoptosis and ameliorates murine dextran sulfate sodium-induced colitis. Scand J Gastroenterol. 2008;43:689-697. [PubMed] |
| 11. | Sainathan SK, Hanna EM, Gong Q, Bishnupuri KS, Luo Q, Colonna M, White FV, Croze E, Houchen C, Anant S. Granulocyte macrophage colony-stimulating factor ameliorates DSS-induced experimental colitis. Inflamm Bowel Dis. 2008;14:88-99. [PubMed] |
| 12. | Alsultan A, Sokol RJ, Lovell MA, Thurman G, Ambruso DR. Long term G-CSF-induced remission of ulcerative colitis-like inflammatory bowel disease in a patient with glycogen storage disease Ib and evaluation of associated neutrophil function. Pediatr Blood Cancer. 2010;55:1410-1413. [PubMed] |
| 13. | Ouyang W, Kolls JK, Zheng Y. The biological functions of T helper 17 cell effector cytokines in inflammation. Immunity. 2008;28:454-467. [PubMed] |
| 14. | Seiderer J, Elben I, Diegelmann J, Glas J, Stallhofer J, Tillack C, Pfennig S, Jürgens M, Schmechel S, Konrad A. Role of the novel Th17 cytokine IL-17F in inflammatory bowel disease (IBD): upregulated colonic IL-17F expression in active Crohn's disease and analysis of the IL17F p.His161Arg polymorphism in IBD. Inflamm Bowel Dis. 2008;14:437-445. [PubMed] |
| 15. | Zhang Z, Zheng M, Bindas J, Schwarzenberger P, Kolls JK. Critical role of IL-17 receptor signaling in acute TNBS-induced colitis. Inflamm Bowel Dis. 2006;12:382-388. [PubMed] |
| 16. | Kamada N, Hisamatsu T, Okamoto S, Chinen H, Kobayashi T, Sato T, Sakuraba A, Kitazume MT, Sugita A, Koganei K. Unique CD14 intestinal macrophages contribute to the pathogenesis of Crohn disease via IL-23/IFN-gamma axis. J Clin Invest. 2008;118:2269-2280. [PubMed] |
| 17. | Ahern PP, Schiering C, Buonocore S, McGeachy MJ, Cua DJ, Maloy KJ, Powrie F. Interleukin-23 drives intestinal inflammation through direct activity on T cells. Immunity. 2010;33:279-288. [PubMed] [DOI] |
| 18. | Kitani A, Xu L. Regulatory T cells and the induction of IL-17. Mucosal Immunol. 2008;1 Suppl 1:S43-S46. [PubMed] [DOI] |