修回日期: 2013-10-20
接受日期: 2013-11-11
在线出版日期: 2013-11-28
目的: 构建食管癌耐药细胞株, 探讨二十二碳六烯酸(docosahexaenoic acid, DHA)逆转人食管癌Eca109/顺铂(cisplatin, DDP)细胞对DDP的耐药作用及其机制.
方法: 采用递增顺铂药物质量浓度持续作用诱导法建立耐顺铂细胞株; MTT法检测DHA对Eca109/DDP细胞增殖影响, 计算耐药逆转作用, Western blot检测Eca109/DDP细胞膜P-糖蛋白(P-glycoprotein, P-gp)表达水平.
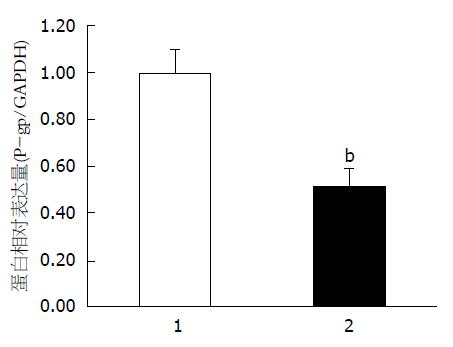
结果: 历经6 mo的诱导, Eca109细胞能在含1 μg/mL DDP的培养基中稳定生长, 耐药指数(resistant index, RI)为15.9; DHA浓度在1.560 μg/mL以下, 对Eca109/DDP细胞的生长无显著抑制作用(P>0.05), 但与DDP联合应用能增加DDP对Eca109/DDP细胞的毒性且呈浓度依赖性(P<0.05); 1 μg/mL DDP对Eca109/DDP细胞的半数抑制浓度(IC50)为3.50 μg/mL±1.04 μg/mL, 当分别与0.195、0.390、0.780、1.560 μg/mL的DHA联合应用时, 对Eca109/DDP细胞的半数抑制浓度(IC50)从1.99 μg/mL±0.11 μg/mL降低到0.83 μg/mL±0.22 μg/mL(P<0.05), 提高逆转指数, 并能显著抑制Eca109/DDP细胞P-gp表达水平, P-gp相对表达量从0.99±0.12降至0.52±0.08(P<0.05).
结论: DHA与DDP联合应用通过下调Eca109/DDP细胞P-gp的表达水平逆转对DDP的耐药, 促进DDP对耐药细胞的杀伤作用.
核心提示: 二十二碳六烯酸随着浓度逐渐增高则表现出对Eca109/顺铂(cisplatin, DDP)细胞的增殖抑制作用, 且呈浓度依赖性. 而对肿瘤细胞无杀伤作用的二十二碳六烯酸与1 μg/mL顺铂联用, 可以逆转Eca109/DDP细胞的耐药性, 且呈浓度依赖性, 同时能显著下调P-糖蛋白(P-glycoprotein, P-gp)蛋白表达水平. 初步探讨了二十二碳六烯酸(docosahexaenoic acid)通过下调Eca109/DDP细胞膜上P-gp的过度表达逆转肿瘤细胞的多药耐药机制.
引文著录: 张徐宁, 戴翠萍, 夏前正, 韩雪花, 季宁东. 二十二碳六烯酸逆转食管癌Eca109/DDP细胞对顺铂耐药的机制. 世界华人消化杂志 2013; 21(33): 3695-3699
Revised: October 20, 2013
Accepted: November 11, 2013
Published online: November 28, 2013
AIM: To establish a cisplatin (DDP)-resistant human esophageal carcinoma cell line (Eca109/DDP) and to explore the mechanisms responsible for the reversal effect of docosahexaenoic acid (DHA) on DDP resistance.
METHODS: A DDP-resistant esophageal cancer cell line (Eca109/DDP) was established by exposure of Eca109 cells to gradually increasing doses of DDP. The effects of DHA on cell proliferation and DDP resistance in Eca109/DDP cells were determined by MTT assay. The expression level of P-glycoprotein (P-gp) was detected by Western blot.
RESULTS: After 6 mo of induction, Eca109 cells in culture medium containing 1 μg/mL DDP grew stably and the resistant index was 15.9. DHA at concentrations < 1.560 μg/mL had no obvious inhibition on Eca109/DDP cells (P > 0.05); however, DHA could enhance the cytotoxicity of DDP to Eca109/DDP cells in a dose-dependent manner (P < 0.05). The half inhibitory concentration (IC50) for DDP in Eca109/DDP cells was 3.50 μg/mL ± 1.04 μg/mL. When combined with 0.195 μg/mL, 0.390 μg/mL, 0.780 μg/mL, or 1.560 μg/mL of DHA, the IC50 for DDP decreased from 1.99 μg/mL ± 0.11 μg/mL to 0.83 μg/mL ± 0.22 μg/mL (P < 0.05). DHA significantly increased the reversal index and down-regulate the expression of P-gp in Eca109/DDP cells (0.99 ± 0.12 vs 0.52 ± 0.08, P < 0.05).
CONCLUSION: DHA possesses a reversal effect on DDP resistance in Eca109/DDP cells by down-regulating the expression of P-gp and enhancing the killing effect of DDP on drug-resistant cells.
- Citation: Zhang XN, Dai CP, Xia QZ, Han XH, Ji ND. Mechanisms underlying reversal effect of docosahexaenoic acid on cisplatin resistance in human esophageal carcinoma cell line Eca109/DDP. Shijie Huaren Xiaohua Zazhi 2013; 21(33): 3695-3699
- URL: https://www.wjgnet.com/1009-3079/full/v21/i33/3695.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i33.3695
我国是食管癌的高发地带, 其发病率居世界之首[1]. 顺铂(cisplatin, DDP)是临床上食管癌化疗的首选药物, 但食管癌细胞的多药耐药(multidrug resistance, MDR)降低了化疗药物的疗效[2]. 使用MDR逆转剂是克服MDR方法之一. 目前在体外实验有效的逆转剂因其不良反应太大而不宜在临床开展. 本研究以耐顺铂的食管癌细胞Eca109/DDP为对象, 探讨二十二碳六烯酸(docosahexaenoic acid, DHA)逆转Eca109/DDP细胞对DDP的耐药作用及机制, 旨在为寻找高效、低毒肿瘤多药耐药逆转剂提供实验依据.
食管癌细胞株Eca109、蛋白提取试剂盒、二喹啉甲酸(bicinchoninic acid, BCA)蛋白定量试剂盒均购自南京凯基生物科技发展有限公司; 二十二碳六烯酸(DHA)购自美国Sigma公司; 注射用顺铂(DDP 10 mg/2 mL)购自山东齐鲁制药有限公司; RPMI 1640细胞培养液购自美国 Gibco公司; 小牛血清购自上海生物工程技术有限公司; 四甲基偶氮唑蓝(methylthiazolyltetrazolium, MTT)购自美国Amresco公司; 二甲基亚砜(dimethyl sulfoxide, DMSO)购自上海久亿化学试剂有限公司; P-糖蛋白(P-glycoprotein, P-gp)单克隆抗体购自美国Abcam公司; 兔甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)多克隆抗体、辣根过氧化物酶标记的二抗均购自美国Santa Cruz公司.
1.2.1 细胞培养: 人食管癌细胞Eca109在含有10%小牛血清的RPMI 1640培养液(含青霉素100 U/mL及链霉素100 μg/mL), 置于37 ℃、50 mL/L CO2的饱和湿度条件下培养.
1.2.2 食管癌Eca109/DDP耐药细胞的构建: 采用递增药物质量浓度持续作用诱导法[3]构建食管癌Eca109/DDP耐药细胞. 取对数生长期的Eca109细胞接种于含顺铂的RPMI 1640培养液中, 从低浓度0.02 μg/mL的DDP(根据预实验约10%的抑制浓度)开始进行培养, 次日更换正常培养液, 待其恢复正常生长时, 增加顺铂的给药浓度, 如此反复冲击, 直到细胞能在含1 μg/mLDDP的培养基中稳定生长.
1.2.3 MTT法检测DHA对Eca109/DDP细胞增殖的影响: 取对数生长期的Eca109/DDP细胞, 0.25%胰酶消化, 调整细胞浓度为5×104个/mL接种于96孔细胞培养板中, 每孔接种5×103个细胞悬液, 培养24 h, 分4组处理: (1)对照组: 不加任何药物处理; (2)DDP组: 终浓度为1 μg/mL的DDP; (3)DHA组: 倍比稀释终浓度为0.195、0.390、0.780、1.560、3.120 μg/mL的DHA; (4)DHA+DDP组: 先加入1 μg/mL的DDP, 再加入上述浓度的DHA. 每组5个复孔, 继续培养72 h, MTT法测定各孔吸光度(A)值, 计算细胞生长抑制率(inhibition rate, IR). IR = (1-实验组A均值/对照组A均值)×100%.
1.2.4 MTT法检测DHA对Eca109/DDP细胞耐药性的逆转作用: 细胞处理同实验方法1.2.3, 按如下分组实验. (1)DDP组: 倍比稀释的终浓度为0.0625、0.125、0.250、0.500、1.00、2.00、4.00、8.00 μg/mL的DDP; (2)DHA+DDP组: 上述不同浓度的DDP组中分别加入终浓度为0.195、0.390、0.780、1.560 μg/mL的DHA, 每组5个复孔, 培养72 h, MTT法测定A值, 计算IR, 应用SPSS17.0软件采用加权回归法(Bliss法)计算DDP对Eca109/DDP细胞的半数抑制浓度(IC50), 并计算细胞耐药逆转指数(reversal index, RI).
RI = IC50(抗肿瘤药物)/IC50(抗肿瘤药物+逆转剂).
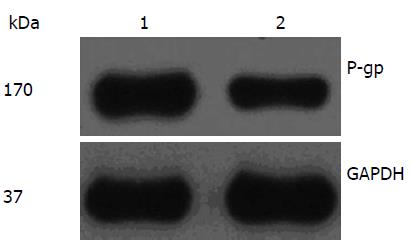
1.2.5 Western blot法检测Eca109/DDP细胞膜上P-gp表达: 分2组实验: (1)DDP组: 加入终浓度为1 μg/mL的DDP; (2)DHA+DDP组: 先加入终浓度为1 μg/mL的DDP, 再加入终浓度为1.560 μg/mL DHA. 每组3个平行复孔, 培养72 h. 收集细胞, 用细胞裂解液裂解细胞提取细胞总蛋白, BCA分析试剂测定各组细胞蛋白质浓度, 取样在SDS-PAGE凝胶中电泳, 将蛋白转移至NC膜上, 加入含5%脱脂奶粉封闭, 用TBST洗膜3次, 加入一抗4 ℃孵育过夜, 次日吸弃一抗, 再洗膜3次后加入辣根过氧化物酶标记的二抗, 室温摇床振荡反应1 h, ECL显色. Western blot图像用GelPro32软件分析灰度值, 以目的蛋白P-gp灰度值/内参蛋白GAPDH灰度值为P-gp的蛋白相对表达量.
统计学处理 用SPSS17.0统计软件对实验数据进行分析, 所有指标以mean±SD表示, 两样本均数比较采用t检验, 多样本均数比较采用方差分析. 以P<0.05为差异有统计学意义.
采用递增药物质量浓度持续作用诱导法, 历经6 mo的诱导, Eca109细胞能在含1 μg/mL DDP的培养基中稳定生长, RI为15.9, 定义为Eca109/DDP(耐DDP的食管癌细胞).
与对照组相比, 当DHA浓度在1.560 μg/mL以下对Eca109/DDP细胞生长无明显抑制作用(P>0.05)(表1), 但和1 μg/mL DDP联合使用则浓度依赖性提高DDP对Eca109/DDP细胞生长抑制作用(P<0.01), 以1.560 μg/mL DHA效果最好(表2).
取对Eca109/DDP细胞无明显毒性作用的DHA(1.560 μg/mL范围以下), 与1 μg/mL DDP联用可不同程度的逆转Eca109/DDP细胞的耐药性, 逆转作用随着DHA浓度升高, 逆转指数也在升高, 呈浓度依赖性. 与DDP组相比, 差异显著(P<0.05, 表3).
Western blot结果显示, DHA与DDP联合作用于Eca109/DDP细胞, Eca109/DDP细胞P-gp表达显著减少(P<0.05, 图1, 2).
肿瘤多药耐药是指肿瘤细胞在接受化疗过程中, 一旦对某种化疗药物产生耐药性, 便同时对其他结构上无关、作用机制各异的药物均产生交叉耐药的广谱耐药现象[4]. 多药耐药是导致肿瘤化疗失败的主要原因之一, 其耐药机制是多种因素综合的结果. 克服肿瘤细胞的多药耐药性已成为提高肿瘤治疗效果的热点研究[5-8].
P-gp是位于细胞膜的糖蛋白, 是一种ATP依赖性的药物转运蛋白, 能够以水解ATP产生的能量将细胞内的药物泵出, 从而减少细胞内的化疗药物浓度, 导致化疗药物不能有效地杀伤肿瘤细胞, 引起肿瘤多药耐药[9]. 因此, 肿瘤细胞膜上P-gp的过度表达或功能异常是肿瘤细胞产生MDR的重要机制之一. 尽管目前关于P-gp的表达调控机制仍不是十分清楚, 但普遍认为丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)信号通路在P-gp介导的MDR中发挥重要作用, 参与了P-gp的表达调控[10]. 维拉帕米、环抱菌素A、奎宁等逆转剂因对P-gp的亲和力低, 给药剂量大, 对人体产生的毒性大, 从而限制了临床应用. 寻找高效、低毒的下调P-gp表达的逆转剂成为了控制MDR策略之一.
二十二碳六烯酸是n-3系多不饱和脂肪酸(n-3 polyunsaturated fatty, n-3 PUFA). 现有研究证实DHA能够抑制乳腺癌、肝癌等多种肿瘤细胞的增殖, 诱导肿瘤细胞的凋亡[11,12]. 但机制尚不明确. 有报道认为与调整PI3-激酶和p38 MAPK通路、激活线粒体凋亡通路有关[12,13], 冯宪光等[14]认为与抑制Bcl-2的表达、促进Bax和Caspase3的表达有关. 此外, 还有实验证明DHA还可以逆转肿瘤细胞的多药耐药性, 提高肿瘤细胞对化疗药物的敏感性[15]. 但二十二碳六烯酸对食管癌亲本细胞及耐药细胞是否有影响未见有文献报道. 我们的实验表明DHA在低浓度(≤1.560 μg/mL)时对Eca109/DDP细胞没有毒性, 但随着浓度逐渐增高则表现出对Eca109/DDP细胞的增殖抑制作用, 且呈浓度依赖性. 为了减少因DHA自身对肿瘤细胞的杀伤作用而产生的实验结果误差, 我们实验均选择了对Eca109/DDP无毒的DHA浓度. 结果显示, 1.560 μg/mL以下的无毒DHA和1 μg/mL DDP联用, 可以逆转Eca109/DDP细胞的耐药性, 且呈浓度依赖性, 同时能显著下调P-gp蛋白表达水平. 初步探讨了DHA通过下调Eca109/DDP细胞膜上P-gp的过度表达逆转肿瘤细胞的多药耐药机制. 关于P-gp的表达调控机制仍有待于进一步深入研究.
顺铂(cisplatin, DDP)是临床上食管癌化疗的首选药物, 但食管癌细胞的多药耐药(multidrug resistance, MDR)降低了化疗药物的疗效. 使用MDR逆转剂是克服MDR方法之一. 目前在体外实验有效的逆转剂因其不良反应太大而不宜在临床开展. 肿瘤多药耐药是指肿瘤细胞在接受化疗过程中, 一旦对某种化疗药物产生耐药性, 便同时对其他结构上无关、作用机制各异的药物均产生交叉耐药的广谱耐药现象. 多药耐药是导致肿瘤化疗失败的主要原因之一, 其耐药机制是多种因素综合的结果.
张力为, 教授, 新疆医科大学第一附属医院胸外科
化疗药物的多药耐药性是导致化疗最终失败的主要原因. 探讨多药耐药的机制以及寻找对人体不良反应小逆转剂是当今研究的热点和重点, 也是当今化疗药物使用效果不理想所亟待解决的问题.
孙思楠等研究了二十二碳六烯酸对人肝癌细胞增殖与凋亡影响及其机制, 羊轶驹等人研究的是二十二碳六烯酸与多柔比星联合用药后对人胃癌细胞SGC-7901的作用. 结果证实二十二碳六烯酸对人肝癌细胞和胃癌细胞都有杀伤作用, 同时可增加化疗药物的敏感, 也影响着癌细胞膜上P-糖蛋白的表达. 与本文二十二碳六烯酸作用于食管癌细胞结果基本一致. 不同的是, 这两篇研究的都是肿瘤的亲本细胞.
尽管目前关于多药耐药的研究较多, 但关于耐药细胞的P-gp研究不多, 关于耐药食管癌细胞的P-gp表达情况未见报道. 关于二十二碳六烯酸对食管癌细胞是否具有杀伤和抑制作用未见相关报道. 关于二十二碳六烯酸能否通过抑制P-糖蛋白的表达逆转耐药食管癌细胞对抗食管癌药物的耐药性未见相关报道.
本文探讨二十二碳六烯酸对食管癌Eca109/DDP细胞的增殖抑制以及对食管癌多药耐药基因P-糖蛋白的影响, 为临床开发高效、低毒肿瘤多药耐药逆转剂提供实验依据. 该项研究目标明确, 实验方法科学合理, 实验结果可靠, 具有较高的临床实用价值.
编辑: 郭鹏 电编:鲁亚静
| 2. | Gan SY, Zhong XY, Xie SM, Li SM, Peng H, Luo F. Expression and significance of tumor drug resistance related proteins and beta-catenin in esophageal squamous cell carcinoma. Chin J Cancer. 2010;29:300-305. [PubMed] [DOI] |
| 3. | 王 开雷, 李 乐平, 靖 昌庆. 两种人大肠癌多药耐药株的建立及耐药性比较. 山东大学学报(医学版). 2011;49:75-79, 114. |
| 4. | Takara K, Sakaeda T, Okumura K. An update on overcoming MDR1-mediated multidrug resistance in cancer chemotherapy. Curr Pharm Des. 2006;12:273-286. [PubMed] |
| 5. | Elkadi OA. MDR-selective microbial-based therapy: a novel approach to cancer treatment. Med Hypotheses. 2013;81:207-211. [PubMed] [DOI] |
| 6. | Schumacher U, Nehmann N, Adam E, Mukthar D, Slotki IN, Horny HP, Flens MJ, Schlegelberger B, Steinemann D. MDR-1-overexpression in HT 29 colon cancer cells grown in SCID mice. Acta Histochem. 2012;114:594-602. [PubMed] [DOI] |
| 8. | 隋 华, 周 利红, 刘 宣, 殷 佩浩, 周 宁, 王 炎, 孙 珏, 范 忠泽, 李 琦. COX-2介导MDR1/P-gp调控人结肠癌细胞多药耐药的研究. 中国癌症杂志. 2011;21:241-246. |
| 9. | Du Y, Shi WW, He YX, Yang YH, Zhou CZ, Chen Y. Structures of the substrate-binding protein provide insights into the multiple compatible solute binding specificities of the Bacillus subtilis ABC transporter OpuC. Biochem J. 2011;436:283-289. [PubMed] [DOI] |
| 10. | Derin D, Eralp Y, Ozluk Y, Yavuz E, Guney N, Saip P, Igci A, Ozmen V, Kücücük S, Aslay I. Lower level of MAPK expression is associated with anthracycline resistance and decreased survival in patients with hormone receptor negative breast cancer. Cancer Invest. 2008;26:671-679. [PubMed] [DOI] |
| 11. | Blanckaert V, Ulmann L, Mimouni V, Antol J, Brancquart L, Chénais B. Docosahexaenoic acid intake decreases proliferation, increases apoptosis and decreases the invasive potential of the human breast carcinoma cell line MDA-MB-231. Int J Oncol. 2010;36:737-742. [PubMed] [DOI] |
| 13. | Toit-Kohn JL, Louw L, Engelbrecht AM. Docosahexaenoic acid induces apoptosis in colorectal carcinoma cells by modulating the PI3 kinase and p38 MAPK pathways. J Nutr Biochem. 2009;20:106-114. [PubMed] [DOI] |