修回日期: 2013-10-06
接受日期: 2013-10-17
在线出版日期: 2013-11-18
目的: 探讨分泌型磷脂酶A2(secreted phospholipase A2, sPLA2)在重症急性胰腺炎(severe acute pancreatitis, SAP)肠道屏障损伤时的表达及作用, 观察清胰汤对其表达及病情转归的影响.
方法: 40只SD大鼠随机分为: 假手术组、SAP组、清胰汤组和地塞米松组, 采用胆胰管逆行注射1.5%去氧胆酸钠制备SAP大鼠模型, 造模后24 h取胰、肠组织及静脉血. 观察胰和肠组织病理改变, ELISA法测定大鼠血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)含量, 化学法检测血清二胺氧化酶(diamineoxidase, DAO)含量, 全自动生化分析仪检测血清淀粉酶(amylase, AMY)含量, RT-PCR法检测肠组织sPLA2 mRNA的表达, Western blot法检测肠组织sPLA2蛋白的表达.
结果: 与假手术组比较, SAP组血清淀粉酶、TNF-α和二胺氧化酶(7208.8 U/L±264.6 U/L vs 1358.8 U/L±458.2 U/L、180.53 ng/L±20.1 ng/L vs 59.67 ng/L±14.3 ng/L、37.889 U/L±5.86 U/L vs 10.374 U/L±2.44 U/L)含量明显升高、肠组织中sPLA2 mRNA和蛋白含量均明显增高, 胰、肠组织病理损伤明显. 与SAP组相比, 清胰汤组、地塞米松组的血清淀粉酶、TNF-α和二胺氧化酶(AMY: 4047.6 U/L±600.9 U/L, 4914.4 U/L±200 U/L vs 7208.8 U/L±264.6 U/L, 均P<0.05; DAO: 22.430 U/L±2.13 U/L, 24.272 U/L±3.36 U/L vs 37.889 U/L±5.86 U/L, 均P<0.05; TNF-α: 122.35 ng/L±15.2 ng/L, 136.99 ng/L±23.4 ng/L vs 180.53 ng/L±20.1 ng/L, 均P<0.05)含量显著降低、肠组织中sPLA2 mRNA和蛋白均不同程度降低, 胰、肠病理损伤较轻.
结论: SAP时过度表达的sPLA2在肠道屏障损伤中起重要作用; 清胰汤能减轻胰和肠组织的病理损害, 对抗sPLA2在肠组织中的过度表达.
核心提示: 本研究显示, 重症急性胰腺炎并发肠道屏障损伤时, 分泌型磷脂酶A2(secreted phospholipase A2, sPLA2)mRNA和sPLA2蛋白的表达明显升高, 清胰汤、地塞米松可以降低磷脂酶A2的表达, 减轻胰和肠组织的损伤, 为进一步探究重症急性胰腺炎时肠道屏障损伤的发病机制提供理论支持.
引文著录: 张经文, 陈海龙, 王玉玺, 王超. 重症急性胰腺炎肠道屏障损伤时sPLA2的表达及清胰汤的影响. 世界华人消化杂志 2013; 21(32): 3537-3542
Revised: October 6, 2013
Accepted: October 17, 2013
Published online: November 18, 2013
AIM: To investigate the expression of secreted phospholipase A2 (sPLA2) in the intestine tissue of rats with severe acute pancreatitis (SAP) and to analyze its implications for therapeutic effects of Qingyitang.
METHODS: Forty healthy Sprague-Dawley rats were randomly divided into a sham group, a SAP group, a Qingyitang group, and a dexamethasone group. SAP was induced by retrograde infusion of 1.5% sodium deoxycholate into the biliopancreatic duct of rats except the sham operation group. All rats were killed 24 h after operation. Pathological alterations of the intestine and pancreas were observed under a light microscope. Serum amylase (AMY) was determined by biochemical method. Blood levels of tumor necrosis factor-α (TNF-α) and diamineoxidase (DAO) were measured by enzyme-linked immunosorbent assay (ELISA) and chemical method. The expression levels of sPLA2 mRNA and protein in the intestine were analyzed by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively.
RESULTS: The expression levels of sPLA2 mRNA and protein in the intestine tissue and serum levels of AMY, DAO, and TNF-α were significantly higher in the SAP group than in the sham operation group (P < 0.05); however, these indexes in the Qingyitang group and dexamethasone group were significantly lower than those in the SAP group (AMY: 4047.6 U/L ± 600.9 U/L, 4914.4 U/L ± 200 U/L vs 7208.8 U/L ± 264.6 U/L, both P < 0.05; DAO: 22.430 U/L ± 2.13 U/L, 24.272 U/L ± 3.36 U/L vs 37.889 U/L ± 5.86 U/L, both P < 0.05; TNF-α: 122.35 ng/L ± 15.2 ng/L, 136.99 ng/L ± 23.4 ng/L vs 180.53 ng/L ± 20.1 ng/L, both P < 0.05).
CONCLUSION: sPLA2 may play a role in the pathogenesis of acute intestine barrier injury in rats with severe acute pancreatitis. Qingyitang decreases intestinal permeability and bacterial translocation possibly by inhibiting overexpression of sPLA2 in the intestine.
- Citation: Zhang JW, Chen HL, Wang YX, Wang C. Expression of sPLA2 in intestine barrier injury in rats with severe acute pancreatitis: Implications for therapeutic effect of Qingyitang. Shijie Huaren Xiaohua Zazhi 2013; 21(32): 3537-3542
- URL: https://www.wjgnet.com/1009-3079/full/v21/i32/3537.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i32.3537
重症急性胰腺炎(severe acute pancreatitis, SAP)是一种外科常见急腹症, 早期常可因为伴发全身炎症反应综合征和多器官功能障碍综合征而导致患者死亡[1], 而这些严重伴发怔的形成往往是由肠道屏障损伤后肠道内的大量细菌和内毒素, 通过血液循环和淋巴途径作用于全身各个脏器[2], 激活了体内单核巨噬细胞系统, 释放大量的肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、干扰素、白介素等炎性因子, 通过"扳机样作用"触发炎症介质的"瀑布样级联反应"[3], 进一步加重组织损伤, 分泌型磷脂酶A2(secreted phospholipase A2, sPLA2)作为一个极其重要的损伤因子, 在大量炎性因子的刺激下, sPLA2过度表达, 并通过降解细胞表面活性物质, 水解生物膜上的卵磷脂而加重器官和组织损伤[4,5]. 清胰汤(qingyitang, QYT)能有效的通腑利肠泻肺实, 中和内毒素降低其毒性, 促进肠内有毒物质的排出保护肠道屏障, 其对SAP时肠道屏障损伤的防治作用及作用机制已成为近年来研究的热点[6]. 因此, 本文通过制备SAP大鼠模型, 观察sPLA2在SAP大鼠肠组织的表达情况, 探讨sPLA2在SAP肠道屏障损伤中的作用及清胰汤的干预作用, 为临床有效调控炎症因子, 保护肠道屏障提供理论基础.
♂SD大鼠40只, 体质量180-220 g, 由大连医科大学清洁级实验动物中心提供; RT-PCR试剂盒和RNAiso Plus购自大连宝生物公司; 引物由大连宝生物公司合成, sPLA2: 5'-GTGGCAGGATCCCCCAAGG-3'(上游), 5'-GCAACTGGGCGTGTTCCCTCTGCA-3'(下游), 产物长度: 283 bp; sPLA2抗体购自美国SANTA公司; 二胺氧化酶(diamineoxidase, DAO)检测试剂盒购自南京建成公司; SDS-PAGE、全蛋白提取液购自南京凯基生物公司; 琼脂糖购自美国Sigma公司; 清胰汤: 由柴胡15 g、黄芩12 g、元胡15 g、木香15 g、白芍15 g、栀子15 g、大黄15 g(后下)、芒硝15 g(冲服)组成, 由大连医科大学中药科熬制, 药液制成后4 ℃保存72 h内使用.
1.2.1 分组和造模: 40只清洁SD大鼠随机分为: 假手术组(sham operation, SO)、SAP模型组、QYT组、地塞米松组(dexamethasone, DEX), 采用胆胰管内逆行注入1.5%去氧胆酸钠, 建立大鼠SAP肠道屏障损伤模型. 大鼠术前禁食12 h、自由饮水, 10%水合氯醛(剂量为3 mL/kg)麻醉. 无菌条件下, 开腹显露十二指肠大乳头, 在十二指肠大乳头胆胰管开口处的对侧肠壁插入1 mL注射器, 针头经十二指肠大乳头的胆胰管开口处逆行进入胆胰管, 匀速注入1.5%去氧胆酸钠(剂量1 mL/kg, 速度0.1 mL/min), 注毕2 min关腹. SO组于开腹后仅轻翻胰腺数次后关腹. DEX组(剂量: 10 mg/kg, 浓度: 5 mg/mL)于造模后立即、6和12 h静脉注射药物. QYT组造模前0.5 h、造模后6和12 h再次灌胃(剂量: 10 mL/kg). 各组动物造模后24 h, 麻醉下开腹, 腹主动脉采血, 留血清-80 ℃保存, 待测血清淀粉酶、二胺氧化酶、TNF-α的含量. 迅速取胰腺、肠组织(距回盲部近端1 cm)各100 mg, -80 ℃保存待测组织sPLA2 mRNA及蛋白的表达水平. 剩余的胰腺、肠组织, 置入中性磷酸盐甲醛固定液中.
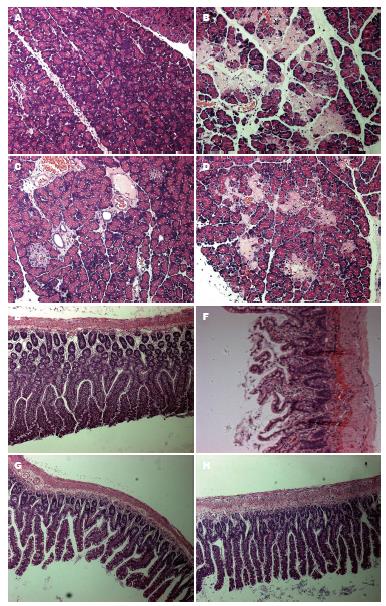
1.2.2 胰腺和肠组织的病理形态学观察: 胰腺、肠组织, 置入中性磷酸盐甲醛固定液中, 液体石蜡包埋, 以2 μm连续切片, 进行常规HE染色观察病理组织学变化.
1.2.3 二胺氧化酶检测: 采用DAO检测试剂盒. 血清80 μL+检测试剂(Tris-HCl、还原型辅酶、谷氨酸脱氢酶、1,4-丁二胺混合液)800 μL, 混匀后20 s时读取340 nm波长的吸光度记录为A1值, 立即放入37 ℃水浴锅反应10 min, 10 min 20 s时读取340 nm波长的吸光度记录为A2值. DAO活力(U/L) = (A1-A2)/[反应时间(10 min)×比色光径(0.5 cm)×6.3(NADH 340 nm处毫摩尔消光系数)]×[反应液总体积(880 μL)/样本体积(80 μL)]×1000.
1.2.4 血清淀粉酶含量测定: 全自动生化分析仪检测, 取50 μL大鼠血清1:600纯水稀释后上机检测.
1.2.5 血清TNF-α检测: 采用酶联免疫吸附剂测定(ELISA)试剂盒, 加入待测样本40 μL、抗TNF-α抗体10 μL和辣根过氧化物酶标记的链霉亲和素50 μL, 在37 ℃环境中反应60 min, 再于洗涤后加入显色剂A液和B液各50 μL, 37 ℃避光条件下显色反应10 min后测量各样品的A值, 再根据样品的吸光度用回归方程计算出其所对应的样品中TNF-α的含量.
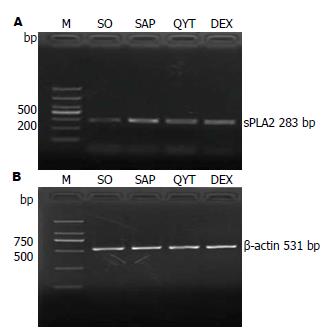
1.2.6 肠组织sPLA2 mRNA的检测: 采用反转录聚合酶链式反应(reverse transcription polymerase chain reaction, RT-PCR)技术, 50 mg肠组织加RNAisoPlus 1 mL, 匀浆后取上清加入200 μL氯仿, 震荡离心后, 取上清液加等体积异丙醇, 混匀后离心, 管底出现沉淀即为总RNA沉淀, 紫外光度计测得A260/A280值在1.8-2.0之间. PCR按常规操作其中退火温度为60 ℃持续30 s, 循环30次, 用紫外成像系统读取PCR产物的琼脂糖凝胶电泳结果并拍照保存, 采用灰度分析肠sPLA2 mRNA条带灰度值与其对应内参β-actin条带灰度值的比值即肠组织sPLA2 mRNA表达水平.
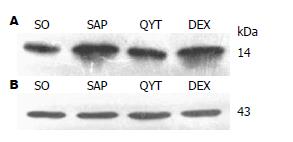
1.2.7 肠组织sPLA2蛋白的检测: 采用蛋白印迹Western blot法检测, 100 mg肠组织加入1 mL蛋白提取液, 匀浆后离心取蛋白, 紫外分光光度计测蛋白含量, 蛋白上样量100 μg, 电泳时间30 min, 转膜14 min, 37 ℃封闭1 h, 一抗(1:400)4 ℃摇床孵育过夜, 漂洗3次, 二抗(1:10000)37 ℃轻摇孵育1 h, 漂洗3次, HRP-ECL发光, 胶片曝光, 用灰度分析软件分析结果.
统计学处理 各检测结果数据用mean±SD表示, 通过SPSS13.0统计软件, 采用单因素方差分析的方法对各组均数进行显著性检验, 指标间的分析采用Pearson积矩相关分析来说明相关性. P<0.05差异具有统计学意义.
各组大鼠的胰及肠组织病理改变差异明显, 其中SO组胰腺小叶和肠黏膜结构清晰未出现水肿出血, SAP组胰腺小叶结构模糊, 大量炎细胞浸润出现大片出血, 坏死面积超过50%, 肠黏膜上皮细胞出现片状坏死. 而QYT、DEX组病理损伤较SAP组明显减轻, QYT组肠黏膜上皮细胞肿胀但大体形态正常, DEX组除细胞肿胀变形外还有不同程度的炎细胞浸润(图1).
与SO组相比较, SAP组大鼠的血淀粉酶显著升高(P<0.01). 与SAP组比较QYT、DEX组大鼠血淀粉酶降低明显(P<0.05), 其中QYT组降低更为明显(表1).
与SO组相比较, SAP组血清TNF-α含量显著升高(P<0.01). 与SAP组相比较, QYT、DEX组血清TNF-α含量显著降低(P<0.05, 表1).
与SO组相比较, SAP组血清二胺氧化酶(DAO)显著升高(P<0.01). 与SAP组相比较QYT、DEX组血清DAO含量显著降低(P<0.05), 其中QYT组的DAO降低更为明显(表1).
mRNA在肠组织中的表达水平 与SO组相比较, 在SAP组肠组织sPLA2 mRNA的表达显著升高(P<0.01). 与SAP组比较, QYT、DEX组肠组织sPLA2 mRNA的表达显著降低(P<0.05). 同时其在QYT、DEX组、的表达较SO组有不同程度升高(P<0.01, 图2).
与SO组相比较, sPLA2蛋白在SAP组肠组织中表达显著升高(P<0.01), 与SAP组比较, QYT、DEX组sPLA2蛋白的表达明显下降(P<0.05), 以QYT组表达下降更明显, QYT、DEX组该蛋白表达较SO组有明显升高(P<0.05, 图3).
sPLA2广泛存在于哺乳动物的组织和细胞中, 其可以在磷脂重建、传递细胞信号等生理过程中发挥重要的作用. 但在某些严重疾病, 如SAP时, 过度表达的sPLA2, 不仅降解细胞表面活性物质, 使组织顺应性下降, 还能促进花生四烯酸(arachidonic acid, AA)、前列腺素(prostaglandin, PG)、血小板活化因子(platelet activating factor, PAF)等生物活性介质的大量释放[7-9], sPLA2的过度表达主要由炎性介质的大量刺激而产生, 也是小肠缺血再灌注损伤的重要因素[10,11]. sPLA2可以通过降解细胞膜的磷脂成分从而直接损伤肠黏膜, 也可间接引起微循环障碍、缺血再灌注损伤和调节炎症细胞因子网络, 从而对肠黏膜屏障发起攻击. 在SAP的发生发展过程中, 肠管的运动能力减弱, 可引起麻痹性肠梗阻[12], 肠道内致病菌大量繁殖, 在大量炎症因子和致伤因素的联合作用下[12], 肠黏膜上皮细胞大量凋亡和坏死[13], 破坏了肠黏膜机械屏障, 并释放大量如磷脂酶和二胺氧化酶等活性物质. 同时Wilmore等首次提出的, 即认为肠道屏障损伤可能是引发SIRS或MODS的始动因素之一[14-17]. 因此, 研究sPLA2在SAP肠道屏障损伤发病机制中的作用, 具有重要的意义. 我们发现, 在SAP大鼠模型建立24 h后, 胰腺和肠组织损伤性病理变化明显, 血清AMY、TNF-α、DAO水平明显升高, RT-PCR和Western blot法检测sPLA2 mRNA和蛋白的表达显著升高, 且二者呈正相关关系. 该实验以血清AMY水平和胰腺病理变化来判定胰腺组织损伤程度, 以血清DAO水平和肠组织病理变化来判定肠道屏障损伤程度. 该实验中显示, 肠道屏障损伤程度与sPLA2 mRNA和蛋白的表达呈正相关关系, sPLA2的过度表达同时发生在转录和翻译水平, 其在SAP肠道屏障损伤的发生过程中具有重要作用.
同时该实验显示, 清胰汤、地塞米松两组药物均能减轻胰腺和肠组织的损伤, 可以降低血清AMY、TNF-α、DAO水平, 降低sPLA2 mRNA和蛋白的表达, 其中以清胰汤疗效更为突出. 清胰汤以通里攻下、清热解毒、活血化瘀辅以益气营血为主要治则[18]. 组方中大黄、芒硝具有通里攻下, 泻热通腑, 涤荡积滞, 通畅腹气, 排出糟粕的作用, 结合该方中元胡活血化淤, 配合木香、柴胡、白芍可起到疏肝理气之功效[19]. 通里攻下有利于减轻肠麻痹的症状, 能促进肠腔内过度表达的磷脂酶、血管活性物质及毒性物质的排除, 减少肠道细菌的增殖, 降低因细菌易位及大量内毒素入血引起的毒性作用, 对抗炎症介质过度表达的损伤作用[8,20]. 但清胰汤对SAP肠道屏障损伤时sPLA2表达水平的影响, 尚未见深入研究. 地塞米松作为一种临床上常用的抗炎剂, 能抑制炎症反应, 减少炎性渗出, 维持血管通透性, 对抗因磷脂酶A2激发而大量释放的血小板活化因子等导致血管通透性增加的作用, 从而起到缓解炎症反应减轻组织损伤的作用. 本实验通过观察清胰汤对SAP大鼠的干预效果, 以地塞米松干预组为参照发现, 其可以在转录和翻译水平有效降低sPLA2的表达水平, 减轻肠道屏障的损伤程度. 而且, 该前期实验结果显示, 单位时间内肠黏膜内sPLA2表达明显高于肺组织内sPLA2表达, 具有显著的统计学意义. 表明sPLA2在肠道屏障损伤中的作用值得引起注意.
在对两种药物干预效果进行比较后, 可以发现在大鼠SAP模型建立后的前6 h内, 地塞米松干预组大鼠的生命活力优于清胰汤组, 但在模型建立后24 h时的生存状态明显差于清胰汤组. 清胰汤组大鼠的病情进展较为平缓, 清胰汤的治疗作用虽起效较慢, 但其作用时间较长, 且作用较地塞米松更为稳定. 在临床对重症急性胰腺炎特别是伴发肺损伤的治疗中已广泛应用, 目前根据急性胰腺炎的临床分期、病情演变等特点, 应用中医辩证论治、因人、因地、因时制宜的理论, 充分利用中药的整体观和综合治疗作用, 将清胰汤与地塞米松、胰酶抑制剂、抗氧化剂、抗生素等西药有机结合起来使用, 并不失时机地选择外科手术引流、腹腔灌洗、床旁血滤等微创和介入治疗方法, 发挥其各自的优点, 降低急性胰腺炎肺损伤等并发症的发生率和死亡率.
急性胰腺炎发病急、变化快. 其中10%-20%急性胰腺炎(acute pancreatitis, AP)患者随时可发展为重症急性胰腺炎(severe acute pancreatitis, SAP), 特别是伴发全身炎症反应综合征和多器官衰竭时, 死亡率可达25%-30%, 而其发病机制至今未完全阐明, 临床救治非常棘手.
陈其奎, 教授, 主任医师, 中山大学附属第二医院消化内科
目前普遍认为SAP伴发多器官衰竭的始动因素为肠道屏障损伤、肠道屏障的损伤和其在SAP发病机制中的作用成为当前研究的热点.
自从1988年Wilmore提出"肠道中心学说"以来, 人们对于肠道屏障损伤在胰腺炎伴发多器官衰竭中的作用有了较深入的认识, 相关的动物模型研究非常多. 系统深入的分子水平研究报道还不多见.
本研究通过观察分泌型磷脂酶A2(secreted phospholipase A2, sPLA2)在肠道屏障损伤中的作用, 为深入探寻肠道屏障在重症急性胰腺炎伴发多器官衰竭发病机制中的作用及临床诊治措施提供有益的线索.
本研究证实sPLA2在急性胰腺炎肠道屏障损伤的发生过程中具有重要作用, 清胰汤、地塞米松可以通过降低磷脂酶A2的表达, 减轻肠和胰腺组织的损伤, 合理的中西医结合治疗能多层次、多水平、多途径的对SAP进行有效的治疗.
本文观察了sPLA2在SAP肠道屏障损伤时的表达及清胰汤对其表达及SAP病情转归的影响. 研究SAP肠道屏障及其影响因素对SAP的防治, 以及预后转归有较好的理论意义和临床价值.
编辑: 郭鹏 电编:闫晋利
| 1. | Tenner S, Sica G, Hughes M, Noordhoek E, Feng S, Zinner M, Banks PA. Relationship of necrosis to organ failure in severe acute pancreatitis. Gastroenterology. 1997;113:899-903. [PubMed] [DOI] |
| 8. | Bingham CO, Austen KF. Phospholipase A2 enzymes in eicosanoid generation. Proc Assoc Am Physicians. 1999;111:516-524. [PubMed] [DOI] |
| 9. | Furue S, Hori Y, Kuwabara K, Ikeuchi J, Onoyama H, Yamamoto M, Tanaka K. Increased activity of group II phospholipase A2 in plasma in rat sodium deoxycholate induced acute pancreatitis. Gut. 1997;41:826-831. [PubMed] [DOI] |
| 11. | McHowat J, Liu S. Interleukin-1beta stimulates phospholipase A2 activity in adult rat ventricular myocytes. Am J Physiol. 1997;272:C450-C456. [PubMed] |
| 14. | Chen X, Ji B, Han B, Ernst SA, Simeone D, Logsdon CD. NF-kappaB activation in pancreas induces pancreatic and systemic inflammatory response. Gastroenterology. 2002;122:448-457. [PubMed] [DOI] |
| 15. | Hassoun HT, Kone BC, Mercer DW, Moody FG, Weisbrodt NW, Moore FA. Post-injury multiple organ failure: the role of the gut. Shock. 2001;15:1-10. [PubMed] [DOI] |
| 16. | Luiten EJ, Hop WC, Endtz HP, Bruining HA. Prognostic importance of gram-negative intestinal colonization preceding pancreatic infection in severe acute pancreatitis. Results of a controlled clinical trial of selective decontamination. Intensive Care Med. 1998;24:438-445. [PubMed] [DOI] |
| 17. | Wilmore DW, Smith RJ, O'Dwyer ST, Jacobs DO, Ziegler TR, Wang XD. The gut: a central organ after surgical stress. Surgery. 1988;104:917-923. [PubMed] |
| 19. | 闻 庆平, 陈 海龙, 关 凤林. 清胰汤对大鼠重症急性胰腺炎时急性肺损伤治疗作用的观察. 中国中西医结合外科杂志. 2003;8:302-306. |