修回日期: 2012-12-26
接受日期: 2013-01-07
在线出版日期: 2013-01-28
目的: 通过夹闭胰头部的方法建立一种新型大鼠重症急性胰腺炎相关性肺损伤(severe acute pancreatitis-associated lung injury, SAP-LI)的动物模型.
方法: 将SPF级健康♂SD大鼠210只随机分为: 对照组、假手术组、重症急性胰腺炎相关性肺损伤模型组, 每组70只. 再分别将每个分组中的70只大鼠随机分为7个分组, 包括0、6、12、18、24、36、48 h组, 每组10只大鼠. SAP-LI模型组用16 cm弯止血钳夹闭胰头2 h后松开. 假手术组于相应各时间点开腹后, 仅轻轻翻动胰腺10次后放回其解剖位置. 正常对照组除麻醉3 h外不做任何处理. 在造模完成后, 分别于相应各时间点采集血液、肺泡灌洗液、肺组织、胰腺组织标本. 行血淀粉酶、总蛋白、中性粒细胞百分比检测, 行大鼠肺组织湿/干质量比, 肺泡灌洗液蛋白检测, 行肺组织、胰腺组织病理学观察.
结果: 造模大鼠均存活. SAP-LI模型组大鼠血清淀粉酶12 h(5 052.1 U/L±114.9 U/L, P<0.01)、中性粒细胞百分比值12 h(75.2%±5.8%, P<0.05)达到峰值, 大鼠肺灌洗液蛋白与血清蛋白比值36 h(0.009021±0.000107, P<0.01)达到高峰; 大鼠肺组织湿/干质量比36 h(1.2001±0.0443, P<0.01)达到最小值. SAP-LI模型组与对照组和假手术组比较, 差异均具有统计学意义(P<0.05). 病理组织学观察可见造模后随时间进程胰腺炎呈加重表现, 肺组织损伤36 h最重. SAP-LI模型组血清淀粉酶与血液中性粒细胞百分比、肺湿干质量比均呈正相关(r = 0.794, P<0.01; r = 0.365, P = 0.002). 中性粒细胞百分比与肺湿干质量比呈正相关(r = 0.356, P = 0.003). 肺湿干质量比、肺灌洗液蛋白与血清蛋白比值呈负相关(r = -0.717, P<0.01). 胰腺病理学评分与肺脏病理学评分呈正相关(r = 0.934, P<0.01).
结论: 通过夹闭胰头部的方法建立了一种新型大鼠重症急性胰腺炎致肺损伤动物模型, 36 h为肺损伤最严重的时间点, 也是我们建模的最佳时间点. 为重症急性胰腺炎致肺损伤的发病机制及药物干预研究提供了一种较为理想的动物模型.
引文著录: 王皓, 刘江伟, 李之令, 薛晓玉, 赵红艳, 郭飞, 许永华. 大鼠重症急性胰腺炎相关性肺损伤模型的建立. 世界华人消化杂志 2013; 21(3): 211-219
Revised: December 26, 2012
Accepted: January 7, 2013
Published online: January 28, 2013
AIM: To establish a rat model of severe acute pancreatitis (SAP)-associated lung injury (LI) by occluding the head of the pancreas.
METHODS: Two hundred and ten rats were randomly and equally divided into a control group, a sham-operated group, and a SAP-LI model group. Rats in each group was further divided into seven subgroups for testing at 0, 6, 12, 18, 24, 36, and 48 h (n = 10 for each). The SAP-LI model group underwent occlusion of the head of the pancreas with vessel forceps. The sham-operated group underwent a surgical procedure similar to the SAP-LI model group but the head of the pancreas was not occluded. The control group only underwent anesthetization for 3 h. Blood, pulmonary alveolar lavage fluid, lung tissue and pancreatic tissue samples were collected at various time points. The level of serum amylase, content of serum proteins, percentage of polymorphonuclear neutrophils, wet/dry weight ratio of lung tissue, and content of proteins in pulmonary alveolar lavage fluid were determined. Pathological changes in lung and pancreatic tissues were observed under a light microscope.
RESULTS: All rats were live in the experiment. The level of serum amylase (5052.1 U/L ± 114.9 U/L, P < 0.01) and the percentage of polymorphonuclear neutrophils (75.2% ± 5.8%, P < 0.05) reached the peak at 12 h, and the ratio of the content of proteins in pulmonary alveolar lavage fluid to the content of serum proteins reached the peak at 36 h in the SAP-LI model group (0.009021 ± 0.000107, P < 0.01). The wet/dry weight ratio of lung tissue, reaching the minimum at 36 h in the SAP-LI mold group (1.2001 ± 0.0443, P < 0.01), differed significantly between the SAP-LI group and the other two groups (both P < 0.05). Pancreatic tissue injury became worse with the prolongation of time. LI was most serious at 36 h. Serum amylase showed a correlation with the percentage of polymorphonuclear neutrophils and wet/dry weight ratio of lung tissue (r = 0.788,P < 0.01; r = 0.365, P = 0.002). The percentage of polymorphonuclear neutrophils showed a correlation with the wet/dry weight ratio of lung tissue (r = 0.348, P = 0.003). The wet/dry weight ratio of lung tissue showed a correlation with the ratio of the content of proteins in pulmonary alveolar lavage fluid to the content of serum proteins (r = -0.717, P < 0.01). The score of pancreatic tissue pathology showed a correlation with that of lung tissue pathology (r = 0.934, P < 0.01).
CONCLUSION: A new rat model of SAP-associated LI has been successfully developed by occluding the head of the pancreas, providing an ideal model for studying the pathogenesis and treatment of this condition. LI was most serious at 36 h, which is the optimal time point for inducing SAP-associated LI.
- Citation: Wang H, Liu JW, Li ZL, Xue XY, Zhao HY, Guo F, Xu YH. Development of a rat model of severe acute pancreatitis-associated lung injury. Shijie Huaren Xiaohua Zazhi 2013; 21(3): 211-219
- URL: https://www.wjgnet.com/1009-3079/full/v21/i3/211.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i3.211
重症急性胰腺炎相关性肺损伤(severe acute pancreatitis-associated lung injury, SAP-LI)是重症急性胰腺炎(severe acute pancreatitis, SAP)胰外损伤中严重的并发症. SAP-LI的发生率高达60%-70%[1], 其中继发急性呼吸窘迫综合征者占20%, 为重症急性胰腺炎(severe acute pancreatitis, SAP)患者早期死亡的主要原因[2]. 目前对于急性胰腺炎导致肺损伤的机制仍未完全阐明. 关于SAP-LI模型的研究少有报道, 目前尚缺少一种稳定、可靠、重复性强的SAP-LI模型, 因而制约着急性胰腺炎相关性肺损伤机制及救治研究的进一步深入. 我们首先在前期建立SAP模型[3]的基础上建立SAP-LI模型, 为急性胰腺炎肺损伤的救治研究奠定基础.
SPF级♂SD大鼠购自新疆医科大学动物中心, 8-10周龄, 平均体质量350 g. 3%戊巴比妥钠由兰州军区乌鲁木齐总医院动物实验科提供. 全自动生化分析仪(迈瑞公司CF-87800); 全自动血细胞检测仪(迈瑞公司BC-5800); 烘箱, 16 cm弯止血钳(张家港市锦丰锦鹿刀剪厂); 一次性使用无菌纱布块(乌鲁木齐市雅婕卫生材料有限公司); 抗凝管: EDTA-K2(山东威高集团医用高分子制品股份有限公司); 促凝管: 促凝剂+分离胶(山东威高集团医用高分子制品股份有限公司); BCA蛋白定量试剂盒: 100T/96样购自南京建成生物技术有限公司.
1.2.1 分组: 将210只♂SD大鼠随机分为对照组、假手术组、SAP-LI模型组, 每组70只. 再分别将每个分组中的70只大鼠随机分为7个分组, 包括0、6、12、18、24、36、48 h组, 每组10只大鼠.
1.2.2 术前准备及术后处理: 大鼠术前禁食12 h, 自由饮水. 术前称质量, 使用3%戊巴比妥钠按照40 mL/kg用量行腹腔注射麻醉. 麻醉成功后行备皮、消毒、铺巾. 术中注意观察大鼠呼吸和心跳情况, 术后放回饲养箱. 大鼠苏醒后可自由进食、饮水.
1.2.3 手术建模方法和步骤: SAP-LI模型组: 取大鼠腹部正中切口, 长约2 cm, 逐层入腹. 将脾脏及胰腺从大鼠左侧腹部一并提出, 将肠管推向下, 胃翻向大鼠头侧, 沿胃大弯侧游离胰腺直至胰头部. 用0.9%生理盐水浸湿纱布, 用两层纱布包绕胰头1 wk, 16 cm弯止血钳夹闭包有湿纱布的胰头部, 将胃复位后放回腹腔, 用盐水纱布覆盖手术区. 2 h后松开止血钳, 探查胰腺及腹腔内无出血后逐层关腹. 假手术组: 将大鼠开腹后提出胰腺, 正反共翻动胰腺10次后, 将其放回解剖位置后关腹. 正常对照组麻醉3 h, 不开腹, 其他处理同其余两组.
1.2.4 指标检测及取材方法: (1)SAP-LI模型组、假手术组、对照组分别于0、6、12、18、24、36、48 h麻醉大鼠, 腹部消毒, 开腹, 由下腔静脉采血2 mL注入EDTA抗凝管, 行血常规检测.采血3 mL注入促凝管, 行血淀粉酶、总蛋白检测; (2)延长腹部切口至胸部, 再延长至颈部. 用丝线在左侧肺门处将左主支气管及肺动静脉一并结扎. 分离气管, 在气管软骨环处用眼科剪将气管剪开一个V型切口, 用一次性静脉输液针做气管插管, 缝线固定插管. 用5 mL注射器吸取4 mL 4 ℃无菌生理盐水, 将注射器连接于气管插管, 缓慢推注, 用无齿镊轻轻晃动右肺, 然后缓慢回抽注射器, 记录回收肺泡灌洗液(BALF)量并计算肺泡灌洗液回收百分率. 要求回收率>80%. 连续灌洗5次, 共灌洗20 mL. 将肺泡灌洗液2000 r/min离心10 min后, 吸取上清置入新EP管中, -80 ℃冰箱冻存, 待行BALF中的蛋白测定; (3)取胰腺体尾部组织两块, 各约0.6 cm×0.6 cm大小, 用4%福尔马林固定后石蜡包埋, 切片后行HE染色, 进行组织形态学观察, 行胰腺病理学评分; (4)取大鼠左肺上叶, 称质量后放入80 ℃温箱烘烤48 h, 烘干后再次称质量, 计算肺湿干质量比.取左肺中叶组织块0.6 cm×0.6 cm大小, 用4%福尔马林固定后石蜡包埋, 切片后行HE染色, 进行组织形态学观察, 行肺脏病理学评分.
1.2.5 胰腺病理学评分方法: 胰腺病理学评分, 按照Kusske[4]、Grewall[5]和Schimidt[6]标准, 制定以下评分标准(表1). 每张切片随机取10个高倍镜视野, 每个视野病理评分为每项相加后的总分值, 每张切片的组织病理评分为10个视野分值的平均数.
| 组织病变 | 评分标准 | ||||
| 0 | 1 | 2 | 3 | 4 | |
| 水肿 | 无 | 弥漫性小叶间水肿 | 小叶间区域水肿 | 腺泡肿胀, 小叶间隙增大 | 明显小叶分隔 |
| 炎细胞浸润 | 无 | 白细胞2-10个/HP | 白细胞11-20个/HP | 白细胞21-30个/HP | 白细胞>30个/HP |
| 出血 | 无 | 胰腺实质出血<25% | 实质出血25%-50% | 实质出血51%-75% | 实质出血>75% |
| 坏死 | 无 | 胰管周围实质破坏 | 点状实质坏死<20% | 小叶缺失21%-50% | 小叶缺失>50% |
1.2.6 肺组织病理学评分方法: 肺组织病理学评分, 参照Osman[7]、Hofbauer[8]和雷文章[9]的评分标准, 制定以下评分标准(表2). 每张切片随机取10个高倍镜视野, 每个视野病理评分为每项相加后的总分值, 每张切片的组织病理评分为10个视野分值的平均数.
| 组织病变 | 评分标准 | |||
| 0 | 1 | 2 | 3 | |
| 水肿 | 无 | 轻度肺泡壁水肿 | 中度肺泡壁水肿 | 肺泡和间质广泛水肿 |
| 炎细胞浸润 | 无 | 间质少量PMN和M浸润 | 间质及肺泡腔内有较多的PMN和M浸润 | 大部分肺泡及间质有PMN聚集成团, 显著M浸润 |
| 出血 | 无 | 间质及肺泡壁有少量出血范围<25% | 毛细血管淤血出血范围25%-50% | 肺泡腔出血范围50%-70% |
统计学处理 数据以mean±SD表示, SAP-LI模型组、假手术组、对照组各组内部不同时间点间的比较以及3组之间同一时间点的比较采用单因素方差分析(One-Way ANOVA), P<0.05表明有显著差异性. 病理学评分采用秩和检验, P<0.05表明有显著差异性. 用Pearson方法来检验血清淀粉酶、中性粒细胞百分比值、肺湿干质量比、肺灌洗液蛋白/血浆蛋白之间的相关性, P<0.05表明有显著相关性. 用Spearman方法来检验胰腺及肺脏病理学评分之间的相关性, P<0.05表明有显著相关性. 用SPSS20.0统计软件行数据分析.
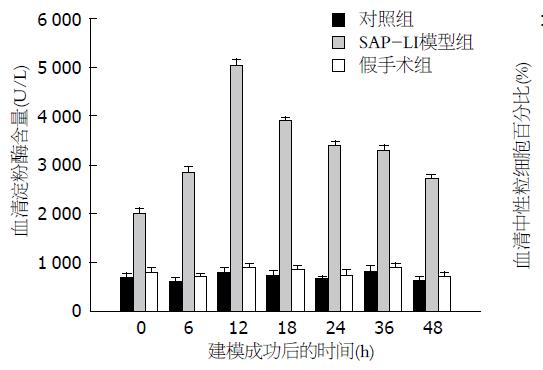
SAP-LI模型组, 大鼠血清淀粉酶于模型制作完成后即开始升高, 于12 h(5 052.1 U/L±114.9 U/L, P<0.01)达到峰值, 其后逐渐下降. 对SAP-LI模型组、假手术组、对照组组内及组间行单因素方差分析, P<0.05表明差异有显著性. SAP-LI模型组组内各时间点淀粉酶之间差异明显, 12 h与各时间点均有明显差别(P<0.01). SAP-LI模型组分别与对照组和假手术组同一时间点比较均高于对照组和假手术组, 差异明显(P<0.05). 对照组和假手术组组内各时间点比较及两组间相同时间点比较无明显差别(P>0.05, 图1).
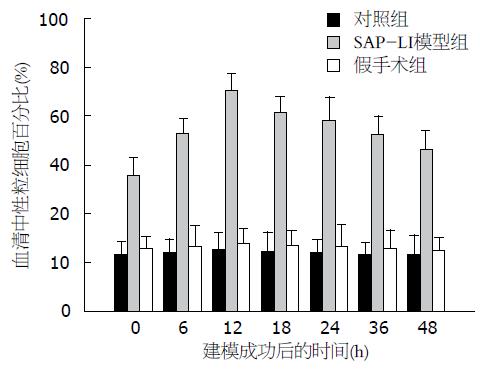
SAP-LI 模型组中, 大鼠血液中性粒细胞百分比于造模完成后即开始升高, 12 h(75.2%±5.8%, P<0.05)达峰值, 其后逐渐下降. 对SAP-LI模型组、假手术组、对照组组内及组间行单因素方差分析, P<0.05表明差异有显著性. SAP-LI模型组组内各时间点比较均有差异(P<0.05). SAP-LI模型组分别与对照组和假手术组同一时间点比较, 均高于对照组和假手术组(P<0.05). 对照组和假手术组组内各时间点比较及两组间相同时间点比较无明显差别(P>0.05, 图2).
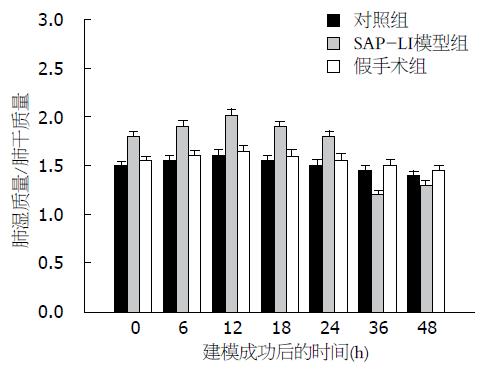
SAP-LI模型组, 大鼠肺组织湿干质量比于模型制作完成后即开始升高, 于12 h达到峰值, 后开始逐渐下降, 36 h(1.2001±0.0443, P<0.01)达到最低值, 后逐渐升高. 对SAP-LI模型组、假手术组、对照组组内及组间行单因素方差分析, P<0.05表明差异有显著性. SAP-LI模型组组内36 h与其他各时间点比较差异明显(P<0.01). SAP-LI模型组分别与对照组和假手术组同一时间点比较差异明显(P<0.05). 对照组和假手术组组内各时间点比较及两组间相同时间点比较无明显差异(P>0.05, 图3).
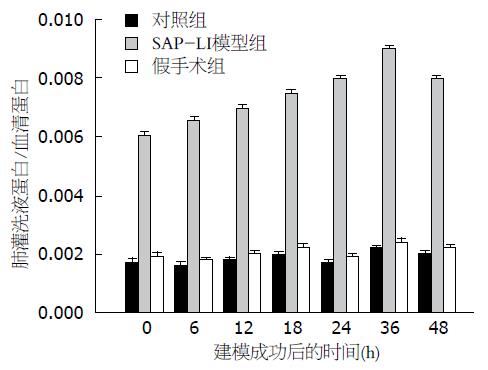
SAP-LI模型组, 大鼠肺灌洗液蛋白与血清蛋白比值, 大鼠肺灌洗液蛋白与血清蛋白比值于模型制作完成后即开始升高, 于36 h(0.009021±0.000107, P<0.01)达到峰值, 其后逐渐下降. 对SAP-LI模型组、假手术组、对照组组内及组间行单因素方差分析, P<0.05表明差异有显著性. SAP-LI模型组组内各时间点比较差异明显(P<0.05). SAP-LI模型组分别与对照组和假手术组同一时间点比较均高于对照组和假手术组, 差异明显(P<0.05). 对照组和假手术组组内各时间点比较及两组间相同时间点比较无明显差异(P>0.05, 图4).
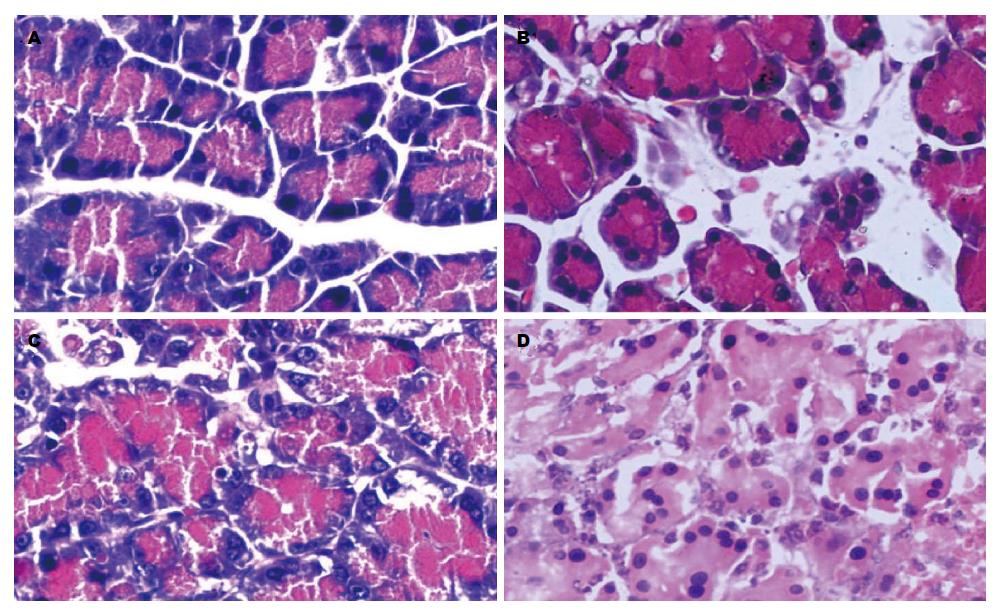
各时间点对照组大鼠胰腺病理切片见胰腺小叶无水肿, 无白细胞浸润, 无出血、坏死, 破裂. 假手术组大鼠仅见胰腺小叶轻度水肿, 无白细胞浸润, 无出血、坏死, 破裂. SAP-LI模型组, 造模完成后0 h即出现胰腺组织水肿, 6 h胰腺小叶间隙增宽、腺泡细胞水肿, 并出现出血、坏死, 腺泡完整性遭破坏, 腺泡液外溢. 12 h出现大量炎细胞浸润. 之后随时间进展, 坏死逐步加重. 48 h时出现大量片状坏死(图5). 对SAP-LI模型组、假手术组、对照组组内病理评分分别行Kruskal-Wallis秩和检验, P<0.05表明差异有显著性. 手术组各时间点间的差异明显(H = 67.473, P<0.01). 假手术组(H = 1.709, P = 0.944)及对照组(H = 2.107, P = 0.910)组内无明显差异(表3).
| 分组 | 0 h | 6 h | 12 h | 18 h | 24 h | 36 h | 48 h |
| SAP-LI模型组 | 1.88±0.41 | 6.07±0.26 | 8.24±0.24 | 10.43±0.28 | 12.30±0.39 | 13.28±0.28 | 14.02±0.35 |
| 假手术组 | 0.50±0.12 | 0.53±0.16 | 0.54±0.18 | 0.53±0.14 | 0.56±0.19 | 0.56±0.15 | 0.57±0.15 |
| 对照组 | 0.49±0.13 | 0.50±0.21 | 0.51±0.16 | 0.52±0.14 | 0.53±0.09 | 0.54±0.16 | 0.56±0.16 |
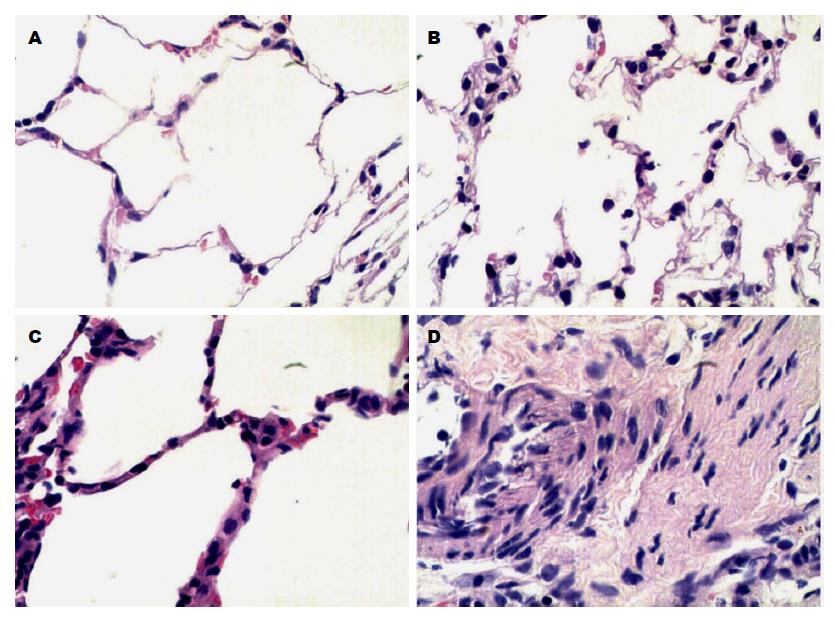
各时间点对照组大鼠肺组织病理切片无水肿、无出血、无炎细胞浸润, 肺泡壁较薄. 假手术组出现轻微肺泡壁细胞水肿, 无出血、无炎细胞浸润. SAP-LI模型组大鼠肺组织, 在造模完成后0 h即出现肺泡壁细胞水肿, 肺泡壁增厚, 随时间进展, 肺泡壁逐渐增厚, 肺泡腔逐渐缩小, 肺泡腔及间质红细胞增多、炎细胞浸润逐渐加重. 12 h时部分肺泡腔闭塞, 肺组织出现实变, 部分肺泡腔代偿性扩张.随时间进展, 水肿及实变逐渐加重, 至36 h时出现大面积的肺实变, 肺泡腔消失, 48 h时出现大量炎细胞浸润, 病变未再继续加重(图6). 对SAP-LI模型组、假手术组、对照组组内病理评分分别行Kruskal-Wallis秩和检验, P<0.05表明差异有显著性. SAP-LI模型组各时间点差异明显(H = 66.216, P<0.01). 假手术组各时间点间无明显差异(H = 1.173, P = 0.978). 对照组各时间点间无明显差异(H = 1.037, P = 0.984, 表4).
| 分组 | 0 h | 6 h | 12 h | 18 h | 24 h | 36 h | 48 h |
| SAP-LI模型组 | 2.12±0.24 | 4.05±0.32 | 6.20±0.30 | 6.91±0.28 | 7.85±0.27 | 8.49±0.16 | 6.24±2.21 |
| 假手术组 | 0.49±0.11 | 0.51±0.21 | 0.52±0.29 | 0.56±0.24 | 0.59±0.33 | 0.61±0.38 | 0.58±0.21 |
| 对照组 | 0.49±0.24 | 0.49±0.30 | 0.50±0.12 | 0.53±0.18 | 0.54±0.27 | 0.55±0.25 | 0.53±0.27 |
用Pearson方法检验SAP-LI模型组血清淀粉酶与血液中性粒细胞百分比、肺湿干质量比均呈正相关(r = 0.788, P<0.01; r = 0.365, P = 0.002). 中性粒细胞百分比与肺湿干质量比呈正相关(r = 0.348, P = 0.003). 肺湿干质量比、肺灌洗液蛋白与血清蛋白比值呈负相关(r = -0.717, P<0.01). 用Spearman方法来检验胰腺病理学评分与肺脏病理学评分呈正相关(r = 0.934, P<0.01).
重症急性胰腺炎占急性胰腺炎的10%-20%, 病程进展迅速, 可出现多种并发症, 常继发全身性炎症反应综合征(systemic inflammatory response syndrome, SIRS)及多器官功能障碍综合征(multiple organ dysfunction syndrom, MODS), 病死率高. 急性肺损伤(acuteLung Injury, ALI)是胰腺炎导致胰外脏器损伤中最常见的表现. 目前对于急性胰腺炎导致肺损伤的机制仍未完全阐明.
在研究急性胰腺炎肺损伤的过程中, 有人采用Lankish等[10]的方法, 通过向胰胆管内注入4%牛磺胆酸钠来制作SAP模型, 继而建立肺损伤模型. 但是逆行性胰胆管注射法制作SAP大鼠模型, 需进行胆胰管穿刺, 操作繁琐、复杂, 精确度要求高, 手术过程中对胰管及肠管的损伤加大, 增大了手术风险, 死亡率加大. 并且近端胆胰管极易被穿破, 造成药物外漏污染腹腔、胆胰管内压力减小等问题, 影响胰腺炎的严重程度, 从而影响肺损伤的严重程度. 有人采用Lampel等[11]、Jaworek等[12]的方法, 通过向大鼠腹腔注射雨蛙素、脂多糖制造SAP模型, 继而制造肺损伤模型. 但是此种方法所致胰腺炎严重程度不够, 仅造成水肿型胰腺炎, 并且药物对腹腔其他脏器产生直接损害, 影响肺损伤结果.
本模型首先采用夹闭法制造SAP模型, 然后在此基础上制造SAP-LI模型. 通过使用止血钳夹闭胰头部2 h, 模拟了胆源性胰腺炎的发病过程, 同时也模拟出胰腺血液循环障碍导致胰腺炎的发病过程. 有人注意到胰腺血液微循环障碍在急性胰腺炎发病过程中所起的作用[13]. 胰腺的血流情况与胰腺炎的严重程度有关, 重症胰腺炎时胰腺血流明显降低, 缺血诱发急性胰腺炎并导致加重[14]. 国内有关急性胰腺炎的报道, 认为最常见的病因为胆源性, 其次是特发性、高脂饮食(过度进食)及酒精性[15,16], 国外报道以胆源性及酒精性为最主要原因. 胆源性胰腺炎的成因是胆道结石崁钝于胆总管造成胰液流出障碍, 胰液反流导致胰管内压力升高, 胰腺导管遭破坏, 是胰腺炎常见的诱因[17]. 通过本方法既能成功建立出SAP模型, 又能达到肺损伤的要求. 通过本实验, 我们证实胰腺在建模完成后0 h即出现充血、水肿, 6 h即出现出血、坏死, 之后症状逐渐加重. 在建模后0 h即出现肺组织水肿, 至36 h时即出现大面积肺实变, 达到肺损伤最严重的时间点. 36 h即为我们SAP-LI模型所需时间点.
有观点认为胰酶的异常激活与释放、胰腺的自身消化为始动因素[18,19], 继而引起炎症介质瀑布样级联反应, 大量炎症介质进入血流, 引发全身炎症反应综合征(systemic inflammatory response syndrome, SIRS). 如SIRS反应过度, 则导致远处器官损害和MODS[20]. 肺是MODS最先累及的器官. SIRS使得血液循环中白细胞激活, 一些白细胞聚集在肺微循环, 随着病情的发展, 白细胞迁移至肺间质. 有研究表明SAP-LI与肺组织内中性粒细胞的积聚、活化, 产生大量促炎因子有关. Werner等[21]用99mTc标记白细胞, 发现在急性坏死性胰腺炎时肺组织内的中性粒白细胞明显增多. Inoue等[22]应用抗中性粒细胞多克隆抗体及CD18单抗来阻断中性粒细胞的粘附功能, 从而阻止了SAP-LI的发生. 间接证明了中性粒细胞在SAP-LI中的作用. 中性粒细胞能释放出各种氧化剂、蛋白酶. 胰蛋白酶可直接水解血浆及组织中的纤维连接素, 使肺血管内皮细胞脱落. 弹性蛋白酶可直接溶解血管壁弹力纤维, 并激活中性粒细胞而导致器官损伤[23]. 急性肺损伤是SIRS的结果, 肺泡上皮细胞和肺血管内皮细胞产生广泛破坏, 细胞损伤、坏死, 紧密连接破坏, 肺毛细血管通透性增加, 大量蛋白渗出, 进入肺泡腔和肺间质, 导致换气功能障碍[24]. 全身炎症反应的轻重决定了病程和结局[25,26]. 本次实验结果也表明, 血液中性粒细胞百分比逐渐升高, 以12 h最高, 之后逐渐下降, 但仍处于较高水平, 其与大鼠肺湿干质量比呈正相关关系(r = 0.348, P = 0.003). 进一步表明中性粒细胞与肺损伤的密切关系.
肺湿干质量比反映了肺水肿情况, 本实验建模完成后0 h肺湿干质量比便开始增加, 至12 h达到最高, 之后逐渐下降, 36 h降到最低.表明肺损伤发展迅速, 在最初的急性期肺泡内液体渗出逐渐增加, 12 h时渗出最多, 36 h时液体渗出最少, 但是蛋白渗出最多, 从而导致大面积的肺实变. 这与肺组织病理切片观察相符合. 测定肺灌洗液(brochoalveolar lavage fluid, BALF)中总蛋白量与血浆蛋白比例, 反映了肺血管的渗透性改变. 血管渗透性增加, 血浆中蛋白渗出到肺泡腔就增加. 本实验造模完成后BALF中总蛋白量与血浆蛋白比例逐渐变大, 至36 h达到峰值. 表明肺血管损伤程度逐渐加重, 36 h肺血管损伤最重, 这与肺干湿质量比值变化相吻合. 统计学相关性分析表明, 肺湿干质量比、肺灌洗液蛋白与血清蛋白比值呈负相关(r = -0.717, P<0.01).
血清总淀粉酶(amylase, AMY)测定常作为临床上诊断急腹症的常规检查项目之一, 并被普遍作为急性胰腺炎实验室诊断的指标之一[27]. 急性胰腺炎时AMY可通过淋巴、血循环及腹腔内吸收等途径进入血液循环. 国外资料表明, AMY对急性胰腺炎诊断的敏感度75%-92%之间, 特异度在60%-90%之间[28]. 但其特异性及其与胰腺炎严重程度的相关性一直存在争议, AMY常于发病后2-4 h即开始增高, 8-12 h标本最有价值, 随着炎症进行, 腺泡进一步破坏, 淀粉酶生成减少或很少, AMY可不增高[29]. 因此AMY对AP的早期诊断较有价值, 对后期的诊断尚有待于讨论. 于嘉屏等[30]的研究表明在急性水肿型胰腺炎模型组中, 血清胰淀粉酶的增高与胰腺炎严重程度呈正相关; 在坏死型胰腺炎组中, 随着胰腺坏死程度的加重, 血清总淀粉酶活性下降至正常对照组的1.5倍左右, 但血清胰淀粉酶活性仍在正常对照组的5倍以上. 本实验中, AMY于建模完成后0 h即开始升高, 12 h达到峰值, 之后逐渐下降, 至48 h仍为正常水平的3倍. 胰腺病理学观察发现, 胰腺组织于建模完成后0 h即开始出现水肿, 12 h出现大量炎细胞浸润. 之后随时间进展, 出血、坏死逐步加重. 48 h时出现大量片状坏死. 统计学分析示SAP-LI模型组血清淀粉酶与血液中性粒细胞百分比、肺湿干质量比均呈正相关(r = 0.788, P<0.01; r = 0.365, P = 0.002).
SAP-LI的损伤机制是复杂的, 至今仍无确切的结论, 仍在进行不断的研究. 本实验建立的SAP-LI模型操作简便, 尽量减少操作过程中对腹腔脏器的刺激, 能够大量、快速的建模. 所建模型各项检测指标结果切合实际, 与现有理论相符合. 建模完成后大鼠死亡率极低, 更便于对相关实验进行长期研究. 本模型的建立为SAP-LI的研究提供了一种新的造模方法, 为SAP-LI的发病机制研究及药物干预研究提供了一种较为理想的动物模型.
重症急性胰腺炎(SAP)常继发其他脏器损伤, 肺损伤是最常见的. SAP继发肺损伤患者病情凶险, 死亡率高.
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科; 李国威, 教授, 西安交通大学医学院第二附属医院普通外科
本文所要解决的问题是在SAP的基础上建立肺损伤模型, 关于精确的建立SAP相关性肺损伤模型的文章较少见, 大多是研究SAP模型的建立, 在研究继发性肺损伤时大都是套用SAP模型, 无精确损伤时间点的选择.
本文采用夹闭胰头部的方法建立急性坏死性胰腺炎肺损伤模型, 致伤胰腺准确, 能很好模拟胆源性及缺血所致的胰腺炎继发性肺损伤.
本文建立的SAP-LI模型操作简便, 尽量减少操作过程中对腹腔脏器的刺激, 能够大量、快速的建模. 所建模型各项检测指标结果切合实际, 与现有理论相符. 建模完成后大鼠死亡率极低, 更便于对相关实验进行长期研究. 本模型的建立为SAP-LI的研究提供了一种新的建模方法, 为研究SAP-LI的发病机制及药物干预提供了一种较为理想的动物模型.
本文参照国内外的相关研究及作者既往的研究结果, 建立了一种新型的重症急性胰腺炎肺损伤的动物模型, 并从多种角度对该模型进行了分析、比较及评价, 并对该模型的理论依据进行了较为详实的论述, 表明该模型稳定、可靠, 为后续机制研究奠定基础, 具有较好的先进性及创新性.
编辑: 田滢 电编: 鲁亚静
| 1. | Mofidi R, Duff MD, Wigmore SJ, Madhavan KK, Garden OJ, Parks RW. Association between early systemic inflammatory response, severity of multiorgan dysfunction and death in acute pancreatitis. Br J Surg. 2006;93:738-744. [PubMed] |
| 2. | Pastor CM, Matthay MA, Frossard JL. Pancreatitis-associated acute lung injury: new insights. Chest. 2003;124:2341-2351. [PubMed] [DOI] |
| 3. | 郭 飞, 刘 江伟, 许 永华, 卢 开柏, 薛 晓玉, 刘 尧炜, 是 文辉, 董 翔, 李 鹏. 胰头夹闭法致大鼠急性坏死性胰腺炎动物模型的建立. 临床和实验医学杂志. 2012;11:1175-1177. |
| 4. | Kusske AM, Rongione AJ, Ashley SW, McFadden DW, Reber HA. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice. Surgery. 1996;120:284-288; discussion 289. [PubMed] |
| 5. | Grewal HP, Mohey el Din A, Gaber L, Kotb M, Gaber AO. Amelioration of the physiologic and biochemical changes of acute pancreatitis using an anti-TNF-alpha polyclonal antibody. Am J Surg. 1994;167:214-218; discussion 214-218. [PubMed] [DOI] |
| 6. | Schmidt J, Lewandrowsi K, Warshaw AL, Compton CC, Rattner DW. Morphometric characteristics and homogeneity of a new model of acute pancreatitis in the rat. Int J Pancreatol. 1992;12:41-51. [PubMed] |
| 7. | Osman MO, Kristensen JU, Jacobsen NO, Lausten SB, Deleuran B, Deleuran M, Gesser B, Matsushima K, Larsen CG, Jensen SL. A monoclonal anti-interleukin 8 antibody (WS-4) inhibits cytokine response and acute lung injury in experimental severe acute necrotising pancreatitis in rabbits. Gut. 1998;43:232-239. [PubMed] [DOI] |
| 8. | Hofbauer B, Saluja AK, Bhatia M, Frossard JL, Lee HS, Bhagat L, Steer ML. Effect of recombinant platelet-activating factor acetylhydrolase on two models of experimental acute pancreatitis. Gastroenterology. 1998;115:1238-1247. [PubMed] [DOI] |
| 10. | Lankisch PG, Ihse I. Bile-induced acute experimental pancreatitis. Scand J Gastroenterol. 1987;22:257-260. [PubMed] [DOI] |
| 11. | Lampel M, Kern HF. Acute interstitial pancreatitis in the rat induced by excessive doses of a pancreatic secretagogue. Virchows Arch A Pathol Anat Histol. 1977;373:97-117. [PubMed] [DOI] |
| 12. | Jaworek J, Jachimczak B, Bonior J, Kot M, Tomaszewska R, Karczewska E, Stachura J, Pawlik W, Konturek SJ. Protective role of endogenous nitric oxide (NO) in lipopolysaccharide--induced pancreatic damage (a new experimental model of acute pancreatitis). J Physiol Pharmacol. 2000;51:85-102. [PubMed] |
| 13. | Schmidt J, Ebeling D, Ryschich E, Werner J, Gebhard MM, Klar E. Pancreatic capillary blood flow in an improved model of necrotizing pancreatitis in the rat. J Surg Res. 2002;106:335-341. [PubMed] [DOI] |
| 14. | Halonen KI, Pettilä V, Leppäniemi AK, Kemppainen EA, Puolakkainen PA, Haapiainen RK. Multiple organ dysfunction associated with severe acute pancreatitis. Crit Care Med. 2002;30:1274-1279. [PubMed] [DOI] |
| 16. | 黄 丽彬, 唐 承薇, 谢 咏梅, 黄 茂涛, 李 良平, 赵 聪, 史 维, 岳 光平. 成都地区3073例急性胰腺炎致病危险因素分析. 四川大学学报(医学版). 2005;36:138-139. |
| 17. | Acosta JM, Ledesma CL. Gallstone migration as a cause of acute pancreatitis. N Engl J Med. 1974;290:484-487. [PubMed] [DOI] |
| 18. | Lerch MM, Saluja AK, Dawra R, Ramaraò P, Saluja M, Steer ML. Acute necrotizing pancreatitis in the opossum: earliest morphological changes involve acinar cells. Gastroenterology. 1992;103:205-213. [PubMed] |
| 19. | Altavilla D, Famulari C, Passaniti M, Galeano M, Macrì A, Seminara P, Minutoli L, Marini H, Calò M, Venuti FS. Attenuated cerulein-induced pancreatitis in nuclear factor-kappaB-deficient mice. Lab Invest. 2003;83:1723-1732. [PubMed] [DOI] |
| 20. | Carroll JK, Herrick B, Gipson T, Lee SP. Acute pancreatitis: diagnosis, prognosis, and treatment. Am Fam Physician. 2007;75:1513-1520. [PubMed] |
| 21. | Werner J, Dragotakes SC, Fernandez-del Castillo C, Rivera JA, Ou J, Rattner DW, Fischman AJ, Warshaw AL. Technetium-99m-labeled white blood cells: a new method to define the local and systemic role of leukocytes in acute experimental pancreatitis. Ann Surg. 1998;227:86-94. [PubMed] [DOI] |
| 22. | Inoue S, Nakao A, Kishimoto W, Murakami H, Harada A, Nonami T, Takagi H. LFA-1 (CD11a/CD18) and ICAM-1 (CD54) antibodies attenuate superoxide anion release from polymorphonuclear leukocytes in rats with experimental acute pancreatitis. Pancreas. 1996;12:183-188. [PubMed] [DOI] |
| 23. | Yamano M, Umeda M, Miyata K, Yamada T. Protective effects of a PAF receptor antagonist and a neutrophil elastase inhibitor on multiple organ failure induced by cerulein plus lipopolysaccharide in rats. Naunyn Schmiedebergs Arch Pharmacol. 1998;358:253-263. [PubMed] [DOI] |
| 24. | Shields CJ, Winter DC, Redmond HP. Lung injury in acute pancreatitis: mechanisms, prevention, and therapy. Curr Opin Crit Care. 2002;8:158-163. [PubMed] [DOI] |
| 25. | McKay CJ, Gallagher G, Brooks B, Imrie CW, Baxter JN. Increased monocyte cytokine production in association with systemic complications in acute pancreatitis. Br J Surg. 1996;83:919-923. [PubMed] [DOI] |
| 26. | Lundberg AH, Granger DN, Russell J, Sabek O, Henry J, Gaber L, Kotb M, Gaber AO. Quantitative measurement of P- and E-selectin adhesion molecules in acute pancreatitis: correlation with distant organ injury. Ann Surg. 2000;231:213-222. [PubMed] [DOI] |
| 28. | Tsujita T, Shirai K, Saito Y, Okuda H. Relationship between lipase and esterase. Prog Clin Biol Res. 1990;344:915-933. [PubMed] |